Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista argentina de cardiología
On-line version ISSN 1850-3748
Rev. argent. cardiol. vol.76 no.4 Ciudad Autónoma de Buenos Aires July/Aug. 2008
Evaluación inmunológica del tratamiento con benznidazol en la enfermedad de Chagas crónica
Graciela L. Bertocchi1, María G. Álvarez1, Damián Pérez2, Alejandro Armenti1, Rodolfo J. Viotti1, Bruno Lococo1, Marcos Petti1, Miriam Postan2, María C. Albareda2, Susana A. Laucella2, Rick L. Tarleton3
1 Hospital Eva Perón (ex "Dr. Mariano R. Castex"), San Martín, Provincia de Buenos Aires, Argentina
2 Instituto Nacional de Parasitología "Dr. Mario Fatala Chabén", Buenos Aires, Argentina
3 Center for Tropical and Emerging Global Diseases, University of Georgia, Athens, USA
Recibido: 18/10/2007
Aceptado: 15/05/2008
Dirección para separatas: Graciela Luciana Bertocchi Moldes 3878 - (1429) Capital Federal e-mail: gbertocchi@intramed.net.ar
RESUMEN
Para determinar el efecto del tratamiento con benznidazol sobre las células T de memoria específica para Trypanosoma cruzi, se seleccionaron 47 pacientes con tres reacciones serológicas positivas para T. cruzi, sin cardiopatía y edades comprendidas entre los 30 y los 50 años. El tratamiento se realizó con benznidazol en dosis de 5 mg/kg/d por 30 días. Se efectuó una evaluación serológica, inmunológica y clínica pretratamiento (tiempo 0) y a los 2, 6 y 12 meses postratamiento. Posteriormente, los controles se hicieron anualmente. La respuesta de linfocitos T frente a un lisado de amastigotas de T. cruzi se evaluó por la técnica de ELISPOT para IFN-γ. La frecuencia de linfocitos T de memoria productores de IFN-γ específicos para T. cruzi disminuyó significativamente en el grupo tratado (n = 33) versus el no tratado (n = 14) 12 meses después del seguimiento. Once de 25 (44%) pacientes que recibieron benznidazol negativizaron la respuesta para IFN-γ. Cuatro de los 11 (36%) pacientes con ELISPOT (+) que negativizaron la respuesta por ELISPOT para IFN-γ también negativizaron la serología convencional a los 2 años postratamiento. Durante el seguimiento no se observaron alteraciones clínicas. Estos hallazgos muestran que el benznidazol es capaz de modular la respuesta celular T de memoria específica para T. cruzi. La medición de la frecuencia de linfocitos T de memoria productores de IFN-γ podría constituir un ensayo más sensible y precoz para determinar el impacto/eficacia del tratamiento específico contra este parásito.
Palabras clave Enfermedad de Chagas; Benznidazol; Linfocitos T; Trypanosoma cruzi
Abreviaturas
HIV Virus de la inmunodeficiencia humana
IFN-γ Interferón gamma
IL-2 Interleucina 2
SUMMARY
Immunological Assessment of Benznidazol Therapy in Chronic Chagas Disease
To determine the effect of benznidazol therapy on memory T cells specific for Trypanosoma cruzi, 47 patients between 30 and 50 years old and three positive serological tests for T. cruzi without cardiopathy were selected. Benznidazol was administered in a dose of 5 mg/kg/d during 30 days. Serological, immunological and clinical assessment was performed at basal (time 0) and at 2, 6 and 12 months following treatment, and once a year thereafter. IFN-γ ELISPOT assay was used to evaluate T cell responses against a T. cruzi lysate obtained from amastigotes. The frequency of IFN-γ - producing memory T lymphocytes specific for T. cruzi was significantly lower in the treatment group (n=33) compared to the control group (n=14) 12 months after the therapy. IFN- γ response became negative in 11 patients in the treatment group (44%). Among these 11 patients, conventional serology also became negative in 4 patients (36%) after 2 years of treatment. No clinical manifestations occurred during follow-up. These findings show that benznidazol is capable of modulating T cell responses specific for T. cruzi. Measuring the frequency of memory T lymphocytes producing IFN-γ might become a more sensitive test to determine earlier the impact and/or efficacy of the specific treatment against this parasite.
Key words: Chagas disease; Benznidazol; Lymphocytes; Trypanosoma cruzi
INTRODUCCIÓN
La enfermedad de Chagas es una enfermedad parasitaria cuyo agente patógeno es un protozoo flagelado, Trypanosoma cruzi. Este parásito ingresa en el ser humano por distintas vías: vectorial, transplacentaria, transfusional, postrasplante y posiblemente digestiva. Produce parasitemia, anida y se reproduce en los tejidos, donde induce inflamación y destrucción. Los órganos especialmente afectados son el músculo cardíaco, el aparato digestivo y el sistema nervioso. En América Central y América del Sur son más de 10 millones las personas infectadas. (1)
Aproximadamente el 30% de los individuos infectados desarrollan miocardiopatía crónica tras un período indeterminado de una o dos décadas después de la infección inicial. En el transcurso de este período se establece una convivencia estable entre el individuo y el parásito, durante la cual no hay evidencia clínica de enfermedad. Esto es porque el sistema inmunológico del huésped controla la infección a través del control de la replicación del parásito. En ocasiones, esta estabilidad se pierde y las alteraciones clínicas sobrevienen, ya sea por la presencia de enfermedades concomitantes, la administración de drogas inmunosupresoras o porque la persistencia crónica de la infección puede inducir agotamiento del sistema inmune, lo que impide el control adecuado de la infección. Estas alteraciones incluyen arritmias, trastornos de conducción, cardiomegalia, insuficiencia cardíaca, tromboembolia y muerte súbita. (2)
Por la condición intracelular del parásito, la respuesta inmune celular es crítica para su control. Células presentadoras de antígenos capturan el antígeno de la sangre, lo procesan y lo presentan a los linfocitos T alojados en los ganglios linfáticos. Estos linfocitos reconocen al antígeno, proliferan y se diferencian en las distintas poblaciones celulares. Los linfocitos T "efectores" CD4 y CD8 migran a los tejidos donde se produce la infección y liberan, entre otros, IFN-γ, capaz de activar macrófagos. Otra función efectora de los linfocitos T CD8+ es la lisis de las células parasitadas. Los linfocitos T "de memoria" se clasifican en linfocitos T de "memoria central" y linfocitos T de "memoria efectora". La población de memoria central está presente una vez que se produjo la depuración completa del antígeno y secreta preponderantemente IL-2. La población de memoria efectora, contrariamente, está presente siempre que haya persistencia del antígeno y tiene la particularidad de intervenir con rapidez ante nuevas exposiciones antigénicas con la producción, preferentemente, de IFN- γ. Este estudio se realizó sobre la población de células de memoria efectora específicas para T. cruzi. La miocardiopatía chagásica evoluciona más tórpidamente que las miocardiopatías dilatadas de otras etiologías. (3) El mecanismo fisiopatológico de la enfermedad es controversial por lo arduo que representa realizar un seguimiento muy prolongado de los pacientes, sumado al bajo número de parásitos en sangre y a la persistencia de anticuerpos circulantes aun después de la eliminación del parásito. (4) Sin embargo, se ha reunido evidencia que sostiene que la persistencia intracelular de T. cruzi en el miocardio constituye el estímulo para la respuesta inflamatoria crónica que resulta luego en daño tisular. (5, 6) Se demostró que el tratamiento antiparasitario es efectivo en la etapa aguda de la infección. (7, 8) Sin embargo, su empleo en la etapa crónica es limitado por diversas razones. (9-13) Una de las principales dificultades es la evaluación de la eficacia terapéutica. No existen ensayos confiables para medir la eliminación del parásito y se requieren períodos muy prolongados para detectar cura serológica. (14) Se desconoce en extenso el impacto de la quimioterapia específica para T. cruzi sobre la respuesta inmune del huésped. (15, 16) Estudios previos de nuestro grupo demostraron que los pacientes sin cardiopatía o con cardiopatía leve presentan niveles mayores de linfocitos T de memoria efectora específicos para el parásito, en comparación con los niveles observados en pacientes con cardiopatía grave. (17) Alrededor del 80% de los pacientes asintomáticos presentan ELISPOT positivo para IFN-γ y sólo el 15% de los pacientes crónicamente infectados que presentan insuficiencia cardíaca muestran niveles detectables de linfocitos T productores de IFN-γ. Existe una relación inversa entre el grado de cardiopatía y el número de linfocitos T de memoria efectora. Es en estos pacientes con cardiopatía grave en los que consideramos que su sistema inmunológico está agotado y no puede responder adecuadamente a las exigencias de la infección. (18) Dos trabajos clínicos mostraron beneficio en el seguimiento a largo plazo de los pacientes tratados con benznidazol. (9, 19)
El objetivo de este estudio fue evaluar el efecto del tratamiento con benznidazol sobre la respuesta celular T de memoria específica para T. cruzi en pacientes en la etapa indeterminada de la enfermedad de Chagas crónica.
MATERIAL Y MÉTODOS
Selección de la población
La población se seleccionó entre las personas que concurren a la Sección de Chagas del Hospital Interzonal de Agudos "Eva Perón", Provincia de Buenos Aires. La reactividad a T. cruzi se evaluó mediante inmunofluorescencia indirecta, hemaglutinación indirecta y ELISA. Los pacientes fueron agrupados de acuerdo con la clasificación de Kuschnir. (20)
Criterios de inclusión
Los criterios de inclusión comprendieron: que tres reacciones serológicas HAI, IFI, ELISA fueran positivas, edad entre 21 y 50 años, ausencia de cardiopatía de cualquier etiología, que no se padeciera de hipertensión, diabetes ni dislipidemia ni de otras enfermedades importantes como cáncer, artritis, alergias, HIV, las mujeres no debían estar embarazadas y que los pacientes ingresados en el grupo tratado hubieran completado el esquema de tratamiento. Los pacientes aptos se asignaron en forma aleatoria, en una relación 2/1, a grupo tratado versus no tratado, respectivamente, previo a la inclusión en este trabajo simple ciego.
Esquema de tratamiento
Se administraron 5 mg/kg/día de benznidazol por vía oral durante 30 días, tras un período de adaptación de 7 días en los que la droga se administró en dosis crecientes hasta alcanzar la dosis deseada. Este esquema lo recomendamos tradicionalmente a nuestros pacientes (9, 19) sobre la base de evidencias previas que no mostraron diferencias significativas respecto de la negativización de la serología cuando la droga se administró por 30 días o por períodos más prolongados. Los efectos adversos graves se pueden prevenir si la dosis acumulativa no excede los 18 g de benznidazol. (10)
Características de la población estudiada
Ingresaron 47 pacientes, 28 mujeres y 16 hombres. Edad promedio: 41,64 ± 6,2 años + DE. Todos pertenecientes al grupo 0 de la clasificación de Kuschnir, 33 al grupo tratado, 14 al grupo no tratado.
Control de los pacientes
Se realizaron una evaluación serológica, inmunológica y clínica al ingreso (tiempo 0) y a los 2, 6 y 12 meses después de la incorporación, laboratorio de rutina en los controles 0 y 12 meses, electrocardiograma en los controles 0, 2, 6 y 12 meses y radiografía tórax, ergometría y ecocardiograma (tiempo 0). Posteriormente, los controles se realizaron en forma anual. Los participantes firmaron un consentimiento informado. El protocolo fue aprobado por el Comité de Ética del Hospital Eva Perón y de la Universidad de Georgia.
Obtención de células mononucleares periféricas y suero
Se extrajeron 50 ml de sangre a cada participante mediante un sistema de colección al vacío con heparina y sin ella. La sangre heparinizada se sometió a un gradiente de centrifugación para la separación de células mononucleares periféricas (PBMC). De la sangre extraída sin heparina se separó el suero luego de permitir su coagulación a 37 °C y centrifugación a 1.000 × g durante 15 minutos.
Obtención de lisado derivado de amastigotas de T. cruzi
Mediante tres ciclos de congelación-descongelación seguido por sonicación se obtuvo un lisado proteico derivado de amastigotas de T. cruzi. (17)
Ensayos de ELISPOT
En microplacas de 96 pocillos con fondo de nitrocelulosa estériles se sembró un anticuerpo monoclonal anti-IFN-γ durante 18 horas a 4 °C; 4 × 105 PBMC/pocillo se sembraron por triplicado y se estimularon con 10 µg/ml del lisado de amastigotas, o con medio de cultivo por 16 horas a 37 °C con 5% CO2. (17) Posteriormente se agregó un anticuerpo anti-IFN-γ biotinilado por 2 horas a temperatura ambiente y los spots, cada uno representando una célula productora de IFN-γ, se revelaron utilizando estreptavidina-peroxidasa seguido por aminoetilcarbazol como sustrato. Los spots se contaron con un lector de ELISPOT (CTL, USA). La respuesta se consideró positiva cuando el número de spots fue igual o mayor de 10 y al menos dos veces mayor al número de spots obtenidos en el control con medio de cultivo. El número de linfocitos T específicos para T. cruzi se obtuvo por la resta del número de linfocitos T obtenidos sin estimulación al número de linfocitos T obtenidos ante el estímulo con el lisado. (17)
Análisis estadístico
Los cambios cuantitativos en la respuesta celular se determinaron por ANOVA por rangos de Friedman. Para comparar las variaciones de la respuesta celular entre los grupos tratado y no tratado se utilizó la prueba de Mann-Whitney U sobre las diferencias postratamiento/pretratamiento de cada grupo. Para comparar categorías entre grupos se utilizaron las pruebas de chi cuadrado y Fisher. Se consideró significativo un valor p = 0,05.
RESULTADOS
Monitoreo de la respuesta celular T de memoria específica para T. cruzi.
En diferentes infecciones humanas, la presencia de linfocitos T de memoria central (productores de IL-2) se asoció con la resolución de la infección, mientras que la memoria de tipo efectora (productora de IFN-γ) es característica de infecciones persistentes. (22-24) La monitorización de la función celular T constituye una herramienta valiosa para determinar la actividad de la enfermedad. En este estudio evaluamos si el benznidazol es capaz de modular la respuesta inmune celular T de memoria efectora específica para el parásito en la fase indeterminada de la infección. Para ello, cuantificamos la frecuencia de linfocitos T productores de IFN-γ mediante la técnica de ELISPOT.
La frecuencia de linfocitos T de memoria productores de IFN-γ específicos para T. cruzi disminuyó significativamente en el grupo tratado en comparación con el no tratado, 12 meses después del seguimiento (Figura 1).

Fig. 1. Efecto del tratamiento con benznidazol sobre la respuesta celular T de memoria específica para Trypanosoma cruzi en pacientes con enfermedad de Chagas crónica. El número de linfocitos T productores de IFN-γ específicos para T. cruzi se determinó por ELISPOT pretratamiento y a los 12 meses postratamiento con benznidazol. Cada símbolo representa el número promedio de spots para cada paciente. (*) p < 0,005 Prueba de Mann-Whitney U sobre las diferencias pretratamientopostratamiento entre los grupos tratados y no tratados.
De los 33 pacientes que ingresaron en el grupo tratado, 25 (76%) presentaron el ensayo de ELISPOT positivo previo al tratamiento, en tanto que en 8 (24%) fue negativo (Figura 2). El ensayo de ELISPOT se negativizó en 11 de los 25 (44%) pacientes que presentaban ELISPOT positivo antes del tratamiento (8 pacientes a los 12 meses y 3 pacientes a los 24 meses postratamiento), mientras que en ninguno de los pacientes del grupo no tratado se observó negativización de la técnica de ELISPOT observándose niveles de linfocitos T secretores de IFN-γ relativamente estables (Figura 2, Fisher entre el porcentaje de pacientes tratados que negativizan el ELISPOT versus el porcentaje de pacientes no tratados que negativizan el ELISPOT, p < 0,05).
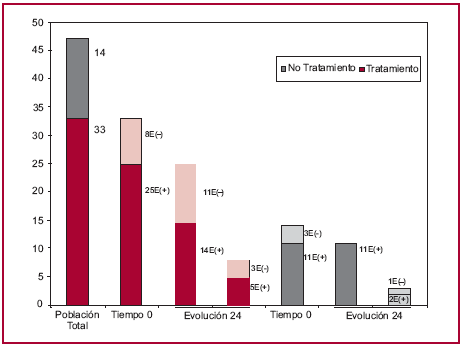
Fig. 2. Evolución de la respuesta celular T de memoria específica para T. cruzi en pacientes tratados con benznidazol y no tratados. (*) Prueba de Fisher p < 0,05 (% de negativización en el grupo tratado versus % de negativización en el grupo no tratado con ELISPOT (+) al ingreso).
El tratamiento con benznidazol también evidenció algún cambio inmunológico en los pacientes cuya respuesta por ELISPOT era negativa previa al tratamiento, observándose niveles detectables de linfocitos T productores de IFN-γ en 5 de los 8 pacientes que mostraban ELISPOT negativo previo al tratamiento. Estos resultados sugieren que la técnica de ELISPOT podría constituir un ensayo sensible y precoz para determinar el impacto del tratamiento específico para T. cruzi.
Cinética de la respuesta celular T de memoria efectora en pacientes tratados con benznidazol
Para evaluar la cinética de la respuesta celular, se determinó también la producción de IFN-γ a los 2 y 6 meses de seguimiento en un grupo de 18 pacientes (12 pacientes tratados, 6 no tratados). La disminución observada en el grupo tratado no se evidenció antes del primer año postratamiento. En el grupo tratado se constataron dos modalidades de comportamiento, un grupo presentó aumento en el número de linfocitos seguido de reducciones progresivas en su número previo a la negativización; este ascenso en el número de linfocitos se observó entre los 2 y 6 meses postratamiento. Otro grupo evidenció reducciones progresivas en la respuesta hasta su negativización sin presentar el pico descripto en el grupo anterior (Figura 3).

Fig. 3. Cinética de la respuesta celular T de memoria efectora en pacientes tratados con benznidazol. La respuesta por ELISPOT para IFN-γ se midió a distintos tiempos postseguimiento en pacientes tratados con benznidazol y en un grupo no tratado. Los distintos gráficos representan el comportamiento para pacientes individuales. La frecuencia de linfocitos T productores de IFN-γ aumenta entre los 2 y los 6 meses de seguimiento para disminuir posteriormente (p < 0,05; columna izquierda), disminuir paulatinamente (p < 0,05; columna central) o no variar (columna derecha) de acuerdo con lo determinado por la prueba de rangos de Friedman.
Relación entre la respuesta por ELISPOT y la serológica convencional
Cuatro de 33 (12,12%) pacientes que recibieron tratamiento negativizaron las tres técnicas serológicas convencionales; 1 de ellos a los 12 meses y 3 a los 24 meses postratamiento. Cuatro de los 11 (36,36%) pacientes que negativizaron la respuesta por ELISPOT para IFN-γ también negativizaron la serología convencional postratamiento.
DISCUSIÓN
En la mayoría de los pacientes, la infección por T. cruzi pasa inadvertida y unos pocos desarrollan cardiopatía transcurridos varios años de la infección inicial. Establecida la cardiopatía, es posible establecer un pronóstico de progresión de la enfermedad sobre la base de indicadores clínicos, (25) pero aún es un enigma la detección de los pacientes que evolucionarán a la miocardiopatía. Tampoco existen indicadores de éxito terapéutico en los pacientes crónicamente infectados por T. cruzi. (9, 14) Sin embargo, la evaluación del estado inmunológico de los pacientes frente al parásito evidenció que aquellos en mejores condiciones clínicas presentan niveles mayores de linfocitos T de memoria productores de IFN-γ específicos para T. cruzi con respecto a pacientes que muestran compromiso cardíaco grave. (17) Cuando analizamos los pacientes del grupo 0 (sin cardiopatía) encontramos que no todos tenían el mismo comportamiento inmunológico. La mayoría presentan un mismo perfil de memoria celular T efectora (productora de IFN-γ e IL-2) y ausencia de linfocitos productores de IL-2 exclusivamente (memoria central). (26)
Mientras la memoria de tipo central posee alta capacidad proliferativa en ausencia del antígeno y puede persistir por largo tiempo, la memoria de tipo efectora depende del antígeno para su persistencia y posee baja capacidad replicativa. (27) Estas evidencias, sumadas a la observación de que la gravedad de la enfermedad se asocia con una frecuencia mayor de linfocitos T CD8+ de memoria totales altamente diferenciados y apoptóticos que presentan características senescentes, (18) apoyan la idea de que la infección crónica por T. cruzi lleva a un agotamiento del sistema inmune como consecuencia de la persistencia antigénica. Esto podría afectar la capacidad del sistema inmune para controlar la infección, con la consecuente progresión de la enfermedad.
Esta investigación evalúa el impacto del tratamiento con benznidazol en la etapa crónica de la infección por T. cruzi sobre la respuesta inmune celular específica para este parásito. Los resultados muestran que el tratamiento etiológico para T. cruzi modula la respuesta celular T de memoria efectora específica para el parásito. Considerando que la memoria T efectora depende del antígeno para persistir, el descenso de la respuesta por ELISPOT para IFN-γ al año postratamiento serviría como un potencial marcador precoz de la eliminación/ disminución de la carga parasitaria. Si bien el tiempo de seguimiento no es suficiente para detectar cambios significativos a nivel de la serología convencional, hemos observado que los 4 pacientes tratados con benznidazol que negativizaron la serología convencional para T. cruzi también nega-tivizaron o disminuyeron la frecuencia de linfocitos T de memoria productores de IFN-γ. Esta interpretación también se apoya en la observación de que el tratamiento fue capaz de modificar los títulos serológicos para proteínas recombinantes (Datos no mostrados) para T. cruzi. El aumento significativo de la población celular T de memoria productora de IFN-γ entre los 2 y 6 meses postratamiento, observado en una proporción alta de los pacientes que negativizaron posteriormente la respuesta celular, indicaría una liberación mayor de antígenos parasitarios por acción del benznidazol, estimulando así la respuesta celular. Esto podría deberse a una sensibilidad mayor al benznidazol o bien a una carga parasitaria mayor en estos pacientes, previamente al tratamiento. Estos hallazgos también explicarían el aumento de la respuesta por ELISPOT para IFN-γ observado en los pacientes que presentaban respuesta negativa antes del tratamiento. Los resultados concuerdan con observaciones previas en el modelo murino, al demostrar que la activación del sistema inmune del huésped por antígenos del parásito y el IFN-γ endógeno tendrían un papel preponderante en la eficacia del tratamiento con benznidazol. (28-30) A largo plazo se podrá evaluar la asociación entre la respuesta celular y la evolución de la enfermedad como consecuencia del tratamiento etiológico. El hallazgo de un efecto positivo del tratamiento sobre la respuesta inmune celular hacia T. cruzi en la etapa crónica de la infección podría avalar el uso del tratamiento en esta etapa. Asimismo, esta investigación aporta también información valiosa sobre la contribución de la respuesta inmune celular en el control del parásito.
En resumen, nuestros hallazgos muestran que el benznidazol es capaz de modular la respuesta celular T de memoria específica para T. cruzi. La medición de la frecuencia de linfocitos T productores de IFN-γ podría constituir un ensayo más sensible y precoz para determinar el impacto/eficacia del tratamiento específico contra este parásito.
Agradecimientos
Este trabajo fue financiado por la Fundación Bunge & Born, BID 1728 PICT 38188, National Institutes of Health, (NIH 5P01AI044979), CONICET y FONCYT.
1. World Health Organization. Control of Chagas disease. Report of a WHO Expert Committee. World Health Organ Tech Rep Ser 2002;905:1-109. [ Links ]
2. Manzullo EC, Chuit R. Risk of death due to chronic chagasic cardiopathy. Mem Inst Oswaldo Cruz 1999;94:317-20. [ Links ]
3. Bestetti RB, Dalbo CM, Freitas OC, Teno LA, Castilho OT, Oliveira JS. Noninvasive predictors of mortality for patients with Chagas' heart disease: a multivariate stepwise logistic regression study. Cardiology 1994;84:261-7. [ Links ]
4. Cancado JR. Tratamento especifico. En: Cancado JR, Chuster M, editores. Cardiopatía Chagásica. Belo Horizonte, Brazil: Fundacao Carlos Chagas; 1985:327-55. [ Links ]
5. Tarleton RL, Zhang L. Chagas disease etiology: autoimmunity or parasite persistence? Parasitol Today 1999;15:94-9. [ Links ]
6. Tarleton RL. Parasite persistence in the aetiology of Chagas disease. Int J Parasitol 2001;31:550-4. [ Links ]
7. Urbina JA. Chemotherapy of Chagas' disease: the how and the why. J Mol Med 1999;77:332-8. [ Links ]
8. Khaw M, Panosian CB. Human antiprotozoal therapy: past, present, and future. Clin Microbiol Rev 1995;8:427-39. [ Links ]
9. Viotti R, Vigliano C, Armenti H, Segura E. Treatment of chronic Chagas' disease with benznidazole: clinical and serologic evolution of patients with long-term follow-up. Am Heart J 1994;127:151-62. [ Links ]
10. Cancado JR. Long term evaluation of etiological treatment of Chagas disease with benznidazole. Rev Inst Med Trop Sao Paulo 2002;44:29-37. [ Links ]
11. Sosa-Estani S, Armenti A, Araujo G, Viotti R, Lococo B, Ruiz Vera B, et al. Treatment of Chagas disease with benznidazole and thioctic acid. Medicina (B Aires) 2004;64:1-6. [ Links ]
12. Fabbro De Suasnábar D, Arias E, Streiger M, Piacenza M, Ingaramo M, Del Barco M, et al. Evolutive behavior towards cardiomyopathy of treated (nifurtimox or benznidazole) and untreated chronic chagasic patients. Rev Inst Med Trop Sao Paulo 2000;42:99-109. [ Links ]
13. Fabbro DL, Streiger ML, Arias ED, Bizai ML, del Barco M, Amicone NA. Trypanocide treatment among adults with chronic Chagas disease living in Santa Fe city (Argentina), over a mean followup of 21 years: parasitological, serological and clinical evolution. Rev Soc Bras Med Trop 2007;40:1-10. [ Links ]
14. Rassi A, Luquetti AO. Specific treatment for Trypanosoma cruzi infection (Chagas disease). En: Tyler KM, Miles MA, editors. American Trypanosomiasis. Boston: Kluwer Academic Publishers; 2003. p. 117-25. [ Links ]
15. Laucella SA, Segura EL, Riarte A, Sosa ES. Soluble platelet selectin (sP-selectin) and soluble vascular cell adhesion molecule-1 (sVCAM-1) decrease during therapy with benznidazole in children with indeterminate form of Chagas' disease. Clin Exp Immunol 1999;118:423-7. [ Links ]
16. Olivieri BP, Cotta-De-Almeida V, Araújo-Jorge T. Benznidazole treatment following acute Trypanosoma cruzi infection triggers CD8+ T-cell expansion and promotes resistance to reinfection. Antimicrob Agents Chemother 2002;46:3790-6. [ Links ]
17. Laucella SA, Postan M, Martin D, Hubby Fralish B, Albareda MC, Alvarez MG, et al. Frequency of interferon- gamma -producing T cells specific for Trypanosoma cruzi inversely correlates with disease severity in chronic human Chagas disease. J Infect Dis 2004;189:909-18. [ Links ]
18. Albareda MC, Laucella SA, Alvarez MG, Armenti AH, Bertochi G, Tarleton RL, et al. Trypanosoma cruzi modulates the profile of memory CD8+ T cells in chronic Chagas' disease patients. Int Immunol 2006;18:465-71. [ Links ]
19. Viotti R, Vigliano C, Lococo B, Bertocchi G, Petti M, Alvarez MG, et al. Long-term cardiac outcomes of treating chronic Chagas disease with benznidazole versus no treatment: a nonrandomized trial. Ann Intern Med 2006;144:724-34. [ Links ]
20. Kuschnir E, Sgammini H, Castro R, Evequoz C, Ledesma R, Brunetto J. Evaluation of cardiac function by radioisotopic angiography, in patients with chronic Chagas cardiopathy. Arq Bras Cardiol 1985;45:249-56. [ Links ]
21. Barclay CA, Cerisola JA, Lugones H, Ledesma O, Lopez Silva J, Mouzo G. Aspectos farmacológicos y resultados terapéuticos del benznidazol en el tratamiento de la infección chagásica. Prens Med Arg 1978; 65:239. [ Links ]
22. Zimmerli SC, Harari A, Cellerai C, Vallelian F, Bart PA, Pantaleo G. HIV-1-specific IFN-gamma/IL-2-secreting CD8 T cells support CD4-independent proliferation of HIV-1-specific CD8 T cells. Proc Natl Acad Sci U S A 2005;102:7239-44. [ Links ]
23. Harari A, Vallelian F, Meylan PR, Pantaleo G. Functional heterogeneity of memory CD4 T cell responses in different conditions of antigen exposure and persistence. J Immunol 2005;174:1037-45. [ Links ]
24. Harari A, Dutoit V, Cellerai C, Bart PA, Du Pasquier RA, Pantaleo G. Functional signatures of protective antiviral T-cell immunity in human virus infections. Immunol Rev 2006;211:236-54. [ Links ]
25. Viotti R, Vigliano C, Armenti A. A risk score for predicting death in Chagas' heart disease. N Engl J Med 2006;355:2489. [ Links ]
26. Alvarez MG, Postan M, Weatherly B, Armenti A, Sidney J, Sette A, et al. HLA Class I-T cell epitopes from trans-sialidase proteins reveal functionally distinct subsets of CD8+ T cells specific for Trypanosoma cruzi in chronic Chagas disease. PLoS Neglected Tropical Diseases (in press). [ Links ]
27. Pantaleo G, Harari A. Functional signatures in antiviral T-cell immunity for monitoring virus-associated diseases. Nat Rev Immunol 2006;6:417-23. [ Links ]
28. Romanha AJ, Alves RO, Murta SM, Silva JS, Ropert C, Gazzinelli RT. Experimental chemotherapy against Trypanosoma cruzi infection: essential role of endogenous interferon-gamma in mediating parasitologic cure. J Infect Dis 2002;186:823-8. [ Links ]
29. Olivieri BP, de Souza AP, Cotta-de-Almeida V, de Castro SL, Araújo- Jorge T. Trypanosoma cruzi: alteration in the lymphoid compartments following interruption of infection by early acute benznidazole therapy in mice. Exp Parasitol 2006;114:228-34. [ Links ]
30. Dantas AP, Olivieri BP, Gomes FH, De Castro SL Treatment of Trypanosoma cruzi-infected mice with propolis promotes changes in the immune response. J Ethnopharmacol 2006;103:187-93. [ Links ]














