Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista argentina de cardiología
On-line version ISSN 1850-3748
Rev. argent. cardiol. vol.76 no.4 Ciudad Autónoma de Buenos Aires July/Aug. 2008
Efecto de la elastancia arterial efectiva sobre la función sistólica ventricular izquierda en la estenosis aórtica grave
Ricardo A. MiglioreMTSAC, María E. AdaniyaMTSAC, Miguel Barranco, Martín Bruzzese†, Guillermo Miramont, Florencio T. Guerrero, Horacio TamagusukuMTSAC, Alfredo SinisiMTSAC
Hospital Eva Perón, San Martín, Provincia de Buenos Aires
MTSAC Miembro Titular de la Sociedad Argentina de Cardiología
† Para optar a Miembro Titular de la Sociedad Argentina de Cardiología
Recibido: 29/11/2007
Aceptado: 25/03/2008
Dirección para separatas: Dr. Ricardo A. Migliore Moreno 3518 - 4° E (1650) San Martín Provincia de Buenos Aires, Argentina e-mail: rmigliore@intramed.net
RESUMEN
Antecedentes
La disfunción ventricular izquierda en la estenosis aórtica (EAo) está relacionada con el exceso de poscarga. El aumento de la poscarga puede deberse a la reducción del área valvular aórtica (AVA), a cambios en la geometría ventricular y a las características de la vasculatura arterial. La elastancia arterial efectiva (Ea) es un índice de carga vascular que incorpora la impedancia característica, la resistencia y la distensibilidad arterial.
Objetivo
Evaluar el efecto de la Ea sobre la función sistólica del ventrículo izquierdo en la EAo grave.
Material y métodos
Se estudiaron prospectivamente 54 pacientes con EAo grave evaluados mediante los gradientes transvalvulares, el AVA, la resistencia valvular y el índice de pérdida de energía. La Ea se calculó mediante el cociente entre la presión de fin de sístole y el volumen sistólico. La presión de fin de sístole se obtuvo a partir del pulso carotídeo calibrado con la presión arterial medida con esfigmomanómetro. Como medida de la poscarga global, se calculó la impedancia valvuloaórtica (Zva), definida por: (presión sistólica + gradiente medio neto) / índice de volumen sistólico. La Zva tiene en cuenta el efecto de la EAo y la Ea. Los pacientes se dividieron en tres grupos: G1, EAo con insuficiencia cardíaca (NYHA III-IV) (n = 13), G2, EAo sintomática pero sin insuficiencia cardíaca (n = 13) y G3, EAo asintomática (n = 28).
Resultados
La fracción de eyección (Fey) (%) fue menor en el G1 (33 ± 15) en comparación con el G2 (42 ± 16) y el G3 (65 ± 14); p < 0,01. La Ea (mm Hg/ml) fue mayor en el G1 (2,46 ± 0,8) con respecto al G2 y el G3 (1,83 ± 0,52 y 1,73 ± 0,47; p < 0,01), al igual que la Zva (mm Hg/ml/ m2): G1 (6,5 ± 2,2), G2 y G3 (4,8 ± 1,0 y 4,7 ± 1,5; p < 0,01). En el análisis univariado, la Zva se correlacionó con la Ea (r = 0,88; p < 0,0001) y la Fey (r = -0,41; p < 0,01). En el análisis multivariado, la Ea y la Zva fueron predictores independientes de la fracción de eyección.
Conclusión
En la EAo grave, el aumento del componente vascular de la poscarga evaluado a través de la Ea contribuye a la reducción de la función sistólica.
Palabras clave: Estenosis de la válvula aórtica; Función ventricular izquierda; Ecocardiografía de Doppler
Abreviaturas
AVA Área valvular aórtica
Ea Elastancia arterial efectiva
EAo Estenosis aórtica
Fey Fracción de eyección
HTA Hipertensión arterial
IAM Infarto agudo de miocardio
IPE Índice de pérdida de energía
PAM Presión arterial media
PFS Presión de fin de sístole
PP Presión del pulso
RVA Resistencia valvular aórtica
SC Superficie corporal
TSVI Tracto de salida del ventrículo izquierdo
VFS Volumen de fin de sístole
VFD Volumen de fin de diástole
VI Ventrículo izquierdo
VS Volumen sistólico
VM Volumen minuto
Zva Impedancia valvuloarterial
SUMMARY
Effect of Effective Arterial Elastance on Left Ventricular Systolic Function in Severe Valvular Aortic Stenosis
Background
Left ventricular dysfunction in valvular aortic stenosis (AS) is related to an elevated afterload. This increase may be related to a reduction in aortic valve area (AVA), to changes in ventricular geometry and to the characteristics of the arterial vessels. Effective arterial elastance (Ea) is an index of arterial vascular load which incorporates the characteristic arterial impedance, and arterial resistance and distensibility.
Objective
To assess the effect of Ea on left ventricular systolic function in severe valvular AS.
Material and Methods
We prospectively studied 54 patients with severe AS; transvalvular gradient, AVA, valvular resistance and energy loss index were assessed. Ea was estimated as the end-systolic pressure/stroke volume ratio. Carotid blood pressure waveform was calibrated against blood pressure measured by conventional cuff sphygmomanometry to calculate endsystolic pressure. We estimated global afterload by the "valvulo-arterial impedance" (Zva) formulated as follows: (systolic arterial pressure + mean net pressure gradient)/ stroke-volume index. Zva considers the effect of AS and Ea. Patients were divided in three groups: G1, AS with heart failure (NYHA III-IV) (n = 13), G2, symptomatic AS without heart failure (n = 13), and G3, asymptomatic AS (n =28).
Results
Ejection fraction (EF) (%) was lower in G1 (33±15) compared to G2 (42±16) and to G3 (65±14); p<0.01. Ea (mm Hg/ml) and Zva (mm Hg/ml/m2) were greater in G1 (2.46±0.8 and 6.5±2.2, respectively) than in G2 and G3 (1.83±0.52 and 1.73±0.47; p<0.01, and 4.8±1.0 y 4.7±1.5; p < 0.01, respectively). When univariate analysis was performed, Zva correlated with Ea (r=0.88; p<0.0001) and EF (r=-0.41; p<0.01). In multivariate analysis Ea and Zva were independent predictors for EF.
Conclusions
In severe AS, the increase of the vascular component of the afterload, assessed by the Ea, contributes to a reduction in systolic function.
Key words: Aortic Valve Stenosis; Left Ventricular Function; Doppler Echocardiography
INTRODUCCIÓN
La aparición de síntomas en la historia natural de la estenosis aórtica (EAo) como el angor, el síncope o la insuficiencia cardíaca se asocian con una mortalidad alta (75%) a los 3 años de no mediar tratamiento quirúrgico. (1) Sin embargo, algunos pacientes son hospitalizados debido a insuficiencia cardíaca grado IIIIV (NYHA) sin referir antecedentes de valvulopatía ni disnea y/o angor en el interrogatorio, debido generalmente a una restricción paulatina en la actividad física. El acortamiento de la fibra miocárdica y el volumen expulsado por el ventrículo izquierdo (VI) se relacionan inversamente con la poscarga. De esta manera, frente a una disminución de un parámetro eyectivo como la Fey, ella puede deberse a un aumento de la poscarga o a una disminución del inotropismo. (2) En el último caso, la Fey es inferior a la esperada para determinado nivel de poscarga. La disfunción ventricular izquierda en la EAo se debe generalmente al exceso de poscarga, exceptuando los pacientes que presentan isquemia significativa, secuela de necrosis extensa o miocardiopatía asociada. (3) El aumento de la poscarga puede deberse a la reducción del área valvular aórtica (AVA), a cambios en la geometría ventricular y a las características de la vasculatura arterial. Por lo tanto, en la EAo, la relación Fey-poscarga es más compleja que lo esperado, ya que al efecto de la obstrucción al tracto de salida se le agregan las fuerzas que se oponen a la eyección dependientes de las características físicas de las arterias periféricas como la impedancia arterial, la cual está determinada por la relación fásica entre la presión y el volumen aórtico y de la resistencia periférica, la rigidez de la pared aórtica, (4) las propiedades de la inercia sanguínea y de las ondas de reflexión que se producen en las bifurcaciones arteriales. (5-7)
Recientemente, Briand (8) describió el concepto de impedancia valvuloarterial (Zva) con el propósito de cuantificar la poscarga global en la EAo (Figura 1A). (9) La Zva incluye el efecto de la estenosis valvular a través del índice de pérdida de energía (IPE, el cual tiene en cuenta la recuperación de presión para el cálculo del área valvular efectiva) y de la distensibilidad arterial. Si bien Briand halló disminución de la Fey en los pacientes que tenían una distensibilidad arterial menor, existen otros parámetros que pueden describir en forma más adecuada el modelo hidráulico de la vasculatura arterial. Una estimación de la carga vascular más precisa descripta por Sunagawa (10) es la elastancia arterial efectiva (Ea), determinada por el cociente entre la presión de fin de sístole y el volumen sistólico. Nuestra hipótesis de trabajo fue analizar el efecto de la Ea arterial sobre la función sistólica del ventrículo izquierdo en pacientes con estenosis aórtica grave.

Fig. 1. A. Impedancia valvuloarterial (Zva). Véase explicación en el texto. PSVI: Presión sistólica del ventrículo izquierdo. PAS: Presión arterial sistémica. GMnet: Gradiente medio neto. VS: Volumen sistólico. VSi: Índice de volumen sistólico. GMvc: Gradiente medio a nivel de la vena contracta. VI: Ventrículo izquierdo. AI: Aurícula izquierda. Ao: Aorta.B. Registro del pulso carotídeo calibrado en simultáneo con fonocardiograma (FCG) y electrocardiograma (ECG) utilizado para el cálculo de la elastancia arterial efectiva (Ea). SS: Soplo sistólico
MATERIAL Y MÉTODOS
Se estudiaron prospectivamente 54 pacientes con edad promedio de 71 ± 10 años, 28 hombres y 26 mujeres portadores de estenosis valvular aórtica grave definida como área valvular aórtica (AVA) < 1 cm2, a los cuales se les había solicitado eco-Doppler. Se excluyeron los pacientes que presentaban insuficiencia aórtica o mitral de grado moderado o grave. Quince pacientes estaban internados, de los cuales 13 presentaron insuficiencia cardíaca grado III-IV (11 pacientes en unidad coronaria y 2 en sala general) y 2 pacientes ingresaron en unidad coronaria con el diagnóstico de angor de reciente comienzo. El 53% de los pacientes (8/15) desconocían ser portadores de valvulopatía aórtica. Los 41 pacientes restantes concurrieron en forma ambulatoria para evaluación de soplo sistólico aórtico. De estos últimos, 13 pacientes presentaban síntomas, 5 angina de pecho y 8 disnea grado I-II. A todos los pacientes se les realizó ecocardiograma Doppler completo, además de, previo a éste, el interrogatorio para detectar la presencia de factores de riesgo coronario y síntomas, examen físico cardiovascular, medición de la presión arterial en decúbito lateral izquierdo y registro del pulso carotídeo. A los pacientes internados se les realizó el estudio luego de lograr la estabilidad clínica con el tratamiento instituido. Se consideró antecedente de hipertensión arterial a la necesidad de haber indicado tratamiento antihipertensivo previamente y de cardiopatía isquémica si el paciente había presentado: 1) antecedentes de IAM, angioplastia o cirugía de revascularización, 2) obstrucciones mayores del 50% en las arterias coronarias determinadas por angiografía y 3) acinesia en el ecocardiograma.
Ecocardiograma y Doppler cardíaco
El estudio se realizó con un ecocardiógrafo TOSHIBA SS140A con transductor de 2,5 MHz, con el paciente en decúbito lateral izquierdo, utilizando la derivación DII del electrocardiograma como referencia. El flujo del tracto de salida del VI (TSVI) se registró mediante la colocación del volumen de muestra del Doppler pulsado por debajo de la válvula aórtica en la vista de 5 cámaras apical. Con Doppler continuo se registró el flujo aórtico desde las vistas apical, subxifoidea, paraesternal derecha y supraesternal; para el análisis se consideró la ventana desde la cual se obtuvo la máxima velocidad pico. La velocidad del registro fue de 100 mm/seg. El estudio se grabó en videocasete para su posterior análisis.
Los parámetros ecocardiográficos medidos fueron:
– Ecocardiograma bidimensional: volumen de fin de diástole (VFD), volumen de fin de sístole (VFS) a través del método área - longitud en 4 y 2 cámaras. Diámetros de la aorta a nivel del anillo, senos de Valsalva, unión sinotubular y en la porción ascendente a 1 cm de la unión sinotubular.
– Doppler: integral del flujo en el tracto de salida del VI y del flujo aórtico, gradiente pico y medio aórtico mediante la ecuación de Bernoulli modificada.
Carotidograma calibrado
Luego de realizar el ecocardiograma se registró el carotidograma con un transductor de pulso TPW - 01 A y se midió la presión arterial con esfigmomanómetro en el brazo derecho con el paciente en decúbito lateral izquierdo. El carotidograma se calibró de acuerdo con el método utilizado en nuestro laboratorio, (11) según el cual se considera que la presión arterial sistólica se corresponde con la onda más alta del carotidograma y la presión arterial diastólica (fase 5), con la porción más baja. Luego se mide la distancia entre la deflexión máxima y la mínima, a la que se considera equivalente a la presión arterial diferencial o presión del pulso. Luego de establecer dicha equivalencia, se mide la distancia desde el punto de fin de sístole hasta la base, se convierte en mm Hg por regla de tres simple y se le suma la presión arterial diastólica. De esta manera, la presión de fin de sístole (PFS) se calcula en forma no invasiva.
Evaluación de la función sistólica del ventrículo izquierdo
La Fey se calculó por el método convencional. El volumen sistólico (VS) se estimó mediante el producto de la integral del flujo en el TSVI y el área del TSVI y el volumen minuto (VM) como el producto de la frecuencia cardíaca por el VS.
Evaluación de la estenosis aórtica
El AVA efectiva se calculó con la ecuación de continuidad mediante el cociente entre el volumen sistólico y la integral de flujo aórtico.
La resistencia valvular aórtica (RVA) pico y media se calculó con la siguiente fórmula: RVA (dinas/seg/cm-5) = 1.333. Gradiente (pico o medio) (mm Hg) / flujo aórtico (ml/ seg), con el flujo aórtico (ml/seg) calculado como el VS (ml) dividido por el tiempo eyectivo (seg).
Se calculó el índice de pérdida de energía (IPE), el cual tiene en cuenta la recuperación de presión a nivel de la aorta ascendente y por lo tanto el gradiente valvular más "real", lo que evita la sobrestimación que podría surgir con la ecuación de continuidad. Se utilizó la fórmula propuesta por García: (12, 13)
IPE (cm2/m2) = [(AVA · AA) / (AA - AVA)] / SC
donde AA (cm2) es el área de corte transversal aórtica calculada a nivel de la unión sinotubular y SC (cm2) es la superficie corporal.
Evaluación de la hemodinamia arterial sistémica
La presión del pulso (PP) se estimó como la diferencia entre la presión arterial sistólica y la diastólica medida con esfigmomanómetro. El cociente PP/VS se calculó como índice de distensibilidad arterial (14) y la elastancia arterial (Ea), un método más adecuado para evaluar la mecánica arterial, el cual se calculó como el cociente entre la PFS y el VS (Figura 1 B). La PFS se estimó con el método del carotidograma calibrado descripto anteriormente. La resistencia vascular periférica se calculó como: (80 × PAM)/VM, donde PAM es la presión arterial media.
Evaluación de la poscarga global
En pacientes con EAo se debe considerar que la poscarga está determinada por la obstrucción valvular más la carga impuesta por la circulación sistémica. Para ello, la Zva se calculó de la siguiente manera (Figura 1 A):
Zva (mm Hg/ml/m2) = (PAS (mm Hg) + GMneto (mm Hg) / VSi (ml/m2)
donde PAS es la presión arterial sistémica, GMneto el gradiente medio transvalvular aórtico corregido para la recuperación de presión de acuerdo con la fórmula de Baumgartner (15) y VSi, el índice de VS.
Los pacientes fueron divididos en tres grupos: grupo 1 (G1, n = 13) pacientes con insuficiencia cardíaca grado IIIIV, grupo 2 (G2, n = 13) pacientes con EAo sintomática y grupo 3 (G3, n = 28) pacientes con EAo asintomáticos.
Análisis estadístico
La variables continuas se expresan como media ± desviación estándar. Para la comparación de los grupos se utilizó el análisis de la varianza. El análisis univariado de las variables se efectuó con el coeficiente de correlación r. Para el establecer los predictores independientes de la Fey se utilizó el análisis multivariado escalonado hacia adelante. Como límite de significación se consideró una p < 0,05.
RESULTADOS
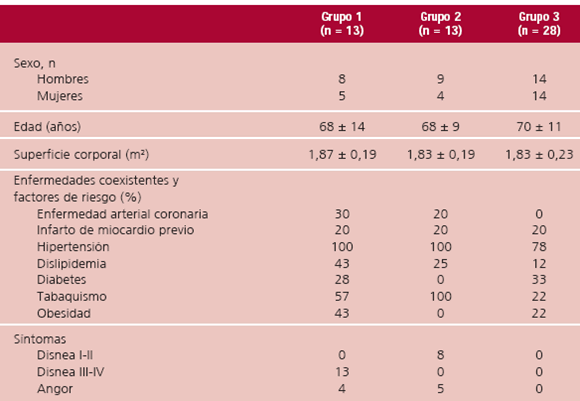
En la Tabla 1 pueden observarse las características demográficas y clínicas de los pacientes estudiados. No hubo diferencias significativas entre los grupos con respecto a la edad, superficie corporal y sexo, si bien hubo mayor proporción de hombres en los grupos 1 y 2. Los factores de riesgo más frecuentes fueron HTA, tabaquismo, dislipidemia y obesidad, sin diferencias significativas entre los tres grupos. El antecedente de cardiopatía isquémica asociada fue más frecuente en los grupos 1 y 2. Por definición, la disnea grado III-IV estuvo presente en los 13 pacientes del G1, de los cuales 4 presentaron además angor. Ocho pacientes del G2 refirieron disnea grado I-II y 5 pacientes, angor.
Tabla 1. Características demográficas y clínicas
Hemodinamia arterial periférica (Tabla 2)
La presión arterial sistólica, la presión arterial diastólica, la presión de fin de sístole y la frecuencia cardíaca no presentaron diferencias significativas entre los tres grupos. Un parámetro clínico de estimación de la distensibilidad arterial como la PP tampoco presentó diferencias significativas entre los tres grupos. La Ea fue significativamente mayor en el G1 (2,46 ± 0,8 mm Hg/ml) que en los grupos 2 y 3 (1,83 ± 0,52 mm Hg/ml y 1,73 ± 0,47 mm Hg/ml, respectivamente; p < 0,01). El cociente PP/VS estuvo incrementado en el G1 (1,1 ± 0,41; p < 0,03) y el G2 (0,94 ± 0,33; p < 0,03) con respecto al G3. Este último hallazgo estuvo influido por la disminución del VS en los grupos 1 y 2 (49 ± 18 ml y 55 ± 19 ml p < 0,03) con respecto al G3 (69 ± 18 ml), ya que el volumen sistólico es el denominador de la relación PP/VS. Estos hallazgos sugieren que en los pacientes de los grupos 1 y 2 la PP no expresa disminución de la distensibilidad arterial debido a que la disminución del VS podría enmascarar dicho hallazgo.
Tabla 2. Hemodinamia arterial periférica y parámetros de eco- Doppler

Función sistólica del ventrículo izquierdo
Como era esperable, la Fey estuvo significativamente disminuida en el G1 (33% ± 15%) con respecto a los grupos 2 y 3 (42% ± 16% y 65% ± 14%; p < 0,01). Si bien la Fey fue menor en el G2 con respecto al G3, la diferencia no fue significativa.
Gravedad de la estenosis aórtica
El AVA, la resistencia valvular pico y media y el IPE no presentaron diferencias significativas entre los tres grupos. Si bien en el G1 los gradientes pico (62 ± 21 mm Hg) y medio (30 ± 13 mm Hg) fueron menores que en el G2 (77 ± 36 mm Hg y 37 ± 22 mm Hg) y en el G3 (77 ± 29 mm Hg y 46 ± 18 mm Hg), la diferencia no fue significativa.
Poscarga global
La Zva fue mayor en el G1 (6,5 ± 2,2 mm Hg/ml/m2) que en los grupos 2 y 3 (4,8 ± 1 mm Hg/ml/m2 y 4,7 ± 1,5 mm Hg/ml/m2, respectivamente; p < 0,01). La Zva se correlacionó significativamente con la Ea (r = 0,88; p < 0,0001, y = 2,4223x + 0,6784) y con la Fey (r = - 0,41; p < 0,01 y = -0,0363x + 6,7738) (Figura 2). No hubo correlación entre Zva y el AVA ni entre la Fey y el AVA (Figura 2). En el análisis multivariado, la Ea y la Zva fueron predictores independientes de la Fey (coef. –4,25 T –2,36; p < 0,02).

Fig. 2. Correlación de la impedancia valvuloarterial (Zva) con la elastancia arterial efectiva (Ea) y la fracción de eyección (Fey) (superior) y del área valvular aórtica (AVA) con la impedancia valvuloarterial (Zva) y la fracción de eyección (Fey) (inferior).
DISCUSIÓN
El principal hallazgo de este estudio es el efecto de la Ea sobre la poscarga global (Zva) y la Fey en los pacientes con EAo grave, lo cual podría potencialmente tener implicaciones pronósticas y terapéuticas, si se tiene en cuenta que hasta hace poco tiempo la única alternativa terapéutica era el tratamiento quirúrgico. (16) Para el análisis, los pacientes fueron divididos en tres grupos que se asemejan a la historia natural de la EAo grave: pacientes asintomáticos (G3) en una primera etapa compensada, sintomáticos en una etapa intermedia (G2) y con insuficiencia cardíaca en la etapa de descompensación (G1). Sin embargo, la mayoría de los pacientes con insuficiencia cardíaca desconocían la existencia de su valvulopatía, lo que puede deberse a restricción paulatina de la actividad física y/o ausencia de diagnóstico más precoz. La Fey se relaciona inversamente con la poscarga, pero en la EAo esta relación es más compleja por la dificultad que surge en valorar en cuánto contribuye la obstrucción al tracto de salida y el acoplamiento con la circulación periférica al aumento de la poscarga. (9) El incremento de la tensión arterial en pacientes con EAo mediante ejercicio isométrico, fenilefrina (17) o angiotensina II (18) induce disminución del volumen sistólico y aumento de la presión de fin de diástole del VI y se ha comunicado la aparición de síntomas con área valvular aórtica menos reducida y gradientes menores en pacientes con HTA asociada con EAo. (19) No hubo diferencias entre los tres grupos al comparar la gravedad de la EAo a través de los gradientes, el AVA, la resistencia valvular aórtica pico y media y el IPE, por lo que puede considerarse que la "carga" valvular fue la misma en los tres grupos. Los gradientes pico y medio fueron menores en el G1, aunque sin significación estadística, probablemente debido a la disminución del VS y del flujo transvalvular aórtico observado en dicho grupo. La Ea estuvo incrementada significativamente en el grupo de pacientes con insuficiencia cardíaca y se correlacionó en forma negativa con la Fey. El cociente PP/VS se incrementó en los grupos 1 y 2; sin embargo, no se correlacionó significativamente con la Fey. El cociente PP/ VS se relaciona con la distensibilidad arterial (20) y probablemente estuvo influido por la disminución del VS observada en esos grupos. De los dos índices que evalúan la mecánica arterial, la Ea parece más adecuada que el cociente PP/VS porque incorpora la impedancia característica (Z0), la resistencia (R), la distensibilidad (D) y la longitud del ciclo (T). (21) Dado que los dos índices comparten el mismo denominador (VS), la diferencia está en que PP/VS utiliza la presión del pulso (PP) y la Ea emplea la presión de fin de sístole (PFS); es más correcto utilizar esta última para caracterizar el componente vascular de la poscarga, (10) ya que el cociente R/T contribuye 2,5 veces más que 1/D a la Ea. (22) El cociente R/T implica que la resistencia es normalizada a la longitud del ciclo (T); de esta manera tiene en cuenta el componente pulsátil además del estático (R). Según puede observarse en la Figura 3, dos pacientes pueden tener las mismas cifras de presión arterial sistólica, diastólica y PP pero diferentes PFS, lo cual indica diferentes elastancias arteriales. (23) De acuerdo con nuestros hallazgos, la "carga" vascular estuvo significativamente aumentada en los pacientes del G1 en concordancia con el aumento de la Zva, un parámetro que evalúa la poscarga global en la EAo. La Zva se correlacionó significativamente con la Ea, pero no con PP/ VS. Briand (8) estudió pacientes con EAo moderada y grave; subdividió los grupos según presentaran rigidez arterial normal o aumentada determinadas por PP/VS. De acuerdo con sus hallazgos, el cociente PP/ VS impactó significativamente sobre la Fey. Nuestro trabajo difiere del de Briand en que se incluyeron pacientes con EAo grave clasificados en tres grupos que intentan remedar la evolución natural de la valvulopatía. Además, conceptualmente, la Ea parece más adecuada que PP/VS para caracterizar las propiedades arteriales. (24) Un hallazgo en concordancia con el trabajo de Briand fue la incidencia alta de factores de riesgo cardiovascular como HTA, tabaquismo, dislipidemia y obesidad en todos los grupos, pero especialmente en los grupos 2 y 3, los cuales probablemente influyen de manera negativa en las propiedades físicas de las arterias. Por lo tanto, este hallazgo amplía las posibilidades del tratamiento médico de una enfermedad activa como la EAo (19, 25, 26) y hace necesario un tratamiento de los factores de riesgo en forma similar al de la cardiopatía isquémica, especialmente desde los estadios más precoces de la enfermedad (estenosis leve a moderada). Estas medidas terapéuticas no se contraponen con el tratamiento con estatinas propuesto para disminuir la progresión de la EAo, (27) aunque algunos estudios no mostraron beneficio, (28) ya que la fisiopatología de la aterosclerosis vascular con presencia de infiltración de lípidos, inflamación, neoangiogénesis y calcificación es similar a la comunicada en la anatomía patológica de la válvula aórtica. (29) La reducción de la carga vascular adquiere relevancia clínica, especialmente en los pacientes con EAo grave, Fey < 35% e índice cardíaco < 2,2 L/min/m2, en los cuales el tratamiento con nitroprusiato de sodio ha demostrado que mejora el perfil hemodinámico previo a la cirugía. (30, 31)
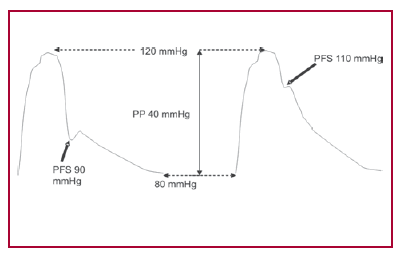
Fig. 3. Véase explicación en el texto.
Limitaciones
No es posible establecer con mayor precisión la influencia de la cardiopatía isquémica sobre la función del VI, dado que a la mayoría de los pacientes no se les realizó coronariografía, ya sea por no estar indicada (52% de pacientes asintomáticos) o por estar disponibles los datos en todos los pacientes de los grupos 1 y 2.
CONCLUSIONES
En la EAo grave, el aumento del componente vascular de la poscarga evaluado a través de la Ea contribuye a la reducción de la función sistólica.
1. Frank S, Johnson A, Ross J Jr. Natural history of valvular aortic stenosis. Br Heart J 1973;35:41-6. [ Links ]
2. Migliore RA. Manejo terapéutico de la estenosis aórtica severa: ¿Cuando es demasiado tarde el reemplazo valvular aórtico? Rev Soc Parag Cardiol 2004;2:76-82. [ Links ]
3. Migliore RA. Estenosis aórtica. En: Piñeiro DJ. Ecocardiografía para la toma de decisiones clínicas. Buenos Aires: Editorial Médica Panamericana; 2005. p. 529-67. [ Links ]
4. Stergiopulos N, Westerhof N. Determinants of pulse pressure. Hypertension 1998;32:556-9. [ Links ]
5. Nichols WW, Conti CR, Walker WE, Milnor WR. Input impedance of the systemic circulation in man. Circ Res 1977;40:451-8. [ Links ]
6. Nichols WW, O´Rouke MF. Wave reflection. En: Nichols WW, O'Rouke MF. Mc Donald's blood flow in arteries. Theoretical, experimental and clinical principles. 4th ed. NY, Oxford University Press; 1998. p. 201. [ Links ]
7. Stergiopulos N, Westerhof BE, Westerhof N. Total arterial inertance as the fourth element of the windkessel model. Am J Physiol 1999;276:H81-8. [ Links ]
8. Briand M, Dumesnil JG, Kadem L, Tongue AG, Rieu R, Garcia D, et al. Reduced systemic arterial compliance impacts significantly on left ventricular afterload and function in aortic stenosis: implications for diagnosis and treatment. J Am Coll Cardiol 2005;46:291-8. [ Links ]
9. Garcia D, Barenbrug PJ, Pibarot P, Dekker AL, van der Veen FH, Maessen JG, et al. A ventricular-vascular coupling model in presence of aortic stenosis. Am J Physiol Heart Circ Physiol 2005;288:H1874-84. [ Links ]
10. Sunagawa K, Maughan WL, Burkhoff D, Sagawa K. Left ventricular interaction with arterial load studied in isolated canine ventricle. Am J Physiol 1983;245:H773-80. [ Links ]
11. Migliore RA, Guerrero FT, Adaniya ME, Ianariello J, Tamagusuku H, Posse RA. Estimación de la pre y poscarga ventricular izquierda en la enfermedad de Chagas. Rev Argent Cardiol 1990;58:252-9. [ Links ]
12. Garcia D, Pibarot P, Dumesnil JG, Sakr F, Durand LG. Assessment of aortic valve stenosis severity: A new index based on the energy loss concept. Circulation 2000;101:765-71. [ Links ]
13. Garcia D, Dumesnil JG, Durand LG, Kadem L, Pibarot P. Discrepancies between catheter and Doppler estimates of valve effective orifice area can be predicted from the pressure recovery phenomenon: practical implications with regard to quantification of aortic stenosis severity. J Am Coll Cardiol 2003;41:435-42. [ Links ]
14. Chemla D, Hébert JL, Coirault C, Zamani K, Suard I, Colin P, et al. Total arterial compliance estimated by stroke volume-to-aortic pulse pressure ratio in humans. Am J Physiol 1998;274:H500-5. [ Links ]
15. Baumgartner H, Stefenelli T, Niederberger J, Schima H, Maurer G. Overestimation of catheter gradients by Doppler ultrasound in patients with aortic stenosis: a predictable manifestation of pressure recovery. J Am Coll Cardiol 1999;33:1655-61. [ Links ]
16. Chan KL. Is aortic stenosis a preventable disease? J Am Coll Cardiol 2003;42:593-9. [ Links ]
17. Awan N, Vismara LA, Miller RR, DeMaria AN, Mason DT. Effects of isometric exercise and increased arterial impedance on left ventricular function in severe aortic valvular stenosis. Br Heart J 1977;39:651-6. [ Links ]
18. Perloff JK, Binnion PF, Caulfield WH, DeLeon AC Jr. The use of angiotensin in the assessment of left ventricular function in fixed orifice aortic stenosis. Circulation 1967;35:347-57. [ Links ]
19. Antonini-Canterin F, Huang G, Cervesato E, Faggiano P, Pavan D, Piazza R, et al. Symptomatic aortic stenosis: does systemic hypertension play an additional role? Hypertension 2003;41:1268-72. [ Links ]
20. Stergiopulos N, Segers P, Westerhof N. Use of pulse pressure method for estimating total arterial compliance in vivo. Am J Physiol 1999;276:H424-8. [ Links ]
21. Segers P, Stergiopulos N, Westerhof N. Relation of effective arterial elastance to arterial system properties. Am J Physiol Heart Circ Physiol 2002;282:H1041-6. [ Links ]
22. Chemla D, Antony I, Lecarpentier Y, Nitenberg A. Contribution of systemic vascular resistance and total arterial compliance to effective arterial elastance in humans. Am J Physiol Heart Circ Physiol 2003;285:H614-20. [ Links ]
23. Kelly RP, Ting CT, Yang TM, Liu CP, Maughan WL, Chang MS, et al. Effective arterial elastance as index of arterial vascular load in humans. Circulation 1992;86:513-21. [ Links ]
24. Peterson KL. Severe calcific aortic stenosis left ventricular afterload and its quantification. J Am Coll Cardiol 2005;46: 299-301. [ Links ]
25. Volberg VI, Berensztein CS, Ber MG, Lanosa G, Lerman J, Piñeiro DJ. Eficacia de la relación gradiente pico-gradiente medio para el diagnóstico de la gravedad de la estenosis aórtica. Rev Argent Cardiol 2006;74:123-8. [ Links ]
26. Chambers J. Can high blood pressure mask severe aortic stenosis? J Heart Valve Disease 1998;7:277-8. [ Links ]
27. Moura LM, Ramos SF, Zamorano JL, Barros IM, Azevedo LF, Rocha-Gonçalves F, et al. Rosuvastatin affecting aortic valve endothelium to slow the progression of aortic stenosis. J Am Coll Cardiol 2007;49:554-61. [ Links ]
28. Cowell SJ, Newby DE, Prescott RJ, Bloomfield P, Reid J, Northridge DB, et al; Scottish Aortic Stenosis and Lipid Lowering Trial, Impact on Regression (SALTIRE) Investigators. A randomized trial of intensive lipid-lowering therapy in calcific aortic stenosis. N Engl J Med 2005;352:2389-97. [ Links ]
29. Mohler ER 3rd, Gannon F, Reynolds C, Zimmerman R, Keane MG, Kaplan FS. Bone formation and inflammation in cardiac valves. Circulation 2001;103:1522-8. [ Links ]
30. Khot UN, Novaro GM, Popoviæ ZB, Mills RM, Thomas JD, Tuzcu EM, et al. Nitroprusside in critically ill patients with left ventricular dysfunction and aortic stenosis. N Engl J Med 2003;348:1756-63. [ Links ]
31. Popovic ZB, Khot UN, Novaro GM, Casas F, Greenberg NL, Garcia MJ, et al. Effects of sodium nitroprusside in aortic stenosis associated with severe heart failure: pressure-volume loop analysis using a numerical model. Am J Physiol Heart Circ Physiol 2005;288: H416-23. [ Links ]














