Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista argentina de cardiología
versión On-line ISSN 1850-3748
Rev. argent. cardiol. v.76 n.4 Ciudad Autónoma de Buenos Aires jul./ago. 2008
Modelado farmacocinético-farmacodinámico de fármacos antihipertensivos: su aplicación en la práctica clínica
Christian Höcht1, 2, Marcos A. Mayer1, 2, Javier A. W. Opezzo1, 2, Facundo M. Bertera1, Carlos A. Taira1, 2
1 Cátedra de Farmacología, Facultad de Farmacia y Bioquímica, Universidad de Buenos Aires
2 Instituto de Fisiopatología y Bioquímica Clínica, Facultad de Farmacia y Bioquímica, Universidad de Buenos Aires
Dirección para separatas: Christian Höcht Cátedra de Farmacología, Instituto de Fisiopatología y Bioquímica Clínica, Facultad de Farmacia y Bioquímica, Universidad de Buenos Aires Junín 956 - (C1113AAD) Buenos Aires, Argentina Tel. +(54-11) 4964-8265 Fax: +(54-11) 4508-3645 e-mail: chocht@ffyb.uba.ar
RESUMEN
El conocimiento de las propiedades farmacocinéticas-farmacodinámicas (PK/PD) de los fármacos puede optimizar la terapia antihipertensiva. El modelado PK/PD en la investigación clínica podría contribuir en el desarrollo del fármaco y en la práctica clínica en varios aspectos, entre ellos la evaluación de eficacia y seguridad de los antihipertensivos, mayor información durante el proceso del desarrollo, identificación de factores de variabilidad de la respuesta farmacológica, y permitir además una identificación rápida de malos respondedores o no respondedores y ayudar a determinar requerimientos óptimos del fármaco y dosis en cada paciente hipertenso. Hay algunas limitaciones en el modelado PK/PD de los antihipertensivos en la práctica clínica, entre las que se incluyen el uso de modelos farmacodinámicos inadecuados y la incapacidad de estudiar dosis elevadas de antihipertensivos para determinar el rango farmacodinámico completo del efecto antihipertensivo.
El propósito de esta revisión es describir el conocimiento actual del modelado PK/PD de los fármacos antihipertensivos en la investigación clínica y sus usos futuros.
Palabras clave: Fármacos antihipertensivos; Modelado farmacocinético-farmacodinámico; Práctica clínica; Optimización de la dosis
Abreviaturas
CE50 Concentración efectiva media
DE50 Dosis efectiva media
Emáx Efecto máximo
IECA Inhibidores de la enzima convertidora
MAPA Medición ambulatoria de la presión arterial
PD Farmacodinamia
PK Farmacocinética
S0 Sensibilidad inicial de la angiotensina II
SUMMARY
Pharmacokinetic-Pharmacodynamic Modelling of Antihypertensive Drugs: Its Application to Clinical Practice
Knowing the pharmacokinetic-pharmacodynamic properties (PK/PD) of drugs might optimize antihypertensive therapy. PK/PD modelling might not only contribute to develop the drug but might also help in clinical practice assessing the efficacy and safety of antihypertensive drugs, bringing more information during the developing process, identifying factors responsible for the variability in pharmacologic response, bad responders or non-responders, and determining the optimal requisites of the drug and doses in each patient with hypertension. There are some limitations in PK/ PD modelling of antihypertensive drugs in clinical practice, such as inadequate pharmacodynamic models and the inability to study high doses of antihypertensive drugs to determine the whole pharmacodynamic range of the antihypertensive effect.
The aim of this review is to describe the current knowledge on PK/PD modelling of antihypertensive drugs in clinical research, and its further uses.
Key words: Antihypertensive Drugs; Pharmacokinetic; Pharmacodynamic Modelling; Clinical Practice; Dose Optimization
INTRODUCCIÓN
La terapia antihipertensiva actual tiene dos inconvenientes que limitan la eficacia de la propuesta terapéutica en la reducción de la mortalidad cardiovascular. En primer lugar, el resultado de la terapia antihipertensiva es subóptima y sólo un tercio de los pacientes hipertensos tratados logran controlar sus valores tensionales luego de la administración de fármacos antihipertensivos en monoterapia. (1, 2) Estudios clínicos y observacionales han demostrado que el control de la presión arterial se puede mejorar con la administración de asociaciones de fármacos antihipertensivos. (1)
Otro inconveniente es la falla en la dosificación óptima de los fármacos antihipertensivos. (3) Tanto los diuréticos tiazídicos como los bloqueantes betaadrenérgicos se están indicando en la actualidad en la clínica práctica en dosis significativamente menores con respecto a los regímenes recomendados inicialmente, por lo cual en el pasado los pacientes hipertensos estuvieron expuestos innecesariamente a dosis elevadas de estos agentes farmacológicos con mayor riesgo de toxicidad. (3) Por otro lado, los inhibidores de la enzima convertidora de la angiotensina II (IECA) y los antagonistas de receptores de la angiotensina II se indican en la actualidad en dosis superiores a las aprobadas inicialmente, ya que se comprobó que el efecto de protección tisular con estos fármacos se logra con dosis más altas. (3)
La terapia farmacológica de la hipertensión se podría mejorar mediante la evaluación de las propiedades farmacocinéticas-farmacodinámicas (PK/PD) de los antihipertensivos mediante el modelado PK/PD. La integración de la farmacocinética y la farmacodinamia de estos agentes ayudaría a individualizar la elección del fármaco, la dosis y el intervalo entre dosis en cada paciente hipertenso. (4-7)
El objetivo del presente artículo es la descripción del conocimiento actual del modelado PK/PD de fármacos antihipertensivos y su contribución a la optimización de la terapia antihipertensiva.
PRINCIPIOS DEL MODELADO PK/PD
Los modelos PK/PD crean un puente entre el curso temporal de las concentraciones de fármacos en el organismo, evaluada por la farmacocinética (PK), y la intensidad de la respuesta farmacológica observada, cuantificada por la farmacodinamia (PD). (4) El enlace se establece mediante modelos matemáticos que permiten la estimación de parámetros como la concentración efectiva que produce el 50% de la respuesta máxima (CE50) y el efecto máximo (Emáx). El modelado PK/PD también provee información acerca del inicio, de la magnitud y de la duración del efecto terapéutico. (8) En la Figura 1 se grafica el principio del modelado PK/PD. En este punto es importante destacar que si bien tradicionalmente el parámetro dosis efectiva media (DE50) se considera un indicador de la potencia de un fármaco antihipertensivo, la DE50 es un parámetro híbrido que depende tanto de la afinidad del fármaco por su blanco molecular como de sus características farmacocinéticas. Por lo tanto, para asegurar una dosificación adecuada del fármaco antihipertensivo es esencial la estimación de parámetros farmacodinámicos "puros", como la CE50.
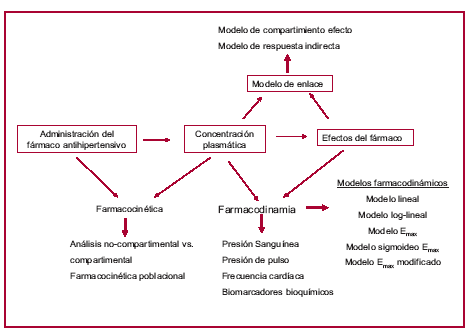
Fig. 1. Principios del modelado PK/PD de fármacos antihipertensivos.
El modelado PK/PD requiere la medición simultánea de niveles tisulares del fármaco y los correspondientes efectos farmacológicos en múltiples puntos temporales. (5) Para que el modelado PK/PD sea válido, el efecto debe cumplir con ciertos parámetros de validación, entre ellos continuidad, sensibilidad, objetividad y repetibilidad. (6)
Para mayor precisi ón en la estimación de la relación PK/PD, el número de mediciones de niveles tisulares de fármaco y del efecto correspondiente debería ser lo más elevado posible. (5) Sin embargo, el muestreo múltiple no siempre es posible en la práctica clínica, ya que requeriría la internación del paciente hipertenso. Para superar esta limitación, en los últimos años se han introducido los modelos poblacionales PK y PK/PD, los cuales requieren únicamente el muestreo plasmático en 2 o 3 puntos temporales. (9)
Es importante tambi én determinar el retraso entre respuesta del fármaco y niveles tisulares. (5) Para evaluar la existencia de una desconexión entre los niveles plasmáticos y el efecto antihipertensivo, es necesario graficar los niveles plasmáticos y el efecto farmacológico obtenido en diferentes puntos temporales, conectándolos por orden cronológico. En el diagrama aparece una histéresis cuando la magnitud del efecto corresponde a más de una concentración de fármaco. Así, una histéresis de giro contrario a las agujas del reloj puede explicarse por el desequilibrio entre la biofase y el compartimiento plasmático, (10) la aparición de metabolitos activos (11) o por mecanismos de acción indirectos. (12) Por otro lado, se sugiere una tolerancia en el efecto farmacológico cuando se observa un loop de histéresis de giro de agujas del reloj. (13)
Si hay conexi ón temporal entre niveles tisulares y respuesta farmacológica, los niveles plasmáticos podrán relacionarse directamente con el efecto farmacológico sin la necesidad de un nexo. (9) Los modelos PD utilizados para el modelado PK/PD se describen en la Tabla 1.
Tabla 1. Modelos farmacodinámicos comunes utilizados para el modelado PK/PD de fármacos antihipertensivos

El modelo PD m ás ampliamente aceptado para la evaluación de la relación PK/PD es el del efecto máximo (Emáx), ya que permite la estimación tanto de la potencia como de la eficacia del fármaco (Tabla 1). Sin embargo, la estimación de los parámetros PK/PD con el empleo del modelo Emáx necesita la determinación del rango farmacodinámico completo luego de una única dosis del fármaco, de modo que se requiere una dosis elevada para alcanzar una magnitud de efecto cercana a la respuesta máxima del fármaco. (5) Cuando el modelo Emáx se utiliza para estimar una curva sin un máximo claro, las estimaciones de Emáx y CE50 son extremadamente variables. (14) Schoemaker y colaboradores (14) diseñaron un modelo farmacodinámico en el que reemplazaron Emáx/CE50 por S0 en la ecuación Emáx. S0 es un parámetro más estable y definido como la sensibilidad inicial al fármaco en concentraciones bajas. En presencia de retraso del efecto farmacológico, las concentraciones plasmáticas no pueden vincularse directamente con el efecto farmacológico, por lo que se requieren modelos PK/PD más complejos (modelos de compartimiento efecto y de respuesta fisiológica indirecta). (9)
Justificación del modelado PK/PD de fármacos antihipertensivos
La mayoría de los fármacos antihipertensivos tienen un mecanismo de acción reversible y la magnitud del efecto está fuertemente relacionada con los niveles tisulares. (15) Para algunos antihipertensivos, por ejemplo IECA, la generación de metabolitos activos debe tenerse en cuenta y los niveles plasmáticos de los metabolitos deberían relacionarse con la respuesta farmacológica. (15)
El modelado PK/PD del efecto antihipertensivo está justificado considerando el hecho de que la presión sanguínea es un marcador biológico excelente de la eficacia clínica a largo plazo de fármacos antihipertensivos. (16, 17) Un gran número de ensayos comparativos aleatorizados han demostrado que para reducciones similares de presión arterial, las diferencias en la incidencia de morbilidad y mortalidad cardiovascular entre las clases de fármacos antihipertensivos son solamente pequeñas. (8)
La presión arterial cumple con los requerimientos que debe presentar el efecto para el modelado PK/ PD, que incluyen continuidad, sensibilidad, objetividad y repetibilidad. (16)
Aspectos metodológicos
Es importante determinar el modelo PK/PD adecuado para evitar conclusiones erróneas. (18) Harder y colaboradores (19) encontraron que la pendiente para el efecto hipotensor del verapamilo después de una dosis única fue mayor que la pendiente estimada luego de dosis múltiples. Aunque concluyen que hubo tolerancia al verapamilo debido a la exposición crónica al fármaco, la explicación más plausible es que un grado más alto de la curva concentración-respuesta del verapamilo se puede alcanzar debido a una concentración del fármaco más alta en el estado estacionario. (20) Nosotros hallamos una disminución dependiente de la dosis en la estimación de la pendiente del verapamilo con la aplicación del modelo lineal en ratas con coartación aórtica. (21) Como la respuesta farmacológica se incrementa más lentamente en la parte más alta de la curva concentración-respuesta, se obtiene una pendiente más declinada luego de una dosis más alta con respecto a una más baja. (21) También demostramos que la ecuación Emáx no permite una estimación exacta de parámetros PK/PD del efecto hipotensor del diltiazem, considerando que las estimaciones de CE50 fueron dependientes de la dosis. (22)
En cambio, el modelo Emáx modificado diseñado por Shoemaker y colaboradores permite una estimación exacta y precisa de la sensibilidad al efecto hipotensor del diltiazem cuando la respuesta máxima no puede obtenerse. (14, 22)
Debe considerarse la existencia del retardo temporal en el efecto antihipertensivo con respecto a la concentración plasmática. Tradicionalmente, se creía que no habría una relación entre bloqueantes beta y cambios de presión sanguínea. Sin embargo, hemos encontrado correlación entre los niveles de metoprolol y su efecto antihipertensivo en diferentes modelos de hipertensión experimental mediante un modelo PK/ PD con compartimiento efecto. (23-26). La racionalidad para usar este modelo radica en el mecanismo de los bloqueantes beta, que en el caso de los liposolubles puede incluir una acción central. (27)
La mayoría de los estudios PK/PD de IECA utilizan un modelo con compartimiento efecto para explicar el retardo del inicio de respuesta. (28-30) Esto podría explicarse por inhibición de la enzima convertidora de la angiotensina II y reducción de síntesis de angiotensina II.
En el modelado PK/PD de antihipertensivos es importante considerar el efecto placebo y la variación circadiana de la presión arterial. En el estudio PK/ PD en voluntarios o en pacientes hipertensos es necesario primero estimar el efecto placebo e incluirlo en el modelo para una estimación exacta de los parámetros PK/PD. (31, 32)
La presión sanguínea puede monitorizarse por mediciones con mangos convencionales y medición ambulatoria de la presión arterial (MAPA) de 24 horas. Trocóniz y colaboradores (32) encontraron que la estimación de parámetros PK/PD poblacionales para el efecto antihipertensivo de moxonidina no difiere al comparar la medición manual y la MAPA de 24 horas. Sin embargo, la MAPA permite una descripción detallada de perfiles farmacodinámicos individuales de moxinidina e individualización de la terapia. (32) La farmacodinamia de agentes que actúen sobre el sistema renina-angiotensina se podría monitorizar por determinación de la actividad de renina. (33, 34) La renina sería un marcador confiable de efectos cardiovasculares de fármacos que actúen sobre ese sistema. (33)
Otro aspecto para considerar es la selección de las muestras tisulares para monitorizar concentraciones de fármacos. (7) Se debe tener en cuenta que la presión arterial está regulada por una interacción de tejidos y órganos. (15) Se ha postulado que el efecto antihipertensivo de los bloqueantes beta es consecuencia del bloqueo en el miocardio, los riñones y el sistema nervioso central. (15) Entonces, el muestreo sanguíneo sería lo adecuado para monitorizar concentraciones de antihipertensivos y relacionarlos con sus efectos.
En la Tabla 2 se compendian las recomendaciones para el diseño experimental y análisis de datos para modelado PK/PD.
Tabla 2. Recomendaciones para el modelado PK/PD de fármacos antihipertensivos

APLICACIONES EN LA PRÁCTICA CLÍNICA
Variabilidad de la respuesta a antihipertensivos
Si bien la selección racional del agente más seguro actualmente está basada sobre la información obtenida en el examen físico (edad, sexo, raza, estado de tabaquismo, obesidad y lípidos), los factores que determinan la respuesta a los diferentes fármacos antihipertensivos no están claramente entendidos y no existe un método confiable para identificar cuál paciente responderá a cuál fármaco. (35)
Es importante considerar que la magnitud de la respuesta está determinada, en parte, por la sensibilidad del individuo al efecto farmacológico y la respuesta antihipertensiva está determinada por la cantidad de fármaco en el sitio blanco. Sin embargo, la mayoría de los estudios clínicos no evaluaron las concentraciones plasmáticas de antihipertensivos, por lo cual no aportan información de manera fehaciente con respecto a las fuentes de variabilidad de la respuesta cardiovascular. Por ejemplo, la respuesta antihipertensiva al verapamilo es mayor en la ancianidad, (36) pero no está claro si la mayor eficacia es producto de un incremento de la sensibilidad al fármaco o por niveles plasmáticos altos debido a una depuración reducida del verapamilo.
La mayoría de los estudios de antihipertensivos han estudiado la potencia del fármaco a través de la estimación de la DE50. Este parámetro es un híbrido farmacocinético y farmacodinámico debido a que combina la CE50 con parámetros de depuración y biodisponibilidad. (5) Por esto, esa estimación falla para establecer fuentes de variabilidad de respuesta antihipertensiva. (5)
El modelado PK/PD sería una herramienta poderosísima para el estudio de determinantes de respuesta a diferentes agentes antihipertensivos. Por ejemplo, los estudios PK/PD de bloqueantes alfaadrenérgicos (prazosín y doxazosín) demostraron que la respuesta a largo plazo al tratamiento es dependiente de la presión arterial basal y la respuesta farmacológica a la primera dosis. (37, 38) Donnelly y colaboradores (30) no encontraron una relación entre sensibilidad al enalapril (Emáx o CE50) y edad del paciente o actividad de renina, pero encontraron una correlación positiva entre Emáx y presión arterial pretratamiento. Murray y colaboradores (39) demostraron que la respuesta de la presión arterial a la primera dosis de IECA en pacientes con falla cardíaca no se puede predecir desde variables fisiopatológicas basales.
Más interesante, las investigaciones farmacogenéticas han identificado variaciones en genes particulares que tienen efecto sobre el metabolismo de fármacos antihipertensivos y podrían influir sobre la farmacodinamia antihipertensiva. (40, 41) El uso de modelado PK/PD para el análisis del impacto genético en la respuesta antihipertensiva puede mejorar nuestro entendimiento de determinantes de respuesta antihipertensiva de manera de individualizar la selección terapéutica.
Detección temprana de respondedores
Actualmente no existen determinantes claros de la respuesta farmacológica a los fármacos antihipertensivos y, por lo tanto, la selección de la terapia inicial es empírica. Una detección temprana de malos respondedores a antihipertensivos particulares podría agilizar la elección del régimen apropiado.
Varios estudios PK/PD han demostrado que la sensibilidad a la primera dosis de antihipertensivos se correlaciona con la respuesta luego de una y seis semanas de tratamiento, lo que sugiere que el efecto agudo sería un predictor de respuesta durante la terapia crónica.
Una aplicación del modelado PK/PD sería la identificación temprana de malos respondedores o no respondedores y determinación de requerimientos de la dosis individual para un control óptimo de presión arterial a largo plazo. (35)
Una limitación para el modelado PK/PD es la necesidad del muestreo plasmático para monitorizar niveles de fármacos. El modelado PK/PD poblacional permite la estimación de propiedades PK/PD de antihipertensivos mediante el muestreo sanguíneo espaciado, considerando que dos a tres puntos temporales serían suficientes para la estimación de la farmacocinética poblacional. (42, 43)
Optimización del régimen del fármaco antihipertensivo
El control óptimo de presión arterial requiere tratamientos que la reduzcan a lo largo de 24 horas. Aunque debe considerarse que todos los fármacos antihipertensivos permitidos para administración una vez diaria tienen una duración de acción comparable, es sabido que los antihipertensivos difieren en este aspecto. La estimación de la razón pico-valle es un índice excelente de duración de la acción. (44) Los fármacos que muestran una razón pico-valle alta ejercen un efecto antihipertensivo corto y requieren una dosificación elevada para reducir adecuadamente la presión sanguínea a lo largo de 24 horas. (44) Esta estrategia terapéutica está asociada con una caída profunda de la presión arterial al tiempo del efecto pico del fármaco, lo que aumenta el riesgo de hipotensión. (44)
Una razón pico-valle satisfactoria (> 60%) indica que la duración de acción de un fármaco antihipertensivo es apropiada para el intervalo de dosis elegido. (44) De esta manera, la estimación de parámetros PK/ PD de antihipertensivos y ulterior simulación de perfiles de respuesta para un rango de regímenes de dosificación alternativos permite la identificación de la dosis y del intervalo de dosificación óptimo en cada paciente. Meredith y colaboradores (45) estudiaron las propiedades PK/PD de una dosis única de enalapril con parámetros estimados para simular perfiles de presión arterial durante el tratamiento crónico con varios regímenes alternativos de dosis. Encontraron grandes diferencias interindivuales en los requerimientos e intervalo de dosis para alcanzar una razón pico-valle y un control pleno de 24 horas de presión sanguínea. (45)
Horario óptimo de dosificación del fármaco antihipertensivo
El modelado PK/PD permite el estudio del retraso en el inicio del efecto farmacológico. La presión arterial varía según el momento del día, elevándose rápidamente en el despertar. (46) En pacientes hipertensos dipper, la presión arterial nocturna disminuye entre el 10% y el 20%. (46) Para un control adecuado, es necesario que la respuesta máxima antihipertensiva se produzca durante la subida de presión arterial y el efecto mínimo durante los valores valle para reducir el riesgo de la hipotensión excesiva. El momento de dosificación óptimo de los antihipertensivos se selecciona considerando la farmacocinética del fármaco. Esta estrategia puede ser racional para los antihipertensivos que no demuestran retraso en la respuesta (antagonistas cálcicos). Inversamente, para antihipertensivos con respuesta lenta y mecanismo de acción irreversible o seudoirreversible, la supervisión de niveles plasmáticos no estimaría exactamente el momento óptimo de dosificación. Los modelos PK/PD permiten la cuantificación del tiempo de retraso en el inicio de la acción antihipertensiva. Varios estudios encontraron la disociación entre niveles plasmáticos y respuesta de varios antihipertensivos, que incluyen los bloqueantes alfaadrenérgicos, los bloqueantes betaadrenérgicos, los IECA, los antagonistas de receptores de angiotensina II y los de acción central.
Para estos fármacos, el retraso en el inicio de acción, determinado por modelado PK/PD, debe agregarse al retardo en alcanzar la concentración máxima plasmática después de la dosificación oral para estimar el momento óptimo de la dosificación.
Evaluación de la importancia clínica de las interacciones de fármacos
Las interacciones de fármacos pueden afectar la terapia antihipertensiva por reducción o potenciación del efecto buscado. (47) La terapia antihipertensiva necesita generalmente la combinación de fármacos y el estudio de la asociación de antihipertensivos es importante. Diversos mecanismos participan en una interacción, entre los que se incluyen alteración en la disposición y depuración del fármaco y cambios farmacodinámicos. (46) Los estudios de modelado PK/ PD podrían aclarar la importancia de diversas interacciones en la terapia antihipertensiva. Schaefer y colaboradores, (48) mediante el modelado PK/PD, evaluaron las interacciones fármaco-alimento para una forma de liberación controlada de nisoldipina. La relación entre concentración plasmática de nisoldipina y efectos cardiovasculares fue estudiada por el modelo Emáx. Se encontró que el alimento, al aumentar las concentraciones plasmáticas, incrementó la respuesta máxima cerca del 10%. (48)
El modelado PK/PD es una herramienta para evaluar combinaciones de fármacos antihipertensivos. Huang y colaboradores (49) estudiaron la interacción entre irbesartán e hidroclorotiazida en perros hipertensos renales con el modelado PK/PD. Se demostró que el irbesartán incrementa las concentraciones plasmáticas de hidroclorotiazida en el estado estacionario. (49) Esta combinación aumentó la sensibilidad y la eficacia del antagonista del receptor AT1, considerando que la CE50 y el Emáx para el efecto hipotensor del irbesartán cambiaron perceptiblemente en presencia de hidroclorotiazida. (49)
Meredith y Elliott (44) evaluaron el potencial del modelado PK/PD para determinar la eficacia antihipertensiva de la combinación prazosín-verapamilo. La sensibilidad de la presión arterial diastólica supina era perceptiblemente más alta en 3,3 ± 0,5 mm Hg por ng/ml con la asociación (p < 0,01) en comparación con 2,4 ± 0,5 mm Hg por ng/ml para las dosis estándares del prazosín solo, lo que sugiere componentes farmacocinéticos y farmacodinámicos en esta interacción.
CONCLUSIONES
Varios estudios han encontrado que la respuesta de la presión arterial a los fármacos antihipertensivos está relacionada claramente con los niveles tisulares de estos fármacos y, por lo tanto, el modelado PK/PD permite una comprensión mejor de las características farmacocinéticas-farmacodinámicas de agentes antihipertensivos.
La experiencia en modelado PK/PD ha demostrado su papel para mejorar el uso clínico de fármacos antihipertensivos. Esta metodología no sólo contribuye a la optimización de la dosificación del fármaco y de la selección del paciente en la práctica clínica, sino que incrementa la información de nuevos fármacos antihipertensivos en su proceso de desarrollo. Aunque el modelado PK/PD se utiliza con frecuencia en diversas fases del desarrollo de fármacos, (4) el papel del modelado PK/PD en la práctica clínica realmente se desconoce.
El modelado PK/PD de antihipertensivos tiene un amplio impacto clínico, dado que permite una valoración rápida de la respuesta a largo plazo de la terapia antihipertensiva y la selección del esquema de dosificación óptimo en cada paciente. Sin embargo, el uso del modelado PK/PD en la práctica clínica estaría limitado por varios aspectos, entre ellos: 1) el desconocimiento de conceptos de modelado PK/PD, 2) el requerimiento de programas computacionales especiales (9) y 3) la necesidad de un muestreo simultáneo de la concentración plasmática de fármacos con la medición del efecto antihipertensivo. El muestreo sanguíneo frecuente es engorroso durante los estudios PK/PD. Por eso, la farmacocinética poblacional se utiliza cada vez más para estimar características PK/PD. (42, 43) Se espera que el modelado PK/PD poblacional aumente su aplicabilidad clínica para individualizar la terapia antihipertensiva.
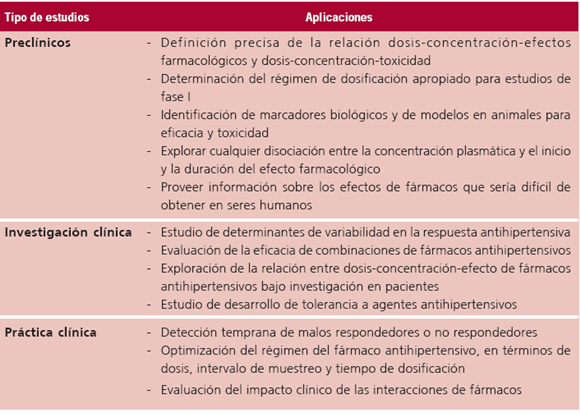
En conclusión, el modelado PK/PD puede mejorar perceptiblemente la terapia farmacológica de la hipertensión con el establecimiento del fármaco óptimo y el régimen de dosificación adecuado en cada paciente hipertenso (Tabla 3). Además, el modelado PK/ PD también contribuye para estudiar las fuentes de la variabilidad de la respuesta antihipertensiva a esos agentes terapéuticos.
Tabla 3. Aplicaciones del modelado PK/PD de agentes antihipertensivos
Los antecedentes comentados en el presente artículo de revisión avalan la necesidad del análisis fármacocinético-farmacodinámico para la totalidad de los agentes antihipertensivos utilizados en la práctica médica. Sin embargo, dado que su realización implica una complejidad técnica y un tiempo que lo hace difícilmente accesible al médico asistencial, una solución podría ser la exigencia por parte de las autoridades de regulación de que los laboratorios farmacéuticos realicen estudios PK-PD durante la fase de desarrollo del medicamento y publiquen luego los resultados en los prospectos del medicamento a fin de que el médico pueda evaluar mejor la indicación en cada uno de sus pacientes.
1. Düsing R. Overcoming barriers to effective blood pressure control in patients with hypertension. Curr Med Res Opin 2006;22:1545-53. [ Links ]
2. Elliott WJ. What factors contribute to the inadequate control of elevated blood pressure? J Clin Hypertens (Greenwich) 2008;10:20-6. [ Links ]
3. Stergiou GS. Flaws in dose-finding of antihypertensive drugs. Am J Cardiovasc Drugs 2007;7:357-9. [ Links ]
4. Derendorf H, Lesko LJ, Chaikin P, Colburn WA, Lee P, Miller R, et al. Pharmacokinetic/pharmacodynamic modeling in drug research and development. J Clin Pharmacol 2000;40:1399-418. [ Links ]
5. Toutain PL. Pharmacokinetic/pharmacodynamic integration in drug development and dosage-regimen optimization for veterinary medicine. AAPS PharmSci 2002;4:E38. [ Links ]
6. Pérez-Urizar J, Granados-Soto V, Flores-Murrieta FJ, Castañeda- Hernández G. Pharmacokinetic-pharmacodynamic modeling: why? Arch Med Res 2000;31:539-45. [ Links ]
7. Dingemanse J, Appel-Dingemanse S. Integrated pharmacokinetics and pharmacodynamics in drug development. Clin Pharmacokinet 2007;46:713-37. [ Links ]
8. Mancia G, De Backer G, Dominiczak A, Cifkova R, Fagard R, Germano G, et al; Management of Arterial Hypertension of the European Society of Hypertension; European Society of Cardiology. 2007 Guidelines for the Management of Arterial Hypertension: The Task Force for the Management of Arterial Hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC). J Hypertens 2007;25:1105-87. [ Links ]
9. Csajka C, Verotta D. Pharmacokinetic-pharmacodynamic modelling: history and perspectives. J Pharmacokinet Pharmacodyn 2006; 33:227-79. [ Links ]
10. Sheiner LB, Stanski DR, Vozeh S, Miller RD, Ham J. Simultaneous modeling of pharmacokinetics and pharmacodynamics: application to d-tubocurarine. Clin Pharmacol Ther 1979;25:358-71. [ Links ]
11. Mandema JW, Tuk B, van Steveninck AL, Breimer DD, Cohen AF, Danhof M. Pharmacokinetic-pharmacodynamic modeling of the central nervous system effects of midazolam and its main metabolite alpha-hydroxymidazolam in healthy volunteers. Clin Pharmacol Ther 1992;51:715-28. [ Links ]
12. Dayneka NL, Garg V, Jusko WJ. Comparison of four basic models of indirect pharmacodynamic responses. J Pharmacokinet Biopharm 1993;21:457-78. [ Links ]
13. Bauer JA, Balthasar JP, Fung HL. Application of pharmacodynamic modeling for designing time-variant dosing regimens to overcome nitroglycerin tolerance in experimental heart failure. Pharm Res 1997;14:1140-5. [ Links ]
14. Schoemaker RC, van Gerven JM, Cohen AF. Estimating potency for the Emax-model without attaining maximal effects. J Pharmacokinet Biopharm 1998;26:581-93. [ Links ]
15. Hoffman BB. Therapy of hypertension. En: Brunton LL, Lazo JS, Parker KL, editors. Goodman & Gilman's the pharmacological basis of therapeutics. 11th ed. New York: McGraw Hill, 2006. p. 845-68. [ Links ]
16. Desai M, Stockbridge N, Temple R. Blood pressure as an example of a biomarker that functions as a surrogate. AAPS J 2006;8:E146-52. [ Links ]
17. Martin C, Cameron J, McGrath B. Mechanical and circulating biomarkers in isolated clinic hypertension. Clin Exp Pharmacol Physiol 2008;35:402-8. [ Links ]
18. Höcht C, Opezzo JA, Bramuglia GF, Taira CA. Application of microdialysis for pharmacokinetic-pharmacodynamic modelling. Expert Opin Drug Discov 2006;1:289-301. [ Links ]
19. Harder S, Rietbrock S, Thürmann P. Concentration/effect analysis of verapamil: evaluation of different approaches. Int J Clin Pharmacol Ther Toxicol 1993;31:469-75. [ Links ]
20. Harder S, Thürmann P, Rietbrock N. Concentration/Effect Analysis of Antihypertensive Drugs. Am J Ther 1994;1:116-24. [ Links ]
21. Bertera FM, Mayer MA, Opezzo JA, Taira CA, Höcht C. Comparison of different pharmacodynamic models for PK-PD modeling of verapamil in renovascular hypertension. J Pharmacol Toxicol Methods 2008 May-Jun;57:212-9. [ Links ]
22. Bertera FM, Mayer MA, Opezzo JA, Taira CA, Bramuglia GF, Höcht C. Pharmacokinetic-pharmacodynamic modeling of diltiazem in spontaneously hypertensive rats: a microdialysis study. J Pharmacol Toxicol Methods 2007;56:290-9. [ Links ]
23. Höcht C, Di Verniero C, Opezzo JA, Bramuglia GF, Taira CA. Pharmacokinetic-pharmacodynamic (PK-PD) modeling of cardiovascular effects of metoprolol in spontaneously hypertensive rats: a microdialysis study. Naunyn Schmiedebergs Arch Pharmacol 2006;373:310-8. [ Links ]
24. Höcht C, DiVerniero C, Opezzo JA, Taira CA. Applicability of microdialysis as a technique for pharmacokinetic-pharmacodynamic (PK-PD) modeling of antihypertensive beta-blockers. J Pharmacol Toxicol Methods 2005;52:244-50. [ Links ]
25. Höcht C, Di Verniero C, Opezzo JA, Taira CA. Pharmacokineticpharmacodynamic properties of metoprolol in chronic aortic coarctated rats. Naunyn Schmiedebergs Arch Pharmacol 2004;370:1-8. [ Links ]
26. Di Verniero CA, Silberman EA, Mayer MA, Opezzo JA, Taira CA, Höcht C. In vitro and in vivo pharmacodynamic properties of metoprolol in fructose-fed hypertensive rats. J Cardiovasc Pharmacol 2008;51:532-41. [ Links ]
27. Höcht C, Opezzo JA, Taira CA. Hypothalamic antihypertensive effect of metoprolol in chronic aortic coarctated rats. Clin Exp Pharmacol Physiol 2005;32:681-6. [ Links ]
28. Bellissant E, Giudicelli JF. Pharmacokinetic-pharmacodynamic model for perindoprilat regional haemodynamic effects in healthy volunteers and in congestive heart failure patients. Br J Clin Pharmacol 2001;52:25-33. [ Links ]
29. Bellissant E, Giudicelli JF. Pharmacokinetic-pharmacodynamic model relating zabiciprilat plasma concentrations to brachial and femoral haemodynamic effects in normotensive volunteers. Br J Clin Pharmacol 1998;46:383-93. [ Links ]
30. Donnelly R, Meredith PA, Elliott HL, Reid JL. Kinetic-dynamic relations and individual responses to enalapril. Hypertension 1990;15:301-9. [ Links ]
31. Aarons L, Baxter C, Gupta S. Pharmacodynamics of controlled release verapamil in patients with hypertension: an analysis using spline functions. Biopharm Drug Dispos 2004;25:219-25. [ Links ]
32. Trocóniz IF, de Alwis DP, Tillmann C, Callies S, Mitchell M, Schaefer HG. Comparison of manual versus ambulatory blood pressure measurements with pharmacokinetic-pharmacodynamic modeling of antihypertensive compounds: application to moxonidine. Clin Pharmacol Ther 2000;68:18-27. [ Links ]
33. Azizi M, Bissery A, Lamarre-Cliche M, Ménard J. Integrating drug pharmacokinetics for phenotyping individual renin response to angiotensin II blockade in humans. Hypertension 2004;43:785-90. [ Links ]
34. Hong Y, Dingemanse J, Mager DE. Pharmacokinetic/pharmacodynamic modeling of renin biomarkers in subjects treated with the renin inhibitor aliskiren. Clin Pharmacol Ther 2008;84:136-43. [ Links ]
35. Donnelly R, Elliott HL, Meredith PA. Antihypertensive drugs: individualized analysis and clinical relevance of kinetic-dynamic relationships. Pharmacol Ther 1992;53:67-79. [ Links ]
36. Bühler FR, Hulthén UL, Kiowski W, Müller FB, Bolli P. The place of the calcium antagonist verapamil in antihypertensive therapy. J Cardiovasc Pharmacol 1982;4:S350-7. [ Links ]
37. Elliott HL, Donnelly R, Meredith PA, Reid JL. Predictability of antihypertensive responsiveness and alpha-adrenoceptor antagonism during prazosin treatment. Clin Pharmacol Ther 1989;46:576-83. [ Links ]
38. Donnelly R, Elliott HL, Meredith PA, Reid JL. Concentrationeffect relationships and individual responses to doxazosin in essential hypertension. Br J Clin Pharmacol 1989;28:517-26. [ Links ]
39. Murray L, Squire IB, Reid JL, Lees KR. Determinants of the blood pressure response to the first dose of ACE inhibitor in mild to moderate congestive heart failure. Br J Clin Pharmacol 1998;45:559-66. [ Links ]
40. Filigheddu F, Troffa C, Glorioso N. Pharmacogenomics of essential hypertension: are we going the right way? Cardiovasc Hematol Agents Med Chem 2006;4:7-15. [ Links ]
41. Mellen PB, Herrington DM. Pharmacogenomics of blood pressure response to antihypertensive treatment. J Hypertens 2005;23:1311-25. [ Links ]
42. Wade JR, Sambol NC. Felodipine population dose-response and concentration-response relationships in patients with essential hypertension. Clin Pharmacol Ther 1995;57:569-81. [ Links ]
43. Csajka C, Buclin T, Fattinger K, Brunner HR, Biollaz J. Population pharmacokinetic-pharmacodynamic modelling of angiotensin receptor blockade in healthy volunteers. Clin Pharmacokinet 2002;41:137-52. [ Links ]
44. Meredith PA, Elliott HL. Concentration-effect relationships and implications for trogh-to-peak ratio. Am J Hypertens 1996;9: 66S-70S. [ Links ]
45. Meredith PA, Donnelly R, Elliott HL, Howie CA, Reid JL. Prediction of the antihypertensive response to enalapril. J Hypertens 1990;8:1085-90. [ Links ]
46. Giles TD. Circadian rhythm of blood pressure and the relation to cardiovascular events. J Hypertens Suppl 2006;24:S11-6. [ Links ]
47. Elliott WJ. Drug interactions and drugs that affect blood pressure. J Clin Hypertens (Greenwich) 2006;8:731-7. [ Links ]
48. Schaefer HG, Heinig R, Ahr G, Adelmann H, Tetzloff W, Kuhlmann J. Pharmacokinetic-pharmacodynamic modelling as a tool to evaluate the clinical relevance of a drug-food interaction for a nisoldipine controlled- release dosage form. Eur J Clin Pharmacol 1997;51:473-80. [ Links ]
49. Huang XH, Qiu FR, Xie HT, Li J. Pharmacokinetic and pharmacodynamic interaction between irbesartan and hydrochlorothiazide in renal hypertensive dogs. J Cardiovasc Pharmacol 2005;46:863-9. [ Links ]














