Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista argentina de cardiología
versión On-line ISSN 1850-3748
Rev. argent. cardiol. v.76 n.5 Ciudad Autónoma de Buenos Aires sept./oct. 2008
Ecocardiografía fetal
Pablo MarantzMTSAC, 1, Carlos García Guevara2
MTSAC Miembro Titular de la Sociedad Argentina de Cardiología
1 Jefe de Cardiología Infantil - Hospital Italiano de Buenos Aires
2 Director de Cardiología Fetal. Cardiocentro William Soler, La Habana, Cuba
Dirección para separatas: Dr. Pablo Marantz, e-mail: marantz@cardioinfantil.com.ar
INTRODUCCIÓN
A inicios de los años ochenta se presentaron casi simultáneamente varias comunicaciones sobre la identificación de la anatomía cardíaca durante la vida fetal y poco después se reconocieron algunas formas de anomalías estructurales. Durante esta etapa, la evaluación del corazón fetal estuvo limitada a las embarazadas con riesgo incrementado de tener un feto afectado por cardiopatía congénita, considerándose como tales aquellas con historia familiar de cardiopatía congénita y los fetos en los que se diagnosticaban malformaciones extracardíacas.
No obstante, casi en la totalidad de los casos las cardiopatías congénitas ocurren en embarazos en los que no se identifican factores de riesgo. Por esta razón, en 1985 un grupo de especialistas en París propuso la idea de enseñar a los obstetras a evaluar de forma sencilla el corazón fetal durante el ultrasonido obstétrico de rutina, lo cual fue bien establecido en toda Francia. Como resultado, a finales de la década de 1980, la vista ultrasonográfica de cuatro cámaras comenzó a formar parte integral del examen anatómico fetal en varios países. En los inicios de los años noventa algunos autores sugirieron adicionar al pesquisaje la evaluación de los tractos de salida de las grandes arterias, con el objetivo de incrementar el diagnóstico de estas malformaciones. (1)
En Cuba se desarrolló un programa similar al realizado en Francia, con la asesoría de Michel Tynan y Lindsey D. Allan del Guy’s Hospital de Londres.
Las malformaciones congénitas representan la principal causa de muerte en el período neonatal; de ellas, las que afectan el corazón son las más frecuentes. En países como los Estados Unidos constituyen el defecto más común al nacer, (2, 3) mientras que en nuestro país se hallan, en orden de frecuencia, luego de la prematurez y las infecciones.
Las cardiopatías congénitas son los defectos que con mayor frecuencia pasan inadvertidos en el ultrasonido obstétrico de rutina, situación que persiste a pesar de la inclusión de la vista de cuatro cámaras, de la definición de los grupos de “alto riesgo” y de los programas de entrenamiento para el ecografista obstétrico. (4)
El diagnóstico intraútero de estos defectos resulta de extraordinario valor, ya que permite ofrecer a la pareja asesoramiento cardiogenético prenatal, con el objetivo de brindarle información relacionada con las características de la enfermedad, su evolución, las posibilidades terapéuticas, el pronóstico y el riesgo de recurrencia para futuros embarazos.
Una vez realizado el diagnóstico con certeza, la pareja podrá optar por la terminación del embarazo en países donde el aborto es legal o programar el nacimiento en un centro de alta complejidad con facilidades cardiovasculares para recibir al recién nacido y brindarle la atención médica requerida de forma inmediata.
EPIDEMIOLOGÍA DE LAS CARDIOPATÍAS CONGÉNITAS
Las cardiopatías congénitas son los defectos congénitos graves más frecuentes y una de las tres principales causas de mortalidad prenatal y perinatal. (5) Su prevalencia es de aproximadamente 8 por cada mil nacidos vivos; en el Reino Unido, un estudio de pesquisaje por ultrasonido en mujeres con embarazo de bajo riesgo mostró una prevalencia de 1,3 a 3,2 por cada 1.000 embarazos. Cerca de la mitad de estos defectos son asintomáticos y la otra mitad se clasifican como defectos mayores, porque son letales o requieren cirugía. (6) Sin embargo, la impresión en la práctica diaria indicaría que es mayor.
Estas malformaciones son el resultado de alteraciones embrionarias del corazón y su etiología frecuentemente se desconoce; la causa se llega a conocer en menos de una cuarta parte de los casos. (7)
MALFORMACIONES CARDÍACAS ASOCIADAS
Algunas comunicaciones señalan que el 25% a 30% de los niños con cardiopatías congénitas presentan malformaciones extracardíacas asociadas, debido a la actuación del agente causal no sólo en el corazón, sino también en diversos puntos del organismo; las más frecuentes son las renales y las del sistema nervioso central. (7)
En un estudio (8) realizado en nuestro Servicio de Cardiología Fetal del Hospital Italiano de Buenos Aires (PM) observamos que el pronóstico es mejor en los casos de cardiopatías congénitas (CC) aisladas. En este estudio, 146 pacientes se dividieron en dos grupos: A, 111 (76%) con cardiopatías congénitas aisladas y B, 35 (24%) con cardiopatías congénitas asociadas con otra anomalía extracardíaca mayor o síndrome genético. Se analizó la mortalidad desde el momento del diagnóstico (etapa prenatal) hasta el egreso de neonatología. En el grupo A, 7 fetos fallecieron por insuficiencia cardíaca antenatal debido a la CC; de los recién nacidos, 20 fallecieron durante la primera semana de vida: hipoplasia de ventrículo izquierdo (10), anomalía de Ebstein (2), tetralogía de Fallot con agenesia de la válvula pulmonar (2), transposición completa de los grandes vasos (2), miocardiopatía (3) y síndrome de Shone (1). El 75,6% (84/111 casos) sobrevivieron con cirugía o sin ella. En el grupo B, 4 pacientes fallecieron durante la vida fetal: tetralogía de Fallot (1), miocardiopatía (1), comunicación interventricular (1), hipoplasia del ventrículo izquierdo (1) y 14 en el período neonatal; en éstos, la causa de muerte se atribuyó a las malformaciones extracardíacas o a un síndrome genético asociado y ninguno de estos pacientes fue sometido a cirugía cardíaca. La sobrevida al alta fue del 48,5% (17/35 casos) y la mortalidad perinatal del grupo B (CC asociadas) fue significativamente mayor que en el grupo A con CC aislada (OR 3,29 IC 1,49-7,27) (Tablas 1 y 2).
Tabla 1. Grupo A. Mortalidad por cardiopatía congénita aislada

Tabla 2. Grupo B. Mortalidad por cardiopatía congénita asociada con otra anomalía

Los defectos cardiovasculares congénitos se han relacionado con algunos factores de riesgo, considerándose como tales aquellos que incrementan la posibilidad de tener un hijo afectado por una malformación cardiovascular congénita; estos factores pueden ser de origen materno, familiares y fetales. (9, 10)
Dentro de los factores maternos se han descripto el antecedente de cardiopatía congénita materna, la exposición a teratógenos (anticonvulsivantes, litio, alcohol), las enfermedades metabólicas, especialmente diabetes mellitus y fenilcetonuria y las pacientes con historia de tratamiento por infertilidad una vez descartadas otras causas. (11)
Algunos autores encuentran para las cardiopatías más comunes un riesgo de transmisión mayor si la afectada es la madre que si lo es el padre. Burn y colaboradores observaron un riesgo de transmisión a la descendencia de las cardiopatías congénitas en general, del 2,2% (4/183) cuando el padre era el afectado y del 5,7% 8812/110) cuando la madre era la afectada. Para la tetralogía de Fallot encontraron un riesgo de recurrencia del 1,6% cuando el padre era el afectado y del 4,5% cuando lo era la madre; para los defectos septales ventriculares, el riesgo de recurrencia era del 7,7% y del 7,9%, respectivamente. (12)
La exposición a drogas teratógenas en las primeras 6 a 8 semanas de gestación se ha asociado con un riesgo mayor de defectos septales, específicamente comunicación interventricular.
Las infecciones virales como la rubéola en las primeras 12 semanas de embarazo pueden ocasionar daño en el tejido arterial del ductus fetal, además de causar daños neurológicos, que provocan la persistencia del ductus después del nacimiento; otra lesión que se describe asociada con esta patología es la estenosis pulmonar. Se han identificado además enfermedades como las causadas por los parvovirus y los virus Coksackie, relacionadas con miocardiopatía dilatada en el feto. (13, 14) En el caso de las patologías autoinmunes, como el lupus eritematoso sistémico y el síndrome de Sjögren, se ha encontrado asociación con bloqueos auriculoventriculares completos y miocardiopatías, causadas probablemente por el paso de anticuerpos transplacentarios durante las semanas 16 a 18 de la gestación. (15, 16)
La diabetes mellitus incrementa tres a cinco veces el riesgo de cardiopatía congénita, pero se ha demostrado que el riesgo mayor se encuentra presente cuando la enfermedad no está controlada en etapas tempranas del embarazo; las cardiopatías asociadas resultantes con mayor frecuencia son la doble salida del ventrículo derecho, tronco arterioso, transposición de los grandes vasos, comunicación interventricular y síndrome de hipoplasia de cavidades izquierdas. (17)
La fenilcetonuria materna se ha observado relacionada con anomalías troncoconales, obstrucciones del corazón izquierdo y comunicaciones interventriculares, sobre todo cuando existe nutrición deficiente con niveles de fenilalanina menores de 600 µmol/L durante las primeras semanas del embarazo. (18)
Entre los factores de riesgo familiares se encuentran: un hijo o feto previos con cardiopatía congénita, antecedente de padre o madre con CC o antecedentes en la familia de síndromes genéticos que cursen con cardiopatías congénitas asociadas, como los síndromes de Noonan, Marfan, Holt-Oram, DiGeorge, velocardiofacial, Williams, entre otros. (19)
En el grupo de los factores de riesgo fetales se incluyen el polihidramnios, la hidropesía fetal, la detección de cualquier malformación extracardíaca, incluidas las anomalías cromosómicas, la detección de arritmias y la sospecha de cardiopatía congénita mediante las vistas de cuatro cámaras y tractos de salida de los grandes vasos durante el ultrasonido de rutina. (20)
Determinadas malformaciones como onfalocele, hernia diafragmática, atresia duodenal, arteria umbilical única, fístula traqueoesofágica e higroma quístico se han encontrado asociadas particularmente con las cardiopatías congénitas.
El polihidramnios tiene una relación elevada con las anomalías congénitas, sobre todo cuando el líquido amniótico supera los 24 cm. En una de las más grandes series publicadas, Dashe y colaboradores revisaron retrospectivamente 672 embarazos complicados con polihidramnios: 77 (11%) estuvieron relacionados con anomalías fetales, de las cuales 20 (25%) fueron defectos cardíacos. (21)
Recientemente, el incremento de la translucencia nucal (espacio presente posterior al occipucio y región cervical posterior, no tabicado y de contenido líquido) y el flujo sanguíneo anormal del ductus venoso, evaluable entre las semanas 11 y 14 del embarazo, se han mencionado como factores de riesgo independientes. (22)
Sin embargo, más del 80% de las cardiopatías congénitas ocurren en embarazos sin factores de riesgo reconocidos hasta el momento. Fueron estos datos los que inspiraron la idea hoy ampliamente aceptada de que el análisis detallado del corazón fetal constituye la herramienta más importante para el diagnóstico prenatal de las cardiopatías congénitas. (23)
El ultrasonido representa el principal recurso para el diagnóstico y la determinación del riesgo individual durante el embarazo, carente de peligros directos para la madre y el feto. (24, 25)
A las 11 semanas de gestación se puede detectar el 20% de las cardiopatías, porcentaje que se incrementa al 95% a las 14 semanas. (26) La experiencia internacional ha demostrado que es posible diagnosticar con gran precisión por ultrasonido un número importante de malformaciones complejas del corazón y, lo que es no menos importante, determinar y tratar intraútero un gran número de arritmias capaces de causar en el feto insuficiencia cardíaca y muerte. (27)
El corazón fetal puede examinarse a través de una serie de vistas ultrasonográficas secuenciales que permiten observar las conexiones y las estructuras intracardíacas. Este estudio se amplía con mediciones cardíacas y Doppler pulsado, continuo o color, que permiten evaluar la mayoría de las cardiopatías congénitas complejas.
La Sociedad Americana de Ecocardiografía, en 2004, (9) sugirió ciertas guías relacionadas con la práctica de la especialidad para los profesionales vinculados con esta actividad, entre las que se destacan:
- Conocer y emplear todas las modalidades de la ecocardiografía (modo M, bidimensional, Doppler pulsado, continuo y color).
- Contar con información de todos los tipos de enfermedades del corazón, simples y complejas, congénitas y adquiridas.
- Poseer conocimientos sólidos de fisiología cardíaca fetal.
- Conocer las limitaciones de la ecocardiografía fetal.
- Dominar la historia natural de las cardiopatías congénitas durante el embarazo.
- Manejar los tipos de arritmias fetales y su diagnóstico.
- Alcanzar una comunicación adecuada con la pareja.
- Conocer sobre las perspectivas de desarrollo futuro, incluido el intervencionismo fetal.
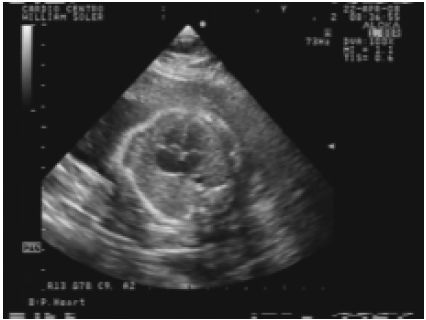
Ecocardiograma fetal: corte de 4 cámaras.

Ecocardiograma fetal: eje largo del ventrículo izquierdo.

Ecocardiograma. Eje corto de la base.
EXPERIENCIA DEL CARDIOCENTRO WILLIAM SOLER DE LA HABANA (CGG)
En un estudio retrospectivo descriptivo, (28) realizado con el objetivo de analizar los resultados del diagnóstico prenatal de cardiopatías congénitas en Cuba en los años 2006 y 2007, a partir de los registros con que cuenta el Cardiocentro Pediátrico “William Soler” de diagnóstico prenatal y niños nacidos vivos con estos defectos por provincias, se observó que la tasa de incidencia ajustada de cardiopatías congénitas mayores en Cuba en los años 2006 y 2007 resultó similar (2,56 y 2,70, respectivamente), comportándose con pocas variaciones entre las provincias. Las cardiopatías congénitas mayores más frecuentes fueron: canal auriculoventricular (16,63%), comunicaciones interventriculares grandes (16,29%) y síndrome de hipoplasia de cavidades izquierdas (10,52%). El índice de efectividad del diagnóstico prenatal para los defectos potencialmente diagnosticables en el período objeto de estudio fue del 59,18% (2006) y 59,70% (2007). De las cardiopatías más frecuentes, las más diagnosticadas fueron el síndrome de hipoplasia de cavidades izquierdas (85,48%) y el canal auriculoventricular (60,22%). La coartación de la aorta y la anomalía total del retorno venoso pulmonar resultaron las menos diagnosticadas (21,05% en ambos casos).
VENTAJAS QUE OFRECE LA ECOCARDIOGRAFÍA FETAL
- Permite diagnosticar el defecto y, por lo tanto, ofrecer asesoramiento cardiogenético en la etapa prenatal para que la pareja pueda tomar la decisión que considere más adecuada en relación con el curso del embarazo.
- Ayuda a determinar el sitio y la vía del parto en los casos de fetos afectados por anomalías cardíacas serias.
- Permite realizar una monitorización sofisticada de las arritmias cardíacas durante el tratamiento transplacentario y la administración de drogas directas en el feto.
LIMITACIONES DE LA ECOCARDIOGRAFÍA FETAL
La ecocardiografía fetal, como otros estudios, presenta una serie de limitaciones (29) relacionadas con:
- La calidad de la imagen: en este aspecto influyen la habilidad y la experiencia del ultrasonografista, además de factores locales que atentan contra la visualización adecuada del corazón fetal, entre los que se incluyen: dorso anterior, movilidad fetal acentuada, embarazos múltiples, cicatrices abdominales y obesidad materna.
- La resolución de los equipos: algunos defectos no se pueden diagnosticar antes del nacimiento, como comunicaciones interventriculares pequeñas, estenosis valvulares ligeras o aquellas que no pueden predecirse ya que forman parte de la fisiología fetal normal, como las comunicaciones interauriculares y la persistencia del ductus arterioso.
IMPACTO DE LA ECOCARDIOGRAFÍA FETAL
En otro estudio (30) que realizáramos en el Hospital Italiano de Buenos Aires (PM) nos propusimos evaluar el impacto del diagnóstico precoz sobre la morbimortalidad y los costos en pacientes con CC graves que estuvieron internados en neonatología de nuestro hospital entre mayo de 1998 y octubre de 2000 y que requirieron cirugía o cateterismo intervencionista con urgencia debido a su grave estado clínico-hemodinámico. Los pacientes se dividieron en dos grupos: I, 49 neonatos que nacieron en nuestro hospital y II, 37 que fueron derivados de centros de menor complejidad, sin facilidades cardiovasculares. En la Tabla 3 se detallan los resultados de este estudio.
Tabla 3. Resultados del diagnóstico precoz sobre la morbimortalidad y los costos en pacientes con cc

Como puede apreciarse, la mortalidad quirúrgica fue similar en ambos grupos; sin embargo, 5 niños que habían sido derivados de centros de baja complejidad fallecieron antes de que se pudiera intentar un procedimiento terapéutico debido a su extrema gravedad, incrementada por la demora en la derivación y al deterioro sufrido por el traslado. Entre los sobrevivientes fue significativa la diferencia en cuanto a la edad quirúrgica, el tiempo de internación y el costo final.
Todos los pacientes tenían seguimiento obstétrico y se les había realizado al menos una ecografía obstétrica. A 27 de los 49 pacientes del grupo I se les efectuó ecocardiografía fetal y en todos se realizó el diagnóstico de la CC, que luego fue confirmado por el cateterismo o durante la cirugía; 7 de éstos habían sido sospechados en otros centros y fueron derivados para su confirmación y posterior nacimiento en el Hospital Italiano de Buenos Aires. En los otros 22 recién nacidos, el diagnóstico se realizó dentro de las primeras 48 horas de vida.
En el grupo II, la CC no fue advertida por el ecografista obstétrico en ninguno de los 37 pacientes.
Como puede verse, según nuestra experiencia, y similar a la mayoría de centros que realizan ecocardiografía fetal, es de suma importancia el reconocimiento prenatal de las cardiopatías congénitas, ya que las posibilidades de éxito en el tratamiento son mayores cuando estos niños son esperados con el armamento necesario para enfrentar su patología, sobre todo en aquellos con transposición completa de los grandes vasos y en la hipoplasia ventricular izquierda, o intentar en el futuro la intervención intraútero, en especial en casos de obstrucciones graves a los tractos de salida ventriculares, o la colocación de marcapasos en casos de bloqueos completos AV con deterioro de la función cardíaca.
Muchos de los abortos espontáneos y muertes en los primeros días de vida se deben a cardiopatías congénitas no sospechadas, que podrán evitarse en el futuro cuando se comprenda el impacto real del diagnóstico precoz de las cardiopatías congénitas, la importancia del entrenamiento del ecografista obstétrico en la detección de las cardiopatías y la integración de grupos multidisciplinarios de medicina fetal en centros de alta complejidad.
INTERVENCIONISMO CARDÍACO FETAL
El intervencionismo cardíaco fetal es el aspecto más interesante de la cardiología fetal para el cardiólogo pediátrico y la ecocardiografía resulta indispensable para su desarrollo.
Pocos centros en el mundo se hallan ofreciendo el cateterismo intraútero, que brinda la posibilidad de realizar valvuloplastia a los fetos afectados por estenosis aórtica o pulmonar. (31-33)
Un grupo de defectos se consideran adecuados para la práctica de la intervención intraútero, e incluyen: estenosis aórtica, estenosis pulmonar, comunicación interauricular restrictiva, en caso de transposición de los grandes vasos e hipoplasia ventricular izquierda, y drenaje pericárdico en caso de derrame. (34, 35)
Las obstrucciones anatómicas que causan disfunción ventricular pueden producir disminución del flujo sanguíneo fetal y derivar en hipoplasia de la cavidad involucrada. (36) Un número pequeño de series comunicadas han mostrado la progresión de la estenosis aórtica a un ventrículo izquierdo hipoplásico causado por la reducción del flujo a través del ventrículo durante la gestación. (37)
Según Wayne Towresky, la apertura de la válvula entre las semanas 20 y 25 preservaría la función ventricular, mejoraría el flujo y prevendría una hipoplasia ventricular izquierda. (37)
En el Hospital italiano de Buenos Aires (PM) hemos realizado con éxito técnico tres procedimientos, (38) uno de ellos con éxito clínico.
Desde la primera comunicación de intervención cardíaca fetal para la estenosis aórtica grave en 1991 se han comunicado 11 casos más de diez centros diferentes (39) y otros 56 de un mismo centro. (38)
La importancia de la detección precoz de CC con potencial para la intervención fetal se aplica particularmente a la estenosis aórtica o pulmonar grave, en las cuales habría una ventana de oportunidad en la cual podría salvarse el crecimiento ventricular. (40)

Valvuloplastia fetal en estenosis aórtica grave realizada en la semana 24 de gestación.

Valvuloplastia aórtica fetal: catéter en raíz aórtica.

Valvuloplastia aórtica. Balón inflado en la raíz aórtica.
COMENTARIO FINAL
La cardiología fetal representa una de las más excitantes áreas de desarrollo en el campo de la cardiología pediátrica. Seguramente se lograrán avances importantes en los próximos 10 a 20 años en la detección, el diagnóstico y el tratamiento de la patología cardiovascular fetal, tanto estructural como funcional. Por el momento, la posibilidad de la intervención médica sobre el feto con patología cardíaca grave y la planificación del parto en el lugar adecuado justifican ampliamente todos los esfuerzos dirigidos a mejorar las tasas de detección prenatal.
1. Allan L. Antenatal diagnosis of heart disease. Heart 2000;83:367. [ Links ]
2. Lee K, Khoshnood B, Chen L, Wall SN, Cromie WJ, Mittendorf RL. Infant mortality from congenital malformations in the United States, 1970-1997. Obstet Gynecol 2001;98:620-7. [ Links ]
3. Hoffman JI, Kaplan S. The incidence of congenital heart disease. J Am Coll Cardiol 2002;39:1890-900. [ Links ]
4. Viñals F, Giuliano B. Cardiopatías congénitas. Incidencia antenatal. Rev Chil Obstet Ginecol 2002;67:203-6. [ Links ]
5. Hyett J, Perdu M, Sharland G, Snijders R, Nicolaides KH. Using fetal nuchal translucency to screen for major congenital cardiac defects at 10-14 weeks of gestation: population based cohort study. BMJ 1999;318:81-5. [ Links ]
6. Allan L, Hornberger L, Sharland G. Textbook of fetal cardiology. GMM 2000;5:68-76,163-73, 274-87. [ Links ]
7. Tennstedt C, Chaoui R, Körner H, Dietel M. Spectrum of congenital heart defects and extracardiac malformations associated with chromosomal abnormalities: results of a seven year necropsy study. Heart 1999;82:34-9. [ Links ]
8. Marantz P, Rosselot S, Guerchicoff M, Aiello H, Fustinana C, Otaño L. Fetal and neonatal clinical evolution of isolated congenital heart disease and associated with major extracardiac malformations or genetic syndromes. Perinatal Cardiology 2007;185-6. [ Links ]
9. Xavier P, Matias A, Silva JT, Montenegro N, Areias JC. Prenatal diagnosis of congenital heart disease. Critical evaluation of a twelve-month experience. Rev Port Cardiol 2000;19:203-12. [ Links ]
10. Doxastakis GB, Meriño AL, Prose AA, Goujo NW, Mayol LA, Van Domselaar PE. Ecocardiografía fetal: un estudio sobre su alcance en el diagnóstico de cardiopatías congénitas. Rev Pos Cat Med 2002;117:1-3. [ Links ]
11. Allan L. Technique of fetal echocardiography. Pediatr Cardiol 2004;25:223-33. [ Links ]
12. Moreno García M, Gómez Rodríguez MJ, Barreiro Miranda E. Genetics of congenital cardiopathies. An Esp Pediatr 2000;53:30-9. [ Links ]
13. Gregg NM. Congenital cataract following german measles in mother. Trans Ophthamal Soc Aust 1941;3:35-6. [ Links ]
14. Benirschke K, Swartz WH, Leopold G, Sahn D. Hydrops due to myocarditis in a fetus. Am J Cardiovasc Pathol 1987;1:131-3. [ Links ]
15. Chameides L, Truex RC, Vetter V, Rashkind WJ, Galioto FM Jr, Noonan JA. Association of maternal systemic lupus erythematosus with congenital complete heart block. N Engl J Med 1977; 297:1204-7. [ Links ]
16. McCue CM, Mantakas ME, Tingelstad JB, Ruddy S. Congenital heart block in newborns of mothers with connective tissue disease. Circulation 1977;56:82-90. [ Links ]
17. Hornberger LK. Maternal diabetes and the fetal heart. Heart 2006;92:1019-21. [ Links ]
18. Rouse B, Azen C, Koch R, Matalon R, Hanley W, de la Cruz F, et al. Maternal Phenylketonuria Collaborative Study (MPKUCS) offspring: facial anomalies, malformations, and early neurological sequelae. Am J Med Genet 1997;69:89-95. [ Links ]
19. Gawde H, Patel ZM, Khatkhatey MI, D’Souza A, Babu S, Adhia R, et al. Chromosome 22 microdeletion by F.I.S.H. in isolated congenital heart disease. Indian J Pediatr 2006;73:885-8. [ Links ]
20. Copel JA, Pilu G, Kleinman CS. Congenital heart disease and extracardiac anomalies: associations and indications for fetal echocardiography. Am J Obstet Gynecol 1986;154:1121-32. [ Links ]
21 Dashe JS, McIntire DD, Ramus RM, Santos-Ramos R, Twickler DM. Hydramnios: anomaly prevalence and sonographic detection. Obstet Gynecol 2002;100:134-9. [ Links ]
22. McAuliffe FM, Hornberger LK, Winsor S, Chitayat D, Chong K, Johnson JA. Fetal cardiac defects and increased nuchal translucency thickness: a prospective study. Am J Obstet Gynecol 2004;191:1486-90. [ Links ]
23 González R. Ecocardiografía fetal. Cómo mejorar nuestra capacidad diagnóstica. Rev Chil Obstet Ginecol 2005;70:140-6. [ Links ]
24 Guía Perinatal, MINSAL, Marzo 2003. ISBN: 956-7711-29-1. [ Links ]
25. Muñoz H, Jankelevich J, Gutiérrez J. Ultrasonido de rutina en obstetricia. Revisión de consenso. Rev Chil Ultrasonog 2001;4:58-9. [ Links ]
26 Haak MC, Twisk JW, Van Vugt JM. How successful is fetal echocardiographic examination in the first trimester of pregnancy? Ultrasound Obstet Gynecol 2002;20:9-13. [ Links ]
27 Allan LD, Santos R, Pexieder T. Anatomical and echocardiographic correlates of normal cardiac morphology in the late first trimester fetus. Heart 1997;77:68-72. [ Links ]
28 Garcia Guevara C. Análisis de los resultados del diagnóstico prenatal de cardiopatías congénitas en Cuba 2006-2007. Tesis doctoral. [ Links ]
29 Savío Benavides A, Oliva Rodríguez J. Ecocardiografía fetal: Evaluación y resultados de un Programa Nacional. Cuba 1989-1991. Rev Cubana Pediatr 1995;67. [ Links ]
30 Guerchicoff M, Marantz P, Infante J, Villa A, Gutiérrez A, Montero G. Evaluación del impacto del diagnóstico precoz de las cardiopatías congénitas. Arch Argent Pediatr 2004;102:445-50. [ Links ]
31. Saxena A, Soni NR. Fetal echocardiography: Where we are? Indian Pediatr 2005;72:603-8. [ Links ]
32. Perich RM. Temas de actualidad en cardiología pediátrica y cardiopatías congénitas. Rev Esp Cardiol 2006;59:87-98. [ Links ]
33 Von Bergen NH, Burkhart HM, Latson LA, Emery SP, Younoszai AK, Bartlett HL. Complete cavopulmonary shunt completion after in utero balloon atrial septoplasty for hypoplastic left heart syndrome. J Thorac Cardiovasc Surg 2007;134:1355-6. [ Links ]
34. Tworetzky W, Marshall AC. Balloon valvuloplasty for congenital heart disease in the fetus. Clin Perinatol 2003;30:541-50. [ Links ]
35. Huhta J, Quintero RA, Suh E, Bader R. Advances in fetal cardiac intervention. Curr Opin Pediatr 2004;16:487-93. [ Links ]
35. Mäkikallio K, McElhinney DB, Levine JC, Marx GR, Colan SD, Marshall AC, et al. Fetal aortic valve stenosis and the evolution of hypoplastic left heart syndrome: patient selection for fetal intervention. Circulation 2006;113:1401-5. [ Links ]
37. Tworetzky W, Wilkins-Haug L, Jennings RW, van der Velde ME, Marshall AC, Marx GR, et al. Balloon dilation of severe aortic stenosis in the fetus: potential for prevention of hypoplastic left heart syndrome: candidate selection, technique, and results of successful intervention. Circulation 2004;110:2125-31. [ Links ]
38. Marantz P, Granja M, Aiello H, Trentacoste L, Izbizky G, Elias D, Otaño L. Angioplastia aórtica intrauterina. Revista Hospital Italiano de Buenos Aires 2006;26:1:27. [ Links ]
39. Kohl T, Sharland G, Allan LD, Gembruch U, Chaoui R, Lopes LM, et al. World experience of percutaneous ultrasound-guided balloon valvuloplasty in human fetuses with severe aortic valve obstruction. Am J Cardiol 2000;85:1230-3. [ Links ]
40. Tulzer G, Arzt W, Franklin RC, Loughna PV, Mair R, Gardiner HM. Fetal pulmonary valvuloplasty for critical pulmonary stenosis or atresia with intact septum. Lancet 2002;360:1567-8. [ Links ]














