Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista argentina de cardiología
versión On-line ISSN 1850-3748
Rev. argent. cardiol. v.76 n.6 Ciudad Autónoma de Buenos Aires nov./dic. 2008
Implante cardíaco de mioblastos. Resultado en el seguimiento a cinco años
Jorge C. TraininiMTSAC, Noemí LagoMTSAC, José L. BarisaniMTSAC, Osvaldo MasoliMTSAC, 1, Jorge Mouras, Juan C. Chachques2, Jesús Herreros3, Roberto Giordano, Alejandra I. ChristenMTSAC, Jorge De Paz
Servicio de Cirugía Cardíaca, Hospital Interzonal de Agudos Presidente Perón, Avellaneda, Pcia. de Buenos Aires, Argentina
MTSAC Miembro Titular de la Sociedad Argentina de Cardiología
1 Hospital General de Agudos "Dr. Cosme Argerich", Buenos Aires
2 Hospital Europeo G. Pompidou, París, Francia
3 Universidad de Navarra, Pamplona, España
Recibido: 24/09/2008
Aceptado: 09/10/2008
Dirección para separatas: Dr. Jorge C. Trainini HIGA Presidente Perón Anatole France 773 (1870) Avellaneda, Pcia. de Buenos Aires, Argentina e-mail: jctrainini@hotmail.com
RESUMEN
Las primeras experiencias en la búsqueda de regeneración cardíaca en fase clínica se llevaron a cabo con mioblastos en diversos centros del mundo, entre los que se cuentan instituciones de la República Argentina. Esto motivó en su momento publicaciones en los años 2002 y 2003 sobre los estudios iniciales. Posteriormente se realizó una evaluación de estos pacientes a los tres años de seguimiento. Es nuestro interés presentar en el mismo grupo tratado un nuevo análisis superados los cinco años del implante.
Si tomamos en cuenta los segmentos comprometidos y los dividimos en infarto transmural, infarto no transmural, isquémicos y normales, hallamos que sobre 68 segmentos pasibles de estudio en los 4 enfermos sobrevivientes a los 66 ± 6,2 meses hubo un claro retroceso de los segmentos con infarto transmural y un incremento en los segmentos no transmurales e isquémicos. Los segmentos con compromiso transmural retrocedieron de 15 a 3, lo que representa una reducción del 80% (p = 0,0005). El análisis de los segmentos no transmurales debe ser exhaustivo. Si bien globalmente aumentaron de 7 a 9, los segmentos no transmurales registrados originariamente en el preoperatorio descendieron de 7 a ninguno. Se puede considerar que el aumento global de estos segmentos no transmurales correspondió a segmentos incorporados tanto por el avance de la enfermedad como a expensas de los transmurales, en claro retroceso del tejido fibrótico.
Palabras clave: Mioblastos; Trasplante de células; Insuficiencia cardíaca
Abreviaturas
CF Clase funcional
DDVI Diámetro diastólico del ventrículo izquierdo
FEVI Fracción de eyección del ventrículo izquierdo
SUMMARY
Myoblast Transplantation in the Heart: Outcomes at 5-year Follow-Up
Several centers all around the world, including some institutions in Argentina, performed the first experiences in clinical phase with myoblast transplantation for cardiac regeneration. These initial studies were published during 2002 and 2003. The outcomes of these patients at 3-year followup were reported thereafter. It is in our interest to present the outcomes of the same group of patients 5 years after the implant.
We have classified the compromised segments in 4 categories: transmural infarction, nontransmural infarction, ischemic and normal. In this way, 68 segments from 4 patients who were alive at 66±6.2 months were available for evaluation. There was a clear reduction in the number of segments with transmural infarction and an increase in the number of segments with nontransmural infarction and with ischemia. The number of segments with transmural compromise decreased from 15 to 3 (risk reduction of 80%; p=0.0005). Analysis of nontransmural segments should be performed in a comprehensive fashion. The global number of these segments increased from 7 to 9; however, preoperative nontransmural segments originally reported decreased from 7 to none. It might be considered that the global increase of these nontransmural segments corresponded to segments incorporated not only as a consequence of the progression of the disease but also at the expense of transmural segments, in a clear reduction of the fibrotic tissue.
Key words: Myoblasts; Cells Transplantation; Heart Failure
INTRODUCCIÓN
Es bien conocido que el músculo cardíaco lesionado es reemplazado por tejido fibrótico. En la pérdida de la masa muscular, la hipertrofia celular puede compensar parcialmente la disminución de la contractilidad, pero el cortejo de remodelación lleva al cuadro de insuficiencia cardíaca progresiva. La sumatoria del conocimiento de disciplinas derivadas de la genética y de la biología celular han permitido instaurar un proyecto de autorreparo celular. Sin embargo, persisten varias cuestiones por dilucidar para que esta posibilidad se transforme en terapéuticas posibles y habituales. ¿Cuál es su eficacia? ¿Cuál es la mejor célula para utilizar? ¿Cómo deben implantarse? son interrogantes por resolver. Para alcanzar niveles de factibilidad clínica e índices de confiabilidad terapéutica, esta técnica deberá ampararse en sus resultados a largo plazo.
Las primeras experiencias en la búsqueda de regeneración cardíaca en fase clínica se llevaron a cabo en diversos centros del mundo con mioblastos, entre los que se cuentan instituciones de la República Argentina. (1-10) Esto motivó en su momento una publicación sobre la experiencia inicial en los años 2002 y 2003. (8-10) Posteriormente se realizó una evaluación de estos pacientes a los tres años de seguimiento. (11) Es nuestro interés presentar en el mismo grupo tratado un nuevo análisis superados los cinco años del implante. El objetivo de esta comunicación es comprobar únicamente la evolución a los 66 ± 6,2 meses de los segmentos con necrosis transmural que fueron tratados con el implante de mioblastos. No persigue analizar sobrevida ni variables funcionales. Los estudios originales de cada paciente fueron revaluados en su totalidad.
POBLACIÓN
De los 5 pacientes incluidos en el primer informe (8) en 2003, uno falleció por insuficiencia cardíaca a los 13 meses, secundaria a un nuevo infarto de miocardio. Por lo tanto, este paciente no completó el seguimiento y se descartó del análisis. En este informe se incluyen los 4 pacientes restantes que sobrevivieron. Pertenecen al sexo masculino con una edad media de 61 ± 6,4 años (rango 52-66), portadores de disfunción ventricular posinfarto y con indicación de cirugía de revascularización miocárdica en un área remota. La localización del infarto fue inferolateroposterior (n = 2), inferior (n = 1) e inferoposterior (n = 1). Todas las áreas infartadas tenían coronarias ocluidas y no revascularizables.
Todos los pacientes tenían síntomas clínicos de insuficiencia cardíaca en clase funcional (CF) II, evidencias de isquemia miocárdica en el territorio de la arteria descendente anterior (única arteria revascularizada) demostrada por angina y/o pruebas funcionales, ecográficas y radioisotópicas o angina que no respondía al tratamiento médico.
El análisis del ventrículo izquierdo se realizó en un modelo de 17 segmentos, mediante pruebas de perfusión miocárdica con gated-SPECT99m Tc sestamibi en reposo y posesfuerzo. Se utilizó un puntaje de cuantificación de los defectos de perfusión de 0 a 4 en cada segmento evaluado, que correspondía: 0 = normal, 1 = hipoperfusión leve, 2 = hipoperfusión moderada, 3 = hipoperfusión grave y 4 = aperfusión.
Se consideran segmentos con ausencia de viabilidad transmural (infarto transmural) los que tienen un puntaje de perfusión de 4 o 3 en las adquisiciones de esfuerzo que no revierten en el reposo y no muestran engrosamiento en las imágenes gatilladas. La ausencia de viabilidad es transmural (infarto no transmural) cuando en las adquisiciones de reposo el puntaje de perfusión cambia a 2 o 1.
Se inyectaron un promedio de 200 ± 47 × 106 células en un volumen de 3,9 ± 1,4 ml (rango 3-6) y con un porcentaje de células CD56+ (mioblastos) del 54% ± 8,6%. Los sitios de implante fueron en promedio de 22 ± 8 (rango 10-27).
ESTADÍSTICA
Las variables continuas se expresaron como media ± desviación estándar (DE) y se compararon mediante la prueba de la t, mientras que las variables discretas se compararon con la prueba de chi cuadrado. Se consideró significación estadística un valor de p < 0,05.
Seguimiento
A los 66 ± 6,2 meses de seguimiento promedio (rango 61-75 meses), todos los pacientes se hallan en CF I. La fracción de eyección del ventrículo izquierdo (FEVI), de 36% ± 6,1% en el preimplante se incrementó a 45% ± 13,4% (p = ns); por su parte, el diámetro diastólico del ventrículo izquierdo (DDVI) pasó de 61,7 ± 4,6 mm a 60,9 ± 6,3 mm (p = ns). En cuanto a los segmentos comprometidos, en las Tablas 1 y 2 y en la Figura 1 pueden verse las modificaciones halladas en cada uno de los segmentos.
Tabla 1. Segmentos transmurales, no transmurales (no T) e isquémicos. Evolución a los 6, 33 y 66 meses

Tabla 2. Evolución de los segmentos transmurales por paciente a los 66 meses

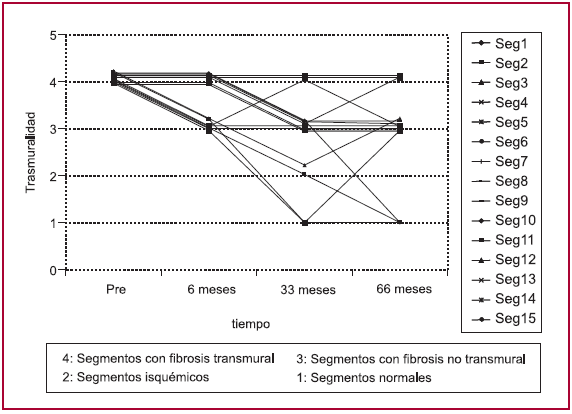
Fig. 1. Evolución de los segmentos con fibrosis transmural.
DISCUSIÓN
Los mioblastos utilizados en la presente experiencia provienen del músculo esquelético y se denominan también células satélite. Son de fácil multiplicación y se hallan entre los más estudiados, lo cual ha permitido su aplicación en la fase clínica. Están ubicados en la membrana basal en carácter latente hasta que un estímulo puede disparar su réplica. Los mioblastos se encuentran en la línea celular que se extiende desde la célula indiferenciada mesodérmica hasta las diferenciadas cardíaca, esquelética y también del músculo liso.
A pesar de que estas células se implantan en áreas infartadas, estas zonas nunca son del todo avasculares y por otra parte los mioblastos también son resistentes a la isquemia, lo cual permitiría el crecimiento y la multiplicación en un medio de nutrición óptimo. Nuestro objetivo principal fue demostrar la compatibilidad en el uso humano, avalados por una larga experiencia internacional en los últimos años llevada a cabo en diversas especies animales. Los resultados clínicos en este aspecto fueron satisfactorios, ya que se demostró la posibilidad de la réplica celular desde la biopsia inicial hasta alcanzar su número una cantidad adecuada para el injerto entre las 3 y 4 semanas de cultivo.
En cuanto a la seguridad del procedimiento, no hubo complicaciones en la cirugía ni en el seguimiento hasta el presente en los pacientes implantados. En este aspecto, los mioblastos tienen poca capacidad de oncogénesis o de migración a células de diferente naturaleza (osteoblastos, condroblastos). Su linaje miogénico es un punto a favor respecto de las células progenitoras de la médula ósea, las cuales tienen una posibilidad fenotípica más amplia.
Las técnicas tradicionales de cultivos comprenden el uso de suero fetal bovino para conseguir el crecimiento celular. El contacto de las células humanas con suero fetal bovino, después de tres semanas de cultivo, da por resultado la fijación de las proteínas animales en la superficie celular, lo cual representa un antígeno con posibilidades de efectos adversos, como se observó en la experiencia de Menasché. (1) Nosotros utilizamos desde el inicio suero autólogo. Nuestra experiencia se constituyó en el primer estudio clínico con esta técnica de cultivo y está reconocido y demostrado que no genera arritmias. (12, 13)
Las explicaciones sobre el mecanismo por el cual las células mejoran la performance del corazón son discutidas. Varios factores en forma directa o indirecta contribuyen a lograr los beneficios estructurales y funcionales. El implante de células musculares incrementaría la elasticidad regional con probabilidades de modificar la matriz celular y mejorar la remodelación ventricular. Con este fin hemos presentado recientemente experiencias clínicas con el agregado de matriz extracelular a células progenitoras de la médula ósea. (14)
El análisis estricto de la eficacia de este trabajo debe relacionarse en sus resultados con el objetivo básico planteado, el cual consiste en observar los cambios cinéticos producidos en las áreas no viables, metabólicamente inactivas y no revascularizables, las cuales fueron implantadas con mioblastos (Figura 2). En este aspecto son fundamentales los estudios que evidencien contractilidad en los segmentos tratados con células implantadas, ya que estos pacientes fueron revascularizados concomitantemente. Esta situación constituye una limitación en este protocolo, aunque los pacientes presentaban únicamente isquemia en el área anteroseptal, remota a las escaras injertadas.
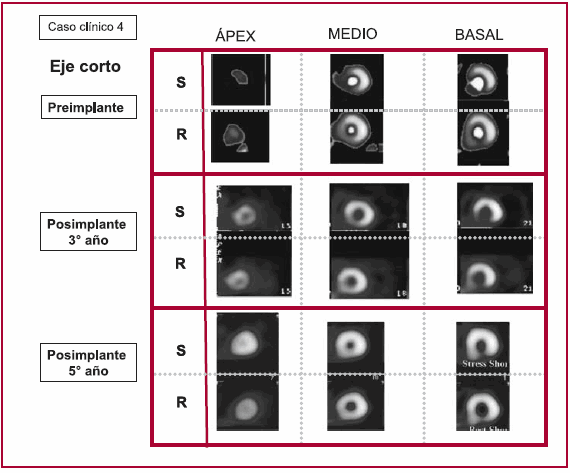
Fig. 2. Evolución de la perfusión en un paciente.
En relación con las variables funcionales, entre los 3 y los 5 años no hubo cambios en el valor de la CF, que permaneció en I. El DDVI inicial de 61,7 ± 4,6 mm y de 59 ± 5,8 mm a los 3 años se mantuvo no significativo en su evolución al observarse 60,9 ± 6,3 mm a los 5 años. La FEVI había pasado de 36% ± 6,1% al 46% ± 12,2% a los 3 años (p < 0,05). A los 5 años se observó un valor apenas menor, 45% ± 13,4%, que resultó no significativo. El análisis global nos hace avizorar una estabilidad clínica respecto de estas variables, las cuales se han mantenido en el tiempo.
Si tomamos en cuenta los segmentos comprometidos y los dividimos en infarto transmural, infarto no transmural, isquémicos y normales, hallamos que sobre 68 segmentos pasibles de estudio en los 4 enfermos sobrevivientes a los 66 ± 6,2 meses hubo un claro retroceso de los segmentos con infarto transmural y un incremento en los segmentos no transmurales e isquémicos. Los segmentos con compromiso transmural retrocedieron de 15 a 3, lo cual corresponde a una reducción del 80% (p = 0,0005). El análisis de los segmentos no transmurales debe ser exhaustivo. Si bien globalmente aumentaron de 7 a 9, aquellos segmentos no transmurales registrados originariamente en el preoperatorio descendieron de 7 a 0. Se puede explicar que el aumento global de estos segmentos no transmurales, analizado con la evaluación radioisotópica en cada uno de ellos, correspondió a segmentos incorporados tanto por el avance de la enfermedad como a expensas de los transmurales, en claro retroceso del tejido fibrótico. Debe considerarse que esta serie es breve en cuanto a número de pacientes, lo que vuelve el valor de las consideraciones de análisis una observación relativa, pero tiene la trascendencia de la evolución a los 5 años de esos primeros pacientes implantados con mioblastos en el mundo. Consideramos además, en lo que hace a la ética del empleo del conocimiento, un estricto deber la divulgación del seguimiento de observaciones pioneras si éstas se han realizado con métodos que nos permiten discernir sobre las técnicas que podemos emplear actualmente en este tema.
1. Menasché P, Hagege A, Scorsin M, Pouzet B, Desnos M, Duboc D, et al. Myoblast transplantation for heart failure. Lancet 2001;357: 279-80. [ Links ]
2. Chachques JC, Herreros J, Trainini JC, editores. Regeneración Cardíaca. Buenos Aires: Magister Eos Ed; 2005. [ Links ]
3. Atkins BZ, Lewis CW, Kraus WE, Hutcheson KA, Glower DD, Taylor DA. Intracardiac transplantation of skeletal myoblasts yields two populations of striated cells in situ. Ann Thorac Surg 1999;67:124-9. [ Links ]
4. Taylor DA, Atkins BZ, Hungspreugs P, Jones TR, Reedy MC, Hutcheson KA, et al. Regenerating functional myocardium: improved performance after skeletal myoblast transplantation. Nat Med 1998;4:929-33. [ Links ]
5. Trainini JC, Lago N, de Paz J, Cichero D, Giordano, Mouras J y col. Trasplante de mioblastos esqueléticos para reparo de necrosis miocárdica. Rev Argent Cardiol 2002;70-324-7. [ Links ]
6. Chachques JC, Herreros J, Trainini JC. Cardiomioplastia celular. Rev Argent Cardiol 2003;71:138-45. [ Links ]
7. Chachques JC, Cattadori B, Herreros J, Trainini JC, Blanchard D, Fabiani JN, et al. Treatment of heart failure with autologous skeletal myoblasts. Herz 2002;27:570-8. [ Links ]
8. Trainini JC, Lago N, de Paz J, Cichero D, Giordano R, Mouras J, et al. Myoblasts transplantation for myocardial repair: a clinical case. J Heart Lung Transp 2004;23:503-5. [ Links ]
9. Lago N, Trainini JC, Genovese J, Barisani JL, Mouras J, Guevara E y col. Tratamiento de la disfunción ventricular posinfarto mediante el cardioimplante de mioblastos autólogos. Rev Argent Cardiol 2003;71 (abstract):90. [ Links ]
10. Lago N, Trainini JC, Genovese J, Barisani JL, Mouras J, Guevara E y col. Tratamiento de la disfunción ventricular posinfarto mediante el cardioimplante de mioblastos autólogos. Rev Argent Cardiol 2003;71 (abstract):90. [ Links ]
11. Trainini JC, Lago N, Masoli O, Mouras J, Guevara E, Barisani JL y col. Implante cardíaco de mioblastos. Resultado en el seguimiento a cinco años. Rev Argent Cardiol 2006;74:304-7. [ Links ]
12. Herreros J. Regeneración cardíaca. Rev Argent Cardiol 2004; 72:97-8. [ Links ]
13. Herreros J, Prosper F, Perez A, Gavira JJ, Garcia-Velloso MJ, Barba J, et al. Autologous intramyocardial injection of cultured skeletal muscle-derived stem cells in patients with non-acute myocardial infarction. Eur Heart J 2003;24:2012-20. [ Links ]
14. Chachques JC, Trainini JC, Lago N, Cortes-Morichetti M, Schussler O, Carpentier A. Myocardial Assistance by Grafting a New Bioartificial Upgraded Myocardium (MAGNUM Trial): Clinical Feasibility Study. Ann Thorac Surg 2008;85:901-8. [ Links ]














