Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista argentina de cardiología
versión On-line ISSN 1850-3748
Rev. argent. cardiol. v.77 n.1 Ciudad Autónoma de Buenos Aires ene./feb. 2009
Hemocromatosis primaria. Detección precoz de compromiso miocárdico a través de la resonancia magnética cardíaca
Fernando CorbellaMTSAC, 1, Carlos Rivas2, Laura Dragonetti3, Eduardo Eyheremendy4, Claudia Caló5
MTSACMiembro Titular de la Sociedad Argentina de Cardiología
1 Ex médico del Servicio de Ecocardiografía y Doppler del Hospital General de Agudos José María Ramos Mejía. Ex médico de Ecocardiografía y Doppler del Instituto Fleni, Sede Escobar
2 Jefe del Servicio de Cardiología del Hospital Alemán
3 Médica del Servicio de Radiología del Hospital Alemán
4 Jefe del Servicio de Diagnóstico por Imágenes del Hospital Alemán
5 Técnica del Servicio de Diagnóstico por Imágenes del Hospital Alemán
RESUMEN
La hemocromatosis primaria es la enfermedad genética más común de Occidente (1 de cada 300 a 400 personas). El compromiso cardíaco durante sus estadios iniciales no se detecta por las técnicas de diagnóstico por imágenes y es durante este período cuando sobrevienen arritmias potencialmente letales. A través de la resonancia magnética cardíaca (RMC) con su secuencia de T2 estrella es posible detectar precozmente la afectación cardíaca y permite estratificar el riesgo y monitorizar la evolución del tratamiento de los pacientes afectados.
Palabras clave: Hemocromatosis; Arritmias malignas; Resonancia magnética
Abreviaturas
RMC Resonancia magnética cardíaca
SUMMARY
Primary Hemochromatosis Early Detection of Myocardial Involvement through Cardiac MRI
The primary hemochromatosis is the most common genetic disease in Western regions (1 out of 300/400 individuals). The cardiac involvement during its early stages is not detected with the diagnostic imaging techniques, and it is during these stages when potentially life-threatening arrhythmias occur. Through the CMRI, with its T2 star sequence, it is possible to early detect the cardiac involvement and to stratify the risk and monitor the evolution of treatment in affected patients.
Key words: Hemochromatosis; Malignant Arrhythmias; Magnetic Resonance Imaging
INTRODUCCIÓN
La hemocromatosis primaria o hereditaria se transmite en forma autosómica y recesiva; el defecto se encuentra en el brazo corto del cromosoma 6, donde se producen dos mutaciones: cisteína 282 tirosina e histidina 63 aspargina.
Estas mutaciones producen: 1) un aumento del número de receptores al hierro en la membrana plasmática de los enterocitos del duodeno y de los primeros centímetros del intestino delgado, 2) alteraciones de la calidad de los receptores que permite una absorción mayor del hierro al interior de las células y 3) alteraciones de la secuencia de los aminoácidos que codifican la proteína transportadora del hierro (transferrina). (1, 2)
La sintomatología es totalmente inespecífica: algias musculares difusas, dolores abdominales difusos, diarreas, dolores articulares fundamentalmente en las manos y la cintura escapular, astenia, adinamia, anorexia y disfunción sexual. (3)
Los niveles de ferremia, ferritina y porcentaje de saturación de transferrina no siempre son concordantes con el nivel de hierro depositado en los tejidos. (4)
CASO CLÍNICO
Paciente de sexo masculino de 53 años, sin antecedentes cardiovasculares previos, que consulta en abril de 2005 por crisis sincopal de segundos de duración.
Antecedentes personales
Ptosis palpebral bilateral congénita, osteocondroma de cabeza de peroné, bursitis de codo izquierdo, menisectomía izquierda, tonsilectomía y apendicectomía. Todos ellos con examen cardiológico prequirúrgico normal.
Antecedentes familiares
Padre vivo 79 años. HTA. Piel bronceada. Madre viva 75 años. Examen físico cardiovascular (EFCV): Normal. Hijo 27 años. Palpitaciones. ECG: s/p. Ergo: s/p. Eco: Puntillado hiperrefringente en SIV. Holter: s/p. Hija 24 años.Palpitaciones. Hipotiroidea. EFCV: Normal. ECG: s/p.
Antecedentes personales de enfermedad actual
01/92: Internado en UTI por FAP que revierte espontáneamente. EFCV y ECG: s/p. Laboratorio de rutina: s/p. Tiroides: s/p. Ergo: s/p. Eco: s/p. Holter: s/p. 08/98: Palpitaciones. EFCV: Normal. ECG: Rs HBAi. Ergo: s/p. Eco: s/p. Holter: s/p. Análisis de rutina y tiroides: s/p. 02/99: Malestar abdominal difuso y diarrea. Laboratorio de rutina. Eco abdominal y examen físico: s/p. 01/02: Dolores musculares generalizados con predominio de ambos MMSS, con parestesias, hipoestesias y dolores en las articulaciones de los dedos de 2 años de evolución. Laboratorio de rutina: s/p. Interconsulta con reumatología: Descarta colagenopatía. 06/02: Palpitaciones con EFCV y ECG s/p. Ergo, eco y Holter: s/p. 10/02: Dolores abdominales difusos y diarrea. Dolores musculares difusos. Examen físico y análisis de rutina: s/p. Videocolonoscopia: s/p (colon irritable). 10/02: Cefaleas intensas, vértigo y mareos. Examen neurológico: s/p. RMN y TAC de encéfalo: s/p. 11/02: Ferritina 1.680 (Vn 35 a 280 mg/ml). Ferremia 215 (Vn 60 a 170 μg/100ml). Transferrina 538 (Vn 250 a 300 μg/100 ml). % de saturación de transferrina 75% (Vn ♂:50% ♀:30%). TGP y TGO: levemente aumentadas. 12/02: Estudio genético positivo para hemocromatosis con mutación genética homocigota C 282 T. Se comienza con flebotomías de 500 cm3 semanales con controles de parámetros hematológicos. 08/03: Normaliza los parámetros hematológicos y se realizan flebotomías y controles mensuales. Desaparecen los síntomas de dolores abdominales, musculares y diarreas. 03/05: Hipotiroidismo (tiroiditis subaguda por laboratorio, eco, centello y captación de yodo 131). T4 50 μg/día. 04/05: Presenta crisis sincopal de segundos de duración, que ocasiona accidente de tránsito.
En la figura 1 se muestran un trazado electrocardiográfico y dos trazados Holter de 24 horas del paciente.
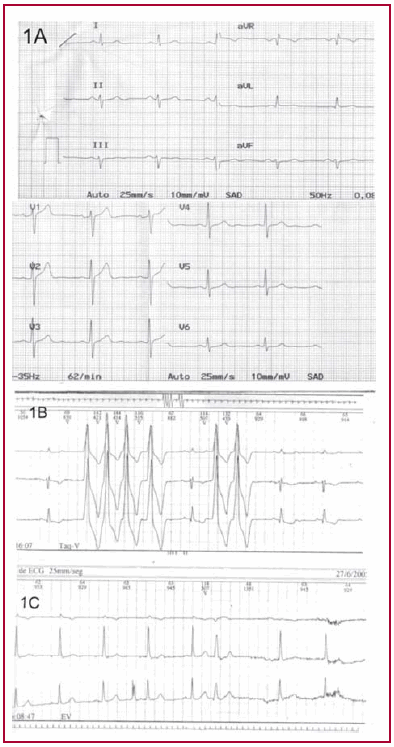
Fig. 1. A. ECG: ritmo sinusal. Desviación del eje eléctrico a -45° compatible con hemibloqueo anterior izquierdo. B. Trazado Holter de 24 horas en el que se observa taquicardia ventricular monofocal autolimitada (6 latidos). C. Trazado Holter de 24 horas en el que se observan extrasístoles ventriculares monofocales aisladas.
DISCUSIÓN
En los estadios iniciales de la hemocromatosis, el hierro se deposita dentro del miocito, pero no lo destruye y no es reemplazado por tejido fibroso o cicatrizal responsable de la alteración de la movilidad y el engrosamiento sistólico del músculo. Por este motivo, en esta etapa inicial, tanto el eco en modo M, 2D, Doppler tisular, Doppler tisular color y Doppler transmitral, así como la RMC en sus secuencias anatómicas y funcionales no detectan alteraciones. Por eco- Doppler cardíaco y RMC, la función sistólica de ambas cámaras ventriculares, así como su masa, espesores, volúmenes y función diastólica fueron normales (Figuras 2 y 3).
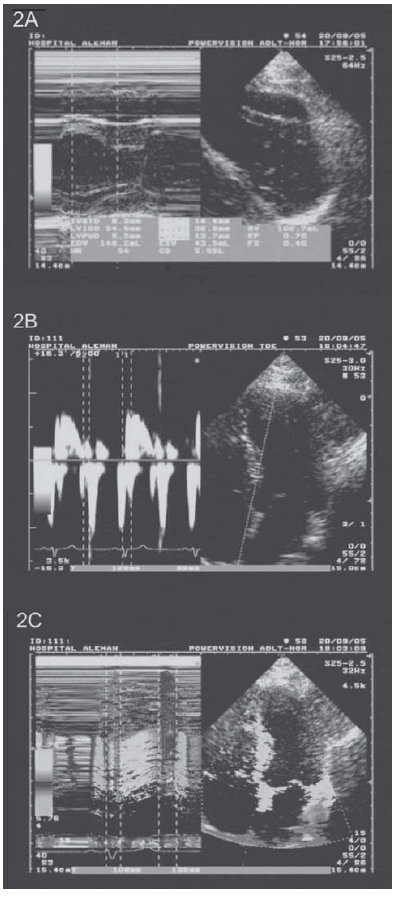
Fig. 2. A. Trazado ecocardiográfico en modo M y 2 D dentro de la normalidad. B. Trazado Doppler tisular normal. C. Trazado Doppler tisular color normal.
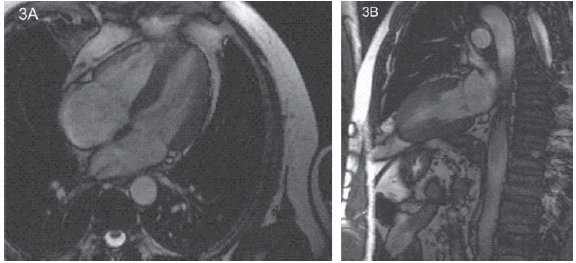
Fig. 3. A. Cinerresonancia magnética cardiovascular (secuencia sangre blanca - gradiente eco) de cuatro cámaras, morfológico y funcional, normales. B. Cinerresonancia magnética cardiovascular (secuencia sangre blanca - gradiente eco) de dos cámaras, morfológico y funcional, normales.
Al no existir fibrosis, los métodos radioisotópicos y el realce tardío por RMC tampoco muestran alteraciones.
La RMC a través de la secuencia de T2 estrella (secuencia que emite tiempos de ecos [TE]) de duración sucesivamente mayor, desde los 5 ms hasta los 20 ms, y si aparecen áreas "negras"en el miocardio, antes de los 20 ms, pone de manifiesto la presencia de depósitos patológicos de hierro que pueden producir arritmias potencialmente fatales y que no se observan por otra técnica de diagnóstico por imágenes (Figura 4). Este hallazgo permite el seguimiento longitudinal del tratamiento y la estratificación pronóstica de los pacientes en estadios tempranos de esta enfermedad. (5, 6) Debido al aumento de las enzimas hepáticas (TGO y TGP), se buscó la presencia de depósitos patológicos de hierro en el tejido hepático, que no se observaron, habiéndose modificado el FOV (field of view) para poder visualizar en su totalidad el parénquima hepático.
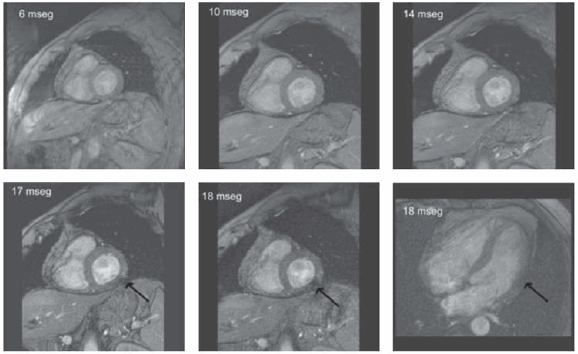
Fig. 4. Secuencia Turbo Flash T2* con tiempos de eco (TE) variables e in crescendo hasta los 20 ms. A partir de los 17 ms se observa la presencia de un área negra en la cara lateral medial, en eje corto y en la cara lateral medial en 4C, compatible con depósitos patológicos de hierro.
1. MacDonald RA, Mallory GK. Hemocromatosis and hemosiderosis. Study of 211 autopsied cases. Arch Intern Med 1960;105:686-700. [ Links ]
2. Hershko C, Link G, Cabantchik I. Pathophysiology of iron overload. Ann NY Acad Sci 1998;850:191-201. [ Links ]
3. Buja LM, Roberts WC. Iron in the heart. Etiology and clinical significance. Am J Med 1971;51:209-21. [ Links ]
4. Barosi G, Arbustini E, Gavazzi A, Grasso M, Pucci A. Myocardial iron grading by endomyocardial biopsy. A clinico-pathologic study on iron overloaded patients. Eur J Haematol 1989;42:382-8. [ Links ]
5. Anderson LJ, Holden S, Davis B, Prescott E, Charrier CC, Bunce NH, et al. Cardiovascular T2-star (T2*) magnetic resonance for the early diagnosis of myocardial iron overload. Eur Heart J 2001; 22:2171-9. [ Links ]
6. Reeder SB, Faranesh AZ, Boxerman JL, McVeigh ER. In vivo measurement of T*2 and field inhomogeneity maps in the human heart at 1.5 T. Magn Reson Med 1998;39:988-98. [ Links ]














