Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista argentina de cardiología
versión On-line ISSN 1850-3748
Rev. argent. cardiol. vol.78 no.2 Ciudad Autónoma de Buenos Aires mar./abr. 2010
COMUNICACIÓN BREVE
Papel de la angiotensina-(1-7) sobre la recaptación neuronal de noradrenalina en la hipertensión
María A. López Verrilli1, Martín Rodríguez Fermepín2, Belisario E. Fernández2, Mariela M. Gironacci1
Trabajo ganador del Premio Braun Menéndez del XXXV Congreso Argentino de Cardiología
1 Instituto de Química y Fisicoquímica Biológicas (IQUIFIB)
2 Cátedra de Fisiopatología, Facultad de Farmacia y Bioquímica, Universidad de Buenos Aires
Recibido: 17/12/2009
Aceptado: 23/12/2009
Dirección para separatas: Dra. Mariela M. Gironacci Instituto de Química y Fisicoquímica Biológicas (IQUIFIB) Facultad de Farmacia y Bioquímica Universidad de Buenos Aires Junín 956 (1113) Buenos Aires, Argentina Tel. 54-11-4964-8290 e-mail: mariela@qb.ffyb.uba.ar
RESUMEN
Previamente demostramos que la angiotensina (Ang)-(1-7), en contraste con la Ang II, disminuye la liberación y la síntesis de noradrenalina (NA) en ratas espontáneamente hipertensas (SHR). En el presente trabajo investigamos en ratas SHR el efecto de la Ang-(1-7) sobre la recaptación neuronal y la expresión del transportador de NA (NET), principal responsable de la eliminación de NA del espacio sináptico. Si bien la Ang-(1-7) no presenta un efecto agudo sobre la recaptación neuronal de noradrenalina, tiene un papel estimulador sobre el contenido proteico del NET a largo plazo. Esta acción la ejerce a través de la estimulación de la síntesis proteica de novo del transportador por la activación del receptor Mas. Esto sugeriría que, a través de la regulación de los niveles de NA en el espacio sináptico, la Ang-(1-7) contribuiría a la regulación de la presión arterial.
Palabras clave: Angiotensina; Noradrenalina; Sinapsis; Neuronas; Hipertensión
Abreviaturas
Ang II Angiotensina II
Ang-(1-7) Angiotensina (1-7)
ARNm Ácido ribonucleico mensajero
CACT-D Actinomicina D
CHX Cicloheximida
NA Noradrenalina
NO Óxido nítrico
NET Transportador de noradrenalina
SHR Ratas espontáneamente hipertensas
SRA Sistema renina-angiotensina
SUMMARY
Role of Angiotensin (1-7) in Neuronal Norepinephrine Reuptake in Hypertension
We have previously demonstrated that angiotensin (Ang)-(1-7) decreases the release and synthesis of norepinephrine (NE) in spontaneously hypertensive rats (SHR). In the present study, we have investigated the effect of Ang-(1-7) on neuronal NE reuptake and the expression of NE trans-porter (NET), responsible for eliminating NE from the syn-aptic cleft. Although Ang-(1-7) does not have an acute effect on NE neuronal reuptake, it plays a role in stimulating the protein content of the NET in the long-term. Ang-(1-7) activates Mas receptor and stimulates protein synthesis de novo of the transporter. In this way, Ang-(1-7) would contribute to blood pressure control through the regulation of NE levels in the synaptic cleft.
Key words: Angiotensin; Norepinephrine; Synapsis; Neurons; Hypertension
INTRODUCCIÓN
El sistema renina-angiotensina (SRA) es uno de los principales sistemas que participan en la regulación de la presión arterial y de la homeostasis de líquidos. La angiotensina (Ang) (1-7) es un péptido bioactivo del SRA que provoca vasodilatación, diuresis y natriuresis, lo cual favorece la disminución de la presión arterial, particularmente en situaciones de actividad aumentada de la Ang II, como ocurre en la hipertensión. (1, 2)
Uno de los mecanismos por los que la Ang II ejerce su efecto presor es a través de la estimulación del sistema nervioso simpático, con aumento de la síntesis y la liberación de catecolaminas en núcleos cerebrales asociados con el control de la presión arterial. (3, 4) Hemos demostrado que la Ang-(1-7), en contraste con la Ang II, presenta un efecto neuromodulador inhibidor de la neurotransmisión noradrenérgica a nivel central, que provoca una disminución de la liberación de NA en hipotálamos aislados de ratas normotensas y espontáneamente hipertensas (SHR). (5, 6) La disminución de la liberación de NA provocada por la Ang-(1-7) podría ser la consecuencia de una inhibición de la síntesis del neurotransmisor, así como de un aumento en su recaptación neuronal, dos procesos que contribuirían a reducir la concentración de neurotransmisor en el espacio sináptico. Recientemente demostramos que la Ang-(1-7) presenta un efecto inhibidor sobre la síntesis de NA por estimulación de la degradación de la tirosina hidroxilasa, enzima que cataliza la etapa inical y limitante en la biosíntesis de catecolaminas. (7) Para completar el estudio sobre el papel neuromodulador inhibidor de la Ang-(1-7) sobre la neurotransmisión noradrenérgica en la hipertensión, nuestro objetivo fue investigar el efecto de la Ang-(1-7) sobre la recaptación neuronal y la expresión del transportador de NA (NET), principal responsable de la eliminación de NA del espacio sináptico (8, 9) en ratas SHR, un modelo genético de hipertensión esencial.
MATERIAL Y MÉTODOS
Recaptación neuronal de 3H-NA
La recaptación neuronal de NA se evaluó en hipotálamos aislados de ratas adultas SHR y Wistar-Kyoto (WKY) como control normotenso, según se describió previamente. (10) Brevemente, los hipotálamos se incubaron en solución de Krebs conteniendo [3H]-NA durante 5 min, en ausencia y en presencia de distintas concentraciones de Ang-(1-7).
Luego se homogeneizaron y la radiactividad presente en las muestras se cuantificó en un contador de centelleo líquido.
Medición del contenido del transportador de noradrenalina
Se utilizaron cultivos primarios hipotalámicos de ratas WKY y SHR recién nacidas según se describió previamente. (7) Los cultivos neuronales preincubados en presencia y en ausencia de Ang-(1-7) durante diferentes tiempos se homogeneizaron y se sometieron a Western-blot utilizando un anticuerpo específico anti-NET (1/3.000), según descripción previa. (7)
Análisis estadístico
Los resultados se expresaron como la media ± error estándar de la media. El análisis estadístico de los resultados se realizó mediante la prueba de análisis de la varianza (ANOVA) y posprueba de Bonferroni. Las diferencias se consideraron significativas con p < 0,05.
RESULTADOS
Efecto de la angiotensina-(1-7) sobre la recaptación neuronal de noradrenalina
Como se muestra en la Figura 1, no se observaron cambios significativos en la recaptación neuronal basal de NA en hipotálamos aislados de ratas SHR respecto de los de WKY. La Ang-(1-7) 0,1 y 1,0 µM no modificó la recaptación neuronal de NA (Figura 1).

Fig. 1. Porcentaje de cambio de la recaptación neuronal de 3H-NA en hipotálamos aislados de ratas SHR respecto de WKY. Los hipotálamos se preincubaron en ausencia (basal) o en presencia de Ang-(1-7) 0,1 y 1,0 µM durante 5 min y se determinó la recaptación neuronal de NA según se describe en Material y métodos. Se representan las medias ± EEM de 6 experimentos independientes.
Efecto de la angiotensina-(1-7) sobre el contenido del transportador de noradrenalina
Si bien la recaptación neuronal de NA no se modificó por la adición de la Ang-(1-7), se estudió su efecto sobre el contenido del NET como posible mecanismo de regulación de la recaptación neuronal de NA a largo plazo.
Los niveles endógenos del transportador no fueron significativamente diferentes en los cultivos neuronales de ratas SHR respecto de los de WKY (Figura 2 A). Al incubar los cultivos neuronales de ratas SHR con Ang-(1-7) 0,1 µM durante diferentes tiempos, se observó un aumento significativo del contenido de NET luego de 1, 3 y 5 horas (30% ± 16%, 40% ± 7% y 20% ± 8%, respectivamente) (Figura 2 B).

Fig. 2. A. Contenido basal del NET en cultivos primarios neuronales. La intensidad de las bandas se cuantificó por densitometría óptica y se expresó como porcentaje del valor medido en WKY, al cual se le asignó un valor del 100%. Se representan la media ± EEM de cuatro experimentos independientes. *p < 0,05 comparado con WKY. B. Efecto de la Ang-(1-7) sobre el contenido del NET en cultivos neuronales de ratas SHR. Los cultivos neuronales de cada cepa se incubaron en ausencia (control) o en presencia de Ang-(1-7) 0,1 µM durante los tiempos indicados. Los resultados se representan como la media ± EEM de cinco experimentos independientes. * p < 0,05 comparado con el control. C. Efecto de los antagonistas de receptores AT2, Mas o AT1 sobre el efecto estimulador de la Ang-(1-7) sobre el contenido de NET en cultivos primarios neuronales de ratas SHR. Los cultivos neuronales se preincubaron con solución de Krebs en ausencia (control) o en presencia de PD123319 1 µM, antagonista de receptores AT2 (antag AT2), o con [D-Ala7]-Ang-(1-7) 1 µM, antagonista de receptores Mas (antag Mas), o con losartán 1 µM, antagonista de receptores AT1 (antag AT1), durante 15 min. Luego se adicionó Ang-(1-7) 0,1 µM durante 30 min. El contenido del NET se evaluó por Westernblot como se describe en Material y métodos. La intensidad de las bandas se midió por densitometría óptica y se expresó como porcentaje del valor relativo al control, que se consideró como el 100%. Se representan la media ± EEM de seis experimentos independientes. * p < 0,05 comparado con el control.
Para determinar el tipo de receptor involucrado en el efecto estimulador de la Ang-(1-7) sobre el contenido de NET, se emplearon antagonistas específicos de los receptores AT1 y AT2 de Ang II y del receptor Mas de Ang-(1-7). [D-Ala7]Ang-(1-7) 1 µM, antagonista específico de los receptores Mas, bloqueó el efecto estimulador de la Ang-(1-7) sobre el contenido de NET, mientras que PD12319 1 µM, antagonista específico del receptor AT2 de Ang II, o losartán 1 µM, antagonista específico del receptor AT1 de Ang II, no modificaron el efecto estimulador de la Ang-(1-7) sobre el contenido de NET. Esto sugiere que el aumento sobre el contenido de NET inducido por la Ang-(1-7) es mediado por el receptor Mas. Los antagonistas no tuvieron efecto per se (Figura 2 C).
Para evaluar si el efecto de la Ang-(1-7) sobre el contenido de NET era consecuencia de un aumento en la s íntesis del transportador, los cultivos neuronales se incubaron con actinomicina D (ACT-D) o cicloheximida (CHX), inhibidores de la transcripción y de la traducción génica, respectivamente, junto con Ang-(1-7) 0,1 µM. Tanto la ACT-D como la CHX bloquearon el aumento provocado por la Ang-(1-7) sobre el contenido del NET, lo cual indica que la Ang-(1-7) estimula la transcripción y la traducción del gen del NET, con el consecuente aumento del contenido proteico del transportador (Figura 3).
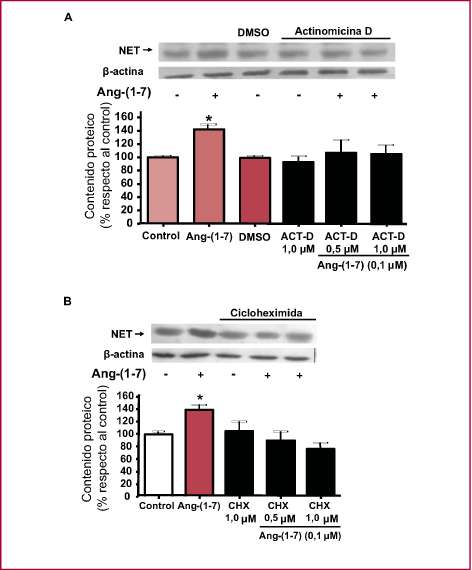
Fig. 3. A. Efecto de la Ang-(1-7) sobre el contenido de NET en presencia del inhibidor de la transcripción génica, actinomicina-D (ACT-D). Los cultivos neuronales de ratas SHR se preincubaron con solución de Krebs (control) en ausencia o en presencia de ACT-D 0,5 y 1 µM, disuelta en DMSO, durante 15 min a 37 °C. Luego se adicionó Ang-(1-7) 0,1 µM y los cultivos neuronales se incubaron durante 3 h a 37 °C. El DMSO no modificó el contenido de NET. B. Efecto de la Ang-(1-7) sobre el contenido de NET en presencia del inhibidor de la traducción, cicloheximida (CHX). Los cultivos primarios neuronales provenientes de ratas SHR se preincubaron con solución de Krebs en ausencia (control) o en presencia de CHX 0,5 y 1 µM durante 30 min a 37 °C. Luego se adicionó Ang-(1-7) 0,1 µM y las células se incubaron durante 3 h. La intensidad de las bandas se midió por densitometría óptica y se expresó como porcentaje del valor relativo al control, que se consideró como el 100%. Se representan la media ± EEM de seis experimentos independientes. * p < 0,05 comparado con el control
DISCUSIÓN
El sistema nervioso simpático es el principal responsable del desarrollo de hipertensión arterial. La sobreactivación del sistema simpático resulta de una descarga elevada de los centros simpáticos y de un aumento en los niveles de NA en el espacio sináptico. Por ende, la sobreactivación simpática resulta de una liberación elevada, así como de un mal funcionamiento en la recaptación neuronal del neurotransmisor. El NET es el principal responsable de la eliminación neuronal rápida de la NA liberada al espacio sináptico, modulando la transmisión sináptica y la homeostasis de NA. (8, 9) Nuestros resultados muestran que la recaptación neuronal de NA en hipotálamos aislados, así como el contenido proteico de NET en los cultivos neuronales, no presenta diferencias en las ratas SHR con respecto a las ratas WKY, lo cual demuestra que la actividad y el contenido del transportador a nivel central no están alterados en la hipertensión. En concordancia, Lu y colaboradores (11) demostraron que tanto la actividad como los niveles de ARNm del NET en el tallo cerebral, el hipotálamo y en cultivos neuronales de ratas SHR no presentan diferencias respecto de las ratas WKY.
Aunque la Ang-(1-7) disminuye la liberación de NA de las terminales presinápticas simpáticas (5, 6) y que este efecto podría ser la consecuencia de una recaptación mayor de NA, la Ang-(1-7) no modifica la recaptación neuronal de dicha amina en hipotálamos aislados de ratas normotensas. (10) Del mismo modo, nuestros resultados demuestran que la Ang-(1-7) no provoca un efecto agudo sobre la recaptación neuronal de NA en hipotálamos de ratas SHR, ya que no la modifica. Sin embargo, no podemos descartar que la Ang-(1-7) pueda modificar este mecanismo a largo plazo como consecuencia de cambios en la expresión del transportador. Apoyando esta hipótesis, nuestros resultados demuestran que la Ang-(1-7) aumenta el contenido del NET en los cultivos primarios neuronales de ratas SHR.
Este aumento del contenido del NET provocado por la Ang-(1-7) es mediado por la activación del receptor Mas y es independiente de la estimulación de los receptores AT2 o AT1. Numerosos efectos de la Ang-(1-7) a nivel central son bloqueados en presencia de antagonistas del receptor Mas, como el estímulo de la potenciación a largo plazo en el hipocampo (12) y la facilitación del barorreflejo en el núcleo de tracto solitario de ratas normotensas y SHR (13) y la estimulación de la liberación de NO y prostanoides en amígdala de ratón, (14) lo que demuestra la interacción de la Ang-(1-7) con este receptor a nivel central.
El incremento del contenido del NET provocado por la Ang-(1-7) fue bloqueado en presencia de ACT-D y de CHX, indicativo de que la Ang-(1-7) estimula la transcripción y la traducción del gen que codifica al NET (resultados presentes). Se han comunicado resultados similares para la Ang II en los cultivos neuronales provenientes de ratas WKY y SHR, donde la Ang II estimula la síntesis del ARNm del NET y este efecto se observa a partir de las 2 horas de incubación. (15)
En conclusión, demostramos que la Ang-(1-7) no ejerce un efecto agudo sobre la recaptación neuronal de NA. Sin embargo, la Ang-(1-7) aumenta la expresión del NET a largo plazo, estimulando la síntesis proteica de novo del transportador a través de la activación del receptor Mas. Así, la Ang-(1-7) contribuiría al aumento del número de moléculas del transportador, lo cual estimularía la recaptación neuronal de NA y contribuiría así a regular la homeostasis de NA.
Agradecimientos
Agradecemos los subsidios otorgados por la Universidad de Buenos Aires y el Consejo Nacional de Investigaciones Científicas para la realización de este trabajo.
1. Gironacci MM. Contribution of angiotensin-(1-7) to the pathophysiology of hypertension. Rev Bras Hypertens 2005;12:147-52. [ Links ]
2. Santos RA, Campagnole-Santos MJ, Andrade S P. Angiotensin-(1-7): an update. Regul Pept 2000;91:45-62. [ Links ]
3. Reid IA. Interactions between ANG II, sympathetic nervous system, and baroreceptor reflexes in regulation of blood pressure. Am J Physiol 1992;262:E763-E78. [ Links ]
4. de Wardener HE. The hypothalamus and hypertension. Physiol Rev 2001;81:1599-658. [ Links ]
5. Gironacci MM, Vatta M, Rodriguez-Fermepin M, Fernandez BE, Peña C. Angiotensin-(1-7) reduces norepinephrine release through a nitric oxide mechanism in rat hypothalamus. Hypertension 2000; 35:1248-52. [ Links ]
6. Gironacci MM, Valera MS, Yujnovsky I, Peña C. Angiotensin-(1-7) inhibitory mechanism of norepinephrine release in hypertensive rats. Hypertension 2004;44:783-7. [ Links ]
7. Lopez Verrilli MA, Pirola CJ, Pascual MM, Dominici F P, Turyn D, Gironacci MM. Angiotensin-(1-7) through AT receptors mediates tyrosine hydroxylase degradation via the ubiquitin-proteasome pathway. J Neurochem 2009;109:326-35. [ Links ]
8. Masson J, Sagné C, Hamon M, El Mestikawy S. Neurotransmitter transporters in the central nervous system. Pharmacol Rev 1999;51:439-64. [ Links ]
9. Eisenhofer G. The role of neuronal and extraneuronal plasma membrane transporters in the inactivation of peripheral catecholamines. Pharmacol Ther 2001;91:35-62. [ Links ]
10. Gironacci M, Rodriguez Fermepín M, Vatta M, Fernandez BE, Rubio M, Peña C. Angiotensin-(1-7) does not affect norepinephrine neuronal uptake or catabolism in rat hypothalamus and atria. Cell Mol Neurobiol 2000;20:773-9. [ Links ]
11. Lu D, Yu K, Paddy MR, Rowland NE, Raizada MK. Angiotensin II regulation of tyrosine hydroxylase gene expression in the neuronal cultures of normotensive and spontaneously hypertensive rats. Endocrinology 1996;137:763-72. [ Links ]
12. Hellner K, Walther T, Schubert M, Albrecht D. Angiotensin-(1-7) enhances LTP in the hippocampus through the G-protein-coupled receptor Mas. Mol Cell Neurosci 2005;29:427-35. [ Links ]
13. Chaves GZ, Caligiorne SM, Santos RA, Khosla MC, Campagnole-Santos MJ. Modulation of the baroreflex control of heart rate by angiotensin-(1-7) at the nucleus tractus solitarii of normotensive and spontaneously hypertensive rats. J Hypertens 2000; 18:1841-8. [ Links ]
14. Albrecht D. Angiotensin-(1-7)-induced plasticity changes in the lateral amygdala are mediated by COX-2 and NO. Learn Mem 2007; 14:177-84. [ Links ]
15. Lu D, Yang H, Raizada MK. Angiotensin II regulation of neuromodulation: downstream signaling mechanism from activation of mitogen-activated protein kinase. J Cell Biol 1996; 135:1609-17. [ Links ]














