Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista argentina de cardiología
versión On-line ISSN 1850-3748
Rev. argent. cardiol. vol.78 no.5 Ciudad Autónoma de Buenos Aires set./oct. 2010
CARDIOLOGÍA PEDIÁTRICA
Origen anómalo de la coronaria izquierda en la arteria pulmonar: resultados de la cirugía correctora
Ignacio Lugones, Christian Kreutzer, María I. RománMTSAC , Andrés J. SchlichterMTSAC
Servicio de Cirugía Cardiovascular Pediátrica. Hospital de Niños "Dr. Ricardo Gutiérrez". Buenos Aires, Argentina
MTSAC Miembro Titular de la Sociedad Argentina de Cardiología
Recibido: 13/10/2009
Aceptado: 01/04/2010
Dirección para separatas: Dr. Ignacio Lugones Calle 10 Nº 857 - Piso 13 "B" La Plata, Argentina Tel. (0221) 15 525 6264 Fax: (0221) 425 5579 e-mail: ignaciolugones@hotmail.com
RESUMEN
Introducción
El origen anómalo de la arteria coronaria izquierda en la arteria pulmonar es una cardiopatía congénita rara que produce isquemia miocárdica con disfunción ventricular izquierda e insuficiencia mitral de grado variable. Las técnicas actuales han modificado la historia natural de esta enfermedad mediante el restablecimiento de un sistema de doble irrigación coronaria.
Objetivos
Evaluar la experiencia institucional en la corrección quirúrgica del origen anómalo de la coronaria izquierda en la arteria pulmonar.
Material y métodos
Entre febrero de 2000 y mayo de 2008 fueron operados 13 pacientes con este diagnóstico. Seis eran menores de 1 año; mediana: 2,5 años; rango: 45 días a 21 años. Antes de la cirugía, el 61% de los pacientes presentaban insuficiencia cardíaca, el 69% signos de infarto y el 84% cardiomegalia moderada a grave. La fracción de acortamiento promedio era del 26,07% y existía insuficiencia mitral moderada a grave en el 46% de los casos. El diagnóstico se confirmó por cateterismo en 11 pacientes.
En un paciente se realizó cirugía de Takeuchi y en los 12 restantes se efectuó el reimplante de la coronaria izquierda en la aorta. En un paciente se realizó plástica mitral. Seis recibieron perfusión y cardioplejía de la coronaria anómala por la arteria pulmonar.
Resultados
La mortalidad al presente, con un seguimiento promedio de 74,76 meses, es del 0%. Ningún paciente presentaba insuficiencia cardíaca al alta. En 9 de los 11 pacientes con cardiomegalia, ésta se redujo. La fracción de acortamiento promedio posoperatoria fue del 39,92%. La insuficiencia mitral disminuyó en todos los que la presentaban, excepto en uno. Ninguno presentó insuficiencia grave en el posoperatorio alejado.
Conclusiones
Los resultados de la cirugía correctora del origen anómalo de la coronaria izquierda en la arteria pulmonar son excelentes en todos los grupos etarios, con mejoría significativa de la función miocárdica y disminución de la insuficiencia mitral en la mayoría de los pacientes.
Palabras clave: Cardiopatías congénitas; Cirugía cardiovascular; Función ventricular; Insuficiencia cardíaca; Insuficiencia mitral; Isquemia miocárdica; Valvuloplastia
Abreviaturas:
ALCAPA Origen anómalo de la coronaria izquierda en la arteria pulmonar
IM Insuficiencia mitral
FA Fracción de acortamiento
SUMMARY
Outcomes after Surgical Correction of Anomalous Origin of the Left Coronary Artery from the Pulmonary Artery
Background
The anomalous origin of the left coronary artery from the pulmonary artery is a rare congenital heart defect that produces myocardial ischemia with left ventricular dysfunction and mitral regurgitation. The natural history of the disease has been modified by the current surgical techniques which establish a system with two coronary arteries.
Objectives
To evaluate our experience with the surgical correction of the anomalous origin of the left coronary artery from the pulmonary artery.
Material and Methods
A total of 13 patients underwent surgical repair of this condition from February 2000 to May 2008. Median age was 2.5 years; range 45 days to 21 years. Six patients were <1 year old. Before surgery, 61% of patients presented congestive heart failure, 69% had signs of myocardial infarction and 84% moderate to severe heart enlargement. Average shortening fraction was 26.07% and 46% of patients had moderate to severe mitral regurgitation. The diagnosis was confirmed by coronary angiography in 11 patients.
The Takeuchi procedure was performed in one patient and 12 patients underwent direct anastomosis of the anomalous left coronary artery directly to the aorta. One patient underwent mitral valve repair. Perfusion of the anomalous coronary artery and cardioplegia were provided via the pulmonary artery in six patients.
Results
At present, after a mean follow-up of 74.76 months, mortality rate is 0%. None of the patients presented congestive heart failure at discharge. A reduction in cardiac size was observed in 9/11 patients. The average postoperative shortening fraction was 39.92%. A decrease in the severity of mitral regurgitation was observed in all patients with only one exception. None of the patients presented severe mitral regurgitation in the late postoperative period.
Conclusions
The outcomes of the surgical correction of the anomalous origin of the left main coronary artery from the pulmonary artery are excellent in all age groups, with significant improvement of myocardial function and reduction of the severity of mitral regurgitation in most patients.
Key words: Congenital Heart Defects; Cardiovascular Surgery; Ventricular Function; Heart Failure; Mitral Regurgitation; Myocardial Ischemia; Mitral Valve Repair
INTRODUCCIÓN
El origen anómalo de la arteria coronaria izquierda en la arteria pulmonar (ALCAPA) es una cardiopatía congénita rara, que inicialmente describió Brooks en 1885 (1) y cuyo cuadro clínico identificaron Bland, White y Garland en 1933. (2) Produce isquemia miocárdica con disfunción ventricular izquierda e insuficiencia mitral (IM) de grado variable. Sin tratamiento quirúrgico, el pronóstico es adverso. Las técnicas actuales han modificado la historia natural de esta enfermedad mediante el restablecimiento de un sistema de doble irrigación coronaria.
El presente estudio fue realizado a fin de evaluar los resultados de la cirugía correctora en nuestra institución.
MATERIAL Y MÉTODOS
Se realizó un estudio retrospectivo descriptivo utilizando las historias clínicas como fuente de información. Se recolectaron los datos y se definieron variables categóricas y numéricas continuas. Se utilizaron tablas y gráficos de barras para la descripción de los datos. El análisis estadístico de éstos se realizó con el programa EpiInfo, versión 3.3.2; para las pruebas de comparación de medias se consideró estadísticamente significativo un valor de p < 0,05.
Pacientes
El objeto de estudio fueron los 13 pacientes a quienes se les diagnosticó ALCAPA entre febrero de 2000 y mayo de 2008 en el Hospital de Niños "Dr. Ricardo Gutiérrez" de la ciudad de Buenos Aires. De los 13 pacientes, 8 eran mujeres y 5 varones. Todos fueron operados. De acuerdo con la edad en el momento de la intervención quirúrgica se agruparon en menores de 1 año de vida y en mayores de esta edad. Los menores fueron 6 y los mayores 7. El rango etario fue de 45 días a 21 años y la mediana de las edades, de 2,5 años.
Evaluación preoperatoria
En el momento de la evaluación prequirúrgica se constató insuficiencia cardíaca congestiva en 8 de 13 pacientes, de los cuales 6 eran menores de 1 año. Los 5 pacientes restantes, con síntomas leves o asintomáticos, eran los mayores de todo el grupo y todos tenían más de 10 años. Once pacientes presentaban cardiomegalia moderada a grave en la radiografía de tórax. Los 2 restantes, de 11 y 21 años, ambos asintomáticos, presentaban silueta cardíaca dentro de los límites normales.
En el electrocardiograma, las ondas Q patológicas en la cara anterior y en las derivaciones precordiales izquierdas estaban presentes en 9 enfermos.
El diagnóstico se estableció mediante ecocardiograma Doppler color, que identificó la coronaria izquierda conectada a la arteria pulmonar. Asimismo, se evaluaron el sitio de emergencia de la coronaria anómala, la presencia de colaterales intercoronarianas, la patología intracardíaca o extracardíaca asociada, la fracción de acortamiento (FA) y el grado de insuficiencia mitral (IM).
La media de la FA en los menores de 1 año fue del 15,83% con una desviación estándar del 2,40%. En los mayores fue del 34,85% con una desviación estándar del 7,17%, lo cual evidencia una diferencia estadísticamente significativa entre ambos grupos (p = 0,0001). Diez de los 13 pacientes tenían IM. En 4 era leve, en 3 moderada y en 3 grave.
Tres pacientes presentaban asimismo ductus arterioso permeable.
En la Tabla 1 se resumen las características clínicas, electrocardiográficas, radiológicas y ecocardiográficas de los 13 pacientes.
Tabla 1. Características prequirúrgicas de los pacientes
Se realizó cateterismo para confirmación del diagnóstico en 11 pacientes, en el que se constató ausencia de la emergencia de la coronaria izquierda de la aorta. Se evaluaron también la presencia de colaterales intercoronarianas, la dilatación del ventrículo izquierdo y el grado de IM. Se midieron presiones y saturaciones en todas las cámaras y grandes vasos.
En 4 pacientes se realizó ergometría de esfuerzo preoperatoria, que arrojó resultados patológicos en todos los casos, con infradesnivel del segmento ST y capacidad funcional disminuida.
Se efectuó además un estudio de perfusión miocárdica con isótopos radiactivos en 7 pacientes. Todos ellos presentaron defectos de perfusión en la cara anterolateral izquierda, dilatación ventricular y alteraciones en la motilidad y el espesor sistólico.
Cirugía
Nueve pacientes fueron operados con hipotermia profunda (17 °C) y paro circulatorio. Los 4 restantes, todos ellos mayores de 1 año, a 27 °C y 2,4 litros/m2/min de flujo de circulación extracorpórea. En 3 pacientes se realizó el cierre del ductus arterioso persistente inmediatamente tras la entrada en circulación extracorpórea.
En los últimos 6 pacientes de esta serie se colocó una cánula pequeña en el tronco de la arteria pulmonar con clampeo distal de dicha arteria, para permitir la perfusión anterógrada de la coronaria izquierda durante el enfriamiento. La protección miocárdica incluyó la administración de cardioplejía cristaloide, tanto en la raíz aórtica como en el tronco pulmonar; en este último se utilizó la cánula de perfusión previamente colocada.
La coronaria izquierda se implantaba en la cara posterior de la arteria pulmonar en el 76,9% de los casos. En los 3 pacientes restantes lo hacía en la cara anterior en uno, en la cara lateral izquierda en otro y próxima al nacimiento de la rama derecha de la arteria pulmonar en el tercero. En todos los casos se logró realizar el reimplante directo de la coronaria izquierda en la aorta, excepto en un paciente, en el cual, por emerger la coronaria de la cara anterior de la arteria pulmonar, lejos de la aorta, se realizó la reconexión transpulmonar de la coronaria anómala (técnica de Takeuchi).
Un paciente de 30 meses de edad presentaba IM grave con válvula mitral displásica, engrosada y con dos hendiduras en la valva anterior. Se realizó anuloplastia y cierre de las hendiduras previo a la reconexión de la coronaria izquierda.
RESULTADOS
La mortalidad a corto y a largo plazos fue del 0%. No se requirió soporte circulatorio mecánico en ningún caso. En 2 pacientes, ambos menores de 1 año, se cerró el tórax en forma diferida por inestabilidad hemodinámica y cardiomegalia grave tras la salida de circulación extracorpórea.
El seguimiento se realizó mediante entrevistas programadas en los consultorios del hospital a los 15 días, 1 mes, 3 meses y luego cada 6 meses tras el alta hospitalaria, durante un tiempo promedio de 74,76 meses. Asimismo, en los intervalos entre consultas, cada familia dispuso del contacto telefónico con su respectivo cardiólogo pediátrico de cabecera. Durante todo el período de seguimiento posquirúrgico se evaluó el estado clínico general con especial énfasis en el aspecto cardiovascular mediante interrogatorio y una detallada semiología.
Todos los pacientes sintomáticos mejoraron significativamente luego de la cirugía. Ninguno presentó insuficiencia cardíaca durante el seguimiento alejado.
De los 11 pacientes que presentaban cardiomegalia preoperatoria en la radiografía de tórax, en 9 se redujo. En los otros 2 no hubo un cambio importante en el índice cardiotorácico, a pesar de que ambos habían mejorado clínicamente y de que se había normalizado la función del ventrículo izquierdo.
En cada consulta programada se realizó una ecocardiografía transtorácica. La FA posoperatoria a los 6 meses del alta hospitalaria fue del 39,92% en promedio, con una desviación estándar del 5,67%. En todos los casos fue mayor que la prequirúrgica y siempre superior al 30%. La media en los menores de 1 año fue del 36,50%, con una desviación estándar del 3,72%, en comparación con una media prequirúrgica del 15,83% (p < 0,0001). En los mayores fue del 42,85% con una desviación estándar del 5,58% frente a un valor prequirúrgico del 34,85% (p = 0,0032). Estos datos se resumen en la Figura 1.

Fig. 1. Medias de las fracciones de acortamiento por grupos, preoperatorias y posoperatorias.
En los pacientes que presentaban IM, ésta disminuyó en todos, excepto en uno. Ninguno presentó IM grave a los 6 meses del egreso hospitalario; en sólo dos casos fue moderada y en los 11 restantes no existió o fue leve. La valvuloplastia realizada al niño de 30 meses redujo el grado de regurgitación de grave a leve. El único paciente de esta serie en el que la IM progresó de grado leve antes de la cirugía a moderado en el posoperatorio fue evaluado minuciosamente en busca de obstrucción de la reconexión y se halló la coronaria izquierda permeable en todo su trayecto. Estos datos se resumen en la Figura 2.
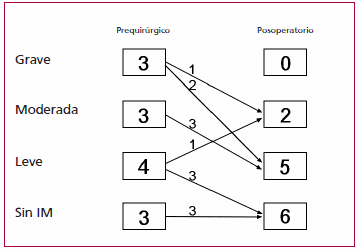
Fig. 2. Evolución de la insuficiencia mitral (IM) en los 13 pacientes luego de la cirugía.
Se utilizaron además como métodos complementarios la hemodinamia, la ergometría de esfuerzo y estudios de perfusión miocárdica. Sólo un paciente requirió cateterismo cardíaco para confirmar la permeabilidad de la coronaria izquierda, ya que en los 12 casos restantes se constató por ecocardiografía. Las cinco ergometrías posoperatorias realizadas fueron normales y dos de los cuatro estudios de perfusión también lo fueron, en tanto que los otros dos mostraron una mejoría significativa de la perfusión miocárdica.
No hubo reoperaciones durante el seguimiento.
DISCUSIÓN
En la mayoría de los lactantes, esta patología se presenta como un cuadro de insuficiencia cardíaca congestiva con alta mortalidad sin tratamiento. La escasez de flujo colateral intercoronariano provoca isquemia ventricular grave. Cuando el ductus se cierra y las resistencias pulmonares caen, el robo de sangre desde la pulmonar favorece la isquemia. (3) Los niños mayores y los adultos con esta cardiopatía suelen ser asintomáticos, ya que poseen una abundante red de colaterales intercoronarianas y, a veces, una estenosis del ostium de la coronaria izquierda, que limita el robo e incrementa la presión de perfusión miocárdica. (2, 4)
Se constituye entonces un espectro continuo que va desde el infarto de miocardio y la insuficiencia cardíaca congestiva en la presentación infantil hasta el soplo de IM en un paciente asintomático de presentación tardía, que puede complicarse con el desarrollo de síncope y muerte súbita.
El electrocardiograma suele evidenciar signos de isquemia o de infarto anterolateral izquierdo, con ondas Q profundas, ondas T invertidas y desnivel del segmento ST en las derivaciones I, aVL y precordiales izquierdas. El diagnóstico diferencial entre ALCAPA, miocarditis y miocardiopatía dilatada puede ser difícil. Se utiliza una fórmula para calcular la probabilidad de existencia de ALCAPA, en la que ésta es igual a 12d + 24s - w, donde "d" indica la profundidad en milímetros de la onda Q en aVL, "s" la amplitud en milímetros del segmento ST en aVL y "w" el ancho en milímetros de la onda Q en I. Cuando este valor es mayor de 27, se establece el diagnóstico de ALCAPA con un 100% de sensibilidad y el 96% de especificidad. (5, 6)
El ecocardiograma bidimensional y con Doppler color puede demostrar el origen de la coronaria anómala, además de la arteria coronaria derecha dilatada y un flujo de entrada en la arteria pulmonar. Este flujo puede aparecer en dos patrones diferentes: continuo con refuerzo sistólico en niños mayores con múltiples colaterales intercoronarianas dilatadas o sistólico tardío en pacientes más pequeños, con escasas colaterales. (6) Existe asimismo hipomotilidad global de grado variable del ventrículo izquierdo, con volumen de fin de diástole aumentado. El Doppler color permite evidenciar el grado de IM.
Este método presenta limitaciones en situaciones especiales. La presión pulmonar alta, propia de los neonatos o de niños con falla del ventrículo izquierdo, genera un flujo anterógrado de sangre en la coronaria anómala, con escasa dilatación de la coronaria derecha. En pacientes adultos, la demostración del origen anómalo puede ser más difícil, por lo que la detección de vasos dilatados en el septum interventricular anterior debe despertar la sospecha y guiar el diagnóstico ecocardiográfico paso a paso. (7)
El cateterismo cardíaco continúa siendo el método más efectivo para establecer el diagnóstico con certeza. La aortografía muestra la emergencia de una sola arteria coronaria, la derecha. Su inyección selectiva permite observar que está dilatada y presenta un trayecto sinuoso. A veces pueden observarse colaterales intercoronarias por las cuales el contraste opaca la arteria pulmonar. Existe un resalto oximétrico en la arteria pulmonar dado por el cortocircuito, con una relación de flujo pulmonar a sistémico variable y generalmente poco significativa. En casos con mínima circulación colateral, este resalto puede no presentarse. La alta presión pulmonar en pacientes neonatos puede mostrar flujo anterógrado en la coronaria izquierda al inyectar el contraste en la pulmonar. La ventriculografía izquierda evidencia dilatación, hipocinesia y, con frecuencia, IM de grado variable.
La indicación quirúrgica hoy en día es clara: el paciente con diagnóstico confirmado de ALCAPA debe operarse. La temprana edad no debe considerarse un factor de riesgo y contraindicar la cirugía. Los pacientes estables, independientemente de su edad, deben ser operados prontamente. Posponer la intervención quirúrgica implica riesgo de deterioro del estado clínico, no sólo en los lactantes, sino también en pacientes mayores asintomáticos en los que esta patología puede derivar en la muerte súbita precedida o no por síntomas de angor, insuficiencia cardíaca o arritmias.
Si bien durante décadas se describieron diversas técnicas quirúrgicas para el tratamiento de esta patología, en la actualidad existe consenso general respecto de la superioridad del restablecimiento del sistema de doble irrigación coronaria por sobre la ligadura de la coronaria anómala. (8) Estas técnicas producen un impacto positivo importante sobre la historia natural de esta enfermedad, con baja mortalidad y mejoría significativa de la función del ventrículo izquierdo. Los posibles mecanismos que subyacen a esta mejoría son la hiperplasia y la hipertrofia de los miocitos, además de la recuperación del miocardio hibernado por la hipoperfusión crónica. Esta remodelación es lenta y se observa una reducción progresiva de los diámetros de fin de diástole y de fin de sístole del ventrículo izquierdo, incluso hasta 6 meses después de la cirugía. (9) La ligadura de la coronaria izquierda, en cambio, si bien mejora el cuadro clínico de presentación sobre todo en casos de emergencia, (10) presenta una disminución importante del índice de sobrevida a largo plazo. (8)
Existe una amplia variedad de técnicas para restablecer este sistema de doble irrigación coronaria. La creciente experiencia en el manejo de las coronarias en la transposición de grandes arterias ha hecho del reimplante directo en la aorta la técnica de elección en la mayoría de los casos. Se utiliza circulación extracorpórea con perfusión anterógrada de la coronaria izquierda mediante canulación de la arteria pulmonar. Perfundiendo ambos territorios coronarios, se desciende la temperatura corporal hasta alcanzar hipotermia moderada o profunda, según la estrategia elegida. Se clampea la aorta y se administra cardioplejía anterógrada en las raíces aórtica y pulmonar, con lo que se logra protección miocárdica uniforme en ambos ventrículos. (11, 12) Luego se desconecta la coronaria izquierda de la arteria pulmonar con un botón de tejido circundante y se reimplanta en la raíz aórtica.
En algunos casos, diversos tipos de tunelización del ostium coronario izquierdo a la aorta pueden ser útiles. Tashiro y colaboradores (13) describieron la confección de un túnel usando el aro de tejido de la arteria pulmonar del que nace la coronaria y anastomosándola a la cara posterior de la raíz aórtica. Cuando la coronaria anómala nace baja en la cara posterolateral izquierda de la arteria pulmonar, puede utilizarse el fragmento rectangular de la pared de dicha arteria que se extiende hasta el nacimiento de la rama izquierda. Con él se fabrica un túnel de tejido autólogo que se conecta a la aorta. (14)
En los infrecuentes casos en los que la coronaria nace en la cara anterior de la arteria pulmonar, la tunelización usando un botón de tejido pericoronariano más una porción de tejido aórtico parcialmente desinsertada de la raíz puede ser de utilidad. (15)
Takeuchi y colaboradores describieron en 1979 la reconexión transpulmonar de la coronaria izquierda en la aorta, que consiste en la creación de una ventana aortopulmonar y su conexión al ostium coronario mediante un túnel intrapulmonar. (16)
Estas técnicas presentan el riesgo de obstrucción de la tunelización. La cirugía de Takeuchi puede asimismo ocasionar grados variables de obstrucción a la salida del ventrículo derecho y también conexiones residuales entre la arteria pulmonar y la luz de la coronaria.
La anastomosis de la coronaria izquierda a otros vasos arteriales o mediante puentes venosos puede realizarse con circulación extracorpórea o sin ésta y a través de múltiples vías de abordaje torácico. Sin embargo, es técnicamente más difícil en lactantes y la obstrucción por torsión continúa siendo una desventaja importante. (17)
La IM tiene como sustrato la dilatación del ventrículo izquierdo con la consecuente dilatación del anillo mitral, la isquemia o el infarto de los músculos papilares y la discinesia de la pared libre del ventrículo izquierdo. Si bien algunos grupos realizan plástica mitral en todos los pacientes con insuficiencia moderada a grave, (18) actualmente existe consenso en que la valvuloplastia no debe practicarse de rutina. (19) En la mayoría de los casos, con sólo corregir el ALCAPA la IM se reduce en un grado importante, con mejoría progresiva de la continencia valvular incluso tras 1 año de realizada la cirugía. (9) En caso de persistencia de la insuficiencia es aconsejable realizar un cateterismo para descartar la obstrucción de la coronaria reconectada. (20) En aquellos casos particulares en los que existe daño isquémico irreversible de los músculos papilares o alguna valva presenta hendiduras debe considerarse la plástica mitral. Tal fue el caso del único paciente de nuestra serie en el que se llevó a cabo la valvuloplastia mitral. En los demás pacientes, el grado de regurgitación disminuyó ostensiblemente sin necesidad de procedimiento alguno sobre la válvula.
En nuestra serie no fue necesario el soporte mecánico cardiovascular, si bien constituye un método válido en pacientes con deterioro grave de la función miocárdica.
CONCLUSIONES
Los resultados de la cirugía correctora del origen anómalo de la coronaria izquierda en la arteria pulmonar son excelentes en todos los grupos etarios, con mejoría significativa de la función miocárdica y disminución de la insuficiencia mitral en la mayoría de los pacientes.
1. Brooks HS. Two cases of an abnormal coronary artery of the heart arising from the pulmonary artery: with some remarks upon the effect of this anomaly in producing cirsoid dilatation of the vessels. J Anat Physiol 1885;20:26-9. [ Links ]
2. Bland EF, White PD, Garland J. Congenital anomalies of the coronary arteries: report of an unusual case associated with cardiac hypertrophy. Am Heart J 1933;8:787-801. [ Links ]
3. Edwards JE [editorial]. The direction of blood flow in coronary arteries arising from the direction of blood flow in coronary arteries arising from the pulmonary trunk. Circulation 1964;29:163-6. [ Links ]
4. Schwerzmann M, Salehian O, Elliot T, Merchant N, Siu SC, Webb GD. Images in cardiovascular medicine. Anomalous origin of the left coronary artery from the main pulmonary artery in adults: coronary collateralization at its best. Circulation 2004;110:e511-3. [ Links ]
5. Johnsrude CL, Perry JC, Cecchin F, Smith EO, Fraley K, Friedman RA, et al. Differentiating anomalous left main coronary artery originating from the pulmonary artery in infants from myocarditis and dilated cardiomyopathy by electrocardiogram. Am J Cardiol 1995;75:71-4. [ Links ]
6. Lee ML, Chiu IS, Chen SJ, Chaou WT. Imaging characteristics of anomalous left coronary artery from the pulmonary artery. J Thorac Imaging 2002;17:96-100. [ Links ]
7. Pisacane C, Pinto SC, De Gregorio P, Pisacane F, Monda V, Caso P, et al. "Steal" collaterals: an echocardiographic diagnostic marker for anomalous origin of the left main coronary artery from the pulmonary artery in the adult. J Am Soc Echocardiogr 2006;19:107.e3-107.e6. [ Links ]
8. Bunton R, Jonas RA, Lang P, Rein AJ, Castaneda AR. Anomalous origin of left coronary artery from pulmonary artery. Ligation versus establishment of a two coronary artery system. J Thorac Cardiovasc Surg 1987;93:103-8. [ Links ]
9. Michielon G, Di Carlo D, Brancaccio G, Guccione P, Mazzera E, Toscano A, et al. Anomalous coronary artery origin from the pulmonary artery: correlation between surgical timing and left ventricular function recovery. Ann Thorac Surg 2003;76:581-8. [ Links ]
10. Kreutzer C, Schlichter AJ, Roman MI, Kreutzer GO. Emergency ligation of anomalous left coronary artery arising from the pulmonary artery. Ann Thorac Surg 2000;69:1591-2. [ Links ]
11. Alexi-Meskishvili V, Hetzer R, Weng Y, Lange PE, Jin Z, Berger F, et al. Anomalous origin of the left coronary artery from the pulmonary artery. Early results with direct aortic reimplantation. J Thorac Cardiovasc Surg 1994;108:354-62. [ Links ]
12. Turley K, Szarnicki RJ, Flachsbart KD, Richter RC, Popper RW, Tarnoff H. Aortic implantation is possible in all cases of anomalous origin of the left coronary artery from the pulmonary artery. Ann Thorac Surg 1995;60:84-9. [ Links ]
13. Tashiro T, Todo K, Haruta Y, Yasunaga H, Nagata M, Nakamura M. Anomalous origin of the left coronary artery from the pulmonary artery. New operative technique. J Thorac Cardiovasc Surg 1993;106:718-22. [ Links ]
14. Katsumata T, Westaby S. Anomalous left coronary artery from the pulmonary artery: a simple method for aortic implantation with autogenous arterial tissue. Ann Thorac Surg 1999;68:1090-1. [ Links ]
15. Sese A, Imoto Y. New technique in the transfer of an anomalously originated left coronary artery to the aorta. Ann Thorac Surg 1992;53:527-9. [ Links ]
16. Takeuchi S, Imamura H, Katsumoto K, Hayashi I, Katohgi T, Yozu R, et al. New surgical method for repair of anomalous left coronary artery from pulmonary artery. J Thorac Cardiovasc Surg 1979;78:7-11. [ Links ]
17. Kesler KA, Pennington DG, Nouri S, Boegner E, Kanter KR, Harvey L, et al. Left subclavian-left coronary artery anastomosis for anomalous origin of the left coronary artery. Long-term follow-up. J Thorac Cardiovasc Surg 1989;98:25-9. [ Links ]
18. Isomatsu Y, Imai Y, Shin'oka T, Aoki M, Iwata Y. Surgical intervention for anomalous origin of the left coronary artery from the pulmonary artery: the Tokyo experience. J Thorac Cardiovasc Surg 2001;121:792-7. [ Links ]
19. Dodge-Khatami A, Mavroudis C, Backer CL. Anomalous origin of the left coronary artery from the pulmonary artery: collective review of surgical therapy. Ann Thorac Surg 2002;74:946-55. [ Links ]
20. Huddleston CB, Balzer DT, Mendeloff EN. Repair of anomalous left main coronary artery arising from the pulmonary artery in infants: long-term impact on the mitral valve. Ann Thorac Surg 2001;71:1985-8. [ Links ]














