Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista argentina de cardiología
On-line version ISSN 1850-3748
Rev. argent. cardiol. vol.79 no.1 Ciudad Autónoma de Buenos Aires Jan./Feb. 2011
ELECTROFISIOLOGÍA Y ARRITMIAS
Miocardiopatía no compactada. Estratificación de riesgo de muerte súbita para indicación de cardiodesfibrilador automático implantable
Néstor O. GalizioMTSAC, José l. GonzálezMTSAC, Liliana E. Favaloro, Mirta DiezMTSAC, Adrián Fernández, Eduardo GuevaraMTSAC, Alejandro A. Palazzo, Federico Robles, José H. CasabéMTSAC
MTSAC Miembro Titular de la Sociedad Argentina de Cardiología
Recibido: 13/10/2010
Aceptado: 15/12/2010
Dirección para separatas:
Dr. Néstor O. Galizio
Rodríguez Peña 1034 (1876) Bernal, Pcia. de Buenos Aires
e-mail: ngalizio@gmail.com
Resumen
Introducción
La miocardiopatía no compactada es una entidad rara. Su historia natural incluye insuficiencia cardíaca, eventos tromboembólicos, arritmias y muerte súbita (MS). En ausencia de datos de estudios aleatorizados o registros, las Guías ACC/AHA/HRS 2008 recomiendan el cardiodesfibrilador automático implantable (CDAI) en todos los pacientes con miocardiopatía no compactada para reducir el riesgo de muerte súbita.
Objetivo
Describir la evolución de pacientes con miocardiopatía no compactada de acuerdo con criterios seleccionados de estratificación de riesgo de muerte súbita para decidir el implante de un CDAI.
Material y métodos
Se analizaron 80 pacientes. El diagnóstico se estableció mediante criterios ecocardiográficos y de resonancia magnética nuclear cardíaca. Los criterios para el implante de un CDAI como prevención secundaria incluyeron muerte súbita y taquicardia ventricular sostenida (TVS); como prevención primaria comprendieron fracción de eyección del ventrículo izquierdo (FEVI) < 30% o ≥ 2 factores de riesgo (antecedentes familiares de muerte súbita [AFMS], síncope y TV no sostenida).
Resultados
Grupo CDAI (n = 26) para prevención secundaria (n = 3): 3 pacientes sufrieron muerte súbita (2 TVS). Grupo CDAI para prevención primaria (n = 23): 10 pacientes tuvieron FEVI < 30%, 1 FEVI < 30% + AFMS, 1 FEVI < 30% + síncope, 5 FEVI < 30% + TV no sostenida, 3 TV no sostenida + síncope, 2 TV no sostenida + AFMS y 1 TVS en estudio electrofisiológico. El seguimiento fue de una mediana de 16,61 meses. Dos pacientes fueron sometidos a un trasplante cardíaco, 3 recibieron choques apropiados y 4 pacientes, choques inapropiados. Grupo sin CDAI (n = 54): 4 pacientes tuvieron síncope y 4 TV no sostenida. El seguimiento fue de una mediana de 12,15 meses. Dos pacientes fallecieron por insuficiencia cardíaca y 3 fueron sometidos a un trasplante cardíaco.
Conclusiones
El 32,5% de los pacientes con miocardiopatía no compactada recibieron un CDAI, el 88,5% por prevención primaria; el 11,5% recibieron choques apropiados. No hubo muerte súbita en pacientes sin CDAI; la muerte sobrevino por progresión de la insuficiencia cardíaca. Este registro sugiere que los pacientes con miocardiopatía no compactada podrían estratificarse para seleccionar a aquellos que tienen mayor riesgo de muerte súbita y podrían beneficiarse con el implante de un CDAI.
Palabras clave: Miocardiopatías; Ventrículos cardíacos; Riesgo; Muerte súbita cardíaca; Pronóstico
Summary
Non-Compaction Cardiomyopathy. Risk Stratification of Sudden Death for Automatic Cardioverter Defibrillator Implantation
Background
Non-compaction cardiomyopathy is a rare disease. The natural history of this condition includes heart failure, thromboembolic events, arrhythmias and sudden death (SD). In the absence of information from randomized studies or registries, the 2008 ACC/AHA/HRS guidelines recommended cardioverter defibrillator implantation in all patients with non-compaction cardiomyopathy to reduce the risk of sudden death.
Objective
To describe the outcomes of patients with non-compaction cardiomyopathy according to the selection criteria used for risk stratification of sudden death for automatic implantable cardioverter defibrillator therapy.
Material and Methods A total of 80 patients were analyzed. The diagnosis was made using criteria from echocardiography and cardiac magnetic resonance imaging. The criteria used for implantation of an ICD were sudden death and sustained ventricular tachycardia (SVT) for secondary prevention, and left ventricular ejection fraction (LVEF) <30% or ≥2 risk factors (family history of sudden death [FHSD], syncope and non-sustained VT).
Results
Group ICD (n=26) for secondary prevention (n=3): 3 patients presented sudden death (2 SVT). Group ICD for primary prevention (n=23): 10 patients had LVEF <30%, 1 LVEF <30% + FHSD, 1 LVEF <30% + syncope, 5 LVEF <30% + nonsustained VT, 3 non-sustained VT + syncope, 2 non-sustained + FMSD and 1 VT in the electrophysiologic study. Median follow-up was 16.61 months. Two patients underwent heart transplantation, 3 received appropriate ICD shocks, while ICD shocks were inappropriate in 4 patients. Group without ICD (n=54): 4 patients presented syncope and 4 non-sustained VT. Median follow-up was 12.15 months. Two patients died due to heart failure and 3 underwent cardiac transplantation.
Conclusions
ICD was implanted in 32.5% of patients with non-compaction cardiomyopathy, 88.5% for primary prevention; appropriate shocks were received in 11.5% of patients. None of the patients who did not receive an ICD presented sudden death; these patients died due to heart failure progression. This registry suggests that patients with non-compaction cardiomyopathy might be stratified to select those at a higher risk of sudden death who might beneficiate from ICD therapy.
Key words: Cardiomyopathies; Cardiac Ventricles; Risk; Cardiac Sudden Death; Prognosis
Abreviaturas
AFMS Antecedentes familiares de muerte súbita
CDAI Cardiodesfibrilador automático implantable
FEVI Fracción de eyección del ventrículo izquierdo
FV Fibrilación ventricular
TV Taquicardia ventricular
IC Insuficiencia cardíaca
TVS Taquicardia ventricular sostenida
MS Muerte súbita
VI Ventrículo izquierdo
PP Prevención primaria
PS Prevención secundaria
RMN Resonancia magnética nuclear
TAC Tomografía axial computarizada
Introducción
Comunicada inicialmente en 1932 por Bellet y colaboradores como "hipertrabeculación del VI", asociada con defectos cardíacos congénitos (1) y posteriormente en 1984 por Engberding y Bender como "persistencia aislada de sinusoides miocárdicos", (2) la miocardiopatía no compactada del ventrículo izquierdo fue descripta oficialmente por Chin y colaboradores en 1990 al comprenderse mejor la anomalía en la morfogénesis del miocardio. (3)
Es una patología poco frecuente, clasificada como una miocardiopatía genética primaria por la American Heart Association (4) y como una miocardiopatía no clasificable por el Grupo de Trabajo sobre Enfermedades del Miocardio y Pericardio de la Sociedad Europea de Cardiología. (5)
Se caracteriza por presentar un miocardio ensanchado con dos capas que consisten en una de miocardio compacto y una de miocardio no compacto, con trabéculas prominentes y recesos intertrabeculares profundos, continuidad entre la cavidad del ventrículo izquierdo y los recesos intertrabeculares, los que reciben sangre desde la cavidad, y disminución de la reserva de flujo coronario en la mayoría de los segmentos que muestran un movimiento anormal de su pared.
La hipótesis de no compactación se basa en que la compactación del miocardio hipertrabeculado del embrión es detenida o enlentecida por un defecto genético primario que ocurre entre la quinta y la octava semanas del desarrollo embrionario. (6) En ese momento, el "miocardio esponjoso", hipertrabeculado, comienza a compactarse en paralelo al desarrollo de la vasculatura coronaria: de base a punta y de epicardio a endocardio.
La gravedad del fenotipo dependerá del momento en que se detiene o enlentece el curso natural de la maduración del miocardio. Sólo en el 25-50% de los pacientes se encuentran trastornos genéticos.
La heterogeneidad genética es evidente por las numerosas mutaciones identificadas, que en su patogenia involucran a proteínas sarcoméricas, mitocondriales, del citoesqueleto y de la línea Z. Sin embargo, muchos casos aislados están relacionados con mutaciones de novo. (7)
Su historia natural, aún no resuelta, incluye disfunción sistólica del VI e insuficiencia cardíaca (IC),
eventos tromboembólicos, arritmias y muerte súbita.
Debido a la ausencia de datos de estudios aleatorizados o registros, las guías ACC/AHA/HRS 2008 recomiendan el implante de un cardiodesfibrilador automático implantable (CDAI) en todos los pacientes con miocardiopatía no compactada para reducir el riesgo de muerte súbita (clase IIb, nivel de evidencia C). (8)
Sin embargo, todavía no se dispone de la evidencia suficiente para la detección de pacientes con mayor riesgo de muerte súbita que puedan beneficiarse más con el implante de un CDAI.
Los registros son útiles para determinar el impacto de los estudios clínicos y las recomendaciones de las guías en la práctica médica cotidiana, ya que las conclusiones que se pueden sacar de ellos pueden mejorar las estrategias de prevención y tratamiento.
COMPAS (COMparación de estrategias de Prevención de Arritmias Sostenidas) es un registro prospectivo de pacientes con CDAI implantados para prevención primaria y secundaria de muerte súbita que se lleva a cabo en nuestro Hospital Universitario.
Este estudio se desarrolló con el objetivo de describir, a partir de los resultados obtenidos de un registro prospectivo, la evolución de pacientes con miocardiopatía no compactada en los que se estratificó el riesgo de muerte súbita para decidir el implante de un CDAI.
Material y métodos
Entre enero de 1997 y enero de 2010 se analizaron 80 pacientes consecutivos con miocardiopatía no compactada. Edad: 41 ± 17 años (51 hombres). Seguimiento: mediana 13,35 meses (percentil 25-75 entre 5,85-25,09), rango de 0,8 a 151 meses. El seguimiento en el grupo sin CDAI comenzó en el momento del diagnóstico, en tanto que en el grupo con CDAI se inició el día del implante del dispositivo.
Durante el seguimiento, los eventos finales (muerte, choque apropiado y choque inapropiado) se evaluaron por controles ambulatorios y consultas telefónicas periódicas cada 4 meses.
No se perdieron pacientes durante el seguimiento.
Treinta y cuatro pacientes se encontraban en clase funcional II-IV (NYHA), 17 pacientes con fracción de eyección del VI (FEVI) < 30%, 3 habían sufrido muerte súbita, 2 taquicardia ventricular sostenida (TVS), 15 TV no sostenida, 10 síncope y 3 pacientes stroke.
El diagnóstico se estableció en base a criterios aceptados para eco-Doppler cardíaco y resonancia magnética nuclear (RMN). Los hallazgos por tomografía axial computarizada (TAC) multicorte se homologaron a los de la RMN (Figura 1).
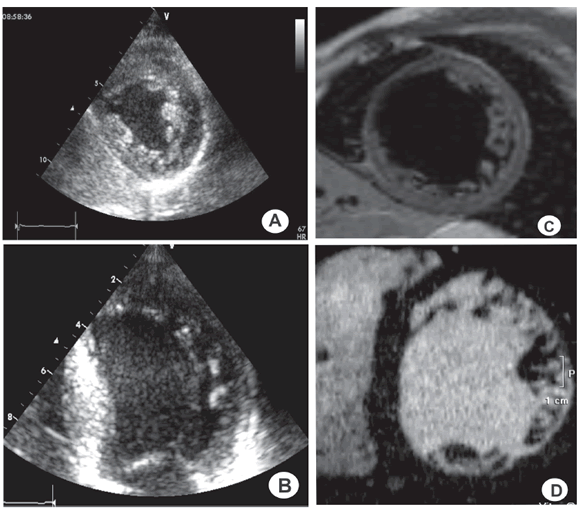
Fig. 1. Diagnóstico. Eco Doppler Cardiaco, Resonanancia Magnética Nuclear Cardiaca y Tomografía Axial Computada Multicorte. A y B. Eco-Doppler cardiaco. A. eje corto. B. Cuatro cámaras focalizado: Trabeculaciones y recesos intertrabeculares con una relación miocardio No-Compacto/Compacto > 2. C. RMN-cardiaca con corte T1: multiples trabeculaciones y relación No-Compacto/Compacto > 2.5. D. TAC multicorte: Trabeculaciones prominentes, múltiples y relación No-Compacto/Compacto > 2.5.
Criterios ecocardiográficos: Chin y colaboradores propusieron la presencia de una relación X/Y ≤ 0,5, donde X es la distancia desde la superficie del epicardio hasta la profundidad del receso trabecular e Y es la distancia desde la superficie del epicardio hasta el pico de la trabécula (a nivel del ápex del VI, en el fin de la diástole, en vistas paraesternal o cuatro cámaras). (3)
Los criterios de Jenni y colaboradores incluyen pared del VI notoriamente engrosada por la presencia de una capa compacta, delgada, epicárdica y una capa engrosada con trabéculas prominentes, numerosas, y recesos profundos, con un radio máximo de miocardio no compacto/compacto> 2:1, medido en fin de sístole en eje corto; las trabeculaciones deben localizarse en los segmentos medioventriculares o apicales del VI con evidencia de flujo dentro de los recesos intertrabeculares por Doppler color; ausencia de cardiopatía estructural coexistente. (9)
Los criterios de Stöllberger y colaboradores comprenden más de 3 trabeculaciones protruyendo desde la pared del VI, apicales a los músculos papilares, que deben moverse sincrónicamente con el miocardio y deben tener su misma ecogenicidad; evidencia de flujo, proveniente de la cavidad del VI, dentro de los recesos intertrabeculares por Doppler color. (10)
Recientemente, Stöllberger y Finsterer propusieron un conjunto de criterios diagnósticos complementarios para definir la presencia de miocardiopatía no compactada (11):
- Diagnóstico definitivo: si se cumplen los criterios de Stöllberger y Jenni.
- Diagnóstico probable: si sólo se cumple con un grupo de criterios.
- Diagnóstico posible: casos con menos de 4 trabeculaciones o relación miocardio no compacto/compacto < 2.
Criterios por RMN cardíaca: el criterio que más lo distingue es una relación miocardio no compacto/compacto > 2,3 en diástole y eje largo o > 2,5 en eje corto y cuatro cámaras. (12-14)
Los criterios diagnósticos por TAC multicorte fueron homologados a los de RMN.
En un principio, el diagnóstico lo efectuamos sólo con los criterios ecocardiográficos, utilizados a medida que se fueron comunicando. (3, 9, 11)
En los últimos años combinamos los criterios ecocardiográficos con los de la RMN y la TAC multicorte.
El presente estudio evaluó mortalidad total y muerte súbita. En el caso de los pacientes con CDAI también se evaluó choque apropiado debido a TV/FV, arritmias que potencialmente pueden producir MS.
Análisis estadístico
Los datos de variables continuas con distribución normal se informan mediante un valor medio y su desviación estándar. La comparación entre ambos grupos se realizó mediante la prueba de la t a dos colas.
Tanto las variables con datos dicotómicos como las variables ordinales se ordenaron en tablas de contingencia y la significación estadística se estableció mediante prueba de independencia a través del cálculo de chi cuadrado.
Cuando al menos el valor de una frecuencia esperada fue menor de 5 se aplicó la corrección de Yates en el cálculo del chi cuadrado En el caso de la variable seguimiento que no presenta distribución normal se informan la mediana y el rango intercuartil (percentiles 25-75) y los valores máximo y mínimo. La comparación de ambas medianas se realizó mediante la prueba de medianas para dos muestras, ubicando en una tabla de contingencia la cantidad de individuos por encima y por debajo de una mediana global en cada grupo examinado.
En todos los casos se consideró estadísticamente significativo un valor de p menor de 0,05.
Resultados
De los 80 pacientes con miocardiopatía no compactada, 26 (32,5%) recibieron un CDAI.
En la Tabla 1 se muestran las características basales de los pacientes sin CDAI (n = 54) y con CDAI (n = 26). Comparando ambos grupos, no se halló una diferencia significativa en cuanto a edad, sexo y clase funcional (NYHA). Hubo una mayor y significativa incidencia de muerte súbita, síncope, TVS, TV no sostenida y menor FEVI en los pacientes con CDAI, como era de esperar debido a que se seleccionó una población de mayor riesgo en lugar de realizar el implante de un CDAI en todos los pacientes como indican las guías del ACC/AHA/HRS 2008. (8)
Tabla 1. Datos comparativos de los pacientes con CDAI y sin CDAI

Los criterios de estratificación de riesgo que se utilizaron para la indicación y el implante de un CDAI se detallan en la Tabla 2. Para prevención secundaria (PS) se consideró el antecedente de muerte súbita y/o TVS, mientras que para prevención primaria (PP) se tuvo en cuenta la presencia de FEVI < 30% o ≥ 2 factores de riesgo de muerte súbita.
Tabla 2. Criterios de estratificación de riesgo para la indicación de un CDAI

En la Tabla 3 se muestra la evolución de los pacientes con implante y sin implante de CDAI según los criterios de estratificación seleccionados.
En el grupo sin CDAI, 2 pacientes fallecieron por progresión de su insuficiencia cardíaca y 3 pacientes fueron sometidos a un trasplante cardíaco. No hubo muerte súbita.
Tabla 3. Evolución de los pacientes con CDAI y sin CDAI
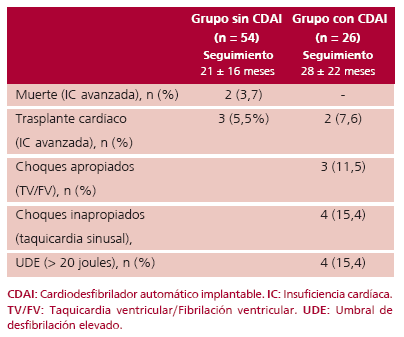
En el grupo con CDAI no se registraron muertes, 2 pacientes recibieron trasplante cardíaco, 3 tuvieron choques apropiados (2 choques en 2 pacientes con TV/FV previa y 1 choque en 1 paciente con FEVI < 30%) y 4 pacientes choques inapropiados por taquicardia sinusal.
El 15,4% de los pacientes tuvieron umbrales de desfibrilación elevados (UD > 20 joules en 2 choques consecutivos).
Discusión
La miocardiopatía no compactada es una enfermedad del miocardio provocada aparentemente por una alteración en la morfogénesis endomiocárdica durante el desarrollo embrionario.
Su pronóstico está determinado por el grado de disfunción ventricular izquierda, la gravedad de las arritmias emergentes y por la ocurrencia de eventos tromboembólicos.
La mayoría de los casos publicados pertenecen a series pequeñas integradas por pacientes con diferente grado de compromiso del VI, lo que hace difícil su comparación.
Las comunicaciones iniciales sugerían que la miocardiopatía no compactada, tanto en adultos como en niños, tenía un pronóstico adverso. Sin embargo, se trataba de grupos de pacientes con cardiopatía avanzada y muy sintomática.
Con el avance del conocimiento y su detección más precoz mediante las distintas técnicas de imágenes (ecocardiografía, RMN cardíaca, TAC multicorte) se observó que la enfermedad presenta un espectro amplio de evolución clínica que incluye desde la ausencia de síntomas a un compromiso avanzado del VI con un porcentaje elevado de muerte por insuficiencia cardíaca, tromboembolia y arritmias ventriculares.
Por el momento, para los casos leves y asintomáticos, el seguimiento estrecho parece lo más apropiado.
Para los pacientes que desarrollan insuficiencia cardíaca leve a moderada, el tratamiento médico parece suficiente.
Cuando se agrega fibrilación auricular y mayor disfunción del VI, la anticoagulación parece obligatoria.
Cuando la insuficiencia cardíaca es muy avanzada, la terapia de resincronización cardíaca y el trasplante cardíaco parecen ser las únicas alternativas viables.
Para los pacientes recuperados de un paro cardíaco o con TV recurrente o mal tolerada, el CDAI, en carácter de prevención secundaria, está aceptado.
En la Tabla 4 puede observarse la evolución de los pacientes con miocardiopatía no compactada en los principales trabajos publicados en adultos y niños; (15-22) junto a ellos hemos agregado los resultados de nuestro registro.
Tabla 4. Evolución de los pacientes con miocardiopatía no compactada. Publicacion.
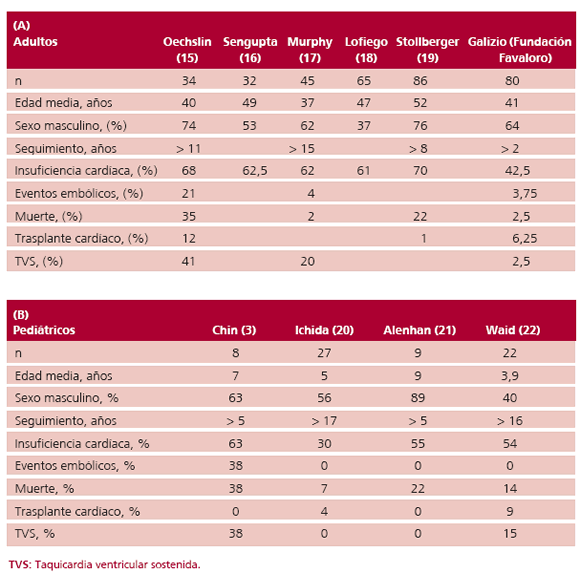
Los hallazgos tan dispares en relación con su evolución natural, potencial arritmogénico y con el riesgo de sufrir muerte súbita hacen que parezca inapropiado, por el momento, sugerir qué pacientes pueden beneficiarse con un CDAI en carácter de prevención primaria.
Si bien en este sentido las Guías ACC/AHA/HRS 2008 recomiendan el implante de un CDAI en todos los pacientes con miocardiopatía no compactada para reducir el riesgo de muerte súbita, es importante el desarrollo de estudios aleatorizados y registros clínicos que puedan guiarnos en la estratificación de riesgo para seleccionar a los pacientes que se beneficiarían con un CDAI en lugar de efectuar el implante en todos ellos.
En esta población en estudio, sólo el 32,5% de los pacientes con miocardiopatía no compactada recibieron el implante de un CDAI, de acuerdo con criterios seleccionados previa estratificación de mayor riesgo de MS.
En el 88,5% de ellos el implante del CDAI se realizó en carácter de prevención primaria debido a FEVI baja o ≥ 2 factores de riesgo de muerte súbita.
No hubo muerte súbita en el grupo sin CDAI. Los pacientes fallecieron por insuficiencia cardíaca progresiva.
En el grupo con CDAI, la incidencia de choques apropiados e inapropiados fue similar a la que se comunica para pacientes con miocardiopatía isquémica o dilatada.
La selección de pacientes en carácter de prevención secundaria o primaria con FEVI baja y ≥ 2 factores de riesgo parece ser útil para la estratificación de riesgo de muerte súbita y la elección de pacientes que se beneficiarían más con el implante de un CDAI, debido a la observación de ausencia de muerte súbita en el grupo sin CDAI y a la presencia de choques apropiados (TV/FV) en el grupo CDAI.
Se necesitan más registros y/o estudios para poder comprender mejor esta miocardiopatía y obtener predictores de riesgo para una indicación adecuada de los dispositivos.
1. Bellet S, Gouley BA. Congenital heart disease with multiple cardiac anomalies. Report of a case showing aortic atresia, fibrous scar in myocardium and embryonal sinusoidal remains. Am J Med Sci 1932;183:458-65. [ Links ]
2. Engberding R, Bender F. Identification of a rare congenital anomaly of the myocardium by two-dimensional echocardiography: persistence of isolated myocardial sinusoids. Am J Cardiol 1984;53:1733-4. [ Links ]
3. Chin TK, Perloff JK, Williams RG, Jue K, Mohrmann R. Isolated noncompaction of left ventricular myocardium. A study of eight cases. Circulation 1990;82:507-13. [ Links ]
4. Maron BJ, Towbin JA, Thiene G, Antzelevitch C, Corrado D, Arnett D, et al; American Heart Association; Council on Clinical Cardiology, Heart Failure and Transplantation Committee; Quality of Care and Outcomes Research and Functional Genomics and Translational Biology Interdisciplinary Working Groups; Council on Epidemiology and Prevention. Contemporary definitions and classification of the cardiomyopathies: an American Heart Association Scientific Statement from the Council on Clinical Cardiology, Heart Failure and Transplantation Committee; Quality of Care and Outcomes Research and Functional Genomics and Translational Biology Interdisciplinary Working Groups; and Council on Epidemiology and Prevention. Circulation 2006;113:1807-16. [ Links ]
5. Elliott P, Andersson B, Arbustini E, Bilinska Z, Cecchi F, Charron P, et al. Classification of the cardiomyopathies: a position statement from the European Society of Cardiology Working Group on Myocardial and Pericardial Diseases. Eur Heart J 2008;29:270-6. [ Links ]
6. Finsterer J. Cardiogenetics, neurogenetics, and pathogenetics of left ventricular hypertrabeculation/noncompaction. Pediatr Cardiol 2009:30;e659-81. [ Links ]
7. Xing Y, Ichida F, Matsuoka T, Isobe T, Ikemoto Y, Higaki T, et al. Genetic analysis in patients with left ventricular noncompaction and evidence for genetic heterogeneity. Mol Genet Metab 2006;88:71-7. [ Links ]
8. Epstein AE, DiMarco JP, Ellenbogen KA, Estes NA 3rd, Freedman RA, Gettes LS, et al; American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Revise the ACC/AHA/NASPE 2002 Guideline Update for Implantation of Cardiac Pacemakers and Antiarrhythmia Devices); American Association for Thoracic Surgery; Society of Thoracic Surgeons. ACC/AHA/HRS 2008 Guidelines for Device-Based Therapy of Cardiac Rhythm Abnormalities: a report of the American College of Cardiology/ American Heart Association Task Force on Practice Guidelines (Writing Committee to Revise the ACC/AHA/NASPE 2002 Guideline Update for Implantation of Cardiac Pacemakers and Antiarrhythmia Devices): developed in collaboration with the American Association for Thoracic Surgery and Society of Thoracic Surgeons. Circulation 2008;117(21):e350-408. [ Links ]
9. Jenni R, Oechslin E, Schneider J, Attenhofer Jost C, Kaufmann PA. Echocardiographic and pathoanatomical characteristics of isolated left ventricular non-compaction: a step towards classification as a distinct cardiomyopathy. Heart 2001;86:666-71. [ Links ]
10. Stöllberger C, Finsterer J, Blazek G. Left ventricular hypertrabeculation/ noncompaction and association with additional cardiac abnormalities and neuromuscular disorders. Am J Cardiol 2002;90:899-902. [ Links ]
11. Finsterer J, Stollberger C. Definite, probable, or possible left ventricular hypertrabeculation/noncompaction. Int J Cardiol 2008;123:175-6. [ Links ]
12. Stöllberger C, Kopsa W, Tscherney R, Finsterer J. Diagnosing left ventricular noncompaction by echocardiography and cardiac magnetic resonance imaging and its dependency on neuromuscular disorders. Clin Cardiol 2008;31:383-7. [ Links ]
13. Petersen SE, Selvanayagam JB, Wiesmann F, Robson MD, Francis JM, Anderson RH, et al. Left ventricular non-compaction: insights from cardiovascular magnetic resonance imaging. J Am Coll Cardiol 2005;46:101-5. [ Links ]
14. Fazio G, Novo G, D'Angelo L, Visconti C, Sutera L, Grassedonio E, et al. Magnetic resonance in isolated noncompaction of the ventricular myocardium. Int J Cardiol 2010;140:367-9. [ Links ]
15. Oechslin EN, Attenhofer Jost CH, Rojas JR, Kaufmann PA, Jenni R. Long-term follow-up of 34 adults with isolated left ventricular noncompaction: a distinct cardiomyopathy with poor prognosis. J Am Coll Cardiol 2000;36:493-500. [ Links ]
16. Sengupta PP, Mohan JC, Mehta V, Jain V, Arora R, Pandian NG, et al. Comparison of echocardiographic features of noncompaction of the left ventricle in adults versus idiopathic dilated cardiomyopathy in adults. Am J Cardiol 2004;94:389-91. [ Links ]
17. Murphy RT, Thaman R, Blanes JG, Ward D, Sevdalis E, Papra E, et al. Natural history and familial characteristics of isolated left ventricular non-compaction. Eur Heart J 2005;26:187-92. [ Links ]
18. Lofiego C, Biagini E, Ferlito M, Pasquale F, Rocchi G, Perugini E, et al. Paradoxical contributions of non-compacted and compacted segments to global left ventricular dysfunction in isolated left ventricular noncompaction. Am J Cardiol 2006;97:738-41. [ Links ]
19. Stöllberger C, Winkler-Dworak M, Blazek G, Finsterer J. Prognosis of left ventricular hypertrabeculation/noncompaction is dependent on cardiac and neuromuscular comorbidity. Int J Cardiol 2007;121:189-93. [ Links ]
20. Ichida F, Tsubata S, Bowles KR, Haneda N, Uese K, Miyawaki T, et al. Novel gene mutations in patients with left ventricular noncompaction or Barth syndrome. Circulation 2001;103:1256-63. [ Links ]
21. Alehan D. Clinical features of isolated left ventricular noncompaction in children. Int J Cardiol 2004;97:233-7. [ Links ]
22. Wald R, Veldtman G, Golding F, Kirsh J, McCrindle B, Benson L. Determinants of outcome in isolated ventricular noncompaction in childhood. Am J Cardiol 2004;94:1581-4. [ Links ]














