Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista argentina de cardiología
versión On-line ISSN 1850-3748
Rev. argent. cardiol. vol.79 no.3 Ciudad Autónoma de Buenos Aires mayo/jun. 2011
MIOCARDIOPATÍAS / DIAGNÓSTICO POR IMÁGENES
Evaluación de la miocardiopatía no compactada con resonancia magnética cardíaca en pacientes con función sistólica del ventrículo izquierdo conservada y disminuida
Cardiac Magnetic Resonance Imaging for Evaluation of Non-Compaction Cardiomyopathy in Patients with or without Left Ventricular Systolic Dysfunction
Alejandro DeviggianoMTSAC, 1, Patricia CarrascosaMTSAR, †, 1, Carlos CapuñayMSAR, †, 1, Héctor Deschle MTSAC, 1, Julio M. LewkowiczMTSAC, 1, Carlos D. TajerMTSAC, 1, Alejandro Stewart-Harris2, 3, Javier VallejosMSAR, 1
MTSAC Miembro Titular de la Sociedad Argentina de Cardiología
MTSAR Miembro Titular de la Sociedad Argentina de Radiología
MSAR Miembro de la Sociedad Argentina de Radiología
† Para optar a Miembro Titular de la Sociedad Argentina de Cardiología
1 Diagnóstico Maipú. Vicente López, Pcia. de Buenos Aires, Argentina
2 Hospital General de Agudos "Dr. Cosme Argerich". Ciudad Autónoma de Buenos Aires, Argentina
3 Médico Cardiólogo
Recibido: 14/05/2010
Aceptado: 18/08/2010
Dirección para separatas:
Dr. Alejandro Deviggiano
Av. Maipú 1668 (B1602ABQ) Vicente López Buenos Aires, Argentina Tel./Fax 54-11-4837-7596 e-mail: adeviggiano@gmail.com
RESUMEN
Introducción
La miocardiopatía no compactada (MNC) es un trastorno genético que se caracteriza por la presencia de una extensa capa de miocardio trabeculado con recesos intertrabeculares comunicados con la cavidad ventricular. Si bien su prevalencia es mayor en poblaciones sintomáticas con disfunción ventricular, las nuevas modalidades diagnósticas incrementaron su detección en pacientes asintomáticos con función sistólica conservada. No obstante, la patología permanece subdiagnosticada debido al bajo índice de sospecha sumado al uso de clasificaciones ecocardiográficas con criterios diagnósticos dispares. Se establecieron dos criterios diagnósticos de resonancia magnética cardíaca (RMC) que reconocen correctamente esta entidad.
Objetivo
Evaluar las características clínicas y morfológicas de los pacientes con MNC con disfunción sistólica y sin ella evaluados por resonancia magnética cardíaca (RMC).
Material y métodos
Se incluyeron en forma retrospectiva 20 pacientes con diagnóstico de MNC. Se determinaron: volumen de fin de diástole (VFDVI) y de sístole, diámetro de fin de diástole (DFDVI) y de sístole, fracción de eyección (FEVI), masa cardíaca y trabeculaciones del ventrículo izquierdo (VI). La distribución del miocardio NC se llevó a cabo con el modelo de 17 segmentos miocárdicos.
Resultados
El espesor medio del miocardio NC y el miocardio C fue de 13,1 ± 3,3 mm y de 3,6 ± 0,6 mm, respectivamente. El DFDVI, el VFDVI, la masa global, compactada y trabeculada del VI estuvieron incrementados en forma significativa en el grupo de pacientes con disfunción ventricular. Hubo una correlación positiva y una relación lineal entre el DFDVI y la MTVI (g/m2): r = 0,76; r² = 0,59; p < 0,001.
Conclusiones
Hallamos dos formas de presentación de la patología, una sutil con función sistólica conservada y otra asociada con disfunción ventricular que se comporta como la miocardiopatía dilatada.
Palabras clave: Miocardiopatía no compactada ;Resonancia magnética cardíaca ; Trabeculaciones ; Miocardiopatías; Ecocardiograma
SUMMARY
Background
Non-compaction cardiomyopathy (NCC) is a genetic disorder characterized by deep trabeculations in the ventricular wall, which define recesses communicating with the main ventricular chamber. The prevalence of NCC is greater in symptomatic populations with left ventricular dysfunction; yet, it may also be detected in asymptomatic patients with normal left ventricular function using novel diagnostic tools. However, this condition is under-diagnosed due to a low index of clinical suspicion and to the use of echocardiography classifications based on different diagnostic criteria. The use of cardiac magnetic resonance imaging (CMRI) has established two diagnostic criteria that clearly recognize this disease.
Objective
To evaluate the clinical and morphological characteristics of patients with NCC with and without systolic dysfunction undergoing cardiac magnetic resonance imaging (CMRI). Material and Methods
A total of 20 patients with NCC were retrospectively included. The following parameters were determined: left ventricular end-diastolic volume (LVEDV), left ventricular end-systolic volume (LVESV); left ventricular end-diastolic diameter (LVEDD); left ventricular end-systolic diameter (LVESD); cardiac mass and left ventricular trabeculations. The distribution of NC myocardium was evaluated according to the model of 17 myocardial segments.
Results
Mean myocardial thickness was 13.1±3.3 mm and 3.6±0.6 mm in NC versus normal myocardium, respectively. Patients with left ventricular dysfunction presented increased LVEDD,
LVEDV, total cardiac mass, and LV non-compaction and trabeculations. We found a positive correlation and a linear relationship between LVEDD and TLVM (g/m2): r=0.76; r²=0.59; p<0.001.
Conclusions
We found that NCC can present either as a subtle condition with normal systolic function or as a dilated cardiomyopathy associated with ventricular dysfunction.
Key words: Non-compaction Cardiomyopathy ; Cardiac Magnetic; Resonance Imaging ; Trabeculations ; Cardiomyopathies ; Echocardiography
Abreviaturas
C Compactado
MCVI Masa compactada del ventrículo izquierdo
MCPDI Miocardiopatía dilatada de origen idiopático
MTVI Masa trabeculada del ventrículo izquierdo
RMC Resonancia magnética cardíaca
TR Tiempo de repetición
FEVI Fracción de eyección del ventrículo izquierdo
MGVI Masa global del ventrículo izquierdo
MNC Miocardiopatía no compactada
NC No compactado
TE Tiempo de eco
VI Ventrículo izquierdo
INTRODUCCIÓN
La miocardiopatía no compactada (MNC) es un trastorno genético que se caracteriza por la presencia de una extensa capa de miocardio trabeculado con múltiples y profundos recesos intertrabeculares comunicados con la cavidad ventricular. (1, 2) Sus principales manifestaciones clínicas son insuficiencia cardíaca, eventos tromboembólicos, arritmias y muerte súbita. (3) Dentro de los miembros de una misma familia, la penetrancia y el fenotipo de la MNC son muy variables. (4-9)
Si bien la prevalencia de la MNC es mayor en poblaciones sintomáticas con disfunción ventricular, (10) las nuevas modalidades diagnósticas incrementaron su detección en pacientes asintomáticos con función sistólica conservada. A pesar de ello, la patología sigue siendo subdiagnosticada en la práctica clínica debido al bajo índice de sospecha sumado al uso de clasificaciones ecocardiográficas con criterios diagnósticos dispares. (8, 11, 12) Existen dos criterios de resonancia magnética cardíaca (RMC) que reconocen correctamente esta entidad. (13, 14) Al presente no hay estudios en la bibliografía que comparen pacientes portadores de MNC con disfunción ventricular y sin ésta por medio de RMC.
La discrepancia entre los criterios diagnósticos de la RMC y de la ecocardiografía ha instalado el debate dentro de la comunidad cardiológica con el fin de lograr un diagnóstico correcto de la patología. El propósito de este trabajo es evaluar las características clínicas y morfológicas de los pacientes con MNC con disfunción sistólica y sin ésta evaluados por RMC, así como poner en discusión los alcances y las limitaciones de la ecocardiografía y la RMC en el diagnóstico de esta patología.
MATERIAL Y MÉTODOS
Se realizó un estudio retrospectivo en el que se incluyeron 20 pacientes con diagnóstico de MNC durante el período comprendido entre enero de 2008 y marzo de 2010. El diagnóstico se basó en la ausencia de cardiopatías congénitas asociadas u otras miocardiopatías y el hallazgo por RMC de dos capas de miocardio bien diferenciadas, una de miocardio NC o trabeculada de mayor grosor con recesos intertrabeculares y otra de miocardio C más fina, con una razón entre ambas (miocardio NC/C) > 2,3 en el sector más trabeculado (13) (Figura 1). Del total de pacientes estudiados, 14 recibieron contraste.

Fig. 1. Imágenes de RMC de secuencia cine adquiridas en el fin de la diástole. A y B. Secuencia cine en eje corto y cuatro cámaras que muestran la cuantificación del espesor de la capa de miocardio no compactado (línea negra) y de miocardio compactado (línea blanca). C. Medición de la masa global del VI. La línea interna que delimita el endocardio incluye los músculos papilares y el miocardio trabeculado. D. Medición de la masa compactada del VI. La línea interna que delimita el endocardio incluye los músculos papilares y excluye el miocardio trabeculado.
Adquisición de las imágenes de resonancia magnética cardíaca
Se empleó un equipo de 1,5 tesla (Achieva, Philips Medical Systems, Best, The Netherlands). Se utilizó una antena cardíaca específica de 16 canales y las imágenes se adquirieron con sincronización cardíaca con vectocardiograma. El estudio anatomofuncional se efectuó con secuencia cine balanceada en estado estacionario, aceleración de imagen en paralelo adquirida al final de la espiración empleando un tiempo de repetición (TR) de 3,5 ms, un tiempo de eco (TE) de 1,8 ms y un ángulo de 60º en los ejes 2 cámaras, 4 cámaras, eje corto cubriendo toda la extensión del ventrículo izquierdo (VI) y el tracto de salida. También se realizaron secuencias turbo spin eco con sangre negra en densidad protónica con un TR de 1.935 ms y un TE de 40 ms.
Las secuencias de realce tardío se realizaron con la secuencia de eco de gradiente potenciada en T1 en 14 pacientes luego de una espera de 12 a 15 minutos desde la administración por vía intravenosa de una dosis de gadolinio de 0,2 mmol/kg.
Análisis de las imágenes de resonancia magnética cardíaca
El análisis se realizó en una estación de trabajo (ViewForum; Philips Medical Systems) con un software específico. Se determinaron el volumen de fin de diástole (VFDVI) y de sístole, el diámetro de fin de diástole (DFDVI) y de sístole, la fracción de eyección (FEVI), la masa cardíaca y las trabeculaciones del VI.
En las secuencias cine en eje corto que abarcaban la totalidad del VI se establecieron las fases de fin de diástole (FD) y de fin de sístole (FS); posteriormente se delimitaron en forma semiautomática el epicardio y el endocardio con la inclusión de los músculos papilares. Se definió trabeculación al miocardio que protruía hacia la cavidad ventricular izquierda en el fin de la diástole. El espesor diastólico del miocardio NC y el miocardio C se midió sobre el sector de mayor trabeculación, en el eje corto de la secuencia cine. La distribución del miocardio NC se llevó a cabo con el modelo de 17 segmentos miocárdicos de la clasificación de la AHA. (15)
La determinación de la masa miocárdica global del VI (MGVI) se realizó con la inclusión de los músculos papilares y el miocardio trabeculado, mientras que para la determinación de la masa miocárdica compactada del VI (MCVI) el miocardio trabeculado fue excluido. La masa de miocardio trabeculado del VI (MTVI) se calculó restándole la MCVI a la MGVI (Figura 1). También se calculó el porcentaje de la MTVI en relación con la MGVI (%MTVI). (14)
La determinación de los volúmenes ventriculares y la FEVI se realizó con la inclusión de los músculos papilares y la exclusión del miocardio trabeculado. (16) Se consideró disfunción ventricular un valor de FEVI < 50%. Todas las determinaciones fueron ajustadas a la superficie corporal.
Se consideró realce tardío positivo a la presencia de áreas de miocardio hiperintensas luego de la administración de gadolinio.
Análisis de las imágenes de ecocardiografía
Luego de la RMC se repitieron cinco ecocardiografías. Los estudios se realizaron con un equipo Toshiba Xario, con transductores de 3.0 MHz.
Se utilizaron dos clasificaciones, la de Jenni y colaboradores, (11) que toma en cuenta la ausencia de otras anormalidades congénitas, una razón NC/C de fin de sístole > 2 y la objetivación de flujo intertrabecular por Doppler color, y la de Stolberg y colaboradores, (12) que considera la visualización de espacios intertrabeculares perfundidos desde la cavidad ventricular en el Doppler color sumado a la presencia de más de tres trabeculaciones que sobresalgan de la pared ventricular izquierda a nivel apical, por delante de los músculos papilares, visibles en un plano ecocardiográfico.
Análisis estadístico
Las variables categóricas se expresaron como porcentajes y las variables continuas como media ± desviación estándar en caso de distribución normal y como mediana con rango intercuartil 25-75 para las variables de distribución no gausiana. En la comparación de dos grupos, la significación estadística se determinó con la prueba de la t o de Wilcoxon según la distribución fuera gausiana o no, respectivamente. Para la comparación de las variables categóricas se utilizó una prueba de proporciones.
La relación entre variables continuas se obtuvo mediante análisis de regresión lineal simple con cálculo del coeficiente de Pearson. El nivel de significación se estableció en p< 0,05. Los análisis se realizaron con el software de estadística StatsDirect (Version 2.6.5, Altrincham, UK).
RESULTADOS
El 70% de la población eran hombres y la edad media fue de 49,6 ± 13,8 años. Se conocía la anatomía coronaria en 7 pacientes; 5 tenían disfunción ventricular y 2 función ventricular conservada. Sólo uno tenía enfermedad coronaria leve en la arteria descendente anterior. Un paciente tenía antecedente materno de MNC y 3 refirieron antecedentes familiares de miocardiopatía dilatada y muerte súbita. Dos pacientes con defectos de perfusión en la cámara gamma y los cuatro pacientes derivados por miocardiopatía dilatada de origen idiopático (MCPDI) tuvieron arterias coronarias normales.
En la Tabla 1 se detallan las características de la población estudiada.
Tabla 1. Características clínicas, motivos del pedido y hallazgos de la RMC
RMC: Resonancia magnética cardíaca. M: Masculino. F: Femenino. NC: Miocardio no compactado. C: Miocardio compactado. DP: Dolor precordial. DPR: Defecto de perfusión reversible. MCPDI: Miocardiopatía dilatada de origen idiopático. FOP: Foramen oval permeable. ASI: Aneurisma del septum interauricular. MCP-P: miocardiopatía periparto. DFDVI: Diámetro de fin de diástole del VI. VFDVI: Volumen de fin de diástole del VI. FEVI: Fracción de eyección del VI. %MTVI: Porcentaje de la MTVI en relación con la masa global del VI. La distribución del miocardio NC se llevó a cabo con el modelo de 17 segmentos miocárdicos de la clasificación de la AHA. (15)

Afectación ventricular izquierda
El espesor medio del miocardio NC y el miocardio C fue de 13,1 ± 3,3 mm y de 3,6 ± 0,6 mm, respectivamente. Sólo un paciente presentó un espesor del miocardio C mayor de 5 mm. El número de segmentos medio con ausencia de compactación fue de 8,2 ± 1,2. Los segmentos más afectados fueron el ápex cardíaco y los segmentos laterales a nivel apical y medioventricular (Figura 2). En ninguno de los casos se vieron afectados los segmentos anteroseptal e inferoseptal basal.
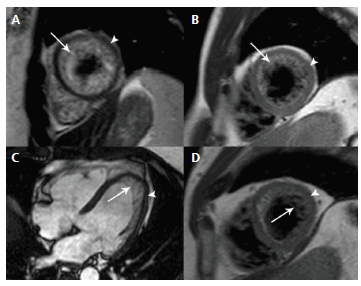
Fig. 2. A. Imagen de RMC en densidad protónica en eje corto de la paciente 4. B. Imagen de RMC en densidad protónica en eje corto de su hermano, paciente 5. C y D. Imagen cine en cuatro cámaras y densidad protónica en eje corto del paciente 13. Las flechas indican el miocardio no compactado y las cabezas de flecha el miocardio compactado.
No hubo diferencias estadísticamente significativas entre los pacientes con disfunción ventricular izquierda y sin ésta respecto de edad, sexo, razón NC/C y %MTVI. El DFDVI, el VFDVI, la MGVI, la MCVI y la MTVI estuvieron incrementados en forma significativa en el grupo de pacientes con disfunción ventricular (Tabla 2). Hubo una correlación positiva y una relación lineal entre el DFDVI y la MTVI (g/m2): r = 0,76; r² = 0,59; p < 0,001 (Figura 3).
Tabla 2. Comparación de pacientes con disfunción ventricular izquierda y sin ésta
VI: Ventrículo izquierdo. DFDVI: Diámetro de fin de diástole del VI. VFDVI: Volumen de fin de diástole del VI. FEVI: Fracción de eyección del VI. NC: No compactado. C: Compactado. MGVI: Masa global del VI. MCVI: Masa compactada del VI. MTVI: Masa trabeculada del VI. %MTVI: Porcentaje de la MTVI en relación con la MGVI.


Fig. 3. Gráfico que muestra la relación lineal entre aumento del DFDVI y el aumento de la MTVI (g/m2) evaluados a través de la resonancia magnética cardíaca. DFDVI: Diámetro de fin de diástole del VI. MTVI: Masa trabeculada del VI.
Presentaron realce tardío 4 (28%) de los 14 pacientes que recibieron gadolinio.
Sólo en 5 de los 18 pacientes con ecocardiograma previo se reconoció correctamente el miocardio NC. Se repitió el ecocardiograma Doppler en forma dirigida en 5 de los 13 pacientes con miocardio NC no reconocido; tres de ellos se hallaban sintomáticos con disfunción ventricular. Se objetivó flujo intertrabecular en cinco y una razón miocardio NC/C > 2 en dos de ellos (Figura 4).

Fig. 4. A. Imagen de RMC en secuencia cine en 4 cámaras del paciente 2. Las flechas indican el miocardio no compactado. B. Ecocardiografía con Doppler color en cuatro cámaras. Las cabezas de flecha indican el flujo intertrabecular.
DISCUSIÓN
La MNC es una patología poco frecuente, agrupada dentro de las miocardiopatías primarias genéticas. (17) Aunque puede asociarse con diversas cardiopatías congénitas, (18- 20) habitualmente se manifiesta en forma aislada. En un principio, la prevalencia de la MNC era muy baja, < 0,3%. (3) Publicaciones recientes muestran una prevalencia del 23% en pacientes con insuficiencia cardíaca. (10)
La MNC se origina a partir de la interrupción del proceso de compactación miocárdica que ocurre entre la cuarta y la octava semanas de gestación, momento en el que los recesos embrionarios se transforman paulatinamente en miocardio C desde el epicardio al endocardio, de septum a pared libre y de la base al ápex. (21) Esto explica el predominio del miocardio NC a nivel del ápex y de la cara lateral del VI, así como la ausencia de afectación del septum medial y basal. (13, 22, 23)
Diversas publicaciones confirman el corte familiar de la MNC. El sustrato genético de la MNC involucra la mutación de genes relacionados con la función mitocondrial, como la proteína G 4.5, y de genes relacionados con la síntesis de la proteínas cypher/ZASP y lamina A/C. (5-7) Estas mutaciones intervienen en el desarrollo de distintas miocardiopatías, como la hipertrófica y la dilatada, y debido a ello es posible encontrar diferentes tipos de miocardiopatías en los miembros de una misma familia. (4-7, 24) Lo expuesto fundamenta el screening familiar de pacientes portadores de MNC.
En la población estudiada se identifica el gran pleomorfismo clínico de la MNC. La sobrecarga de volumen que ocurre inmediatamente luego del alumbramiento hace que en ocasiones la MNC pueda confundirse con la miocardiopatía periparto. (25) El desarrollo anómalo de la microcirculación en las áreas de no compactación estaría relacionado con la presencia del dolor precordial y los defectos de perfusión en ausencia de enfermedad coronaria. (26) En la bibliografía se describe también la asociación de la MNC con el aneurisma del septum interauricular y el foramen oval permeable. (27)
Petersen y colaboradores (13) establecieron el primer criterio diagnóstico de la RMC, al demostrar que una razón NC/C > 2,3 diferenciaba correctamente a la MNC de formas menores de compactación presentes en individuos normales, deportistas, pacientes con miocardiopatía hipertrófica y dilatada y estenosis aórtica. La inclusión del miocardio NC dentro de la cavidad ventricular es la forma más eficiente y reproducible de medición de volúmenes ventriculares y la FEVI. (16) Recientemente, Jacquier y colaboradores (14) incorporaron el segundo criterio diagnóstico de la RMC. El %MTVI > 20% diferenció correctamente la trabeculación de la MNC de la presente en individuos normales, pacientes con miocardiopatía hipertrófica y dilatada. Al comparar este criterio diagnóstico con el de Petersen y colaboradores (13) se obtuvo una sensibilidad y una especificidad del 78,5% y el 72,2%, respectivamente. (14) La determinación de la MTVI tiene la limitación de que incluye el volumen sanguíneo localizado en los recesos intertrabeculares.
La similitud de los parámetros de la RMC entre los pacientes que concurrieron por screening familiar y los que no lo hicieron por este motivo habla a favor de la presencia de la patología en nuestra población (datos no mostrados). Un espesor de miocardio C menor de 5 mm en áreas de NC refuerza el diagnóstico de la patología; este dato habitualmente no se considera en la bibliografía.
La presencia de disfunción ventricular no se corresponde con la razón NC/C ni con el porcentaje de miocardio NC, sino con la MGVI, la MCVI, la MTVI,el VFDVI y el DFDVI, es decir que se comporta como la miocardiopatía dilatada. Asimismo, el aumento del DFDVI se relacionó de manera lineal y estadísticamente significativa con el aumento de la MTVI.
El hallazgo de una MTVI mayor en los pacientes con disfunción ventricular izquierda se relaciona con los hallazgos de Belager y colaboradores, (28) quienes evidenciaron una relación lineal entre la disminución de la función sistólica y el aumento del área de miocardio NC a través de la evaluación ecocardiográfica, en pacientes con diversos grados de trabeculación miocárdica sin el requisito de tener que cumplir con la presencia de la razón NC/C > 2 en el fin de la sístole. Los autores consideraron que la MNC tiene un espectro de presentación que va desde grados leves a graves de trabeculación miocárdica. (28)
Por otro lado, es probable que la RMC esté mirando con una "lupa" formas sutiles o en estadios tempranos y/o hipertrabeculación no patológica no evidenciadas por la ecocardiografía. En la actualidad no contamos con parámetros imagenológicos que permitan predecir la evolución hacia la disfunción ventricular sintomática en pacientes jóvenes.
La falta de análisis genético en nuestra población nos lleva a plantear la hipótesis de que los pacientes con disfunción ventricular podrían tener genes relacionados con la miocardiopatía dilatada o tener un patrón genético similar a los que presentan función sistólica conservada, pero con expresión fenotípica diferente debida a la influencia de factores ambientales. Así como sucedió con la miocardiopatía hipertrófica, es tiempo de incorporar la determinación genética dentro de la estratificación de riesgo de pacientes con MNC, (29) especialmente en aquellos con función sistólica conservada. La respuesta a los interrogantes que surgieron de nuestra observación serán develadas a través de estudios longitudinales con mapeo genético.
La clasificación de Chin y colaboradores (11) considera la razón C/NC en el fin de la diástole, tomando un valor ≤ 0,5, sin tomar en cuenta la evaluación por Doppler del flujo intertrabecular. La clasificación más utilizada es la de Jenni y colaboradores, (12) que emplea una razón NC/C de fin de sístole > 2 sumada a la objetivación de flujo intertrabecular por Doppler color. La clasificación de Stolberg y colaboradores (3) suma a la clasificación de Jenni y colaboradores (12) la presencia de más de tres trabeculaciones que sobresalgan de la pared ventricular izquierda a nivel apical, por delante de los músculos papilares, visibles en un plano ecocardiográfico; este criterio está cobrando creciente interés.
Puede ocurrir que un paciente tenga alguno pero no todos los criterios diagnósticos. La presencia de flujo intertrabecular es un signo característico, claro y sencillo de hallar, (12) no así la medición del espesor de ambas capas de miocardio, ya que cada clasificación los mide
en diferentes fases del ciclo cardíaco. La medición del miocardio NC en el fin de la sístole es dificultosa debido a la unión de las trabéculas y la disminución de los recesos intertrabeculares que produce la contracción cardíaca.
Kohli y colaboradores (10) mostraron que sólo el 29,8% de los pacientes con MNC reunían los criterios diagnósticos ecocardiográficos de distintas clasificaciones. Estos hallazgos coinciden con la menor detección de la razón en fin de la sístole entre el miocardio NC/C > 2 que la presencia de flujo intertrabecular en los individuos a los que se les realizó un segundo ecocardiograma Doppler en forma dirigida. Por otro lado, cabe mencionar que la falta de reconocimiento de áreas de no compactación en las ecocardiografías previas podría estar relacionada con el equipamiento utilizado y con el hecho de ser una práctica dependiente del operador. Ante la sospecha ecocardiográfica de MNC, la realización de una RMC esclarecería el diagnóstico.
Implicaciones clínicas
Las primeras publicaciones evaluaron formas graves de la MNC con una incidencia elevada de insuficiencia cardíaca, eventos tromboembólicos, arritmias y muerte súbita. (3, 11) Sin embargo, la MNC tiene una evolución más favorable de lo que se pensaba, con una sobrevida libre de trasplante cardíaco o muerte del 97% a los 46 meses de seguimiento. (24)
Habida cuenta de las diversas formas de presentación y el escaso conocimiento de la patología, los médicos cardiólogos deben sospechar la presencia de MNC en pacientes con miocardiopatía dilatada de etiología no establecida, aun sin deterioro grave de la FEVI, como también en los que tengan estudios nucleares con defectos de perfusión no vinculados con patología coronaria.
Limitaciones
Debido a que la MNC es una afección poco prevaleciente y que los resultados provienen de un único centro será necesaria la realización de estudios multicéntricos con seguimiento longitudinal en un número mayor de pacientes para validar nuestros hallazgos.
Si bien no ha habido determinación genética en la población analizada, el hallazgo de MNC en familiares directos sugiere el carácter hereditario de esta entidad.
CONCLUSIONES
La RMC, en nuestra población, a través de una razón NC/C > 2,3 y un porcentaje de MTVI mayor del 20% no permitió discriminar a los pacientes con función sistólica conservada y disminuida. Hallamos dos formas de presentación de la patología, una sutil con función sistólica conservada y otra asociada con disfunción ventricular que se comporta como la miocardiopatía dilatada. Los criterios ecocardiográficos dispares y la baja tasa de sospecha podrían ser los factores que determinarían el subdiagnóstico de la MNC en la práctica clínica.
Agradecimiento
A la Dra. Graciela Fernández Alonso por su asistencia en la preparación de este manuscrito.
Declaración de conflicto de intereses
Los autores declaran que no poseen conflicto de intereses
1. Weiford BC, Subbarao VD, Mulbern KM. Non-compaction of the ventricular myocardium. Circulation 2004;109:2965-71. [ Links ]
2. Chiribiri A, Leuzzi S, Salvetti I, Patané S, Bonamini R, Trevi GP, et al. Isolated noncompaction of the right ventricular myocardium in the adulthood? Int J Cardiol 2009;134:17-9. [ Links ]
3. Oechslin EN, Attenhofer Jost CH, Rojas JR, Kaufmann PA, Jenni R. Long-term follow-up of 34 adults with isolated left ventricular noncompaction: a distinct cardiomyopathy with poor prognosis. J Am Coll Cardiol 2000;36:493-500. [ Links ]
4. Monserrat L, Hermida-Prieto M, Castro-Beiras A. Avances en miocardiopatía dilatada idiopática: del genotipo al fenotipo clínico. Rev Esp Cardiol Supl 2007;7:2F-13F. [ Links ]
5. Neustein HB, Lurie PR, Dahms B, Takahashi M. An X-linked recessive cardiomyopathy with abnormal mitochondria. Pediatrics 1979;64:24-9. [ Links ]
6. Vatta M, Mohapatra B, Jimenez S, Sanchez X, Faulkner G, Perles Z, et al. Mutations in Cypher/ZASP in patients with dilated cardiomyopathy and left ventricular non-compaction. J Am Coll Cardiol 2003;42:2014-27. [ Links ]
7. Hermida-Prieto M, Monserrat L, Castro-Beiras A, Laredo R, Soler R, Peteiro J, et al. Familial dilated cardiomyopathy and isolated left ventricular noncompaction associated with lamin A/C gene mutations. Am J Cardiol 2004;94:50-4. [ Links ]
8. Stollberger C, Finsterer J, Blazek G. Left ventricular hypertrabeculation/ noncompaction and association with additional cardiac abnormalities and neuromuscular disorders. Am J Cardiol 2002;90:899-902. [ Links ]
9. Stöllbergera C, Blazekb G, Winkler-Dworakc M, Finsterera J. Diferencias de sexo en la ausencia de compactación ventricular izquierda con y sin trastornos neuromusculares. Rev Esp Cardiol 2008;61(2):130-6. [ Links ]
10. Kohli SK, Pantazis AA, Shah JS, Adeyemi B, Jackson G, McKenna WJ, et al. Diagnosis of left-ventricular non-compaction in patients with left-ventricular systolic dysfunction: time for a reappraisal of diagnostic criteria? Eur Heart J 2008;29:89-95. [ Links ]
11. Chin TK, Perloff JK, Williams RG, Jue K, Mohrmann R. Isolated noncompaction of left ventricular myocardium. A study of eight cases. Circulation 1990;82:507-13. [ Links ]
12. Jenni R, Oechslin E, Schneider J, Attenhofer Jost C, Kaufmann PA. Echocardiographic and pathoanatomical characteristics of isolated left ventricular non-compaction: a step towards classification as a distinct cardiomyopathy. Heart 2001;86:666-71. [ Links ]
13. Petersen SE, Selvanayagam JB, Wiesmann F, Robson MD, Francis JM, Anderson RH, et al. Left ventricular non-compaction insights from Cardiovascular magnetic resonance imaging. J Am Coll Cardiol 2005;46:101-5. [ Links ]
14. Jacquier A, Thuny F, Jop B, Giorgi R, Cohen F, Gaubert JY, et al. Measurement of trabeculated left ventricular mass using cardiac magnetic resonance imaging in the diagnosis of left ventricular noncompaction. Eur Heart J 2010;31:1098-104 [ Links ]
15. Cerqueira MD, Weissman NJ, Dilsizian V, Jacobs AK, Kaul S, Laskey WK, et al. Standardized Myocardial Segmentation and Nomenclature for Tomographic Imaging of the Heart: A Statement for Healthcare Professionals From the Cardiac Imaging Committee of the Council on Clinical Cardiology of the American Heart Association. Circulation 2002;105:539-42. [ Links ]
16. Papavassiliu T, Kuhl HP, Schroder M, Suselbeck T, Bondarenko O, Bohm CK, et al. Effect of endocardial trabeculae on left ventricular measurements and measurement reproducibility at cardiovascular MR imaging. Radiology 2005;236:57-64. [ Links ]
17. Maron BJ, Towbin JA, Thiene G, Antzelevitch C, Corrado D, Arnett D, et al. Contemporary definitions and classification of the cardiomyopathies: an American Heart Association Scientific Statement from the Council on Clinical Cardiology, Heart Failure, and Transplantation Committee; Quality of Care and Outcome Research and Functional Genomics and Translational Biology Interdisciplinary Working Groups; and Council on Epidemiology and Prevention. Circulation 2006;113:1807-16. [ Links ]
18. Ichida F, Tsubata S, Bowles KR, Haneda N, Uese K, Miyawaki T, et al. Novel gene mutations in patients with left ventricular noncompaction or Barth syndrome. Circulation 2001;103:1256-63. [ Links ]
19. Ilercil A, Barack J, Malone MA, Barold SS, Herweg B. Association of noncompaction of left ventricular myocardium with Ebstein's anomaly. Echocardiography 2006;23:432-3. [ Links ]
20. Bellet S, Gouley BA. Congenital heart disease with multiple cardiac anomalies: report of a case showing aortic atresia. Am J Med Sci 1932;183:458-65. [ Links ]
21. Weiford BC, Subbarao VD, Mulbern KM. Non-compaction of the ventricular myocardium. Circulation 2004;109:2965-71. [ Links ]
22. Dursun M, Agayev A, Nisli K, Ertugrul T, Onur I, Oflaz H, et al. MR imaging features of ventricular noncompaction: emphasis on distribution and pattern of fibrosis. Eur J Radiol 2010;74:147-51. [ Links ]
23. Calvillo P, Martí-Bonmatí L, Chaustre F, Roldán I, Mora V, Peláez A, et al. Cuantificación de la función, perfusión y realce tardío del ventrículo izquierdo no compactado mediante resonancia magnética. Radiología 2009;51:45-56. [ Links ]
24. Murphy RT, Thaman R, Blanes JG, Ward D, Sevdalis E, Papra E, et al. Natural history and familial characteristics of isolated left ventricular non-compaction. Eur Heart J 2005;26:1143-4. [ Links ]
25. Bahl A, Swamy A, Sharma Y, Kumar N. Isolated noncompaction of left ventricle presenting as peripartum cardiomyopathy. Int J Cardiol 2006;109:422-3. [ Links ]
26. Sato Y, Matsumoto N, Matsuo S, Kunimasa T, Yoda S, Tani S, et al. Myocardial perfusion abnormality and necrosis in a patient with isolated noncompaction of the ventricular myocardium: evaluation by myocardial perfusion SPECT and magnetic resonance imaging. Int J Cardiol 2007;120:24-6. [ Links ]
27. Monserrat L, Hermida-Prieto M, Fernández X, Rodríguez I, Dumont C, Cazón L, Cuesta MG, et al. Mutation in the alpha-cardiac actin gene associated with apical hypertrophic cardiomyopathy, left ventricular non-compaction, and septal defects. Eur Heart J 2007;28:1953-61. [ Links ]
28. Belanger AR, Miller MA, Donthireddi UR, Najovits AJ, Goldman ME. New classification scheme of left ventricular noncompaction and correlation with ventricular performance. Am J Cardiol. 2008;102: 92-6. [ Links ]
29. Monserrar L. Miocardiopatía no compactada: una enfermedad en búsqueda de criterios. Rev Esp Cardiol 2008;61:112-5. [ Links ]














