Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista argentina de cardiología
On-line version ISSN 1850-3748
Rev. argent. cardiol. vol.79 no.6 Ciudad Autónoma de Buenos Aires Dec. 2011
PRESENTACIÓN DE CASOS
Cierre percutáneo de fuga paravalvular mitral
Percutaneous Closure of Mitral Paravalvular Leak
Gerardo NauMTSAC, 1, Mariano AlbertalMTSAC, 1, Mariano VrancicMTSAC, 2, Ricardo Ronderos3, Gustavo Sánchez3, Daniel NaviaMTSAC, 2, Sebastián Peralta1, Jorge BelardiMTSAC, 1, Fernando CuraMTSAC, 1
MTSAC Miembro Titular de la Sociedad Argentina de Cardiología
1 Servicio de Cardiología Intervencionista y Terapéuticas Endovasculares, Instituto Cardiovascular de Buenos Aires (ICBA). Buenos Aires, Argentina
2 Servicio de Cirugía Cardiovascular, Instituto Cardiovascular de Buenos Aires (ICBA). Buenos Aires, Argentina
3 Servicio de Diagnóstico por Imágenes, Instituto Cardiovascular de Buenos Aires (ICBA). Buenos Aires, Argentina
Recibido: 01/11/2010
Aceptado: 21/01/2011
Dirección para separatas:
Dr. Gerardo Nau
Servicio de Cardiología Intervencionista y Terapéuticas Endovasculares, ICBA Blanco Encalada 1543 (1428) Buenos Aires Tel. +54 (011) 4787-7570 Fax: +54 (011) 4787-7571
e-mail: gnau@icba-cardiovascular.com.ar
RESUMEN
El desarrollo de fuga paravalvular (FPV) luego del reemplazo valvular mitral es un fenómeno poco frecuente pero de gran repercusión sintomática. Debido a la elevada morbimortalidad de su abordaje quirúrgico se han intentado varias técnicas percutáneas con una tasa éxito que varía entre el 60% y el 90%. En esta presentación se describe el caso de una paciente joven, con múltiples cirugías valvulares mitrales previas, sintomática por disnea limitante y anemia hemolítica. Con el uso de imágenes ecocardiográficas tridimensionales, se realizó la oclusión de la FPV con un dispositivo Amplatzer III, diseñado específicamente para dicha indicación. Luego de un seguimiento de 3 meses, la FPV permanece totalmente excluida y la paciente se encuentra asintomática.
Palabras clave: Prótesis valvular cardíaca; Falla de prótesis; Cierre percutáneo
SUMMARY
Percutaneous Closure of Mitral Paravalvular Leak
The development of mitral paravalvular leak (PVL) after mitral valve replacement is an uncommon complication with severe symptoms. The surgical repair of this condition has high morbidity and mortality; for this reason, several percutaneous techniques have been attempted with success rates between 60% and 90%. We describe the case of a young female patient with multiple mitral valve surgeries, who presented limiting dyspnea and hemolytic anemia. The PVL was closed using a specially designed Amplatzer III device under three-dimensional echocardiography. After 3 months of follow-up, the PVL remains completely excluded and the patient is asymptomatic.
Key words: Heart Valve Prosthesis; Prosthesis Failure; Percutaneous Closure
Abreviaturas
CRVM Cirugía de reemplazo valvular mitral
FPV Fuga paravalvular
ETE Ecocardiograma transesofágico
INTRODUCCIÓN
El desarrollo de fuga paravalvular (FPV) luego del reemplazo valvular mitral (CRVM) es un fenómeno raro (3,5-12,5%) pero de gran repercusión sintomática. (1-3) Su causa está dada por cuestiones técnicas, infecciones localizadas o calcificación grave del anillo. (4-6) El tratamiento invasivo de la FPV deriva en una franca mejoría sintomática y en mayor supervivencia. Sin embargo, su corrección quirúrgica se asocia con una morbimortalidad elevada. Esto llevó a que se intentaran varias técnicas percutáneas con una tasa éxito que varía entre el 60% y el 90% y una tasa de recurrencia del 40%. (2, 3, 7)
La imposibilidad de cruzar la FPV secundaria a la compleja ubicación en relación con la punción transeptal y/o la incompatibilidad de los dispositivos de adaptación a la forma de la fuga o compromiso de las valvas mecánicas circundantes son las causas más frecuentes del fracaso del cierre percutáneo. Fundamentalmente, existen tres puntos clave para el éxito de la técnica percutánea: 1) conocimiento anatómico espacial detallado, 2) utilización de una vía de acceso apropiada y 3) uso de un dispositivo que se adecue a la anatomía del FPV. En esta presentación se describe el caso de una paciente con FPV mitral que fue sometida con éxito al cierre percutáneo con un novedoso dispositivo llamado Amplatzer III (AGA Medical, Plymouth, Minnesota, USA) por vía transapical miocárdica y guiado por imágenes ecocardiográficas tridimensionales.
CASO CLÍNICO
Paciente de 50 años con antecedentes de insuficiencia mitral grave del tipo reumático y múltiples CRVM que fue derivada a nuestro servicio debido a la presencia de una FPV mitral. La paciente fue intervenida quirúrgicamente en tres oportunidades: en 2005 (CRVM mecánica #27), en 2006 (nueva CRVM mecánica #27 secundaria a pannus) y 2007 (nueva CRVM biológica #27 secundaria disfunción valvular de causa trombótica). A partir de marzo de 2010, la paciente presentó disnea progresiva asociada con fibrilación auricular paroxística y anemia de tipo hemolítica (hematocrito 33%). Se realizó un ecocardiograma transesofágico (ETE) ante el diagnóstico de FPV por Doppler transtorácico, que evidenció dehiscencia a nivel anterolateral de 10 × 4 mm, por debajo de orejuela, con producción de flujo regurgitante de alta velocidad (Figura 1 A-C).
Por los antecedentes de sus múltiples cirugías previas e interpretando importante su FPV, se propuso el cierre percutáneo. Para guiar su cierre, se realizó una reconstrucción tridimensional ecocardiográfica de la prótesis mitral que permitió observar con precisión la forma y la localización de la FPV y su relación anatómica con estructuras contiguas (Figura 1 D).
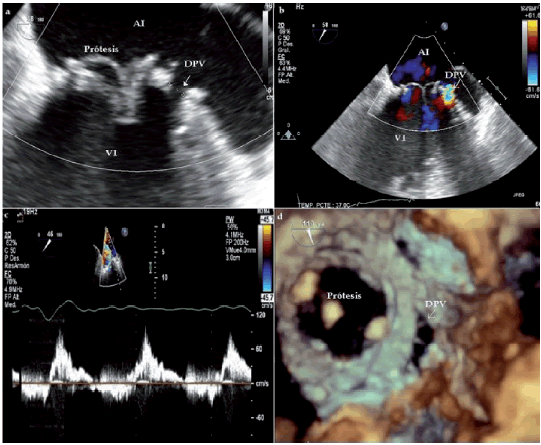
Figura 1. Evaluación inicial por ETE. A-C. Doppler e imágenes bidimensionales que revelan la presencia de DPV. D. Reconstrucción tridimensional que ilustra la forma y la localización de la DPV. AI: Aurícula izquierda. VI: Ventrículo izquierdo. VMi: Válvula mitral. DPV: Dehiscencia paravalvular.
Procedimiento
Bajo anestesia general y guiada por ETE, se realizó un abordaje transapical (Figura 2 A). Primero se punzó el ápex en forma directa (bajo guía ETE), luego de una pequeña incisión intercostal. Inmediatamente de punzado, se avanzó una cuerda de 0,035-pulgadas hacia el ventrículo izquierdo, intercambiándose la aguja de punción por un introductor 6 Fr de 11 cm (Figura 2). Se administraron 8.000 UI de heparina por vía intravenosa. Seguidamente, se avanzó un catéter angulado hidrófilo junto con una cuerda guía, también hidrófila y angulada, de 0,035 pulgadas, cruzando la lesión regurgitante hacia la aurícula izquierda (con cuerda y catéter). Se intercambió la cuerda por una cuerda con extrasoporte Amplatz (0,035 pulgadas, 260 mm de largo con una punta flexible de 1,5 mm de largo) para mayor estabilidad y soporte. Posteriormente, se avanzó la vaina liberadora del dispositivo (7 Fr de 22 cm de largo) hacia la aurícula izquierda. El dispositivo oclusor utilizado fue un Amplatzer III de 14 × 5 mm. La gran ventaja de este dispositivo es que se puede recoger durante el procedimiento a pesar de haberse liberado de la vaina.
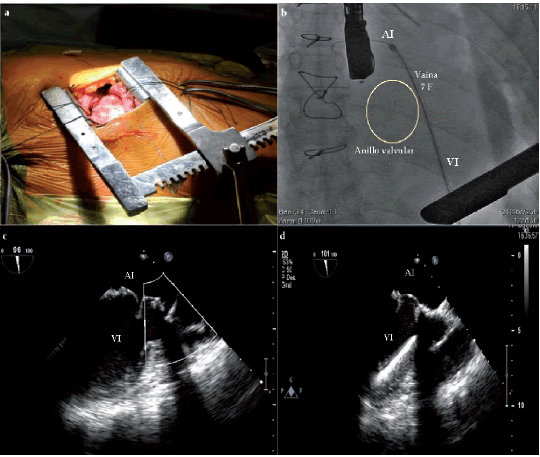
Figura 2. A. Acceso transapical. B-D. Imágenes angiográfica (arriba) y ecocardiográficas (abajo) utilizadas para guiar la punción apical y el procedimiento.
Para su liberación, primero se avanzó el dispositivo a través de la vaina, la cual se retiró para exponer el dispositivo. Mediante evaluación ETE se confirmó su posicionamiento correcto con escaso flujo residual paravalvular y funcionamiento normal de la prótesis mitral (Figura 3 A-C), por lo que se decidió su liberación definitiva. En el seguimiento a 30 días se observó una franca mejoría sintomática, con evidencia de oclusión total de la FPV (Figura 3 D).
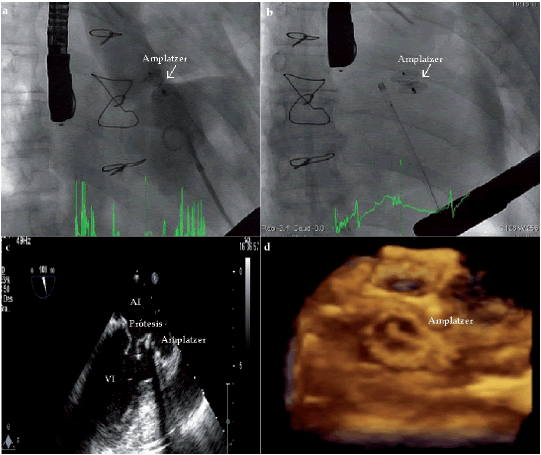
Figura 3. A-B. Imágenes angiográficas de control luego del implante del dispositivo, que confirman ausencia de flujo residual. C. Imagen ecocardiográfica 2D y 3D al seguimiento. Se observa el dispositivo correctamente implantado sin signos de dehiscencia paravalvular.
DISCUSIÓN
El cierre percutáneo de FPV en pacientes de riesgo quirúrgico alto se muestra como una práctica útil y eficaz en esta patología. (8, 9) El éxito del procedimiento tiene clara relación con la modalidad de imágenes obtenidas durante la planificación de la estrategia. La conformación oval de la FPV, la cuantificación de los defectos y la evaluación de la anatomía circundante explican la creciente adopción de la ecocargiografía 3D. Asimismo, este tipo de imágenes se comienza a utilizar como guía del procedimiento, ya que se obtienen un conocimiento espacial mayor y una exposición menor a rayos X y a contraste. Sin embargo, aún persisten algunas limitaciones relacionadas con la adquisición relativamente lenta, la falta de vistas estandarizadas y la integración adecuada de imágenes. (10)
En la bibliografía puede hallarse la descripción y utilización de diferentes dispositivos en el tratamiento de la FPV; sin embargo, ninguno ha sido creado para este especial uso. (11-13) El oclusor vascular III es un dispositivo diseñado en forma ovalada de nitinol, para ajustarse a la conformación semilunar de los defectos. En los extremos superior e inferior presenta dos anillos de 2 mm que sobresalen para prestar mayor estabilidad.
Los dispositivos están diseñados para su utilización en estructuras que se localicen en sitios de gran gradiente de presión. La altura del dispositivo es de 6,5 mm y los tamaños varían de 4 a 14 mm de longitud y 2-5 mm de ancho. Este avance nos permitiría un mayor éxito clínico del procedimiento y una disminución del número de reintervenciones, ya que estas últimas representan un porcentaje importante y una limitación de la técnica.
Por último, la vía de acceso transapical se ha perfeccionado con el estudio diagnóstico hemodinámico de pacientes portadores de enfermedad valvular. El acceso puede realizarse por vía percutánea o quirúrgica. A pesar de que esta última es más compleja, el riesgo de hemotórax o hemopericardio es muy bajo, ya que permite un control estricto del lugar de punción y la fijación del ápice para evitar lesiones con el movimiento ventricular. El abordaje apical permite un acceso directo y corto hacia la válvula mitral, que evita la punción interauricular y angulaciones complejas de la vaina hasta el defecto.
Aun con el advenimiento de nuevas técnicas y herramientas diagnósticas, el cierre percutáneo de FPV mitrales continúa siendo un gran desafío. Sin embargo, estos avances nos permiten obtener un éxito mayor con esta técnica y, así, demorar la indicación quirúrgica ante esta compleja entidad.
1. Miller DL, Morris JJ, Schaff HV, Mullany CJ, Nishimura RA, Orszulak TA. Reoperation for aortic valve periprosthetic leakage: identification of patients at risk and results of operation. J Heart Valve Dis 1995;4:160-5. [ Links ]
2. Toker ME, Kirali K, Balkanay M, Eren E, Ozen Y, Güler M, et al. Operative mortality after valvular reoperations. Heart Surg Forum 2005;8:E280-3. [ Links ]
3. Genoni M, Franzen D, Vogt P, Seifert B, Jenni R, Künzli A, et al. Paravalvular leakage after mitral valve replacement: improved long-term survival with aggressive surgery? Eur J Cardiothorac Surg 2000;17:14-9. [ Links ]
4. Laks H, Pearl JM, Barthel SW, Elami A, Sorensen TJ, Milgalter E. Aortic valve replacement using a continuous suture technique. J Card Surg 1993;8:459-65. [ Links ]
5. Jindani A, Neville EM, Venn G, Williams BT. Paraprosthetic leak: a complication of cardiac valve replacement. J Cardiovasc Surg (Torino) 1991;32:503-8. [ Links ]
6. Schoen FJ. The first step to understanding valve failure: an overview of pathology. Eur J Cardiothorac Surg 1992;6:S50-3. [ Links ]
7. Oz BS, Iyem H, Akay HT, Bolcal C, Yokusoglu M, Kuralay E, et al. Risk factors for short- and long-term survival in patients undergoing re-replacement due to prosthetic valve dysfunction. Heart Vessels 2006;21:339-43. [ Links ]
8. Rizzoli G, Bottio T, De Perini L, Scalia D, Thiene G, Casarotto D. Multivariate analysis of survival after malfunctioning biological and mechanical prosthesis replacement. Ann Thorac Surg 1998;66:S88-94. [ Links ]
9. Jones JM, O'Kane H, Gladstone DJ, Sarsam MA, Campalani G, MacGowan SW, et al. Repeat heart valve surgery: risk factors for operative mortality. J Thorac Cardiovasc Surg 2001;122:913-8. [ Links ]
10. Piéchaud JF. Percutaneous closure of mitral paravalvular leak. J Interv Cardiol 2003;16:153-5. [ Links ]
11. Gillinov AM, Blackstone EH, White J, Howard M, Ahkrass R, Marullo A, et al. Durability of combined aortic and mitral valve repair. Ann Thorac Surg 2001;72:20-7. [ Links ]
12. Pate G, Webb J, Thompson C, Munt B, Chugh S, Carere R, et al. Percutaneous closure of a complex prosthetic mitral paravalvular leak using transesophageal echocardiographic guidance. Can J Cardiol 2004;20:452-5. [ Links ]
13. Kort HW, Sharkey AM, Balzer DT. Novel use of the Amplatzer duct occluder to close perivalvar leak involving a prosthetic mitral valve. Catheter Cardiovasc Interv 2004;61:548-51. [ Links ]














