Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista argentina de cardiología
On-line version ISSN 1850-3748
Rev. argent. cardiol. vol.79 no.6 Ciudad Autónoma de Buenos Aires Dec. 2011
CONSENSO
Consenso de Enfermedad de Chagas-Mazza
Consensus Statement on Chagas-Mazza Disease
SOCIEDAD ARGENTINA DE CARDIOLOGÍA
CONSEJO DE ENFERMEDAD DE CHAGAS "DR. SALVADOR MAZZA"
Capítulo I. Prólogo
Capítulo II. Comisiones de Trabajo - Integrantes
Capítulo III. Introducción
Capítulo IV. Chagas agudo
Capítulo V. Fisiopatología
Capítulo VI. Chagas crónico sin patología demostrable
Capítulo VII. A rritmias en la enfermedad de Chagas
Capítulo VIII. Miocardiopatía dilatada chagásica - Insuficiencia cardíaca
Capítulo IX. Lecturas sugeridas
Capítulo I. Prólogo
El desafío de realizar una revisión y actualización de un Consenso tan destacado como el realizado en el año 2002 por importantes expertos con el fin de introducir nuevas herramientas diagnósticas y terapéuticas, así como cambios de paradigmas, no ha sido una tarea fácil, pero se ha contado con un destacado y numeroso equipo de médicos de la Sociedad Argentina de Cardiología (SAC), integrantes de Consejos y Distritos que han participado activa y entusiastamente en esta tarea.
El gran desarrollo y subsiguiente impacto de las nuevas tecnologías sobre los conocimientos médicos en las últimas décadas hizo variar la mirada sobre ciertas enfermedades como la de Chagas-Mazza en su repercusión más comprometida, como es la cardiológica.
El Área de Normatizaciones y Consensos de la SAC sugiere la revisión y actualización de los Consensos y Guías a la luz de los nuevos conocimientos y posibilidades diagnósticas por lo menos cada 5 años.
Dr Jorge E Mitelman
Coordinador general
Objetivo
Esta actualización no intenta reemplazar el criterio médico frente a cada paciente en forma individual y su circunstancia socioeconómica, sino ser una guía para el progreso en la descripción de sus etapas evolutivas, el diagnóstico precoz y agudizado de su expresión cardiológica, en la búsqueda de nuevos tratamientos que por distintas razones se encuentra más alejada de los grandes ensayos clínicos y la medicina de la evidencia.
Agradecemos al Área de Consensos y Normatizaciones de la SAC por la oportunidad de esta actualización con el objetivo de dar a la enfermedad de Chagas-Mazza la relevancia e importancia no sólo en Latinoamérica, de donde es originaria, sino la adquirida en Europa, los Estados Unidos de Norteamérica, Japón y Australia por las continuas migraciones que han obligado a la Organización Mundial de la Salud (OMS) a intervenir activamente para su control definitivo.
Esta enfermedad relacionada con la pobreza continúa hoy en día provocando incapacidades de todo tipo, muerte súbita y un costo elevado para la salud pública. Los enfermos chagásicos tienen voz pero no son escuchados; es nuestra obligación como profesionales de la salud ser sus voceros ante las autoridades. Consensos como el presente colaborarían para influir en el establecimiento de políticas de estado, que cancelen la deuda con los sectores más débiles de nuestra sociedad. La tasa de pobreza del 23,3% a nivel nacional y la carencia de viviendas en el ámbito rural con falta de cloacas, agua corriente y deficitaria prestación de salud y educación denuncian la necesidad de múltiples respuestas, por lo que resulta imprescindible articular planes que reviertan estas realidades.
Metodología
Se empleó la Clasificación de los Indicadores para Procedimientos Diagnósticos y Terapéuticos y tipos de evidencia utilizados en anteriores Consensos de la SAC, Clasificación habitual de la ACC/AHA y la ESC.
Clases de Recomendaciones
Clase I: evidencia y/o acuerdo general de que un determinado procedimiento diagnóstico/tratamiento es beneficioso, útil y efectivo.
Clase II: evidencia conflictiva y/o divergencia de opinión acerca de la utilidad/eficacia del método/ procedimiento/tratamiento.
Clase IIa: el peso de la evidencia/opinión está a favor de la utilidad/eficacia.
Clase IIb: la utilidad/eficacia está menos establecida por la evidencia/opinión.
Clase III: evidencia o acuerdo general de que el tratamiento método/procedimiento no es útil/efectivo y en algunos casos puede ser perjudicial.
Niveles de Evidencia
Nivel de evidencia A: evidencia sólida, proveniente de estudios clínicos aleatorizados o de cohortes con diseño adecuado para alcanzar conclusiones estadísticamente correctas y biológicamente significativas.
Nivel de evidencia B: datos procedentes de un único ensayo clínico aleatorizado o de grandes estudios no aleatorizados.
Nivel de evidencia C: consenso de opinión de expertos.
Con el objetivo de sintetizar este documento, se han tratado con mayor profundidad aquellos temas en los cuales la información científica de los últimos años justifica actualizaciones. Remitimos para todos los otros aspectos de tratamiento general, farmacológico y de excepción, al Consenso de Enfermedad de Chagas. Consejo de Enfermedad de Chagas "Dr. Salvador Mazza" Rev Argent Cardiol 2002;70(Supl 1):1-87.
Capítulo II. Comisiones de Trabajo - Integrantes
Coordinador General:
Dr. Jorge E. Mitelmanmtsac
Chagas agudo
Coordinadora: Dra. Amalia Descalzomtsac
Secretario: Dr. Felipe Niero
Integrantes:
Dr. Jorge Yanovsky
Dr. Rubén Carrizo Páez
Dr. Mario Carrizo Páez
Dr. Héctor Freilij
Dr. Jorge Pickenhayn
Dra. Gabriela Razzite
Dra. Adelina Riarte
Dr. Francisco Sosa
Dr. Alejandro Darío Deviggianomtsac
Chagas crónico sin patología demostrable
Coordinadora: Dra. Luisa Giménezmtsac
Secretario: Dr. Edgardo Schapachnik
Integrantes:
Dr. Luciano Acuña
Dra. Regina Álbarez
Dr. Sergio Augermtsac
Dr. César Berenstein
Dra. Graciela Adriana Ávila
Dr. Marcelo Benassimtsac
Dr. Jorge Franchella
Dr. Alberto Lifschitz
Dr. Guillermo Marconcini
Dr. Federico Núñez Burgos
Dr. Javier Núñez Burgos
Dr. Marcos P. Tomasella
Dr. Jorge Sánchez Hernández
Dra. Dorita Serra
Dr. Alejandro Díaz
Dr. Néstor I. Singh
Dra. Mónica Galli
Dra. Liliana Bonelli
Chagas crónico con patología demostrada
Arritmias
Coordinador: Dr. Ricardo Pescemtsac
Secretaria: Dra. Elina Valero de Pescemtsac
Integrantes:
Dr. Marcelo Elizarimtsac
Dr. Alberto Ginigermtsac
Dr. Jorge González Zuelgaraymtsac
Dr. Enrique Retykmtsac
Dra. Cristina Tentori
Dr. Carlos Goldberg
Miocardiopatía dilatada chagásica e insuficiencia cardíaca
Coordinador:
Dr. Horacio Romero Villanueva
Secretario:
Dr. José Luis Barisanimtsac
Integrantes:
Dr. Luis Ahualli
Dr. Jorge Traininimtsac
Dr. Miguel Ángel De Rosa
Dr. Gabriel Dionisio
Dra. Mónica Gilli
Dr. Guillermo López Soutric
Dra. Karina Palacios
Dra. Marta Ruggiero
Dr. Gastón Gómez
Consejo Asesor
Dr. Horacio Faellamtsac
Dr. Daniel José Piñeiromtsac
Dr. Simón Salzbergmtsac
Dr. Néstor Pérez Baliñomtsac
Dr. Osvaldo Masolimtsac
Dr. Álvaro Sosa Liprandimtsac
Dra. Liliana Grinfeldmtsac
Comité Redactor
Dr. Ricardo Pescemtsac
Dra. Elina Valero de Pescemtsac
Dra. Luisa Giménezmtsac
Dr. Marcos Tomasella
Dr. Luciano Acuña
Dr. Sergio Augermtsac
Área de Consensos y Normas de la SAC
Dr. Eduardo Sampó (Director)mtsac
Dr. Gustavo Giuntamtsac
Capítulo III. Introducción
Situación Vectorial de la Enfermedad de Chagas en la Argentina
La enfermedad de Chagas es una tripanosomiasis que en su forma crónica compromete a extensos sectores de la comunidad, que para su diagnóstico y tratamiento requieren un fácil acceso a los sistemas de salud. Por su morbimortalidad y su impacto socioeconómico constituye una de las enfermedades con mayor carga global en la región.
Según estimaciones recientes, la población de América Latina expuesta al riesgo de infección por Trypanosoma cruzi supera los 108 millones, el número de pacientes infectados es mayor de 7 millones y los nuevos casos agudos vectoriales por año se estimaron en 41.200 personas.
En julio de 1991, en la Tercera Reunión de Ministros de Salud del Cono Sur, los seis Estados Miembros -Argentina, Bolivia, Brasil, Chile, Paraguay y Uruguay-, en el marco de la Iniciativa en Salud de los Países del Cono Sur realizada en Brasilia (Brasil), se elaboró y aprobó la Resolución 04-3-CS del Control de Enfermedades Zoonóticas, que creó una comisión intergubernamental para la enfermedad de Chagas, con el apoyo de la Organización Panamericana de la Salud (OPS). Su objetivo fue la elaboración de un Plan de Acción Subregional para la eliminación de Triatoma infestans domiciliario, el vector más importante en el Cono Sur, y la interrupción de la transmisión de T. cruzi por transfusión sanguínea. Esta iniciativa intergubernamental, con el apoyo de OPS/OMS, tuvo amplio impacto sanitario en cinco de los seis Estados Miembros del Cono Sur, en los que el accionar continuo redujo drásticamente la población de T. infestans y mejoró la seguridad de la sangre a transfundir. Dentro de esta iniciativa se desarrollaron Programas Nacionales para cumplir con las metas de la Iniciativa del Cono Sur (INCOSUR) y el apoyo político de los diferentes gobiernos fue esencial para la provisión de fondos económicos destinados a la prevención y el control de la enfermedad de Chagas en los diferentes países. Así, en 1997, Uruguay fue el primer país en realizar el corte de la transmisión vectorial y transfusional en toda su área endémica. En 1999, Chile fue el segundo país miembro que certificó el corte de la transmisión vectorial.
En el año 2000, Brasil certificó la interrupción en 6 de los 13 estados de este país, y progresivamente en diferentes estados hasta que, en el 2006, el estado de Bahía fue el último en certificar la interrupción, por lo que Brasil fue declarado libre de transmisión por el vector. Un hecho relevante para el vecino país, que lo logró antes de que se cumplan 100 años de la descripción de la enfermedad por Carlos Chagas.
En el 2001, la Argentina interrumpe la transmisión vectorial en cinco provincias endémicas: Jujuy, Río Negro, La Pampa, Neuquén y Entre Ríos.
La INCOSUR produjo un descenso en la infestación domiciliaria del vector en todos los países miembros del Cono Sur.
En los países del Cono Sur, el principal vector de la enfermedad de Chagas es Triatoma infestans, que tiene hábitos exclusivamente domiciliarios, ya que coloniza el interior y el peridomicilio de las viviendas humanas. Los programas de control de la transmisión se han basado tradicionalmente en la fumigación de las viviendas con insecticidas de efecto residual y en la vigilancia continua de su reinfestación por los triatominos. La implementación de la vigilancia en forma sostenida induce una reducción de la infección natural y también de otras formas de transmisión, como las vías transfusional y congénita.
Situación actual en la Argentina
Hasta 1997, las acciones de control vectorial realizadas en nuestro país mostraron una reducción del 92% en la tasa de infestación domiciliaria en todas las provincias endémicas. Esta reducción tuvo su necesaria correlación en la disminución de la infección humana, que se evidenció en el descenso de la infección por T. cruzi en jóvenes de 18 años del 5,8% en 1983 al 1% en 1996.
A pesar de estos logros, la escasa prioridad política a nivel nacional y provincial en políticas de salud y sus consecuencias, es decir, un presupuesto económico menor en las acciones de control vectorial de ataque y vigilancia sostenida, provocaron un incremento de la endemicidad en la Argentina con su indicador más preciso: el aumento en el número de casos agudos de origen vectorial.
El enorme desafío para el gran objetivo de eliminación del vector es el control de la transmisión vectorial del Gran Chaco, ecosistema que involucra a Paraguay y Bolivia, pero cuya mayor extensión pertenece a la Argentina. En esta zona hiperendémica para la enfermedad de Chagas se demostró recientemente resistencia de Triatoma infestans a los piretroides.
Capítulo IV. Chagas Agudo
Vías de Transmisión
1. Chagas vectorial
La infección es transmitida por insectos hemípteros hematófagos de la subfamilia Triatominae, comúnmente llamados vinchucas.
Existen alrededor de 130 especies de triatominos y en más de la mitad de ellas se ha demostrado la infección por T. cruzi. Se considera que en la Argentina existen 17 especies distribuidas en tres géneros: Psamolestes, Panstrongylus y Triatoma.
Psamolestes: coreodes.
Panstrongylus: megistus, guentheri, geniculatus y rufotuberculatus.
Triatoma: breyeri, delpontei, garciabesi, infestans, limai, melanosoma, plantensis, eratyrusiformis, rubrovaria, patagónica, guasayana y sordida.
Estas especies difieren en importancia epidemiológica según su hábitat, densidad poblacional y distribución geográfica. En nuestro país T. infestans es el único triatomino domiciliado y, por lo tanto, el único de importancia epidemiológica. Otras especies, como T. guasayana, T. sordida, T. eratyrusiformis y T. patagónica, si bien son especies silvestres y peridomiciliarias, frecuentemente invaden y en algunos casos colonizan la vivienda; estas especies se han hallado infectadas por T. cruzi.
Las demás especies son silvestres y/o peridomiciliarias y no colonizan las viviendas, por lo que carecen de importancia en el ámbito de la salud pública.
La infección se produce por medio de las deyecciones contaminantes de estos insectos que penetran por las excoriaciones de la piel producidas por el rascado luego del escozor que causa la picadura de la vinchuca (Figura 1).

Figura 1. Ciclo evolutivo de Trypanosoma cruzi.

Fig. 1. Algoritmo de diagnóstico y tratamiento del Chagas congénito.
Luego de ingresar al organismo a través de una puerta de entrada cutánea o mucosa, los tripanosomas se diseminan por vía hemática o linfática y alcanzan distintas vísceras. En los tejidos, el protozoo se reproduce por división binaria, multiplicándose y pasando por una forma no flagelada, llamada amastigota. En cada localización se producen fenómenos complejos de destrucción, de reacción inflamatoria e inmunopatológicos que prolongan la enfermedad.
Sin embargo, esta forma tradicional de transmisión vectorial en áreas rurales se ha modificado debido a las migraciones internas y epidemiológicamente fue reemplazada por la contaminación humana-humana en áreas urbanas, en donde el pasaje tiene lugar a través de la sangre del infectado al sano, sin intervención de la vinchuca. Esto ha dado origen al llamado 4.º ciclo o urbanización de la enfermedad de Chagas, caracterizado por el contagio por vías connatal, transfusional y de trasplante de órganos.
La tripanosomiasis cruzi tiene distintas etapas: comienza con una fase aguda que se caracteriza por un síndrome febril-infeccioso, le sigue una fase crónica, que puede no tener patología evidente o evolucionar con lesiones manifiestas e irreversibles, sobre todo a nivel cardíaco.
Otra peculiaridad de esta entidad es el largo tiempo que generalmente transcurre entre el período agudo y las alteraciones del período crónico, que se producen a 20, 40 o más años después del comienzo de la enfermedad.
La importancia sanitaria y demográfica de la enfermedad de Chagas estriba en que produce formas de enfermedad mortal tanto en la infancia como en la adultez.
Ante un supuesto caso de forma aguda vectorial de la enfermedad se aconseja, siguiendo normas nacionales, evaluar la siguiente información:
- Antecedentes epidemiológicos y ecológicos (conocimiento del vector, características de la vivienda, lugar de residencia, lugar de nacimiento/procedencia, viajes a zonas endémicas, etc.).
- Presencia del síndrome febril prolongado, taquicardia, que no ceden con medicación convencional.
La presentación clínica puede ser sintomática, oligosintomática o asintomática (Tabla 1) y la infección aguda puede tener distintas formas de comienzo (Tabla 2).
Tabla 1. Expresión clínica en la fase aguda

Tabla 2. Clasificación de las formas de comienzo de la infección aguda

Las expresiones clínicas graves de la fase aguda son miocarditis y meningoencefalitis.
Los signos típicos de presentación representan menos del 5% de los cuadros agudos de enfermedad de Chagas.
En niños menores de 1 año con manifestación de miocarditis, meningoencefalitis con líquido claro o manifestaciones convulsivas febriles o afebriles, sobre todo en un área endémica, existe la obligación de confirmar o descartar la etiología chagásica por investigación del parásito en sangre y en líquido cefalorraquídeo.
2. Transplacentaria (congénita)
Clase I. Nivel de evidencia A
Para que se produzca una infección transplacentaria debe existir parasitemia. T. cruzi produce una infección persistente en el huésped, por lo cual el parásito puede hallarse en la sangre periférica tanto en la fase aguda como en la crónica. Este hecho biológico determina que una mujer gestante pueda transmitir la infección en cualquiera de estos dos períodos. Por lo tanto, una mujer serológicamente positiva puede dar a luz niños con infección congénita en un solo embarazo o en gestas sucesivas.
T. cruzi alcanza al producto de la concepción por vía sanguínea luego de su pasaje, por mecanismo activo, a través de la placenta. En las células de Hofbauer, el tripomastigota se transforma en amastigota, que se multiplica hasta ser liberado nuevamente como tripomastigota. Estas formas atraviesan el trofoblasto y producen la infección del embrión o feto. La infección puede ocurrir aun antes del 4.º mes de gestación cuando el epitelio trofoblástico presenta mayor desarrollo.
La prevalencia de este tipo de transmisión sigue siendo elevada en razón de que un gran número de mujeres embarazadas que concurren a hospitales y clínicas, ya en trance de parto, ignoran su condición de chagásicas crónicas, y su seropositividad se advierte recién en ese momento.
El cuadro clínico de los niños con enfermedad de Chagas congénita puede clasificarse en asintomático y sintomático; a su vez, este último se divide en precoz y tardío, según los síntomas aparezcan antes o después de los 30 días de vida. Las manifestaciones clínicas varían ampliamente; comprende desde niños prematuros con sintomatología importante y mortalidad elevada hasta niños de término asintomáticos.
Los niños pueden presentar compromiso inespecífico del estado general, hipotonía muscular, fiebre y, frecuentemente, hepatoesplenomegalia. En casos aislados se observan cuadros de insuficiencia cardíaca y, más rara vez, de meningoencefalitis con crisis convulsivas.
Para el diagnóstico de la infección chagásica congénita se debe efectuar la búsqueda del parásito por técnicas parasitológicas directas en todo recién nacido de una mujer chagásica. En los mayores de 6 meses de edad se agregará el estudio serológico utilizando al menos dos técnicas.
La positividad serológica, luego de los 6 meses de vida, como método diagnóstico de Chagas congénito tiene valor fuera del área endémica, dado que dentro de ella es imposible descartar la transmisión vectorial aun cuando no exista una puerta de entrada aparente.
En la Tabla 3 se señalan las manifestaciones clínicas para tener en cuenta en todo recién nacido con sospecha de padecer Chagas congénito (Clase I).
La secuencia a seguir en el diagnóstico y el tratamiento del Chagas congénito a partir de la serología reactiva de la madre se esquematizan en la Tabla 3 y la Figura 1.
3. Chagas transfusional
Clase I. Nivel de evidencia A
En Latinoamérica, la enfermedad de Chagas transfusional constituye la tercera forma más importante de transmisión de T. cruzi. Esta vía de ingreso de tripanosomas proviene de transfusiones de sangre de dadores infectados, asintomáticos y que ignoran su padecimiento.
Dada la gran migración de individuos de zonas rurales a los centros urbanos, éstos incorporan poblaciones serológicamente positivas. Esto incrementa el riesgo de transmisión de la infección por la vía transfusional con los potenciales dadores y constituye la principal causa de contagio en las grandes ciudades.
El período de incubación en el Chagas transfusional varía entre 28 y 116 días (Tabla 4).
Tabla 4. Chagas transfusional agudo. Cuadro clínico y elementos diagnósticos. Clase I. Nivel de evidencia A
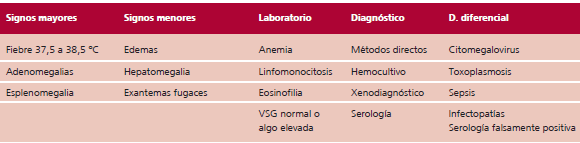
* Por la ley 22.990 (año 1983), en la Argentina se controla obligatoriamente la sangre de los donantes (HAI-ELISA). Ante un resultado positivo se descarta la sangre y se comunica al donante la necesidad de control médico por serología positiva.
Chagas e inmunosupresión: la inmunodeficiencia por diversos cuadros infecciosos como el SIDA producen manifestaciones clínicas graves en diferentes órganos que deben detectarse y tratarse precozmente (Clase I. Nivel evidencia A).
En los sometidos a trasplante se debería conocer su reactividad para Trypanosoma cruzi, atento que las reactivaciones, así como las infecciones, tienen una respuesta favorable al tratamiento precoz (Clase I. Nivel de evidencia A).
Últimamente han cobrado relevancia casos agudos graves (con óbitos) adquiridos por vía oral relacionados con la ingesta de jugos en Brasil (año 2005 en Santa Catarina) y en Venezuela (año 2010 en Caracas).
DIAGNÓSTICO DE LABORATORIO
Clase I. Nivel de evidencia A
Etapa aguda
El diagnóstico de certeza está dado por el hallazgo de Trypanosoma cruzi, pero también se debe considerar la realización de una serología para descartar o no la existencia previa de un contacto con el parásito (Figura 2).

Fig. 2. Algoritmo diagnóstico de laboratorio en la etapa aguda.
Etapa crónica con y sin patología demostrable
En la etapa crónica, ya sea con o sin patología demostrable, el diagnóstico de laboratorio es muy importante. Aquí se debe considerar la escasa o nula concentración de parásitos circulantes y la presencia de anticuerpos contra Trypanosoma cruzi en el suero del individuo (Figura 3).
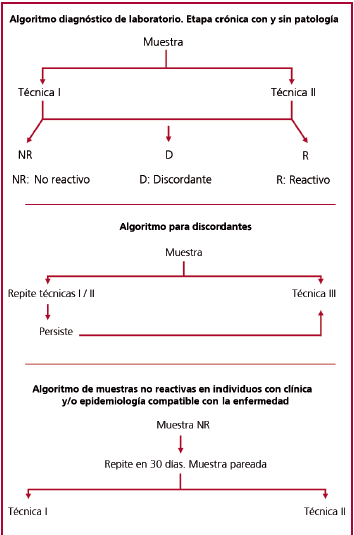
Fig. 3. Algoritmos diagnósticos de laboratorio. Etapa crónica con y sin patología. AP : Aglutinación con partículas de gelatina. HAI: Hemaglutinación indirecta. ELISA: Enzimoinmunoensayo. IFI: Inmunofluorescencia indirecta.
Capítulo V. Fisiopatología
CHAGAS CRÓNICO
Clasificación clínica de la enfermedad de Chagas-Mazza
Véase la clasificación en la Tabla 5.
Tabla 5. Clasificación clínica de la enfermedad de Chagas-Mazza

Consideraciones de la Patogenia en la etapa crónica
Mecanismos postulados:
- Agresión parasitaria directa o a través de una neuraminidasa.
- Teoría microvascular.
- Teoría inmunológica.
- Teoría neurogénica.
Los fenómenos resultantes del daño miocárdico serían: a) alteraciones de la motilidad de carácter segmentario y global, b) arritmias y trastornos de la conducción (por lesiones del sistema excitoconductor), c) incompetencia de las válvulas (por regurgitación valvular), d) insuficiencia cardíaca.
Alteraciones en la microcirculación, disfunción endotelial e isquemia en la etapa crónica sin patología demostrable (ex período indeterminado)
Ya desde las descripciones originales se mencionaba el hallazgo de alteraciones en los pequeños vasos coronarios en las necropsias de pacientes fallecidos por la enfermedad. Miguel Jörg describía una "capilaritis universal".
Entre los autores contemporáneos cabe mencionar en primer lugar la descripción de P. Cossio y su grupo del anticuerpo contra el endotelio, las estructuras vasculares y el intersticio muscular (EVI), tanto en casos agudos como crónicos y también en estudios experimentales; en algunos casos estudiados con biopsia y con el EVI reactivo se demostraron lesiones compatibles con hipoxia celular.
Tanowitz y colaboradores, hace ya más de 30 años, destacaron la precocidad del hallazgo de alteraciones en la microcirculación tanto en modelos experimentales como en cultivos de células endoteliales de pacientes parasitados. También llamaron la atención sobre el espasmo y la trombosis en la microcirculación desde los más precoces estadios agudos.
Recientemente, Rossi señaló las alteraciones microvasculares como causa del desarrollo de la miocardiopatía chagásica en un proceso evolutivo prolongado, relacionándolo con un deterioro en el balance autonómico.
Marín-Neto y Simões analizaron el papel que desempeña la microcirculación en la evolución de la enfermedad de Chagas en su etapa crónica, con especial énfasis en señalar la patología microvascular como principal determinante de las lesiones que caracterizan a los estadios más avanzados de la cardiopatía, en combinación con las alteraciones del sistema nervioso autónomo. Al cabo de 5 años de seguimiento, los pacientes carentes de manifestaciones de compromiso orgánico en los cuales se detectó disfunción endotelial presentaban una caída significativa de la fracción de eyección en relación con aquellos otros en los que la disfunción endotelial no era evidente.
También el grupo de Acquatella y Palacios mostró en pacientes chagásicos con arterias coronarias angiográficamente normales que evolucionaban con dolor precordial e incluso presentaban signos electrocardiográficos de infarto de miocardio o presencia de aneurismas ventriculares, una reacción paradójica a la inyección intracoronaria de acetilcolina, evidencia de disfunción endotelial en el territorio microvascular.
En el terreno molecular, el Instituto Fatala Chabén llama la atención sobre el papel de las interleucinas 1 y 6 en el daño a las células del endotelio y pone de manifiesto que estas citocinas intervienen en la progresión de la enfermedad por vía del daño endotelial. Asimismo, se postula el papel de la endotelina 1 en la vasoconstricción que acompaña a estos fenómenos. Las alteraciones de la microvasculatura demuestran trombos oclusivos plaquetarios en vasos coronarios subepicárdicos e intramurales.
Disautonomía
Amorin y colaboradores, en estadios precoces de la enfermedad, utilizaron la ergometría y el tilt test para estudiar los efectos del sistema nervioso autónomo de estos pacientes; afirman que sus resultados son acordes con los postulados de la desnervación neuronal y el deterioro autonómico.
Junquera Jr. llamó la atención por primera vez en la literatura referente a enfermedad de Chagas sobre la relación entre la disautonomía y la muerte súbita.
Entre 1994 y 1997, Sterin-Borda y Borda y colaboradores publicaron varios trabajos en los que pusieron de manifiesto el papel de los anticuerpos contra receptores ya sean betaadrenérgicos o muscarínicos. Se señala la relación entre esta detección y la presencia de bradicardia y otras manifestaciones disautonómicas. Ribeiro y colaboradores concluyeron que la disautonomía parasimpática es un fenómeno precoz que precede a la disfunción ventricular. Iosa y colaboradores estudiaron las perturbaciones del sistema autonómico, a las que definieron como cardioneuropatía.
La pérdida neuronal ocurre fundamentalmente en la etapa aguda de la enfermedad. La disautonomía parasimpática es un proceso precoz que puede estar presente antes de que sea evidente la disfunción ventricular sistólica y que se ha relacionado con la presencia de arritmias malignas y muerte súbita.
Fisiopatología de la insuficiencia cardíaca
Una vez que se instala una sobrecarga hemodinámica excesiva sobre los ventrículos, se pone en marcha una serie de mecanismos adaptativos, tanto hemodinámicos como neurohormonales, que tratan de mantener la función de bomba. De esta forma, la dilatación ventricular, la hipertrofia de la pared ventricular y la activación del sistema simpático, del sistema reninaangiotensina- aldosterona, la hormona antidiurética y el péptido natriurético auricular actúan como factores compensadores.
La hipertrofia miocárdica se desarrolla como respuesta a una sobrecarga hemodinámica. El incremento del estrés de la pared ventricular lleva a la inducción de protooncogenes específicos que sintetizan miofibrillas. A su vez, el incremento de sarcómeros lleva al engrosamiento de la pared, lo que reduce el estrés ventricular al distribuirse el exceso de tensión entre el número mayor de sarcómeros. Además, en la hipertrofia patológica que se asocia con la insuficiencia cardíaca no sólo aumentan los sarcómeros, sino también los fibroblastos y la matriz colágena intersticial, que contribuyen al aumento del grosor de la pared. Este aumento del colágeno total y del cociente colágeno tipo I/III (el tipo I da mayor rigidez al corazón) favorece la insuficiencia cardíaca diastólica.
En la miocardiopatía dilatada chagásica tienen un papel fundamental la fibrosis, la lesión microvascular y la remodelación miocárdica. La primera sería la mayor responsable de la pérdida progresiva de la capacidad contráctil del corazón y la segunda, a través de la desorganización de la red capilar por infiltración inflamatoria y el daño capilar, sería un factor coadyuvante de la miocitólisis focal con posterior fibrosis.
El mayor hallazgo histopatológico en la forma dilatada de la cardiopatía chagásica crónica es la presencia de una miocarditis difusa con intenso daño tisular y muy escasa presencia de formas de T. cruzi; esto se halló en todas las autopsias y en el 93% de las biopsias endomiocárdicas. Así, la hipótesis de la patogenia autoinmune parecería indicar que si bien la presencia de T. cruzi sería capaz de producir cierto grado de inflamación, ésta no sería un estímulo suficiente para producir una miocardiopatía dilatada. La escasa presencia de parásitos en la miocardiopatía dilatada chagásica llevó a los investigadores a inferir que los linfocitos podían reconocer un componente específico del tejido miocárdico y generar contra él una reacción de tipo inmunidad retardada como resultado de la infección crónica por T. cruzi.
Fisiopatología de las arritmias
La fisiopatología de la muerte súbita en la miocardiopatía dilatada chagásica no difiere, en general, de las miocardiopatías dilatadas de otro origen. En esta etapa de la enfermedad tienen un papel importante la disminución de la contractilidad del ventrículo izquierdo, la mala fracción de eyección y, en muchos casos, la presencia de aneurisma de punta que genera arritmias ventriculares malignas. Así también, la presencia de múltiples focos de fibrosis favorece la génesis de arritmias ventriculares por reentrada. Dentro de los factores moduladores, la hiperactividad adrenérgica y las alteraciones iónicas (de origen farmacológico) pueden precipitar la muerte súbita. Por otra parte, la disfunción autonómica tiene una acción importante en la génesis de muerte súbita, ya que la inervación no uniforme del corazón del paciente chagásico puede dar por resultado una dispersión mayor de la refractariedad ventricular. La disautonomía generaría bradicardias extremas y efectos sobre la conducción cardíaca, que muchas veces es responsable de la aparición de cuadros sincopales y muerte súbita.
La mayor activación del sistema de la coagulación a través de la correlación positiva entre los niveles de fibrinopéptido A y el complejo trombina-antitrombina III junto con el aumento del volumen telediastólico del ventrículo izquierdo favorecen la situación de hipercoagulabilidad que condiciona la trombosis intramural y los eventos embólicos.
La apoptosis de los miocitos puede contribuir a la pérdida celular acelerada en pacientes con cardiopatía avanzada; así, la activación del sistema angiotensinaaldosterona, la hipertrofia y la dilatación también pueden ser estimuladas por genes específicos que provocan apoptosis prematura.
Capítulo VI. Chagas crónico sin patología demostrable
DEFINICIÓN
El período crónico sin patología demostrable (ex período indeterminado) de la enfermedad de Chagas se define como la etapa preclínica, subclínica o inaparente en la que los pacientes tienen serología positiva para Chagas, carecen de síntomas clínicos, el examen físico cardiovascular y del aparato digestivo no demuestran signos patológicos manifiestos y los estudios complementarios realizados (electrocardiograma, telerradiografía de tórax, prueba de esfuerzo; Holter, ecocardiograma, etc.) son normales según lo establecido para cada práctica.
CONCEPTO DE ETAPA CRÓNICA SIN PATOLOGÍA DEMOSTRABLE
1. Antecedente epidemiológico.
2. Serología positiva (hemaglutinación indirecta; inmunofluorescencia; ELISA).
3. Examen clínico cardiovascular normal.
4. Exámenes complementarios: normales.
- Electrocardiograma de 12 derivaciones.
- Telerradiografía de tórax.
- Ergometría.
- Ecocardiograma bidimensional Doppler.
- Holter de 24 horas.
5. Aparato digestivo normal.
6. Estudios complementarios: digestivos según criterio médico.
La simple presencia de serología reactiva debe considerarse como un factor de riesgo de desarrollo de miocardiopatía y aun de muerte súbita. Por lo tanto, todo paciente con serología positiva debe ser incorporado en prevención secundaria. La serología es una herramienta importante de diagnóstico y vigilancia epidemiológica. El hallazgo de alteraciones endoteliales o disautonómicas permitiría identificar a pacientes vulnerables o con riesgo de presentar miocardiopatía en un lapso variable en años que deberán ser incluidos en prevención secundaria a pesar de no presentar manifestaciones clínicas objetivables con la metodología actual. Por ello, este Consenso, con la finalidad de retrasar o impedir la enfermedad, propone flujogramas para la detección de alteraciones precoces. La detección de estas alteraciones fisiopatológicas permitirá, en el futuro, crear algoritmos no sólo de diagnóstico, sino también de tratamiento.
A la estrategia de eliminación del vector debe agregarse la educación de la población sobre la necesidad del control periódico.
Las nuevas tecnologías diagnósticas permiten detectar poblaciones críticas, que deberán originar estrategias diferentes en salud pública, con médicos entrenados en atención primaria, cardiología y prevención, educando a la comunidad sobre la naturaleza de esta enfermedad. Conjuntamente, el Estado debe establecer políticas de desarrollo económico e inclusión social en forma sostenida.
METODOLOGÍA DE ESTUDIO
- Serología para Chagas (Clase I. Nivel de evidencia A).
- Estudios de laboratorio básicos: hemograma, glucemia, urea, creatinina, colesterol, hepatograma y orina.
- Electrocardiograma de 12 derivaciones (Clase I. Nivel de evidencia A).
- Telerradiografía de tórax (Clase I. Nivel de evidencia A).
- Prueba de esfuerzo graduada según protocolo incremental (Clase I. Nivel de evidencia C). Análisis de alternancia onda T.
- Electrocardiografía dinámica sistema Holter de 24 horas. Análisis de la variabilidad de la frecuencia cardíaca (Clase I. Nivel de evidencia C). Análisis de la dispersión del intervalo QT (Clase IIb. Nivel de evidencia C). Análisis de la turbulencia de la frecuencia cardíaca.
- Ecocardiograma bidimensional (Clase I. Nivel de evidencia C).
- Ecocardiograma-Doppler (Clase I. Nivel de evidencia C).
- Exploración del sistema nervioso autónomo(Clase I. Nivel de evidencia C):
- Maniobra postural activa.
- Prueba de la hiperventilación.
- Maniobra de Valsalva.
- Tilt test.
- Anticuerpos antirreceptores muscarínicos.
- Exploración del endotelio (Clase I. Nivel de evidencia C):
- Trombomodulina.
- Eco-Doppler braquial:
- En centros de mayor complejidad, según criterio médico (Clase IIb. Nivel de evidencia C):
- Estudios con radiotrazadores: perfusión miocárdica SPECT gatillado con Tc 99 sestamibi en reposo y esfuerzo, para evaluar en forma simultánea la perfusión y la función ventricular.
- Resonancia magnética cardíaca con gadolinio para la evaluación de la presencia o no de miocarditis.
- Péptido natriurético tipo B (BNP).
- Evaluación del sustrato anatómicomiocárdico
- Electrocardiograma de señal promediada (Clase IIb. Nivel de Evidencia B).
- Estudio de la fibrosis (Clase IIb. Nivel de evidencia C).
Estudios pertinentes en caso de patología cardíaca de otro origen o comorbilidades:
- Estudios invasivos (Clase III. Nivel de evidencia B).
- Estudio electrofisiológico (Clase III. Nivel de evidencia B).
- Estudio hemodinámico y cinecoronariografía (Clase III. Nivel de evidencia B).
- Biopsia endomiocárdica (Clase III. Nivel de evidencia B).
- Estudio del aparato digestivo: según criterio gastroenterológico.
TRATAMIENTO ETIOLÓGICO CON DROGAS PARASITICIDAS
Su utilidad está comprobada (negativización serológica) hasta los 14 años de vida (Clase I. Nivel de evidencia B). Ante la falta de evidencia en edades mayores, la indicación debe ser consensuada con el paciente informándole los resultados terapéuticos aún no totalmente confirmados y los efectos adversos (Clase IIb. Nivel de evidencia C).
a) Nifurtimox 8 a 10 mg/kg./día durante 60 días.
b) Benznidazol 5 mg/kg/día durante 30 a 60 días.
CONTROL Y SEGUIMIENTO
Clase I. Nivel de evidencia C.
Sin alteración comprobada:
Cada 12 meses: examen clínico cardiovascular, electrocardiograma convencional, telerradiografía de tórax, ergometría, estudio Holter de 24 horas y ecocardiograma en modo M y bidimensional.
Es importante señalar:
1. Todo paciente con serología positiva debe ingresar a un plan de prevención secundaria.
2. La ley 26.281 en su artículo 5.º prohíbe realizar reacciones serológicas para determinar la infección chagásica a los aspirantes a cualquier tipo de empleo o actividad laboral.
3. Los pacientes crónicos sin patología demostrable pueden trabajar normalmente.
4. Pueden realizar deportes normalmente de acuerdo con su capacidad funcional.
5. No pueden donar sangre.
6. Los recién nacidos cuyas madres se encuentran en este período deben ser estudiados parasitológicamente. La madre deberá ingresar a prevención secundaria.
7. El período crónico sin patología demostrable es sumamente prolongado. La enfermedad se manifiesta sólo en el 20/30% de los pacientes.
Si bien en el ámbito rural las condiciones culturales y socioeconómicas no son ideales para el tratamiento de una enfermedad crónica de evolución a tan largo plazo, será prudente que el médico rural derive al paciente para la realización de controles periódicos a centros de mayor complejidad y garantizar así el acceso a un diagnóstico precoz. La atención primaria no debe ser necesariamente primitiva.
Capítulo VII. Arritmias en la enfermedad de Chagas
En esta sección se tratan los trastornos electrocardiográficos relacionados con la enfermedad de Chagas fuera del período agudo.
METODOLOGÍA DE ESTUDIO
- Detectado un paciente con serología positiva se deberá establecer cuál es el grado de enfermedad cardíaca.
El valor de la ecocardiografía y el Doppler en la enfermedad de Chagas con arritmias (Clase I. Nivel de evidencia A) radica en:
1. Detección precoz de alteraciones de los diámetros ventriculares y su posterior seguimiento en la etapa subclínica de la enfermedad.
2. Determinación de la función sistólica y diastólica.
3. Establecer alteraciones de motilidad parietal con zonas de hipocinesia, acinesia y/o discinesia.
4. Detección de aneurismas ventriculares y trombos intracavitarios.
5. Presencia de derrame pericárdico.
- Ergometría (Clase I. Nivel de evidencia A).
Se analizan:
1. Existencia de trastornos de conducción intraesfuerzo o en el período de recuperación (auriculoventriculares y/o intraventriculares).
2. Detección de arritmias auriculares y ventriculares.
3. Determinación de la capacidad funcional.
4. Evaluación del cronotropismo.
5. Comportamiento de la presión arterial.
- ECG dinámico sistema Holter de 24 horas (Clase I. Nivel de evidencia A).
- ECG de señal promediada (potenciales ventriculares tardíos) (Clase IIb. Nivel de evidencia C).
- Estudio electrofisiológico (Clase IIa. Nivel de evidencia C).
Permite investigar:
1. Función del nódulo sinusal.
2. Conducción intraauricular.
3. Conducción auriculoventricular e intraventricular.
4. Arritmias y su mecanismo.
- Exploración del sistema nervioso autónomo (Clase I. Nivel de evidencia C):
- Maniobra postural activa.
- Prueba de hiperventilación.
- Maniobra de Valsalva.
- Tilt test.
PERÍODO CRÓNICO CON TRASTORNOS ELECTROCARDIOGRÁFICOS
Estudios comunes a todos los trastornos del ritmo cardíaco
Clase I. Nivel de Evidencia A
1. Interrogatorio. Con especial atención en la sintomatología, hora del día en que se produjeron los síntomas, posición (de pie, supina, etc.), situación en que éstos ocurrieron (reposo, esfuerzo, relación sexual, etc.), situaciones psicológicas, etc. Evaluación de la acción medicamentosa y posibles efectos adversos.
2. Examen semiológico completo. Frecuencia cardíaca. Variación inspiratoria y espiratoria. Posición acostado y de pie.
3. Laboratorio de rutina incluyendo hormonas tiroideas.
4. ECG convencional de 12 derivaciones. Maniobras bradicardizantes y taquicardizantes (compresión del seno carotídeo, maniobra de Valsalva, estrés arritmogénico, ejercicio isométrico).
5. Registro electrocardiográfico continuo, sistema Holter. Variabilidad de la frecuencia cardíaca.
6. Telerradiografía de tórax (frente y perfil).
7. Ecocardiograma en modo M, bidimensional y Doppler.
Clase II
1. Estudios radioisotópicos (Nivel de evidencia B).
2. ECG de señal promediada (Nivel de evidencia C).
3. Sistemas de monitorización implantables. Ante síncope recurrente y/o con traumatismos, con causa no demostrada con los estudio previos (Nivel de evidencia C).
Disfunción del nódulo sinusal (estudios específicos)
A los estudios generales se agregan:
Clase I. Nivel de Evidencia A
1. Pruebas farmacológicas (atropina, isoproterenol).
2. Estudio electrofisiológico. Indicado cuando existe discordancia entre síntomas y resultados de los estudios previos.
Trastornos de conducción auriculoventricular e intraventricular
Clase I. Nivel de evidencia A
1. Estudio electrofisiológico. Indicado cuando existe discordancia entre síntomas y resultados de los estudios previos.
Taquicardia ventricular
A los estudios generales se agregan:
Clase I. Nivel de Evidencia A
1. Estudios radioisotópicos.
2. Cinecoronariografía.
3. Estudio electrofisiológico con inducción de la arritmia si se plantea la duda con respecto a la arritmia padecida o se piensa en indicar ablación transcatéter.
Clase IIb. Nivel de evidencia C
1. ECG de alta resolución, señal promediada, variabilidad de la frecuencia cardíaca.
2. Biopsia endomiocárdica.
3. Resonancia magnética nuclear.
Tratamiento
Las arritmias y la insuficiencia cardíaca son dos aspectos que gobiernan la evolución de los pacientes afectados con enfermedad de Chagas en la etapa crónica:
1. Indicación de implante de marcapasos definitivo en pacientes con trastornos de conducción graves y/o enfermedad del nódulo sinusal.
2. Tratamiento farmacológico o no farmacológico de las arritmias ventriculares (TVS y/o TVNS).
3. Tratamiento eléctrico de la insuficiencia cardíaca (véase Insuficiencia cardíaca).
DISFUNCIÓN DEL NÓDULO SINUSAL
La indicación principal para esta entidad es el implante de un marcapasos definitivo.
Indicación de marcapasos
Clase I
1. Disfunción del nódulo sinusal irreversible, espontánea o inducida por fármacos necesarios e insustituibles, con síncopes, presíncopes o mareos y/o insuficiencia cardíaca relacionados con la bradicardia (Nivel de evidencia A).
2. Síndrome bradi-taqui sintomático (Nivel de evidencia A).
3. Bradi-taquiarritmia asintomática que requiere tratamiento antiarrítmico agregado (Nivel de evidencia B).
4. Intolerancia a los esfuerzos claramente relacionada con incompetencia cronotrópica (Nivel de evidencia B).
5. Síndrome bradi-taqui con arritmias auriculares paroxísticas y alta respuesta ventricular no controlables con tratamiento medicamentoso; se indica ablación del nódulo AV previo al implante de marcapasos (Nivel de evidencia B).
Clase II
1. Disfunción del nódulo sinusal asintomática con incompetencia cronotrópica con frecuencia menor de 40 latidos por minuto en vigilia (Nivel de evidencia B).
2. Bradiarritmia sinusal que desencadena o agrava una insuficiencia cardíaca, angina de pecho o taquiarritmia (Nivel de evidencia B).
Clase III
1. Disfunción del nódulo sinusal en pacientes asintomáticos (Nivel de evidencia B).
2. Disfunción del nódulo sinusal con síntomas independientes de la bradicardia (Nivel de evidencia B).
Recomendaciones para la indicación del modo de estimulación
Clase I
1. DDD/R si existe bloqueo AV avanzado (Nivel de evidencia A).
2. AAI/R con reversión automática a DDD/R si existe bloqueo AV avanzado intermitente (Nivel de evidencia B).
Clase IIb
1. VVI/R en ancianos en ausencia de conducción ventriculoauricular (Nivel de evidencia B).
2. AAI/R en presencia de conducción auriculoventricular e intraventricular normales. (Nivel de evidencia A).
Clase III
1. VVI/R, VDD/R en presencia de conducción retrógrada ventriculoauricular (Nivel de evidencia C).
2. AAI/R en presencia de bloqueo AV avanzado (Nivel de Evidencia C).
Recomendaciones para activar la respuesta en frecuencia
De acuerdo con la cardiopatía, las enfermedades asociadas y el estilo de vida.
Bloqueos Auriculoventriculares
Ante la indicación de un marcapasos y para establecer la modalidad de estimulación, deben tenerse en cuenta existencia de arritmias asociadas, la fracción de eyección del ventrículo izquierdo, la calidad de vida, la condición física del paciente y la necesidad de mantener la sincronía AV.
Bloqueo AV de primer grado
Clase I
1. Bloqueo AV de primer grado irreversible con mareos, presíncope o síncope cuyo estudio electrofisiológico muestra una localización intrahisiana o infrahisiana y con agravamiento por estimulación auricular o prueba farmacológica (Nivel de evidencia B).
Bloqueo AV de segundo grado
Clase I
1. Bloqueo AV de segundo grado sintomático permanente o intermitente, irreversible o provocado por drogas necesarias o insustituibles independientemente del tipo de localización con síntomas definidos de bajo flujo cerebral o insuficiencia cardíaca a consecuencia de bradicardia (Nivel de evidencia B).
2. Bloqueo AV de segundo grado tipo Mobitz II sintomático con QRS angosto (Nivel de evidencia B).
3. Bloqueo AV de segundo grado irreversible, asintomático, asociado con arritmias ventriculares que necesitan tratamiento con fármacos depresores de la conducción (Nivel de evidencia B).
Clase II
1. Bloqueo AV de segundo grado asintomático, permanente o intermitente (Nivel de evidencia B).
2. Bloqueo AV de segundo grado tipo Mobitz II con QRS angosto, asintomático, permanente o intermitente (Nivel de evidencia B).
Clase III
1. Bloqueo AV de segundo grado tipo I asintomático con aumento de la frecuencia cardíaca y mejoría de la conducción AV con el ejercicio físico y/o atropina intravenosa (Nivel de evidencia B).
Bloqueo AV de tercer grado
Clase I
1. Bloqueo AV completo sintomático, permanente o intermitente e irreversible (Nivel de evidencia A).
2. Bloqueo AV completo asintomático, irreversible, de localización intrahisiana o infrahisiana y con ritmo de escape intraventricular críticamente lento (Nivel de evidencia A).
3. Bloqueo AV completo asintomático, irreversible con QRS angosto, con arritmias ventriculares que necesitan antiarrítmicos depresores del automatismo (Nivel de evidencia B).
4. Bloqueo AV completo adquirido, irreversible, asintomático con frecuencia cardíaca inferior a 40 latidos por minuto durante períodos de vigilia, sin incremento durante la actividad diaria (Nivel de evidencia A).
5. Bloqueo AV completo irreversible, asintomático con períodos documentados de asistolia mayores de 3 segundos en período de vigilia (Nivel de evidencia A).
6. Bloqueo AV completo irreversible, asintomático con cardiomegalia progresiva (Nivel de evidencia B).
7. Bloqueo AV completo irreversible, permanente o intermitente como consecuencia de una ablación del nódulo AV (Nivel de evidencia A).
Clase III
1. Bloqueo AV completo transitorio por acción medicamentosa o química o cualquier otra causa reversible.
Recomendaciones para la indicación del modo de estimulación
Clase I
1. DDD/R con disfunción del nódulo sinusal y aurícula estable (Nivel de evidencia A).
2. DDD/R con conducción ventriculoauricular retrógrada (Nivel de evidencia B).
3. VVI/R con fibrilación auricular permanente (Nivel de evidencia B).
Clase II
1. VDD con función sinusal normal (Nivel de evidencia B).
Clase III
1. AAI/R o VVI/R con conducción retrógrada ventriculoauricular (Nivel de evidencia B).
2. VDD con disfunción del nódulo sinusal (Nivel de evidencia B).
Bloqueo Intraventricular
El bloqueo completo de rama derecha (BCRD) solo o asociado con hemibloqueo anterior izquierdo (HBAI) son los trastornos de conducción más comunes de la cardiopatía chagásica, aunque de escaso valor pronóstico. El bloqueo completo de rama izquierda (BCRI) y el hemibloqueo posterior izquierdo (HBPI) son poco frecuentes, pero su presencia se vincula con un pronóstico desfavorable.
Implante de marcapasos definitivo
Clase I
1. Bloqueo de rama bilateral alternante documentado asintomático o con síncope, presíncope o mareos recurrentes (Nivel de evidencia C).
Clase IIa
1. Intervalo HV mayor de 70 mseg espontáneo o con bloqueo intrahisiano o infrahisiano inducido por estimulación auricular o prueba farmacológica en pacientes con síncope, presíncope o mareos recurrentes sin causa predeterminada (Nivel de evidencia C).
2. Paciente asintomático con intervalo HV mayor de 100 mseg espontáneo (Nivel de evidencia C).
Clase IIb
1. Bloqueo de rama o bifascicular asociado o no con bloqueo AV de primer grado sin documentación de bloqueo AV completo paroxístico (Nivel de evidencia C).
Recomendaciones para la indicación del modo de estimulación
Clase I
1. VVI/R con fibrilación auricular permanente (Nivel de evidencia B).
2. DDD/R con disfunción sinusal (Nivel de evidencia B).
3. DDD/R con conducción VA retrógrada (Nivel de evidencia B).
Clase II
1. DDD/R con función sinusal normal sin conducción ventriculoauricular (Nivel de evidencia C).
2. VVI/R sin conducción ventriculoauricular retrógrada (Nivel de evidencia C).
3. VDD con aurícula estable y función sinusal normal (Nivel de evidencia C).
Clase III
1. AAI/R (Nivel de evidencia B).
2. VVI/R con conducción ventriculoauricular retrógrada (Nivel de evidencia B).
3. VDD con aurícula inestable o disfunción sinusal (Nivel de evidencia B).
ARRITMIAS VENTRICULARES
Prevención primaria
Recomendaciones para el implante de un cardiodesfibrilador en la prevención primaria de muerte súbita en pacientes con cardiopatía chagásica
Clase I
- Se indica el implante de un CDI en pacientes con disfunción ventricular o discinesias parietales asociadas con síncope no aclarado con TV/FV inducible en el estudio electrofisiológico, con independencia de la tolerancia hemodinámica (Nivel de evidencia B).
Clase IIa
- El implante de un CDI es razonable en pacientes con síncope de causa no aclarada y con disfunción o discinesia ventricular significativa (Nivel de evidencia C).
Prevención secundaria
Los sobrevivientes de un paro cardíaco por taquicardia ventricular o fibrilación ventricular tienen un alto grado de recurrencia dentro del año siguiente al evento. Durante muchos años se emplearon distintos tipos de drogas antiarrítmicas con el propósito de prevenir un nuevo episodio. La amiodarona demostró ser, probablemente la única, especialmente útil en pacientes con fracción de eyección mayor del 35-40%. Sin embargo, la introducción del CDI se considera hoy el avance más importante en el tratamiento de la recurrencia de estos episodios.
Recomendaciones para el implante de un cardiodesfibrilador en la prevención secundaria de muerte súbita en pacientes con cardiopatía chagásica
Clase I
1. Paro cardíaco por TV/FV de causa no reversible independientemente de la fracción de eyección y expectativa de vida de al menos 1 año (Nivel de evidencia A).
2. Se indica implante de un CDI en los pacientes que presentaron TV espontánea con disfunción ventricular (o discinesias parietales asociadas) independientemente de la tolerancia hemodinámica (Nivel de evidencia B).
3. Sobrevivientes de un paro cardíaco por TV/FV de causa no reversible con fracción de eyección > 35% y expectativa de vida de al menos 1 año (Nivel de evidencia B).
Clase IIa
1. Pacientes con TV sostenida espontánea de causa no reversible sin compromiso hemodinámico y con función ventricular normal (fracción de eyección> 35%) refractaria a otras terapéuticas y expectativa de vida de por lo menos 1 año.
2. Pacientes con síncope de causa indeterminada con inducción de TV sostenida hemodinámicamente inestable y expectativa de vida de por lo menos un año.
Clase III
1. TV incesante.
Taquicardia ventricular no sostenida (TVNS) (Nivel de evidencia C)
Intervienen cuatro variables: función ventricular, síncope no aclarado, TVNS e inducción en estudio electrofisiológico (EEF):
- Síncope no aclarado + TVNS + inducción TV/FV = CDI (Clase IIb).
- Síncope no aclarado + TVNS + mala función ventricular < 35% = CDI (Clase IIb).
- TVNS + mala función ventricular = EEF positivo CDI (Clase IIb).
- Negativo drogas antiarrítmicas (Clase IIb).
Las arritmias supraventriculares: rápidas no constituyen una circunstancia especial en la enfermedad de Chagas. Tanto cuando se presentan como un síndrome braditaquicárdico o como fibrilación auricular, taquicardia auricular, taquicardia supraventricular en el contexto de la miocardiopatía no difieren ni tienen ninguna particularidad por tratarse de Chagas. Su tratamiento, ya sea medicamentoso o invasivo, es el mismo que el señalado en el Consenso de Arritmias por el Consejo de Electrofisiología.
Capítulo VIII. Miocardiopatía Dilatada Chagásica - Insuficiencia Cardíaca
Epidemiología
Del total de pacientes infectados por T. cruzi, el 20% a 30% evolucionan hacia la cardiopatía y un 10% hacia la forma dilatada.
Miocardiopatía Chagásica Dilatada
La prevalencia según el estudio Remida es del 5,9%. Características: 1) cardiopatía dilatada, 2) predomina en hombres entre la cuarta y la sexta décadas, 3) muerte entre los 30 y los 50 años, 4) complicaciones: arritmias (taquiarritmias y bradiarritmias), insuficiencia cardíaca biventricular (prevalencia según el estudio Hospital: 5,47%) y tromboembolia.
Clínica de la insuficiencia cardíaca en la enfermedad de Chagas
Véase la Tabla 6.
Tabla 6. Clínica de la miocardiopatía crónica chagásica

Metodología de estudio
Los procedimientos diagnósticos en el paciente con miocardiopatía chagásica crónica están dirigidos a: 1) el diagnóstico de certeza de insuficiencia cardíaca, 2) las causas desencadenantes o agravantes, 3) estudios de alteración de la función ventricular, 4) evaluación de alteraciones funcionales, 5) evaluación de la respuesta terapéutica, 6) criterios evolutivos y pronósticos. En este tema en particular se evaluará la metodología de estudio en pacientes chagásicos dilatados en presencia de: a) insuficiencia cardíaca descompensada y b) insuficiencia cardíaca crónica.
A. Insuficiencia cardíaca descompensada
Clase I
1. Examen semiológico completo.
2. Electrocardiograma convencional de 12 derivaciones.
3. Laboratorio de rutina completo.
4. Monitorización continua: electrocardiográfica, oximetría de pulso, tensión arterial no invasiva o invasiva y temperatura corporal.
5. Radiografía de tórax.
6. Ecocardiograma bidimensional y Doppler.
Clase II
1. Evaluación de la función ventricular invasiva (Swan-Ganz) cuando no hay respuesta al tratamiento convencional.
2. Registro electrocardiográfico continuo sistema Holter de 24 horas.
Clase III
1. Ergometría.
2. Perfusión miocárdica en reposo y esfuerzo.
3. Cateterismo cardíaco: en pacientes con enfermedad terminal (cáncer, HIV, etc.) que impida una cirugía cardiovascular mayor.
B. Insuficiencia cardíaca crónica
Clase I
1. Examen clínico.
2. Electrocardiograma convencional de 12 derivaciones.
3. Telerradiografía de tórax (frente y perfil).
4. Laboratorio de rutina completo.
5. Ecocardiograma bidimensional y Doppler.
6. Registro electrocardiográfico continuo sistema Holter de 24 horas.
7. Estudios invasivos: cateterismo o estudio electrofisiológico (sólo serán Clase I en caso de antecedentes de muerte súbita y/o arritmias ventriculares graves).
Clase II
1. Ergometría: en pacientes en clase funcional I a III para evaluar respuesta terapéutica.
2. Prueba de la caminata de 6 minutos.
3. Perfusión miocárdica en reposo y esfuerzo.
4. Ecocardiograma transesofágico.
5. Consumo de oxígeno.
6. Biopsia endomiocárdica: en pacientes en espera de trasplante cardíaco.
Clase III
1. Ergometría: en pacientes en clase funcional IV o arritmias ventriculares graves en reposo.
2. Cateterismo cardíaco: en pacientes con enfermedad terminal asociada (cáncer, HIV) que impida una cirugía cardiovascular mayor posterior.
3. Biopsia endomiocárdica: en pacientes que no se encuentran en plan de trasplante.
C. Aneurisma ventricular de origen chagásico en presencia de miocardiopatía dilatada
Clase I
1. Iguales estudios que en A o B.
2. Estudio electrofisiológico: previo a la aneurismectomíam para el mapeo de la arritmia ventricular.
Clase II
1. Iguales estudios que en A o B.
Clase III
1. Ergometría: en presencia de arritmia ventricular compleja o clase funcional IV.
2. Coronariografía: si se decidió no realizar aneurismectomía.
Tratamiento de la cardiopatía chagásica dilatada crónica
El tratamiento de la insuficiencia cardíaca en la miocardiopatía chagásica está dirigido a actuar sobre los mecanismos neurohormonales que la perpetúan o agravan. Las terapéuticas se deben orientar a mejorar los hábitos de vida, establecer una dieta adecuada y la administración de medicamentos que cambian la evolución natural de la enfermedad, como las drogas inhibidoras de la enzima convertidora de la angiotensina, los bloqueantes de los receptores de la angiotensina, los bloqueadores de la aldosterona y los betabloqueantes. En casos apropiados, son útiles los dispositivos electrofisiológicos (marcapasos, resincronizadores, cardiodesfibriladores) y otros tratamientos invasivos (Figura 4).

Fig. 4. Estadios de desarrollo de la insuficiencia cardíaca y terapia recomendada en la miocardiopatía chagásica. Adaptada de ACC/AHA 2005 Guideline update for the diagnosis and management of chronic heart failure in the adult.
La nueva clasificación del ACC/AHA para la IC permite diferenciar estadios de riesgo para el desarrollo de la enfermedad y estadios de IC propiamente dicha y establecer su correspondiente tratamiento. Los estadios A y B de esta clasificación corresponden a pacientes asintomáticos, en clase funcional (CF) I de la New York Heart Association (NYHA), mientras que los estadios C y D corresponden a los pacientes con síndrome de IC, en CF II a IV de la NYHA. Esta clasificación también puede aplicarse a la enfermedad de Chagas (véase Figura 4).
Estadio A: pacientes con factores de riesgo para el desarrollo de la enfermedad, pero sin daño miocárdico estructural, en los que estaría indicada la prevención primaria. En este estadio podemos incluir a los pacientes seropositivos sin evidencias de cardiopatía y a aquellos con arritmias y trastornos de la conducción, pero sin afección miocárdica evidente en el ecocardiograma.
Estadio B: pacientes que presentan daño miocárdico estructural, en quienes se deben tomar medidas de prevención secundaria. El ecocardiograma resulta de vital importancia para la evaluación de esta etapa. La remodelación ventricular, las alteraciones regionales de la contracción, los aneurismas, la dilatación y la disfunción ventricular asintomáticas son componentes de la miocardiopatía chagásica en el estadio B.
Estadio C: pacientes con daño cardíaco estructural que ya han desarrollado síntomas y signos de IC. En este estadio se recomiendan las medidas generales para IC, los tratamientos farmacológicos y ocasionalmente dispositivos electrofisiológicos, tendientes a mejorar la calidad de vida y disminuir la mortalidad.
Estadio D: pacientes en IC avanzada, con gran deterioro de la función ventricular y de la capacidad funcional, refractarios al tratamiento óptimo disponible, con hospitalizaciones frecuentes y que requieren estrategias de sostén especiales: inotrópicos intravenosos, asistencia circulatoria mecánica, terapia de resincronización cardíaca, trasplante cardíaco, alternativas quirúrgicas, terapia celular, etc.
Con el objetivo de sintetizar este Consenso se enuncian solamente los puntos particulares para la cardiopatía chagásica.
MEDIDAS GENERALES
Las medidas generales, no farmacológicas, tienen tanta importancia como la terapia medicamentosa, y de su cumplimiento dependerá en gran parte el pronóstico de la enfermedad y la calidad de vida del paciente. Lograr una adherencia adecuada al tratamiento es uno de los objetivos más importantes, sobre todo teniendo en cuenta la condición socioeconómica baja común a los enfermos de Chagas, lo que dificulta el acceso a los controles y las medidas terapéuticas.
Se debe promover la educación del paciente, el cuidado del peso, la dieta hiposódica, la restricción hídrica en pacientes con síntomas graves o con hiponatremia, el cese del hábito de fumar, la moderación o la abstinencia de alcohol y la actividad física regular en los enfermos estables. Pueden resultar de suma utilidad, cuando están disponibles, los programa de manejo de IC.
TRATAMIENTO FARMACOLÓGICO
La miocardiopatía chagásica cuenta con escasas evidencias de nivel A para su tratamiento. Por este motivo, las recomendaciones se basarán en evidencias provenientes de estudios de nivel B o en la opinión de expertos (nivel C).
Inhibidores de la enzima convertidora de la angiotensina (IECA)
- Deben recibir IECA los pacientes con Fey < 40% asintomáticos o con IC leve a grave (CF I-IV, estadios B, C y D), a menos que existan contraindicaciones o no sean tolerados (Clase I. Nivel de evidencia B).
Antagonistas del receptor de angiotensina II (ARA II)
Su uso en la IC es más controversial. El Consenso de IC de la SAC sugiere indicar ARA II en las siguientes situaciones:
- Pacientes con Fey < 40%, asintomáticos o con IC leve a grave (CF I-IV, estadios B, C y D) con intolerancia a los IECA (Clase I. Nivel de evidencia B).
- Pacientes con Fey < 40% e IC sintomática (estadios C y D) en tratamiento con dosis óptima de IECA y BB, a menos que estén tratados con AA (Clase IIb. Nivel de evidencia B).
Betabloqueantes
En la miocardiopatía chagásica, la presencia de bradicardia y de alteraciones del sistema nervioso autónomo obliga a tener precauciones con el empleo de los betabloqueantes (BB).
- Deben recibir BB los pacientes con Fey < 40% asintomáticos o con IC leve a grave (CF I-IV, estadios B, C y D), a menos que existan contraindicaciones o no sean tolerados (Clase IIa. Nivel de evidencia B).
- Se encuentran contraindicados en los pacientes con broncoespasmo, bloqueo auriculoventricular de segundo o tercer grado, enfermedad del nódulo sinusal y bradicardia sinusal sintomática (FC < 50 lat/min) (Clase III. Nivel de evidencia B).
Antagonistas de la aldosterona (AA)
La espironolactona podría atenuar el proceso fibrótico, predominante en la miocardiopatía chagásica.
- Deben recibir espironolactona los pacientes con Fey < 35% e IC avanzada (CF III-IV, estadio D), a menos que existan contraindicaciones o no sean tolerada (Clase I. Nivel de evidencia B).
- Podrían beneficiarse con los AA los pacientes con IC moderada (CF II, estadio C) (Clase IIa. Nivel de evidencia C).
Hidralazina y dinitrato de isosorbide
Actualmente su indicación se restringe a:
- Pacientes Fey < 40% o con IC sintomática (CF IIIV, estadios C y D) que no toleren la indicación de IECA ni ARA II (Clase IIa. Nivel de evidencia B).
Digoxina
En el paciente chagásico, las alteraciones del automatismo y de la conducción asociados con arritmias ventriculares malignas o potencialmente malignas restringen su uso. La digoxina puede agravar la disautonomía y los trastornos del ritmo y de la conducción.
Se recomienda su uso en:
- Pacientes con fibrilación auricular (FA) con alta respuesta ventricular (Clase I. Nivel de evidencia C).
- Pacientes con FA de moderada respuesta e IC moderada a grave (CF III-IV, estadio D) (Clase IIa. Nivel de evidencia C).
- Pacientes con ritmo sinusal, Fey < 40% e IC moderada a grave (CF III-IV, estadio D), en tratamiento con dosis óptima de IECA o ARA II, BB, AA (Clase IIb. Nivel de evidencia B).
- En la enfermedad de Chagas no debe utilizarse en caso de FA de baja respuesta, bradicardia sinusal, bloqueo trifascicular de rama, bloqueo sinoauricular o bloqueo AV de segundo o tercer grado, a menos que el paciente porte un marcapasos con funcionamiento correcto (Clase III. Nivel de evidencia B).
Diuréticos
- Deben indicarse diuréticos en pacientes con IC y síntomas y signos de retención hidrosalina (CF II a IV, estadios C y D) (Clase I. Nivel de evidencia B).
Anticoagulantes orales y antiagregantes plaquetarios
Son indicaciones de anticoagulación oral en la miocardiopatía chagásica:
- Fibrilación auricular (permanente, persistente o paroxística) (Clase I. Nivel de evidencia A).
- Antecedente de embolia sistémica (Clase I. Nivel de evidencia C).
- Evidencia por imágenes de trombo intracavitario (Clase I. Nivel de evidencia C).
- Aneurisma apical sin evidencia de trombo (Clase IIb. Nivel de evidencia C).
- La aspirina y otros antiagregantes plaquetarios no tienen indicación sistemática en la miocardiopatía chagásica (Clase III. Nivel de evidencia C).
Amiodarona
El estudio GESICA incluyó un 10% de pacientes chagásicos y se demostró una disminución en la mortalidad por progresión de insuficiencia cardíaca o muerte súbita. Sin embargo, la superioridad de los BB desplazó su indicación.
- Sólo se justifica la indicación de amiodarona como tratamiento de la IC en pacientes con contraindicación o intolerancia a los BB (Clase IIb. Nivel de evidencia B). La indicación habitual de la droga son las arritmias.
Tratamiento antiparasitario
La indicación de tratamiento etiológico tripanocida con benznidazol o nifurtimox en el paciente con enfermedad de Chagas crónica es motivo de discusión. Las indicaciones consideradas son:
- Miocarditis chagásica aguda sobre cardiopatía chagásica crónica, producto de una reinfección endógena, en pacientes con trasplante, con síndrome de inmunodeficiencia adquirida (SIDA) o inmunodeprimidos por otra causa (Clase I. Nivel de evidencia C).
- Receptor chagásico en trasplante de órganos como profilaxis (Clase IIa. Nivel de evidencia C).
- Es controversial la indicación de tratamiento antiparasitario en el paciente con IC debido a miocardiopatía chagásica crónica (Clase IIb. Nivel de evidencia B).
Resumiendo, todos los pacientes con IC debida a miocardiopatía dilatada de origen chagásico en cualquiera de sus estadios (B, C o D) deberían recibir un IECA (o en su defecto un ARA II) y BB, siempre que sean bien tolerados y se descarten las contraindicaciones. En los pacientes sintomáticos o con signos congestivos (estadios C y D) están indicadas las medidas generales y los agentes diuréticos. En aquellos que se encuentren con IC en CF III-IV (estadio D) se recomienda, además, un AA. Los que presenten FA, antecedentes embólicos o un aneurisma apical con trombo deben ser anticoagulados. La digitalización cuidadosa está indicada en la FA cuando existe alta respuesta ventricular. En la Tabla 7 se detallan las dosis de las drogas de uso común en la insuficiencia cardíaca.
Tabla 7. Dosis de las drogas de uso común en la insuficiencia cardíaca

REHABILITACIÓN CARDIOVASCULAR
La rehabilitación cardiovascular tiene como objetivo principal mejorar la calidad de vida, la morbimortalidad, la modificación del sedentarismo, el aumento de la capacidad funcional, combatir el estrés, disminuir la ansiedad, modificar los factores de riesgo y la reinserción laboral y social de los pacientes. Criterios de inclusión: pacientes portadores de miocardiopatía chagásica en insuficiencia cardíaca clases I, II y III de la NYHA Se deben excluir los pacientes en clase funcional IV de la NYHA, con arritmias complejas; antecedentes de adicciones a drogas y alcoholismo.
Es importante tener en cuenta los requerimientos de energía en la vida diaria y en las actividades laborales para poder indicar correctamente tareas acordes a la discapacidad del paciente, así como tener en cuenta la sobrecarga que provocan ciertos actos fisiológicos, como la actividad sexual, el exceso de comidas, etc. (Figura 5).
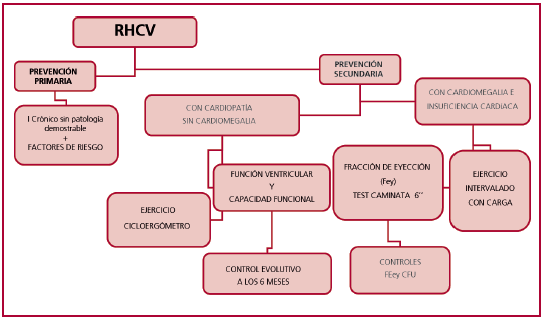
Fig 5. Algoritmo de rehabilitación cardiovascular (RHCV) en patología chagásica
INSUFICIENCIA CARDÍACA AVANZADA
De acuerdo con el Consenso de Insuficiencia Cardíaca desarrollado por el Consejo de Insuficiencia Cardíaca de la Sociedad Argentina de Cardiología, se define y trata como "insuficiencia cardíaca avanzada" al cuadro clínico caracterizado por la persistencia de síntomas en clase funcional III-IV de la NYHA, a pesar del tratamiento médico completo y optimizado (diuréticos, BB, IECA/ARA II y AA) en un paciente con deterioro grave de la función ventricular.
INSUFICIENCIA CARDÍACA. TRATAMIENTO ELÉCTRICO
La estimulación biventricular, es decir, la resincronización, ha mostrado buenos resultados en casos aislados cuando el paciente a tratar presenta insuficiencia cardíaca refractaria a pesar del tratamiento farmacológico óptimo, en clase funcional III-IV con bloqueo completo de rama izquierda e incremento importante de la duración del QRS (≥ 150 mseg) y discinesia y disincronía intraventricular e interventricular. Todos los estudios en gran escala fueron realizados en pacientes con miocardiopatía dilatada idiopática o isquémica.
Aunque en el paciente chagásico el bloqueo de rama izquierda es raro y existe un franco predominio de bloqueo completo de rama derecha con hemibloqueo anterior, se han publicado casos con claro beneficio mediante la estimulación biventricular.
Al igual que el bloqueo de rama izquierda, el de rama derecha se identificó últimamente como un predictor independiente de mortalidad en pacientes con insuficiencia cardíaca congestiva.
Recomendaciones para el implante de un resincronizador cardíaco
Los pacientes con deterioro de la función ventricular izquierda e IC presentan, con una frecuencia variable, trastornos eléctricos de conducción y disincronía en la contracción. Esta disincronía puede presentarse entre ambos ventrículos (interventricular), entre los distintos segmentos del ventrículo izquierdo (intraventricular) o ser auriculoventricular. Su resultado será el empeoramiento de la función ventricular con aumento de los volúmenes ventriculares y reflujo mitral.
Los ensayos iniciales, de tipo fisiopatológico, fueron seguidos por estudios que incluyeron puntos finales de valor clínico (mortalidad/reinternaciones).
Como resultado, se puede concluir que la terapia de resincronización cardíaca (TRC) disminuye la mortalidad promedio en un 22% y las reinternaciones por falla cardíaca en un 37% en pacientes con deterioro grave de la función ventricular y CF avanzada. La reducción de la mortalidad es aplicable tanto a la muerte por progresión de la falla cardíaca como a la muerte súbita. En pacientes con deterioro de la función ventricular, ritmo sinusal y QRS ancho pero con escaso compromiso de la capacidad funcional, dos estudios recientes, MADITCRT y REVERSE, demostraron que el dispositivo mejora la evolución clínica sin impacto sobre la mortalidad.
Se estima que entre los pacientes con indicación de TRC un 30% resultan no respondedores, es decir, sin mejoría clínica. Esto puede deberse a una selección incorrecta del paciente (ausencia de disincronía mecánica), necrosis en el sitio de implante del electrodo izquierdo, imposibilidad de acceder al sitio de mayor disincronía, ausencia de ritmo de marcapasos durante lapsos prolongados, etc. En pequeños estudios, algunos parámetros ecocardiográficos de disincronía han demostrado utilidad para identificar quiénes se beneficiarán con el implante, pero esto aún no se ha podido confirmar en estudios multicéntricos de mayores dimensiones. El uso generalizado de la ecocardiografía no está indicado para selección de candidatos, aunque es de utilidad en algunos pacientes que generan dudas.
Indicaciones de terapia de resincronización cardíaca
Clase I
- Pacientes con IC crónica en CF III-IV (al menos 6 meses de evolución) bajo tratamiento médico máximo, con Fey < 35%, ritmo sinusal y ancho del QRS ≥150 mseg (Nivel de evidencia A).
- Pacientes que tienen indicación de marcapasos o que ya lo tienen implantado y necesitan un recambio (probable upgrade), que presentan IC crónica en CF III-IV (al menos 6 meses de evolución) bajo tratamiento médico máximo posible, con Fey < 35% (Nivel de evidencia B).
- Pacientes con indicación de TRC en los que además debería indicarse un CDI:
- En "prevención secundaria": pacientes con indicación de CDI (taquicardia ventricular sostenida o muerte súbita) (Nivel de evidencia A).
- En "prevención primaria" debería considerarse la indicación de TRC asociada con CDI en pacientes jóvenes, que no tengan comorbilidades graves y con una expectativa de vida mayor de 2 años, en especial con antecedente de episodios de taquicardia ventricular (Nivel de evidencia C).
Clase IIa
- Pacientes con IC crónica en CF III-IV (al menos 6 meses de evolución) bajo tratamiento médico máximo, con Fey < 35%, ritmo sinusal y ancho de QRS entre 120-150 mseg. Se sugiere realizar evaluación de parámetros de disincronía mecánica (Nivel de evidencia B).
- Pacientes con IC crónica en CF I-II, con tratamiento médico máximo, con Fey < 30%, ritmo sinusal y ancho del QRS ≥ 150 mseg (Nivel de evidencia B).
Clase IIb
- Pacientes con IC crónica en CF III-IV (al menos 6 meses de evolución) bajo tratamiento médico máximo, con Fey < 35%, con fibrilación auricular y ancho del QRS ≥ 150 mseg. Es necesario generar un bloqueo A-V farmacológico o por ablación del nódulo A-V para asegurarse de que la mayoría de los latidos van a ser conducidos por el resincronizador (Nivel de evidencia B).
- Pacientes que tienen indicación de marcapasos o que ya lo tienen implantado y necesitan un recambio (probable upgrade) con Fey < 35%, pero sin evidencias clínicas de IC. Debería analizarse el tiempo de marcapaseo que requiere el paciente y, en caso de que sea elevado, puede plantearse la posibilidad de TRC (Nivel de evidencia C).
TRASPLANTE CARDÍACO
La miocardiopatía chagásica dejó de ser una contraindicación para el trasplante cardíaco (TC) ya que, aunque presenta dificultades, puede realizarse exitosamente.
Recomendaciones para trasplante cardíaco en pacientes con miocardiopatía chagásica avanzada
Clase I
- Pacientes en shock cardiogénico, dependientes de drogas parenterales, ARM y/o ACM (Nivel de evidencia C).
- Pacientes con IC avanzada y marcadores de elevada mortalidad (> 30%) dentro del año, a pesar del tratamiento médico óptimo y ajustado (Nivel de evidencia C).
- Pacientes en IC avanzada con consumo de O2 máximo < 10 ml/kg/min (Nivel de evidencia C).
- Pacientes con IC y arritmia ventricular grave sintomática refractaria al tratamiento antiarrítmico y a CDI (Nivel de evidencia C).
Clase IIb
- Pacientes en IC con consumo de O2 máximo entre 11 y 14 ml/kg/min: se propone realizar un puntaje de riesgo para ayudar a estratificar el pronóstico (Nivel de evidencia C).
- Pacientes con indicación de TC y contraindicación relativa (Nivel de evidencia C).
Clase III
- Pacientes con IC bajo tratamiento médico incompleto (Nivel de evidencia C).
- Pacientes con contraindicaciones absolutas para TC (Nivel de evidencia C).
ALTERNATIVAS QUIRÚRGICAS
La demanda de donantes para TC no logra satisfacer la necesidad de órganos, por lo cual las cirugías alternativas tienen especial relevancia, no sólo porque no requieren oferta de donantes, sino por los resultados comparables a los del trasplante.
Es alentador el panorama que ofrece la terapia celular con células madre, cuyos procedimientos se encuentran en desarrollo clínico y sobre el que se están acumulando experiencias prometedoras tanto en miocardiopatía isquémica como no isquémica, incluida la chagásica.
LECTURAS SUGERIDAS
1. Auger S, De Rosa M, Storino R, Accerboni G, Urrutia MI, Gorocito M. Trastornos de la motilidad segmentaria en la enfermedad de Chagas. Resultados del tratamiento con inhibidores de la enzima convertidora. Rev Conarec. Julio-Agosto 2008;95:204-12. [ Links ]
2. Auger S, De Rosa M. La presencia de disautonomía: ¿Puede actuar como marcador evolutivo en la cardiopatía de origen chagásico? Rev Uruguaya de Cardiol 2010;25:153-4. Premio Mejor Tema Libre- Cardiosur 2010. [ Links ]
3. Auger S, Gómez G, Dionisio G, Oliva M, Goin J.C. Influencia de la presencia de anticuerpos antimuscarínicos M2 en el desarrollo de disautonomía y enfermedad cardiovascular en pacientes chagásicos. Rev Argent Cardiol 2010;78:171-2. [ Links ]
4. Barisani JL, Fernández A, Fairman E, Diez M, Thierer J, Christen A y col. Consejo de Insuficiencia Cardíaca de la Sociedad Argentina de Cardiología. Consenso de Insuficiencia Cardíaca Aguda y Avanzada. Rev Argent Cardiol 2010;78:264-81. [ Links ]
5. Barisani JL, Fernández A, Fairman E, Diez M, Thierer J, Nul D y col. Consejo de Insuficiencia Cardíaca de la Sociedad Argentina de Cardiología. Consenso de Diagnóstico y Tratamiento de la Insuficiencia Cardíaca Crónica. Rev Argent Cardiol 2010;78:166-81. [ Links ]
6. Carrizo Páez R, Pickenhayn J, Carrizo Páez M. Chagas urbano en San Juan. Diagnóstico, revisión y propuesta para un sistema integrado de ataque. Rev Argent Cardiol 2008;76:480-7. [ Links ]
7. Carrizo Páez R, Pickenhayn J, Carrizo Páez M. Urbanización del Complejo Patógeno Chagas. Situación en San Juan. En: Storino R. Chagas en el siglo XXI. De la enfermedad a la problemática social. Buenos Aires: Ed Akadia; 2010. [ Links ]
8. Consenso Argentino de Prueba Ergométrica Graduada. Rev Argent Cardiol 2010;78:1-89. [ Links ]
9. Consenso de Enfermedad de Chagas. Consejo de Enfermedad de Chagas y Miocardiopatías Infecciosas "Dr. Salvador Mazza". Rev Argent Cardiol 2002;70:1-87. [ Links ]
10. Dubner S, Schapachnik E, Pérez Riera AR, Valero E. Chagas disease: State-of-the-art-of diagnosis and management. Cardiology Journal 2008;15:493-504. [ Links ]
11. Dubner S, Valero E, Pesce R, González Zuelgaray J, Pachon Mateos JC, Filho SG, et al. A Latin American Registry of Implantable Cardioverter Defibrillators: The ICD-LABOR Study. A.N.E. 2005;10:420-8. [ Links ]
12. Epstein AE, Demarco JP, Ellenbogen KA, Estes NAM, Freedman RA, Gettes LS, et al. ACC/AHA/HRS 2008 Guidelines for Device- Based Therapy of Cardiac Rhythm Abnormalities. J Am Coll Cardiol 2008;51:1-62. [ Links ]
13. Flynn K, Piña I, Whellan D, Lin L, Blumenthal J, Ellis S, et al. Effects of exercise training on health status in patients with chronic heart failure: HF-ACTION randomized controlled trial. JAMA 2009;301:1451-9. [ Links ]
14. Giménez L, Mitelman J, editores. Enfermedad de Chagas-Mazza en las grandes ciudades. Buenos Aires, Argentina: Roemmers 2008. p. 1-163. [ Links ]
15. Greco O, Muratore C, Pachon Mateos JC; Galvao Filho SS, dos Santos S, Escudero J, et al. Estúdio multicentrico de pacientes sometidos a implante de cardioversor-desfibrilador implantable (CDI) en América Latina. Relampa 2010;23:67-74 http://bases.bireme.br/ cgi-bin/wxislind.exe/iah/online/?IsisScript=iah/iah.xis&src=google &base=LILACS&lang=p&nextAction=lnk&exprSearch=559908& indexSearch=ID [ Links ]
16. Haghjoo M, Bagherzadeh A, Moshkani Farahani M, Ojaghi Haghighi Z, Sadr-Ameli MA. Significance of QRS morphology in determining the prevalence of mechanical dyssynchrony in heart failure patients eligible for cardiac resynchronization: particular focus on patients with right bundle branch block with and without coexistent left-sided conduction defects. Europace 2008;10:566-71. [ Links ]
17. Hunt SA, Abraham WT, Chinn MH, Feldman AM, Francis GS, Ganiats TG, et al. ACC/AHA 2005. Guideline update for the diagnosis and management of chronic heart failure in the adult. A report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines: develop in collaboration with the American of Chest Physicians and the International Society for Heart and Lung Transplantation: endorsed by the Heart Rhythm Society. Circulation 2005;112:154-235. [ Links ]
18. Labadet C, Gagliardi J, Leonardi M, De Zuloaga C, Pastori J, Barisani JL y col. Consenso Argentino de Marcapasos y Resincronizadores. Rev Argent Cardiol 2009;77:312-27. [ Links ]
19. Marin-Neto J, Rassi A. Actualización sobre la cardiopatía de la enfermedad de Chagas en el primer centenario de su descubrimiento. Rev Esp Cardiol 2009;62:1211-6. [ Links ]
20. Ministerio de Salud. Plan 2011-2016 para el Control de la Enfermedad de Chagas en la Argentina. Programa Nacional de Chagas; 2010:1-14. [ Links ]
21. Mitelman J, Giménez L, Acuña L, Tomasella M, Cicarelli F, Pugliese O y col. Anticuerpos antirreceptores a neurotransmisores y su correlación con la alteración de la dispersión del QT y de la variabilidad de la frecuencia cardíaca. Reblampa 2006;19:408-15. [ Links ]
22. Mitelman J, Giménez L, editores. Miocardiopatía chagásica: un enfoque actual. Buenos Aires, Argentina: Biblioteca Médica Sanofi- Aventis; 2007. p. 1-202. [ Links ]
23. Mitelman J, Giménez L, Ruggiero M, Fuse J, Núñez Burgos A, Palacios K. Rehabilitación cardíaca en pacientes chagásicos con insuficiencia cardíaca. Rev Costarr Cardiol 2008;10:15-8. http://www. intramed.net/sitios/libro_chagas/miocardiopatia.pdf [ Links ]
24. Rassi A Jr; Rassi A, Rassi SG. Predictors of mortality in chronic Chagas disease: a systematic review of observational studies. Circulation 2007;115:1101-8. [ Links ]
25. Reporte del grupo de trabajo científico sobre la enfermedad de Chagas, TDR/GTC 2005 http://whqlibdoc.who.int/hq/2007/TDR_ SWG_09_spa.pdf [ Links ]
26. Sterin-Borda L, Borda E. Role of neurotransmitter autoantibodies in the pathogenis of Chagasic peripheral dysautonomia. Ann N Y Acad Sci 2000;917:273-80. [ Links ]
27. Storino R, Jorg M, Auger S. Atención médica del paciente chagásico- Manual práctico. Un enfoque biológico, antropológico y social. Ed Ediprof SRL; 2003;1:249. http://www.medicos-municipales.org.ar/ bc0905.htm [ Links ]
28. Storino R, Werner Apt, Auger S, et al. Chagas en el siglo XXI a 100 años de su descubrimiento- de la enfermedad a la problemática social. Ed Akadia 2009;3:293. [ Links ]
29. Strickberger SA, Hummel JD, Bartlett TG, Frumin HI, Schuger CD, Beau SL, et al. Amiodarone versus implantable cardioverterdefibrillator: randomized trial in patients with nonischemic dilated cardiomyopathy and asymptomatic nonsustained ventricular tachycardia- AMIOVIRT. J Am Coll Cardiol 2003;41:1707-12. [ Links ]
30. Trainini JC, Barisani JL, Lago N, Bordone J, Mouras J, Ruiz A y col. Resultados alejados del implante miocárdico de células madre en la miocardiopatía chagásica. Rev Argent Cardiol 2007;75:257-63. [ Links ]
31. World Health Organization. Control of Chagas disease: second report of the WHO expert committee. Geneva-Switzerland, 2010. [ Links ]















