Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista argentina de cardiología
versión On-line ISSN 1850-3748
Rev. argent. cardiol. vol.81 no.2 Ciudad Autónoma de Buenos Aires mar./abr. 2013
http://dx.doi.org/10.7775/rac.es.v81.i2.1904
ARTÍCULO ORIGINAL
Relación entre el índice CHA2DS2-VASc y la presencia de trombo auricular en pacientes con fibrilación auricular en plan de cardioversión*
Correlation Between CHA2DS2-VASc Score and Atrial Thrombus in Patients with Atrial Fibrillation Undergoing Cardioversion
Norberto G. Allende, Carlos Rodríguez Pagani, Eduardo Carrasco, Gerardo Marmbio, Guillermo López Soutric, Federico Cintora, Fanny Calvo, Ricardo Pérez De La HozMTSAC
* Este trabajo resultó ganador del Premio XXXVIII Congreso Argentino de Cardiología Servicio de Ecocardiografía / Servicio de Unidad Coronaria. Sanatorio Otamendi, Buenos Aires, Argentina
MTSAC Miembro Titular de la Sociedad Argentina de Cardiología
Para optar a Miembro Titular de la Sociedad Argentina de Cardiología
Recibido: 10/12/2012
Aceptado: 11/01/2013
Dirección para separatas: Dr. Norberto G. Allende, Av. Gral. Pacheco 1700 - Lote 34 (1611) Don Torcuato Pcia. de Buenos Aires, Argentina e-mail: gallende@arnet.com.ar
RESUMEN
Introducción
Los pacientes con fibrilación auricular representan un grupo de riesgo para el desarrollo de complicaciones tromboembólicas, con consecuencias devastadoras cuando afectan el sistema nervioso central. El rendimiento de los índices de riesgo para predecir eventos clínicos se ha evaluado en numerosas publicaciones, mientras que su relación con la presencia de trombo en la aurícula izquierda o su orejuela se ha explorado menos. Recientemente se ha propuesto la utilización del índice conocido con el acrónimo CHA2DS2-VASc para la estratificación de riesgo cardioembólico.
Objetivo
Evaluar la prevalencia de trombo en la aurícula izquierda y su relación con las variables del índice CHA2DS2-VASc y la función sistólica del ventrículo izquierdo en pacientes con fibrilación auricular que serán sometidos a cardioversión eléctrica.
Material y métodos
Se efectuó un registro prospectivo de los antecedentes clínicos de pacientes con fibrilación auricular de tiempo indeterminado o > 48 horas, a los que se les realizó un eco transesofágico previo a una cardioversión eléctrica. Se analizó la relación de las variables que conforman el índice CHA2DS2-VASc y del puntaje total para predecir trombo en el eco transesofágico. Se evaluó además un modelo que resultó de sumar al CHA2DS2-VASc un puntaje según la función sistólica del ventrículo izquierdo: normal = 0, deterioro leve = 1, moderado = 2, grave = 3.
Resultados
Se incluyeron 129 pacientes con edad media de 70 ± 12 años, de los cuales 21 (16%) presentaron trombo. Este hallazgo fue más prevalente en pacientes con factores de riesgo, pero alcanzó nivel de significación solo para insuficiencia cardíaca y diabetes. Se observó un incremento progresivo del riesgo de trombo en relación con el CHA2DS2-VASc (3,6 ± 1,6 con trombo vs. 2,7 ± 1 sin trombo; p = 0,024, área bajo la curva ROC = 0,65). La asociación se ve reforzada cuando se incluye la función sistólica del ventrículo izquierdo (p = 0,006, área bajo la curva ROC = 0,69). Un puntaje de CHA2DS2-VASc < 2 no garantizó la ausencia de trombos.
Conclusiones
El puntaje CHA2DS2-VASc desarrollado para predecir riesgo clínico de fenómenos embólicos también se asocia con la presencia de trombo en pacientes con fibrilación auricular de tiempo indeterminado. El agregado de la función sistólica del ventrículo izquierdo al puntaje total podría mejorar la capacidad predictiva.
Rev Argent Cardiol 2013;81:144-150. http://dx.doi.org/10.7775/rac.es.v81.i2.1904
Palabras clave: Fibrilación auricular; Eco transesofágico; Trombo; Tromboembolismo; Cardioversión; Anticoagulantes; Función ventricular.
Abreviaturas:
| ACV | Accidente cerebrovascular | FA | Fibrilación auricular |
| AI/OI | Aurícula izquierda/orejuela izquierda | FSVI | Función sistólica del ventrículo izquierdo |
| AIT | Ataque isquémico transitorio | RIN | Razón internacional normatizada |
| ETE | Eco transesofágico |
ABSTRACT
Background
Patients with atrial fibrillation represent a group of risk for thromboembolic complications, with catastrophic consequences when affecting the central nervous system. The performance of risks scores to predict clinical events has been evaluated by several publications; yet, its correlation with the presence of thrombi in the left atrium or left atrial appendage has been poorly investigated. The use of the CHA2DS2-VASc score has been recently proposed for stratification of throm-boembolic risk.
Objective
To evaluate the prevalence of left atrial thrombus and its correlation with the components of the CHA2DS2-VASc score and with left ventricular systolic function in patients scheduled for electrical cardioversion.
Methods
A prospective registry of the medical history of patients with atrial fibrillation of unknown duration or lasting >48 hours, undergoing transesophageal echocardiography before scheduled electrical cardioversion was conducted. The correlation of the components of the CHA2DS2-VASc scores and of the total score with the presence of thrombi in transesophageal echocardiography was analyzed. The result of the sum of the CHA2DS2-VASc score plus a score of left ventricular systolic function (normal = 0, mild dysfunction = 1, moderate dysfunction = 2, severe dysfunction = 3) was also evaluated.
Results
A total of 129 patients (mean age 70±12 years) were included; 21 (16%) had thrombus. This finding was more prevalent in patients with risk factors, but was only statistically significant for heart failure and diabetes. The risk of thrombus in the LA/LAA progressively increased at higher CHA2DS2-VASc (3.6±1.6 with thrombus vs. 2.7±1 without thrombus; p = 0.024, area under the ROC curve = 0.65). This association was greater when left ventricular systolic function was included (p = 0.006, area under the ROC curve = 0.69). A CHA2DS2-VASc < 2 did not warrant the absence of thrombi.
Key words: Atrial Fibrillation; Transesophageal Echocardiography; Thrombus; Thromboembolism; Cardioversion; Anticoagulants; Ventricular Function.
VÉASE CONTENIDO RELACIONADO: http://dx.doi.org/10.7775/rac.es.v81.i2.2522 Rev Argent Cardiol 2013;81:110-114
INTRODUCCIÓN
La fibrilación auricular (FA) es la arritmia cardíaca sostenida más común, que afecta aproximadamente a un 2% de la población general, con mayor prevalencia en individuos añosos. Debido al aumento de la expectativa de vida se espera un incremento del número de pacientes afectados por esta patología para las próximas décadas, lo que constituye un problema de magnitud creciente en el manejo de la salud pública. (1, 2) Los pacientes con FA representan un grupo de riesgo para el desarrollo de complicaciones tromboembólicas, con consecuencias devastadoras cuando afectan el sistema nervioso central. La evidencia científica avala el empleo de anticoagulantes para prevenir esta temida complicación; sin embargo, es indispensable definir el perfil de riesgo del paciente para determinar si se beneficiará con el tratamiento. Se han identificado diversos antecedentes clínicos relacionados con tromboembolia que permitieron elaborar numerosos modelos de estratificación de riesgo con el fin de asistir al médico en la selección del tratamiento antitrombótico más apropiado. (3, 4) Cabe destacar que estos mismos factores son también fuertes predictores de enfermedad vascular y de accidente cerebrovascular (ACV) en pacientes no fibrilados. (5) El rendimiento de los índices de riesgo para predecir eventos clínicos se ha evaluado en numerosas publicaciones, mientras que su relación con la presencia de trombo en la aurícula izquierda o su orejuela (AI/OI) se ha explorado menos. Establecer esta asociación es importante, ya que aporta el sustrato fisiopatológico para fundamentar el tratamiento anticoagulante. Las guías recientemente publicadas por la Sociedad Europea de Cardiología proponen la utilización del índice conocido con el acrónimo CHA2DS2-VASc para la estratificación de riesgo cardioe-mbólico. (6) El objetivo del presente trabajo fue evaluar la prevalencia de trombo en la AI/OI y su relación con las variables del índice CHA2DS2-VASc y la función sistólica del ventrículo izquierdo (FSVI) en pacientes con FA de tiempo indeterminado 48 hs de evolución sometidos a cardioversión eléctrica electiva.
MATERIAL Y MÉTODOS
Entre mayo de 2005 y abril de 2012 se efectuó un registro prospectivo en base de datos de los antecedentes clínicos de todos los pacientes ingresados a la unidad coronaria con diagnóstico de FA, consignando específicamente la presencia de las variables incluidas en el índice de CHADS2 y el antecedente de enfermedad vascular. A través de esta información se construyó el índice de CHA2DS2-VASc asignando el valor correspondiente a cada variable según la descripción original (7): 1 punto para insuficiencia cardíaca o disfunción ventricular, hipertensión arterial, edad = 65 años, diabetes, enfermedad vascular y sexo femenino; 2 puntos para edad = 75 años y antecedente de ACV o de ataque isquémico transitorio (AIT). El puntaje total surge de la suma de los valores correspondientes a las variables de riesgo presentes en cada paciente.
Se incluyeron en este trabajo los pacientes con FA de tiempo indeterminado o de > 48 horas de evolución, a los que se les realizó un eco transesofágico (ETE) previo a una cardioversión eléctrica electiva. Se excluyeron dos pacientes por presentar estenosis mitral reumática. El ETE se realizó con equipamiento General Electric Vivid five o Vivid seven y sonda multiplanar inmediatamente antes del procedimiento, prestando especial atención a la búsqueda de trombo en la AI y la OI. El procedimiento se realizó bajo sedación con propofol, utilizando la misma anestesia para continuar con la cardioversión eléctrica luego de un ETE negativo. La evaluación de la FSVI se efectuó mediante el ecocardiograma transtorácico previo a la introducción de la sonda, complementándose la información desde las vistas esofágicas y transgástricas cuando la ventana ultrasónica resultó inadecuada. Según la fracción de eyección estimada, la función ventricular se calificó como normal: = 55%; deterioro leve: 45% a 54%; deterioro moderado: 35% a 44%; deterioro grave: < 35%. El protocolo de tratamiento consistió en la administración de heparina no fraccionada 0 enoxaparina previo a la cardioversión eléctrica en todos los pacientes que no habían recibido anticoagulación con dicumarínicos por más de 3 semanas previas al procedimiento. Posteriormente se continuó con tratamiento anticoagulante durante al menos 4 semanas de acuerdo con las recomendaciones de las sociedades científicas. Se investigó la capacidad de cada una de las variables que conforman el índice CHA2DS2-VASc y del puntaje total para predecir la presencia de trombo en el ETE. Para analizar las variables individuales categóricas (predictores de riesgo) se utilizó la prueba de chi cuadrado, mientras que para evaluar los índices como una escala ordinal de riesgo se empleó la prueba de U-Mann-Whitney, considerando estadísticamente significativa una p < 0,05. Se evaluó además la capacidad predictiva de un modelo que resultó de sumar al valor del índice CHA2DS2-VASc un puntaje de acuerdo con la FSVI evaluada por ecocardiografía (CHA2DS2-VASc-FSVI). Para ello se asignó un valor numérico creciente en relación con el grado de deterioro de la función sistólica según la siguiente escala: normal = 0, deterioro leve = 1, deterioro moderado = 2, deterioro grave = 3. El rendimiento diagnóstico de ambos modelos para predecir trombo en la AI o la OI se comparó mediante el coeficiente C de la curva ROC. Las medias se expresan seguidas de la desviación estándar y los coeficientes C seguidos de los intervalos de confianza.
RESULTADOS
Se incluyeron 129 pacientes (48 de sexo femenino), edad media 70 ± 12 años, cuyas características clínicas y ecocardiográficas se describen en las Tablas 1 y 2. La proporción de pacientes con RIN > 2 en el momento del estudio fue de solo el 29%, lo que no es de extrañar teniendo en cuenta que en 74 pacientes (57%) se trataba del primer episodio documentado de esta arritmia y se utilizó enoxaparina o heparina no fraccionada como terapia antitrombótica inicial. La cardioversión eléctrica se realizó en 107 pacientes con resultado exitoso en el 97%. En los casos con evidencia de trombo se pospuso el procedimiento y se indicó anticoagulación prolongada.
Tabla 1. Características clínicas
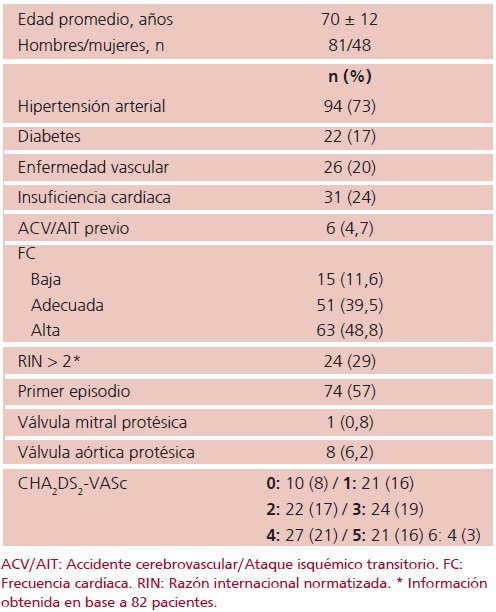
Tabla 2. Datos cardiográficos

Se observó trombo en 21 pacientes (16%): en 19 pacientes localizado en la OI, en un paciente en el cuerpo de la AI y en un paciente en ambas cavidades. La relación de cada variable incluida en el índice CHA2DS2-VASc y de la FSVI con la presencia de trombo se describe en la Tabla 3. La prevalencia de trombo fue mayor en los pacientes con presencia de factores de riesgo para casi todas las categorías, con excepción de sexo femenino y ACV previo; sin embargo, alcanzó nivel de significación solo para la insuficiencia cardíaca, la diabetes y la FSVI. Se observó un incremento progresivo del riesgo de trombo en la AI/OI en relación con el índice CHA2DS2-VASc (Figura 1 A), con un puntaje promedio de 3,62 ± 1,6 con trombo vs. 2,76 ± 1,6 sin trombo (p = 0,024). La evaluación del rendimiento diagnóstico mediante la curva ROC mostró un área bajo la curva de C = 0,65 (0,52-0,78). El modelo que incluye la FSVI como variable (CHA2DS2-VASc-FSVI) mostró una asociación altamente significativa del puntaje con la presencia de trombo (Figura 1 B): 4,86 ± 2,4 vs. 3,35 ± 1,9 sin trombo (p = 0,006), mejorando el área bajo la curva C = 0,69 (0,55-0,83), aunque con superposición de los intervalos de confianza entre ambos modelos.
Tabla 3. Relación de las variables clínicas y la función sistólica del ventrículo izquierdo con la presencia de trombo
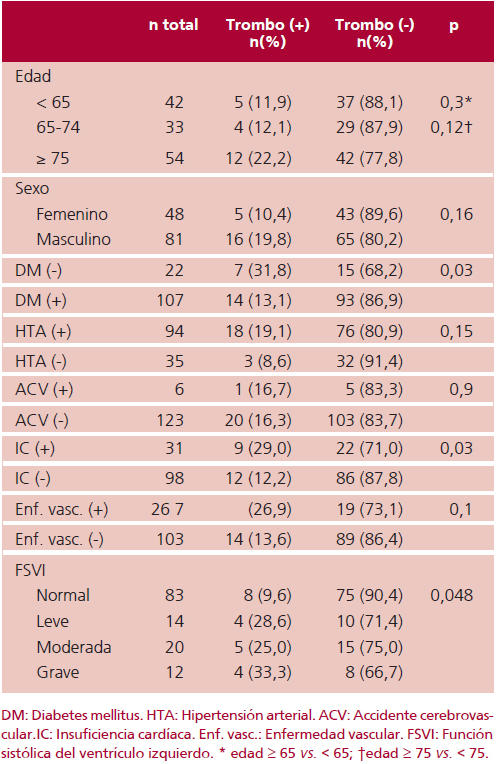

Fig. 2. Datos A. Relación entre CHA2DS2-VASc y trombo. B. Relación entre CHA2DS2-VASc + FSVI y trombo. Las columnas representan el porcentaje de pacientes con trombo en la AI/OI para cada puntaje. Los valores debajo de cada columna indican el número de pacientes.
Cabe destacar que en 3 pacientes con índice CHA2DS2-VASc de riesgo bajo (< 2) se documentó la presencia de trombo en el ETE (1 paciente con puntaje = 0 y 2 pacientes con puntaje = 1). Se registró un solo evento tromboembólico (0,8%), que consistió en un ACV en una mujer bajo tratamiento con ace-nocumarol en la que el ETE previo a la cardioversión no evidenciaba masas intracavitarias. Los pacientes con trombo no presentaron complicaciones embólicas durante la internación.
Si bien la velocidad de vaciado de la OI y la densidad de contraste espontáneo no fueron el objetivo primario del estudio, se analizó en forma retrospectiva su relación con la presencia de trombo. En el 70% de los ETE se consignó información acerca de la presencia de contraste espontáneo y en el 90% se evaluó la velocidad de vaciado de la orejuela. La presencia y la densidad de contraste espontáneo presentaron una clara asociación con la presencia de trombo (p = 0,005) (Figura 2). Asimismo, la velocidad de flujo en la orejuela se encontraba disminuida (< 0,4 m/seg2) en el 93% de los pacientes con trombo vs. el 63% en los pacientes sin trombo (p = 0,015). Ningún paciente con ausencia de ambos indicadores de enlentecimiento del flujo sanguíneo auricular presentó masas intracavitarias.
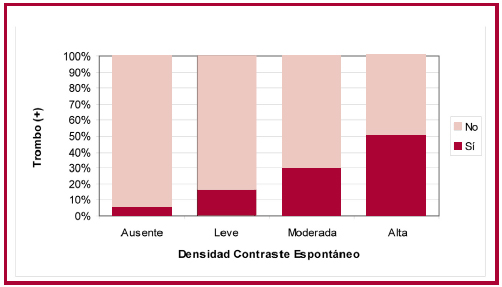
Fig. 2. Relación entre contraste espontáneo y trombo.
DISCUSIÓN
Numerosos estudios han demostrado la superioridad del tratamiento con dicumarínicos para prevenir los eventos clínicos en pacientes con FA, especialmente en los casos con factores de riesgo. (8-11) El fundamento fisiopatológico para la prescripción de anticoagulantes radica en la hipótesis de que los fenómenos tromboe-mbólicos resultarían del desprendimiento de trombos alojados en la AI/OI, lo que podría prevenirse con un tratamiento antitrombótico eficaz. Sin embargo, en diversas publicaciones se describió que entre el 25% y el 50% de los ACV/AIT en estos pacientes tendrían una etiología distinta de la cardioembolia. (12-14) Entre otros mecanismos posibles deberían considerarse la enfermedad carotídea intracraneana y extracraneana, la enfermedad de pequeños vasos y el debris aórtico. Las mismas variables clínicas que se asocian con riesgo embolígeno en la FA también se relacionan con enfermedad vascular y ateromatosis aórtica. (15) Kanter y colaboradores estudiaron con Doppler a 676 pacientes con FA y observaron que la presencia de estenosis ca-rotídea se asociaba con hipertensión arterial, diabetes y tabaquismo. (16) El grupo de Kim y colaboradores encontró una relación directa entre el puntaje CHADS2 y la enfermedad carotídea intracraneana y extracranea-na. (17) En una publicación del grupo de investigadores del "SPAF" se describe una prevalencia mayor de placas complejas en la aorta torácica en los grupos con mayor riesgo clínico y este hallazgo se relacionó a su vez con una tasa mayor de eventos embólicos. (18) El beneficio de los anticoagulantes orales en la prevención de complicaciones embólicas de la FA está justificado por la reducción de eventos clínicos, (19) mientras que, por el contrario, su utilidad para el tratamiento de la enfermedad vascular y aórtica no está demostrada. (20-22) Nuestro trabajo muestra una correlación entre los predictores clínicos de riesgo incluidos en el índice CHA2DS2-VASc y la presencia de trombo en la AI/OI aportando racionalidad al tratamiento anticoagulante. Asimismo, cierra el circuito fisiopatológico entre los factores de riesgo, trombo en la AI y eventos clínicos. La influencia de cada factor para condicionar un entorno favorable para la formación de coágulos auriculares no está del todo esclarecida. La hipertensión arterial podría accionar a través de la hipertrofia y la disfunción diastólica, generando mayor enlentecimiento del caudal sanguíneo auricular. (15, 23) Se ha descripto una disminución de la velocidad de flujo en la orejuela con el envejecimiento, lo que podría explicar en parte el efecto de la edad. (24) El antecedente de ACV/AIT parece corresponder a un marcador de la presencia de trombo más que a un factor que predisponga a su génesis. La diabetes presenta una clara relación con enfermedad macrovascular y microvascular; sin embargo, no es tan directa la interpretación de su papel en la FA. La insuficiencia cardíaca podría influir a través de un aumento de la presión en la AI condicionando mayor rémora del flujo y aumentando el diámetro de la cavidad. La presencia de este síndrome clínico no siempre se acompaña de deterioro contráctil, por lo que la valoración de la FSVI podría ser más representativa del riesgo potencial. La asociación de baja fracción de eyección con el desarrollo de eventos tromboembólicos se ha demostrado en diferentes trabajos. (25, 26) Si bien nuestro estudio muestra un área bajo la curva mayor con el simple agregado del puntaje de la FSVI al índice CHA2DS2-VASc (0,69 vs. 0,65), las conclusiones se ven limitadas por la superposición de los intervalos de confianza. De corroborar el hallazgo en estudios con un número mayor de pacientes, podría incorporarse este sencillo elemento fácilmente disponible con un ecocardiograma transtorácico para mejorar la capacidad predictiva del modelo. La relación del índice de CHADS con la presencia de trombo en la AI/OI fue evaluada en un análisis retrospectivo caso-control por el grupo de la Mayo Clinic, mostrando un puntaje total mayor en los pacientes con coágulo. (27) Decker y colaboradores recolectaron retrospectivamente la información de los registros clínicos de pacientes con FA y ETE precardioversión para construir el índice de CHADS. (28) En su análisis se evidenció un incremento de la proporción de pacientes con trombo en la AI/OI en relación con el aumento del puntaje total. La prevalencia de trombo en nuestro estudio (16%) fue similar a la del estudio ACUTE (14%), en el que se aleatorizaron 1.222 pacientes a cardioversión guiada por ETE vs. tratamiento convencional. (29) Asimismo, las complicaciones tromboembólicas fueron similares y de baja magnitud (0,8% en ambos casos). Cabe destacar que el rendimiento diagnóstico para la presencia de trombo del CHA2DS2-VASc en nuestro trabajo (área bajo la curva ROC 0,65) es similar al comportamiento de este índice en la predicción de eventos cardioem-bólicos en poblaciones del mundo real. (30) Si bien la relación es significativa, dista de ser perfecta, lo que permite suponer que habría otros factores operando, diferentes de los considerados en el modelo. (31) Otro aspecto de gran interés es si la ausencia de predictores de riesgo tromboembólico en pacientes con FA en plan de cardioversión garantiza la ausencia de trombo. De cumplirse esta prerrogativa podría evitarse el ETE precardioversión en los pacientes con FA > 48 horas que carecen de anticoagulación prolongada previa, implicando un ahorro de tiempo y costos médicos. En un estudio de 1.058 pacientes con ETE realizado previo a la ablación de FA, Puwamant y colaboradores encontraron una relación directa entre el índice de CHADS y la presencia de trombo en la AI/OI. (32) De acuerdo con su observación, los casos con puntaje 0 no evidenciaron masas intracavitarias, por lo que afirman que el ETE podría evitarse en este subgrupo de pacientes. Cabe mencionar que en este trabajo el 81% tenía FA paroxística y aproximadamente un 20% se encontraba en ritmo sinusal en el momento del examen, siendo la prevalencia de trombo en su población extremadamente baja (0,6%). Decker y colaboradores tampoco encontraron trombos en pacientes con CHADS de 0, por lo que proponen que se podría evitar el tratamiento anticoagulante previo en estos casos. (28) Si bien nuestro trabajo confirma la relación directa entre el puntaje del modelo de estratificación de riesgo CHA2DS2-VASc y la presencia de coágulos en la AI/OI, el puntaje de riesgo bajo no garantizó la ausencia de masas, las cuales se encontraban presentes en 2 pacientes con puntaje de 1 y en 1 paciente con puntaje 0. Este hallazgo reafirma la necesidad de ETE previo a la cardioversión en los individuos que no cumplen el tiempo de anticoagulación sugerido por las guías actuales. Aun en una población supuestamente de riesgo bajo de tromboembolia por tratar se de FA de menos de 48 horas de evolución, Kleemann y colaboradores señalan la presencia de trombos en el 1,4%. (33) Un hallazgo adicional en nuestra experiencia fue la relación del contraste espontáneo y la velocidad de vaciado de la OI con la prevalencia de masas intracavitarias. La densidad de contraste espontáneo se relacionó en forma directa con la prevalencia de trombo y la velocidad de flujo disminuido en la orejuela estuvo casi omnipresente en estos casos. Cuando ambos fenómenos estaban ausentes en el ETE, no se observaron trombos. Considerando esta observación, la evaluación de estos dos factores podría ser un elemento para tener en cuenta a la hora de definir la necesidad de anticoagulación en situaciones limítrofes con riesgo elevado de complicaciones hemorrágicas.
CONCLUSIONES
En nuestro conocimiento, este trabajo es el primero que evalúa la relación del modelo sugerido en las guías actuales CHA2DS2-VASc con la prevalencia de trombo en la AI/OI confirmando una relación directa entre ambos. Sin embargo, un puntaje de riesgo bajo no garantiza la ausencia de coágulos. El agregado de la variable FSVI al modelo original podría mejorar la capacidad predictiva, hallazgo que debería confirmarse con un número mayor de pacientes.
Conclusions
The CHA2DS2-VASc score, developed to predict the risk of thromboembolic events is also associated with the presence of thrombus in patients with atrial fibrillation of unknown duration. The addition of left ventricular systolic function to the total score might improve its predictive capacity.
Declaración de conflicto de intereses
Los autores declaran que no poseen conflicto de intereses.
Agradecimiento
Al Dr. Raúl A. Borracci, por su asesoramiento en el análisis estadístico.
1. Friberg J, Buch P, Scharling H, Gadsbphioll N, Jensen GB. Rising rates of hospital admissions for atrial fibrillation. Epidemiology 2003;14:666-72. http://doi.org/d34sz2 [ Links ]
2. Lloyd-Jones DM, Wang TJ, Leip E P, Larson MG, Levy D, Vasan RS, et al. Lifetime risk for development of atrial fibrillation: the Framing-ham Heart Study. Circulation 2004;110:1042-6. http://doi.org/b4kr4j [ Links ]
3. Gage B F, Waterman AD, Shannon W, Boechler M, Rich M W, Radford MJ. Validation of clinical classification schemes for predicting stroke: results from the National Registry of Atrial Fibrillation. JAMA 2001;285:2864-70. http://doi.org/djqhd4 [ Links ]
4. Stroke Risk in Atrial Fibrillation Working Group. Comparison of 12 risk stratification schemes to predict stroke in patients with nonval-vular atrial fibrillation. Stroke 2008;39:1901-10. http://doi.org/cppzpc [ Links ]
5. Goldstein L, Bushnell C, Adams R, Appel L, Braun L, Chaturvedi, et al. Guidelines for the Primary Prevention of Stroke: A Guideline for Healthcare Professionals from the American Heart Association / American Stroke Association. Stroke 2011;42:517-84. http://doi.org/dzx3dc [ Links ]
6. Camm J, Kirchhof P, Lip G, Schotten U, Savelieva I, Ernst S, et al. Guidelines for the management of atrial fibrillation. The Task Force for the Management of Atrial Fibrillation of the European Society of Cardiology (ESC). Eur Heart J 2010;31:2369-429. http://doi.org/ftqx5q [ Links ]
7. Lip GY, Nieuwlaat R, Pisters R, Lane DA, Crijns HJ. Refining clinical risk stratification for predicting stroke and thromboembolism in atrial fibrillation using a novel risk factor based approach: the Euro Heart Survey on atrial fibrillation. Chest 2010;137:263-72. http://doi.org/c43wcq [ Links ]
8. Stroke Prevention in Atrial Fibrillation Investigators. Stroke Prevention in Atrial Fibrillation Study. Final results. Circulation 1991;84:527-39. http://doi.org/ksq [ Links ]
9. Petersen P, Boysen G, Godtfredsen J, Andersen ED, Andersen B. Placebo-controlled, randomized trial of warfarin and aspirin for prevention of thromboembolic complications in chronic atrial fibrillation. The Copenhagen AFASAK study. Lancet 1989;1:175-9. http://doi.org/ddfkxx [ Links ]
10. EAFT (European Atrial Fibrillation Trial) Study Group. Secondary prevention in non-rheumatic atrial fibrillation after transient ischaemic attack or minor stroke. Lancet 1993;342:1255-62. [ Links ]
11. The effect of low-dose warfarin on the risk of stroke in patients with nonrheumatic atrial fibrillation. The Boston Area Antico-agulation Trial for Atrial Fibrillation Investigators. N Engl J Med 1990;323:1505-11. http://doi.org/fcpr4m [ Links ]
12. Miller V, Rothrock J, Pearce L, Feinberg W, Hart R, Anderson D. Stroke Prevention in Atrial Fibrillation Investigators. Ischemic stroke in patients with atrial fibrillation: effect of aspirin according to stroke mechanism. Neurology 1993;43:32-6. http://doi.org/ksr [ Links ]
13. Hart RG, Pearce LA, Miller V T, Anderson DC, Rothrock J F, Albers GW, et al. Cardioembolic vs. noncardioembolic strokes in atrial fibrillation: frequency and effect of antithrombotic agents in the stroke prevention in atrial fibrillation studies. Cerebrovasc Dis 2000;10:39-43. http://doi.org/drcx6s [ Links ]
14. Cha MJ, Kim YD, Nam HS, Kim J, Lee DH, Heo JH. Stroke mechanism in patients with non-valvular atrial fibrillation according to the CHADS2 and CHA2 DS2-VASc scores. Eur J Neurol 2012;19:473-9. http://doi.org/c2rdsx [ Links ]
15. Zabalgoitia M, Halperin J, Pearce L, Blackshear JL, Asinger R, Hart R. Transesophageal echocardiographic correlates of clinical risk of thromboembolism in non-valvular atrial fibrillation. Stroke Prevention in Atrial Fibrillation III Investigators. J Am Coll Cardiol 1998;31:1622-6. http://doi.org/crwjk5 [ Links ]
16. Kanter MC, Tegeler CH, Pearce LA, Weinberger J, Feinberg WM, Anderson DC, et al. Carotid stenosis in patients with atrial fibrillation. Prevalence, risk factors, and relationship to stroke in the Stroke Prevention in Atrial Fibrillation Study. Arch Intern Med 1994;154:1372-7. http://doi.org/fwn3x7 [ Links ]
17. Kim YD, Cha MJ, Kim J, Lee DH, Lee HS, Nam CM, et al. Increases in cerebral atherosclerosis according to CHADS2 scores in stroke patients with nonvalvular atrial fibrillation. Stroke 2011;42:930-4. http://doi.org/bgzpcw [ Links ]
18. The Stroke Prevention in Atrial Fibrillation Investigators Committee on Echocardiography. Transesophageal echocardiographic correlates of thromboembolism in high risk patients with nonvalvular atrial fibrillation. Ann Intern Med 1998;128:639-47. [ Links ]
19. Van Walraven C, Hart RG, Singer DE, Laupacis A, Connolly S, Petersen P, et al. Oral anticoagulants vs aspirin in nonvalvular atrial fibrillation: an individual patient meta-analysis. JAMA 2002;288:2441-8. http://doi.org/bgzpcw [ Links ]
20. Mohr J, Thompson JLP, Lazar RM, Levin B, Sacco RL, Furie KL, et al. A comparison of warfarin and aspirin for prevention of recurrent ischemic stroke. N Engl J Med 2001;345:1444-51. http://doi.org/b2j5jx [ Links ]
21. Chimowitz MI, Lynn MJ, Howlett-Smith H, Stern BJ, Hertzberg VS, Frankel MR, et al. Comparison of warfarin and aspirin for symptomatic intracranial arterial stenosis. N Engl J Med 2005;352:1305-16. http://doi.org/b5c6t2 [ Links ]
22. Hiratzka L, Bakris G, Beckman J, Bersin R, Carr V, Casey D, et al. 2010 ACCF/AHA/AATS/ACR/ASA/SCA/SCAI/SIR/STS/SVM Guidelines for the Diagnosis and Management of Patients With Thoracic Aortic Disease: A Report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines, American Association for Thoracic Surgery, American College of Radiology, American Stroke Association, Society of Cardiovascular Anesthesiologists, Society for Cardiovascular Angiography and Interventions, Society of Interventional Radiology, Society of Thoracic Surgeons, and Society for Vascular Medicine. Circulation 2010;121:e266-369. http://doi.org/dp8xkq [ Links ]
23. Stroke Risk in Atrial Fibrillation Working Group. Independent predictors of stroke in patients with atrial fibrillation: a systematic review. Neurology 2007;69:546-54. http://doi.org/bngfgb [ Links ]
24. Goldman ME, Pearce LA, Hart RG, Zabalgoitia M, Asinger RW, Safford R, et al. Pathophysiologic correlates of thromboembolism in nonvalvular atrial fibrillation. Reduced flow velocity in the left atrial appendage. J Am Soc Echo 1999;12:1080-7. [ Links ]
25. Atrial Fibrillation Investigators. Echocardiographic predictors of stroke in patients with atrial fibrillation: a prospective study of 1066 patients from 3 clinical trials. Arch Intern Med 1998;158:1316-20. [ Links ]
26. Stroke Prevention in Atrial Fibrillation Investigators. Predictors of thromboembolism in atrial fibrillation: II. Echocardiographic features of patients at risk. Ann Intern Med 1992;116:6-12. [ Links ]
27. Wysokinski W, Ammash N, Sobande F, Kalsi H, Hodge D, Mcbane R. Predicting left atrial thrombi in atrial fibrillation. Am Heart J 2010;159:665-71. http://doi.org/ccgh79 [ Links ]
28. Decker J, Madder R, Hickman L, Marinescu V, Marandici A, Raheem S, et al. CHADS2 Score is predictive of left atrial thrombus on precardioversion transesophageal echocardiography in atrial fibrillation. Am J Cardiovasc Dis 2011;1:159-65. [ Links ]
29. Klein AL, Grimm RA, Murray RD, Apperson-Hansen C, Asinger R W, Black I W, et al. Use of transesophageal echocardiography to guide cardioversion in patients with atrial fibrillation. N Engl J Med 2001;344:1411-20. http://doi.org/bj48wr [ Links ]
30. Van Staa TP, Setakis, Di Tanna GL, Lane DA, Lip GY. A comparison of risk stratification schemes for stroke in 79,884 atrial fibrillation patients in general practice. J Thromb Haemost 2011;9:39-48. http://doi.org/c9628n [ Links ]
31. Depta J P, Bhatt DL. Atherothrombosis and atrial fibrillation: important and often overlapping clinical syndromes. Thromb Haemost 2010;104:657-63. http://doi.org/bqrthv [ Links ]
32. Puwanant S, Varr B, Shrestha K, Hussain S, Tang W, Gabriel R, et al. Role of the CHADS2 Score in the evaluation of thromboembolic risk in patients with atrial fibrillation undergoing transesophageal echocardiography before pulmonary vein isolation. J Am Coll Cardiol 2009;54:2032-9. http://doi.org/drpspp [ Links ]
33. Kleemann T, Becker T, Strauss M, Schneider S, Seidl K. Prevalence of left atrial thrombus and dense spontaneous echo contrast in patients with short-term atrial fibrillation < 48 hours undergoing cardioversion: value of transesophageal echocardiography to guide cardioversion. J Am Soc Echocardiogr 2009;22:1403-8. http://doi.org/fwmsbj [ Links ]














