Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista argentina de cardiología
versión On-line ISSN 1850-3748
Rev. argent. cardiol. vol.81 no.2 Ciudad Autónoma de Buenos Aires mar./abr. 2013
http://dx.doi.org/10.7775/rac.es.v81.i2.2121
ARTÍCULO DE REVISIÓN
Imaginología en el diagnóstico y el pronóstico de la enfermedad de Chagas
Imaging Techniques in the Diagnosis and Prognosis of Chagas Disease. Emphasis in Doppler Echocardiography
Harry Acquatella, José R. Gómez Mancebo, Franco Catalioti, Juan Puigbó
Facultad de Medicina, Universidad Central de Venezuela. Caracas, Venezuela
Recibido: 16/01/2013
Aceptado: 17/01/2013
Dirección para separatas: Dr. Harry Acquatella 275, Anexo A, Centro Médico, San Bernardino, Caracas 1011, Venezuela, e-mail: hacquatella@gmail.com
Rev Argent Cardiol 2013;81:184-195. http://dx.doi.org/10.7775/rac.es.v81.i2.2121
La introducción de métodos de imaginología cardiovascular ha mejorado sustancialmente la sensibilidad y la especificidad diagnósticas de alteraciones estructurales y funcionales en numerosas afecciones cardíacas. La enfermedad de Chagas aún constituye un problema de salud pública en Latinoamérica. (1) Se han investigado varios métodos de imaginología en pacientes chagásicos con la intención de estudiar su utilidad en el diagnóstico, en el seguimiento, como predictores de morbimortalidad y en resultados de terapéutica. La presente revisión tiene por objeto mostrar los hallazgos más recientes, en especial en ecocardiografía Doppler por ser los más numerosos. También se revisa brevemente su uso con técnicas nucleares y de resonancia magnética.
CLASIFICACIÓN CLÍNICA
La enfermedad de Chagas se puede manifestar inicial-mente en una forma aguda y más comúnmente en su forma crónica. La forma aguda puede expresarse como un síndrome febril inespecífico con una duración de 2 a 8 semanas, haciéndose clínicamente manifiesta en menos del 1% de los sujetos infectados. (2, 3) La miocarditis chagásica aguda es infrecuente; aparece solo en el 1% a 5% de los pacientes que desarrollan la fase aguda (1 a 5 de cada 10.000 sujetos infectados). (2) En general, la infestación natural a través de reduvídeos ocurre en forma inadvertida y pasa a la forma crónica con expresión clínica varias décadas más tarde.
Los sujetos con miocardiopatía crónica chagásica (MCC) pueden ser asintomáticos o sintomáticos. La mayor parte de los investigadores combinan hallazgos clínicos, del electrocardiograma (ECG) y la presencia o ausencia de cardiomegalia o disfunción sistólica en cuatro grupos de afectación cardíaca creciente (Tabla 1, Figura 1). Aproximadamente unas tres cuartas partes de los sujetos seropositivos son asintomáticos. Con ECG normal se considera que se encuentran en la fase "indeterminada" de la enfermedad (estadio A). La presencia de anormalidades en el ECG implica progresión de la enfermedad (estadio B). Por definición, en ambos grupos no hay cardiomegalia ni disfunción sistólica del ventrículo izquierdo (VI). Sin embargo, el 10% o menos pueden tener trastornos contráctiles regionales del VI. Los sujetos sintomáticos con daño cardíaco leve a moderado en clase funcional II o III de la NYHA están en estadio C, y pueden presentar arritmias, embolia, muerte súbita y/o insuficiencia cardíaca (IC) reversible. (1-8) El ECG es anormal en la gran mayoría. El corazón está dilatado y las funciones sistólica y diastólica son anormales. Cerca de la mitad pueden tener trastornos contráctiles regionales del VI, especialmente a nivel del ápex. (1, 3-6, 9, 10) La regurgitación valvular mitral y tricuspídea de grado variable es común. La sobrevida a los 10 años de los pacientes con daño cardíaco moderado (estadio C) puede ser mayor del 50% y hasta del 85%, pero aquellos con daño avanzado, en clase funcional IV de la NYHA (estadio D), no tratados, tienen una mortalidad muy alta, mayor del 50% a los 2 años. La angiografía coronaria en todos los grupos es casi invariablemente normal o muestra lesiones obstructivas no significativas.
Tabla 1. Hallazgos clínicos, elec-trocardiográficos y ecocardio-gráficos en la miocardiopatía crónica chagásica
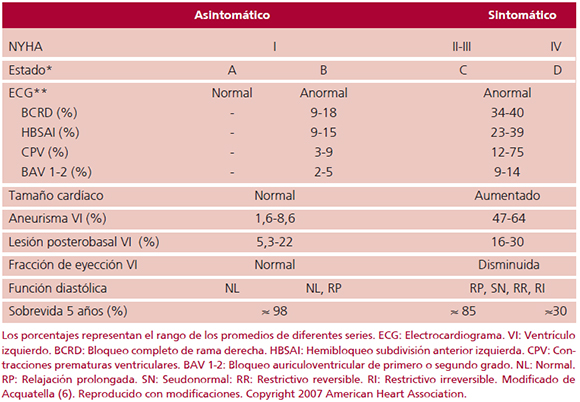
Fig. 1. Miocardiopatía crónica chagásica. Esquema de la evolución por décadas de las lesiones estructurales de las paredes ventriculares por ecocardiografía. Desde la fase indeterminada aparentemente normal (izquierda) hasta la forma de dilatación biventri-cular (derecha), en ocasiones con trombos apicales. Los segmentos en negro indican regiones fibrosas de cicatriz. Reproducido con autorización. Copyright©2011, Gaceta Médica de Caracas.
ENFERMEDAD DE CHAGAS AGUDA
Una de las series ecocardiográficas de mayor número de pacientes con enfermedad de Chagas aguda incluye 58 pacientes, entre los cuales más de la mitad tenían ecocardiogramas anormales. (11) Se observó derrame pericárdico en casi la mitad (42%). En 10 de 12 pacientes con insuficiencia cardíaca el derrame pericárdico era moderado a grave. Como dato de interés se encontró que casi las dos terceras partes (63%) tenían fracción de eyección ventricular izquierda (FEVI) normal; solo el 6% tenía dilatación del VI. El ECG fue anormal en el 41%. Cinco pacientes fallecieron, cuatro de ellos en IC. Se documentó miocarditis aguda chagásica por biopsia miocárdica en 26 y por necropsia en 3 niños. En otros dos trabajos (12, 13) se halló derrame pericárdico en 7 de 8 pacientes, tres de los cuales tenían taponamiento pericárdico.
La infestación chagásica oral puede originar una forma aguda de evolución clínica más grave por la enorme carga parasitaria. En 107 escolares y maestros de una escuela de Caracas infectados por ingestión de jugo de guayaba contaminado, (14) el 75% tuvieron síntomas, el 59% cambios en el ECG, se demostró parasitemia en el 44% y el 20% necesitaron hospitalización. Solo un niño de 5 años falleció por IC. En 18 ecocardiogramas efectuados, la mitad presentaban derrame pericárdico en general leve, pero 2/18 tuvieron taponamiento. La función sistólica fue normal en todos. El inicio temprano de parasiticidas probablemente evitó una evolución peor en esta serie. La imagen de la Figura 2 corresponde a una paciente adulta con taponamiento pericárdico que necesitó pericardiocentesis de urgencia. La exploración ecocardiográfica puede ser de enorme valor en todo paciente sintomático durante la fase aguda.
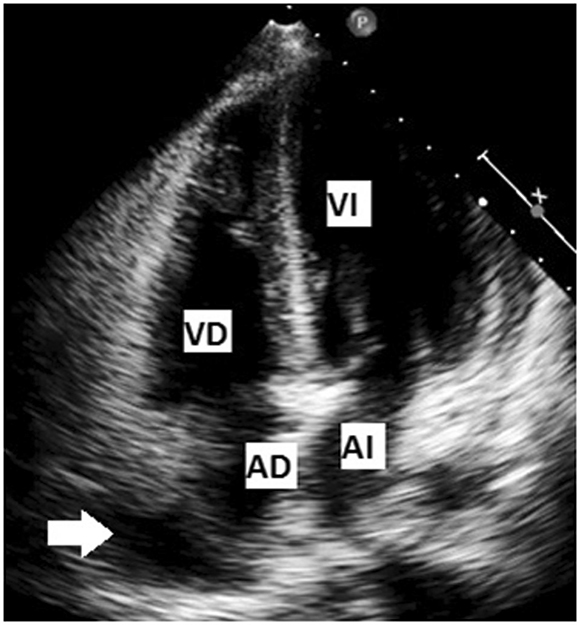
Fig. 2. Enfermedad de Chagas aguda. Imagen de cuatro cámaras de una mujer con miocarditis aguda chagásica con derrame pericárdico y taponamiento que requirió punción con drenaje. El tamaño de las cavidades y la función sistólica fueron normales. Puede observarse la compresión de la pared libre de la aurícula derecha. VD: Ventrículo derecho. VI: Ventrículo izquierdo. AD: Aurícula derecha. AI: Aurícula izquierda. Flecha: Indica la compresión de la pared libre de la AD. Reproducido con autorización. Copyright©2011, Gaceta Médica de Caracas.
ENFERMEDAD DE CHAGAS CRÓNICA
La mayoría de las autopsias de las series iniciales se realizaron en sujetos que fallecieron en las fases terminales avanzadas de la enfermedad, con dilatación biventricular. (1-4) Un trabajo pionero (15) llamó la atención sobre la alta frecuencia de aneurisma chagá-sico del VI en estos pacientes. Estos resultados fueron confirmados por otros, (16, 17) incluyendo una serie grande de 1.078 autopsias, (18) en donde el aneurisma apical se encontró en más de la mitad de los casos, con más frecuencia en el sexo masculino y con tasas similares en todos los grupos etarios. (18) En el 82% se encontró ectasia del VI, 9% en el ápex del ventrículo derecho (VD). En otras series las tasas han variado desde el 30% hasta el 92%. (3, 15, 17) Otras lesiones segmentarias del VI, como en la cara posteroinferior, se han comunicado desde un 21% (16) hasta un 33% (3) (Figura 3). (9)

Fig. 3. Ecocardiograma en modo M y corte cardíaco longitudinal post mortem de un paciente de 42 años con miocardiopatía crónica chagásica en su forma avanzada de insuficiencia cardíaca. A. Modo M a baja velocidad que muestra la preservación relativa contráctil septal (S); contrasta con la pared no contráctil posteroinferior delgada (PW). B. Corte cardíaco eje largo que muestra la cicatriz posteroinferior fibrótica adelgazada con la relativa preservación de la pared septal. El ventrículo derecho está dilatado. Las arterias coronarias fueron normales. (9) Reproducido con autorización. Copyright 1980, American Heart Association.
HALLAZGOS EN ECOCARDIOGRAFÍA DOPPLER
Anormalidades anatómicas
En sujetos asintomáticos puede ser difícil diferenciar un segmento apical delgado normal de una cicatriz apical delgada. Ello podría explicar las diferentes tasas de anormalidad apical encontradas entre las diferentes publicaciones. (19-26) La opacificación de la cavidad del VI con contraste combinada con imaginología armónica puede ser útil en casos difíciles. (19) El tamaño del aneurisma puede ser pequeño, como en "sacabocado", hasta un aneurisma indistinguible del causado por un infarto miocárdico.
El promedio de prevalencia del aneurisma del VI por eco bidimensional en 920 sujetos asintomáticos (indi-ferenciados) o con mínimo daño cardíaco provenientes de varias series fue del 8,5% (rango desde 1,6% hasta 8,6%) (19, 22, 24) y del 55% (rango desde 47% hasta 64%) (22-24, 26) en 242 pacientes con daño cardíaco moderado a grave (véase Tabla 1). En un trabajo que incluyó 1.053 pacientes, (25) las tasas fueron menos frecuentes, del 2% en pacientes con ECG normal y del 24% en pacientes con ECG anormal. Por medio de un análisis de regresión logística, el aneurisma del VI fue predictor independiente de trombo mural. (25)
Una complicación importante en la MCC la constituyen los eventos cardioembólicos, a menudo originados por trombos apicales (Figura 4). En una serie de 75 pacientes (26) estudiados por eco de superficie y transesofágico (ETE) con un seguimiento promedio de 2 años, el 47% tenían aneurisma apical, el 23% tenían trombos apicales, con una asociación significativa entre ambos para accidentes cerebro-vasculares (p < 0,01). Los trombos intracardíacos fueron más frecuentes en los pacientes con disfunción ventricular. Adicionalmente, el ETE permite detectar trombos auriculares.
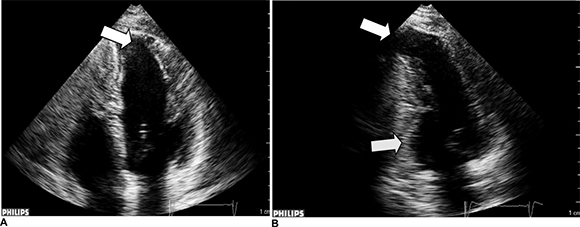
Fig. 4. A. Ventana apical de 4 cámaras en tiempo real que muestra discinesia apical (flecha) con preservación contráctil de las porciones medias y basales del septo y de la pared lateral del ventrículo izquierdo. B. Ventana apical de 2 cámaras que muestra un típico aneurisma apical con un gran trombo (flecha superior). El segmento inferobasal (flecha inferior) estaba acinético. El segmento inferior-medio y la cara anterior mostraban contracción normal. La ventana apical de 2 cámaras puede mostrar mejor el aneurisma apical del ventrículo izquierdo. El paciente sufrió una embolia en el brazo derecho como manifestación inicial. Modificado con autorización. Copyright©2011, Gaceta Médica de Caracas.
Por ecocardiografía pueden detectarse trastornos contráctiles segmentarios de las paredes del VI. Lo más común es en la pared posteroinferior: prevalencia promedio del 20% (rango del 5,3% hasta el 22%) (19, 22, 24, 27) en 1.164 sujetos asintomáticos o con daño cardíaco leve y del 23% (rango 16-30%) (22-24) en 280 pacientes sintomáticos o con IC (véase Figura 3).
Función sistólica
Los pacientes con la forma indeterminada casi invariablemente tienen función sistólica normal, (19, 21, 28-30) aunque algunos pueden tener ecocardiogramas anormales. (19) Entre 505 sujetos con ECG normales y una FEVI promedio del 67%, el 13% tenían lesiones segmentarias y el 0,8% tenían disfunción sistólica. Por el contrario, 257 personas con ECG anormales y una fracción de eyección normal promedio del 68%, el 33% tenían trastornos contráctiles segmentarios y el 8% tenían disfunción sistólica. Ambos grupos tenían dimensiones biventriculares normales en el fin de diástole. (19) Recientemente se ha utilizado la técnica de imagen de Doppler tisular (conocida en inglés como DTI), que permite estimar los cambios de velocidad miocárdica durante el ciclo cardíaco. Los sujetos que tienen ECG y ecocardiogramas normales pueden, sin embargo, tener un aumento del tiempo de contracción isovolúmica del VI (31, 32) y del VD (33) como expresión de trastornos contráctiles precoces. Por consiguiente, un ECG normal no descarta la existencia de otras anormalidades cuyo significado futuro actualmente no se conoce. En pacientes con ECG anormales, la función sistólica global tiene implicaciones pronósticas importantes. En una cohorte de 538 pacientes (30) agrupados en cuatro estadios progresivos de enfermedad (A a D), (7) las tasas de sobrevida fueron significativamente diferentes a los 5 años, del 98%, 91%, 45% y 13%, según si la FEVI era normal, levemente disminuida o tenían IC reversible o irreversible, respectivamente.
La disfunción sistólica puede desenmascararse por medio de estrés farmacológico, tanto en pacientes asintomáticos como en sintomáticos. Se ha observado una disminución de la respuesta cronotrópica, de contractilidad global y regional durante ecocardiografía de estrés con dobutamina. (34) Un grupo tuvo una respuesta bifásica (respuesta inicial de aumento contráctil seguido de hipocinesia con dosis altas de dobutamina), predominantemente en los segmentos posteroinferiores del VI, sugestivo de miocardio viable pero disfuncional. Los posibles mecanismos que expliquen esta respuesta son varios y complejos, e incluyen disfunción betaadrenérgica, disfunción endotelial, isquemia y daño estructural miocárdico. (34) Otros trabajos han encontrado una pendiente disminuida entre la relación de la dimensión/fin sistólica durante la infusión de adrenalina, (35) sugestiva de una reducción de la contractilidad del VI en sujetos con la forma indeterminada de la enfermedad, o con daño miocárdico leve o en portadores de la forma digestiva.
Función diastólica
El daño miocárdico crónico (1, 3, 4, 22) puede dificultar la relajación ventricular y el llenado diastólico. La disminución de la distensibilidad ventricular izquierda conduce a un aumento de la presión auricular izquierda, a cambios en las velocidades de flujo venoso trans-mitral y venosos pulmonares y a prolongación de los intervalos de tiempo sistólico y diastólico (Figura 5). La presencia de disfunción diastólica junto con niveles aumentados de BNP permitió detectar daño miocár-dico inicial. (36) La combinación del Doppler pulsado (PW) de la válvula mitral, junto con las velocidades del Doppler tisular (DTI) del anillo mitral (relación E/E') permiten estimar cuatro estadios progresivos de deterioro de disfunción diastólica: relajación anormal, seudonormal y llenados restrictivos reversible y no reversible. (37)
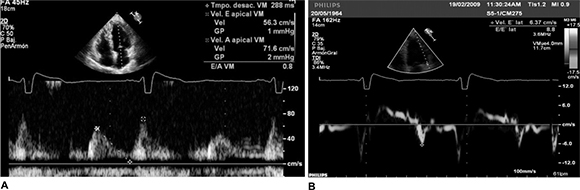
Fig. 5. A. Doppler pulsado mitral que muestra un patrón de llenado del ventrículo izquierdo tipo relajación prolongada, sugestivo de disfunción diastó-lica leve. Relación E/A de 0,8. B. Imagen de Doppler tisular obtenida a nivel de la porción más basal de la cara lateral que muestra prolongación de los tiempos de relajación y contracción isovolúmica, disminución de la onda de llenado E' para una relación E/E' de 8. Modificado con autorización. Copyright©2011, Gaceta Médica de Caracas.
Un grupo de 169 pacientes con MCC (22) fueron divididos de acuerdo con estos cuatro estadios. Se encontró disfunción diastólica en la quinta parte de los pacientes, con una fuerte correlación entre la peor función diastólica, con aumentos de las dimensiones auricular y ventricular izquierdas, y con una disminución de la FEVI. Una disminución de la onda E' septal DTI menor de 11 cm/s y de la relación septal E/E' con un punto de corte de 7,2 fue altamente sensible, moderadamente específica y de alto valor predictivo negativo para la detección de cualquier grado de disfunción diastólica (véase Figura 5). En otro estudio con 89 pacientes, (38) el grupo con función diastólica seudonormal tenía dimensiones mayores de fin de diástole y de sístole, peor puntaje de motilidad segmentaria parietal y menor FEVI al compararlo con el grupo de llenado normal. El DTI pudo diferenciar a los pacientes con MCC con función diastólica normal de aquellos con patrón seu-donormal y aumento de las presiones de llenado del VI. En otros trabajos que utilizaron trazados simultáneos de ecocardiogramas en modo M, fonocardiogramas y apexcardiogramas, (39, 40) se observó una prolongación significativa de los tiempos de relajación isovolúmica y de llenado ventricular tanto en sujetos asintomáticos con función sistólica normal como en pacientes sintomáticos. De hecho, las anormalidades diastólicas suelen preceder a la disfunción sistólica. (38-40)
Otras técnicas
El índice de rendimiento miocárdico (myocardial performance index: MPI, o índice de Tei) evalúa la función global ventricular combinando los tiempos de duración de la sístole y de la diástole por Doppler pulsado. (41) En un estudio de MPI comparativo de 88 pacientes con MCC con 45 controles no chagásicos (42) se encontraron valores altos anormales del MPI del VI (> 0,32) en el 36% de los asintomáticos, en el 100% de los sintomáticos y solo en el 2% de los sujetos control. Los sujetos asintomáticos chagásicos con ECG anormales presentaban MPI anormales, pero los sujetos control sanos con los mismos cambios del ECG no tenían MPI anormales. Los pacientes sintomáticos con valores de MPI del VD y del VI marcadamente anormales sugieren presencia de disfunción miocárdica grave. En otro trabajo (43) se empleó strain miocárdico (Figura 6) para evaluar la función radial y longitudinal contráctil del VI en sujetos con la forma indeterminada y en pacientes con FEVI superior o inferior al 50% y en sujetos control normales. Los porcentajes de acortamiento miocárdico segmentario tanto radial como longitudinal fueron significativamente mayores en los controles sanos que en los sujetos con MCC. Los pacientes con la forma indeterminada presentaban valores mayores que los pacientes con MCC con FEVI disminuida, pero la diferencia no fue estadísticamente significativa en comparación con los sujetos control sanos. Esta técnica permite cuantificar cambios sutiles de disfunción contráctil no detectados visualmente.
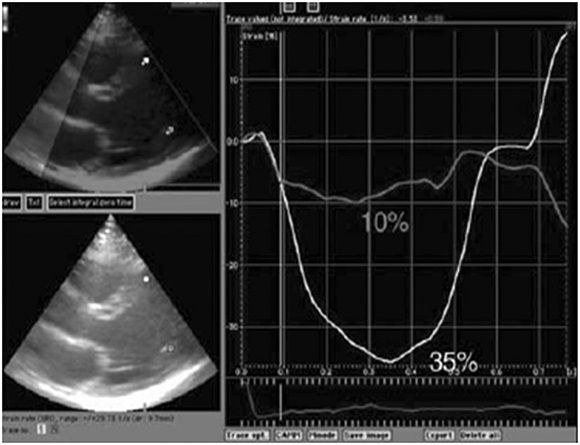
Fig. 6. Análisis de contractilidad miocárdica por strain. La pared septal (curva blanca) muestra un acortamiento sistólico normal, mientras que la pared posterior (gris) tiene una disfunción contráctil. Esta técnica y otras recientes ofrecen la oportunidad de detectar anormalidades ante de la aparición de disfunción sistóli-ca. (43) Reproducido con autorización. Copyright 2005, Arquivos Brasileiros de Cardiologia.
La reciente introducción de la ecocardiografía tridimensional ha facilitado la evaluación en el tiempo de la contractilidad de cada segmento del VI en forma simultánea, permitiendo detectar trastornos de la sincronía (Figura 7).
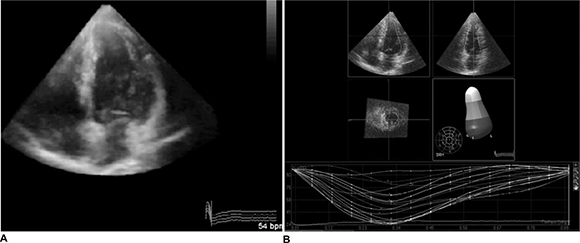
Fig. 7. A. Ecocardiograma tridimensional del paciente de la Figura 5. Varios procesamientos electrónicos permiten efectuar cortes (crop) para estudiar otras vistas. B. Contractilidad regional. Esta técnica permite medir el grado contráctil de cada segmento a lo largo del tiempo y detectar asincronía.
Ventrículo derecho
Por medio de angiografía radioisotópica biventricular se observó disfunción sistólica limitada al VD como la única anormalidad. (44, 45) En un estudio por eco-cardiografía Doppler bidimensional en 74 pacientes se encontró que la disfunción del VD fue secundaria a la gravedad del daño del VI y a los niveles elevados de presión pulmonar, más que por daño intrínseco del VD. (46) Adicionalmente se evaluó la función del VD por medio del índice de Tei en 158 pacientes dilatados con dimensión diastólica final del VI > 31 mm/área superficie corporal y FEVI < 55%. (47) Por análisis multivariado se encontró que el índice de Tei del VD añade un valor predictivo de mortalidad independiente posajuste por FEVI y grado funcional de la NYHA. Se concluyó que la disfunción grave del VD trae consigo un mal pronóstico en la MCC. (47) Más arriba se indicó que el DTI del VD permite detectar daño miocárdico en sujetos con la forma indeterminada con función sistólica normal. (33) En general, los pacientes con MCC desarrollan inicialmente síntomas izquierdos y en etapas avanzadas, síntomas de IC biventricular.
Variables ecocardiográficas pronósticas
Se seleccionaron publicaciones de estudios ecocar-diográficos de pacientes con MCC que estimaron pronóstico por el método de análisis multivariado de sobrevida de Cox (Tabla 2 y Figura 8). Las poblaciones estudiadas incluían sujetos con una amplia gama de gravedad de la enfermedad desde ninguna, (19, 29) hasta leve a moderada (19, 20, 25, 48, 49) y gravemente sintomática. (50, 51)
En las dos series que incluían sujetos asintomáticos con ECG normales a su ingreso no hubo muertes. En la serie de 159 pacientes no hubo eventos, (29) la FEVI permaneció normal en todos y los ECG no se modificaron en cerca del 80%; en la siguiente serie, (19) entre 505 sujetos asintomáticos con ECG normal, no hubo muertes y solo presentaron eventos el 8%. Pero dentro de 257 asintomáticos con ECG inicialmente anormal la mortalidad fue del 1% y el 26% presentaron eventos clínicos. En el resto de 87 pacientes con ECG inicial anormal, cardiomegalia, sin IC, la mortalidad fue del 14% y el 52% tuvieron eventos clínicos. Por análisis univariado y multivariado (19) fueron predictores de mortalidad los cambios del grupo clínico, la dimensión sistólica final del VI y la FEVI, en tanto que anormalidades del ECG originadas por Chagas, las dimensiones diastólicas y sistólicas del VI y la FEVI fueron predic-toras de eventos.
Tabla 2. Resultados de análisis de sobrevida de series ecocar-diográficas

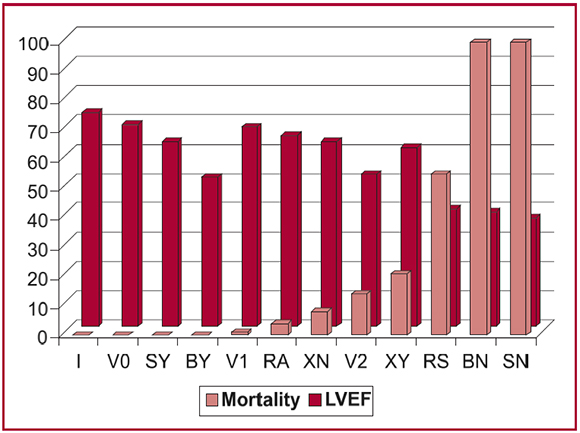
Fig. 8. Correlación inversa estadísticamente significativa entre la fracción de eyección del ventrículo izquierdo (FEVI) y mortalidad en 3.138 pacientes de seis series ecocardiográficas detalladas en la Tabla 2. La primera letra indica la inicial del autor, y la segunda letra el grupo clínico. I = Ianni (29); V = Viotti (19), grupos 0, 1, y 2; S = Salles (48,49), grupos Y (vivos) y N (fallecidos); B = Bes-tetti (5), grupos Y (vivos) y N (fallecidos); R = Rodríguez-Salas (20), grupos A (asintomáticos) y S (sintomáticos); X = Xavier (25), grupos Y y N (aneurisma sí o no) (6). Mortality: Mortalidad. LVEF: FEVI. Para otros detalles, véase el texto. (6) Reproducido con autorización. Copyright 2007, American Heart Association.
Los siguientes trabajos incluyen pacientes con IC. En una serie de 738 pacientes, (48, 49) por análisis de sobrevida univariado de Cox se encontraron diferencias significativas entre sobrevivientes y no sobrevivientes en las dimensiones de final de diástole y final de sístole, FEVI, masa del VI, disfunción sistólica moderada a grave y aneurisma apical. En el análisis multivariado, la dispersión del intervalo QT del ECG (QTd) y la dimensión sistólica final del VI fueron las variables predictoras independientes más significativas en todos los puntos finales. (48, 49) En otro trabajo que incluyó 1.053 sujetos clasificados según si presentaban o no aneurisma apical, (25) por análisis univariado se encontró que los pacientes con aneurisma tenían tasas de mortalidad significativamente mayores (total, cardíaca y súbita), IC, cardiomegalia radiológica, ECG anormal, FEVI inferior al 45%, trombo apical y aumentos de las dimensiones del VI de fin de sístole y de fin de diástole, pero en el análisis multivariado solo la FEVI fue la única variable predictora de mortalidad. El aneurisma apical no tuvo significación posajuste por FEVI.
Las siguientes series incluyeron pacientes con IC avanzada. En una serie de 56 pacientes en grado funcional III y IV de la NYHA, (50) por análisis univariado fueron predictores de mortalidad la FEVI, la dimensión diastólica del VI, el grado funcional IV de la NYHA y el uso de digital; pero por análisis multivariado solo la FEVI fue el único factor de riesgo. En otro estudio (20) de 283 pacientes agrupados según fueran asintomáti-cos o sintomáticos, los valores predictivos de muerte en el análisis univariado fueron las dimensiones de fin de diástole y de sístole del VI, el porcentaje de acortamiento del VI, la separación mitroseptal onda E, la relación radio-grosor del VI, la masa del VI y otras variables no ecocardiográficas. Por análisis de regresión múltiple, los factores predictores de riesgo de mortalidad fueron la clase funcional de la NYHA inicial, la separación mitroseptal onda E y la fracción de acortamiento. Finalmente, dos series estudiaron solo pacientes con IC. En una, con 56 pacientes con grado funcional III-IV de la NYHA, (50) el único factor significativo fue la FEVI. En otra serie de 104 sujetos masculinos (51) en grado funcional II, III y IV de la NYHA, la FEVI y el VO2máx fueron las variables estadísticamente significativas entre sobrevivientes y no sobrevivientes por análisis multivariado. Por consiguiente, en estas series, la disfunción sistólica y el aumento de las dimensiones cardíacas fueron las variables más significativas de predicción de morbilidad y mortalidad.
Se ha propuesto recientemente (52) un sistema de puntaje combinando variables clínicas y ecocardiográ-ficas. En 424 pacientes ambulatorios seguidos por un promedio de 7,9 años hubo 130 decesos. Por análisis de Cox se identificaron seis factores pronósticos de riesgo de muerte y a cada uno se le asignó un puntaje de acuerdo con el coeficiente de regresión: 5 puntos a grado funcional III-IV de la NYHA y/o cardiomegalia radiológica, 3 puntos a fracción de eyección ecocardio-gráfica baja y/o taquicardia ventricular no sostenida en Holter de 24 horas y 2 puntos a bajo voltaje QRS y/o sexo masculino. Riesgo bajo: 0-6 puntos, intermedio 7-11 puntos, alto 12-20 puntos. Las mortalidades a los 10 años fueron de 10%, 44% y de 84%, respectivamente. En un estudio comparativo de factores predictores de mortalidad entre 224 pacientes con MCC y 63 sujetos con miocardiopatía dilatada idiopática (MD), (53) con un seguimiento de casi 40 meses, fallecieron 104 pacientes y 9 fueron sometidos a trasplante cardíaco. Por análisis multivariado de Cox, los factores independientes predictores de eventos cardíacos fueron la clase funcional de la NYHA, la FEVI, el índice de Tei del VD, el volumen índice de la AI en ml/m2 y la etiología chagásica. En un subgrupo con reducción grave de la FEVI, a < 30%, la sobrevida en los pacientes con MCC fue del 55% y del 26% al año y a los 3 años, en tanto que en los sujetos con MD fue del 82% y del 67%, respectivamente.
Aurícula izquierda
El aumento del volumen de la aurícula izquierda (AI) ha demostrado que es un marcador pronóstico en la IC causada por diversas cardiopatías como expresión del aumento de presión de fin de sístole del VI. En una serie de 192 pacientes con MCC con un seguimiento promedio de casi dos años y medio, (54) el volumen in-dexado de la AI aumentó el valor predictivo pronóstico en forma independiente junto con la clase funcional de la NYHA, la FEVI, la función del VD y la relación Doppler de E/E'. El punto de corte asociado con exceso de mortalidad fue de 51 ml/m2 (p < 0,001).
En un estudio reciente comparativo (55) se evaluó la función de la AI por eco tridimensional en 30 pacientes con MCC, en 30 pacientes con miocardiopatía dilatada (MD) y en 20 sujetos normales. Se estimaron los volúmenes máximos (Volmáx AI/m2), los volúmenes mínimos (Vo l min AI/m2) y los volúmenes preauriculares de contracción para calcular la fracción de vaciamiento total y la fracción de vaciamiento activo de la AI. La FEVI y la gravedad de la regurgitación mitral fueron similares en ambos grupos de miocardiopatía. Los pacientes con MCC tenían Volmáx AI/m2 significativamente mayores que los pacientes con MD, y ambos mayores que el grupo control. La fracción de vaciamiento total de la AI fue significativamente menor en el grupo de MCC que en el grupo con MD, y ambos menores que en el grupo control. Lo mismo ocurrió con la fracción activa de vaciamiento de la AI. Además, la relación E/E' fue mayor en los pacientes con MCC que en los pacientes con MD. Por análisis de regresión múltiple el único factor predictor independiente de la peor fracción activa de vaciamiento de la AI fue la relación E/E'. Estos hallazgos sugieren que en la MCC hay un grado mayor de afectación auricular, probablemente relacionado con un aumento mayor de las presiones de llenado del VI. (55)
OTRAS TÉCNICAS DE IMAGEN
Nuclear
En un estudio de angiografía radioisotópica (56) efectuado en 30 pacientes con MCC se observó que la administración de dipiridamol, 20 mg I V, aumentó la FEVI y la fracción de eyección del VD y mejoró la disfunción contráctil de segmentos hipocinéticos, especialmente de las paredes apicales y de la cara inferior del VI y del VD. El uso crónico de dipiridamol oral podría mantener esa respuesta.
Por medio de cintigrafía radioisotópica con talio 201 (57) se observó una correlación entre anormalidades de perfusión miocárdica y la gravedad de la disfunción sistólica del VI, aun en los estadios iniciales de la enfermedad con la FEVI normal por ecocardiografía. Con el uso de 123I MIBG por tomografía computarizada por emisión de fotón único (SPECT), (58) se observaron defectos de captación segmentarios en el 33% de los 12 sujetos asintomáticos, en el 77% de 13 pacientes con ECG anormales y trastornos segmentarios por ecocardiografía, y en el 92% de 12 pacientes con daño cardíaco grave. Adicionalmente hubo una asociación topográfica marcada entre la perfusión, la inervación y las anormalidades contráctiles en todos los grupos. Los defectos predominaron en la cara inferior, en la posterolateral y en el ápex del VI.
En 36 pacientes se efectuó un estudio de seguimiento con tomografía computarizada por emisión de fotón único (SPECT talio 201) en reposo y bajo estrés para detectar trastornos de perfusión miocárdica (59) (Figura 9). Se realizó una revaluación prospectiva a los 5,6 ± 1,5 años con la intención de apreciar cambios en la FEVI y en el área de perfusión. Se observó un deterioro y una correlación significativa entre una reducción porcentual de la FEVI desde un 55% a un 50% asociada con un aumento del defecto de perfusión desde un 19% a un 27% aproximadamente. En forma adicional, 20 pacientes con angiografía coronaria normal mostraban defectos de perfusión reversibles del VI. Hubo una progresión de los defectos reversibles segmentarios iniciales a defectos en reposo en las dos terceras partes de los pacientes, en tanto que los segmentos sin trastornos reversibles iniciales solo progresaron en un 9%. Es interesante señalar que los segmentos afectados fueron de manera predominante los de la cara inferior y del ápex del VI, en forma similar a los observados por ecocardiografía. (6, 19, 22-24, 27) Estos hallazgos apoyan estudios previos (34) que implican trastornos de la microcirculación en la MCC probablemente por disfunción endotelial observados bajo efectos de infusión intracoronaria de acetilcolina.
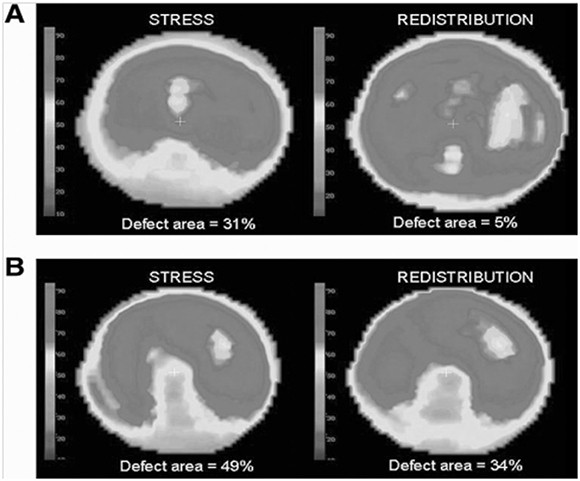
Fig. 9. Mapas polares de perfusión miocárdica con talio 201 durante estrés (stress) y redistribución (redistribution), inicial (A) y de seguimiento (B) a los 6,5 años. La fracción de eyección inicial disminuyó desde el 36% al 31%. Los defectos de perfusión comprometen el ápex y las paredes septal, inferoseptal, inferior e infero-lateral en el estudio inicial. En el estudio tardío los defectos de perfusión son más extensos. (59) Reproducido con autorización. Copyright 2009, American College of Cardiology.
Resonancia magnética
En 10 pacientes con MCC se estudió la captación de galio 67 por resonancia magnética (RM) (60) para evaluar el grado de inflamación miocárdica junto con biopsia endomiocárdica del ventrículo derecho y FEVI ecocardiográfica. Se compararon con 10 pacientes con miocardiopatía dilatada (MD). En 8 de 10 pacientes con MCC hubo aumento de intensidad de la señal, sugestivo de proceso inflamatorio de miocarditis, y en 1 de 10 fue dudoso. Solo en 1 de 10 sujetos con MD fue anormal. Para cuantificar el grado de fibrosis miocárdica (FM) por medio de la técnica de realce tardío miocár-dico por contraste con gadolinio, (61) se estudiaron 51 pacientes, clasificados en tres grupos. Grupo I: 15 pacientes asintomáticos (indiferenciados), grupo II: 26 pacientes con daño cardíaco y grupo III: 10 pacientes con taquicardia ventricular (Figura 10). Se observó FM en el 68,6% del total de los casos. La gravedad varió en cada grupo: 20% en el grupo I, 84,6% en el grupo II y 100% en el grupo III, y la extensión fue desde 0,9 ± 2,3% a 16,0 ± 12,3% hasta 25,4 ± 9,8% en cada grupo, respectivamente. Hubo también una correlación estadísticamente significativa con el grado funcional de la NYHA, y entre la FEVI y el trastorno contráctil segmentario. La RM permite detectar tempranamente la evolución de la MCC por la presencia de FM, su extensión y gravedad y tiene relación con otros parámetros de afectación miocárdica de la MCC.
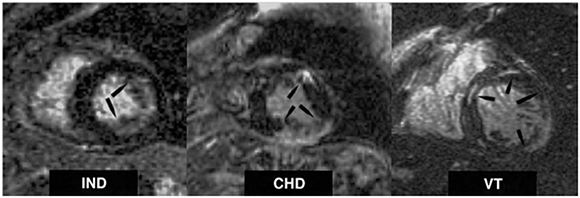
Fig. 10. Resonancia magnética con técnica de resalto tardío miocárdico por medio del contraste con gadolinio (flechas) en cortes del eje menor del ventrículo izquierdo en pacientes con miocardiopatía crónica cha-gásica (61) indicativos de áreas de fibrosis miocárdica. Grupos clínicos: IND, indeterminado; CHD: enfermedad de Chagas; VT: taquicardia ventricular. Reproducido con autorización. Copyright©2005, American College of Cardiology.
Aplicaciones en el manejo de pacientes
La ecocardiografía Doppler del corazón se ha incorporado a los estudios clínicos de la enfermedad de Chagas. Así, la estimación de la FEVI, como ya se señaló, mostró que es de gran valor pronóstico en los análisis de sobrevida de los pacientes, (19, 20, 25, 29, 48-51), en combinación con estudios nucleares (57-59) o de resonancia magnética con galio 67 para detectar inflamación miocárdica, (60) o con contraste con gadolinio en la detección de FM. (61)
La evaluación ecocardiográfica de disfunción sistó-lica y diastólica ha mostrado correlación con los niveles de péptido natriurético cerebral (BNP) en pacientes con MCC con o sin IC. (36, 62) Se ha empleado en el seguimiento de pacientes con implantes de marcapasos (63) o implantes de desfibriladores con cardioversión automáticos (64), en el estudio de medicamentos como el enalapril en la función diastólica, (65) o el parasiticida benznidazol. (66) Esta última droga se evaluó en un ensayo no aleatorizado en 566 pacientes; (66) mostró una disminución de la tasa de mortalidad en pacientes tratados en comparación con los no tratados (1,1% vs. 4,2%, respectivamente). Los únicos valores independientes predictivos de deterioro de estado clínico fueron una FEVI ecocardiográfica baja y el aumento de la dimensión final del VI, aunque esta última variable fue no significativa cuando se ajustó a la FEVI. Actualmente se encuentra en curso un estudio aleatorizado grande que evalúa el efecto del benznidazol en la MCC. (67)
Limitaciones
Varios de los hallazgos ecocardiográficos y de imagino-logía descriptos no son específicos y pueden observarse en otras miocardiopatías (isquémica y no isquémicas). Se necesitan más estudios comparativos para estimar la sensibilidad y la especificidad de estas anormalidades. Estudios con las nuevas técnicas de strain rate, speckle tracking y en especial con ecocardiografía tridimensional podrían ofrecer nueva información de utilidad diagnóstica y pronóstica. Por otra parte, la FEVI idealmente debe efectuarse por eco bidimensional o tridimensional en vez del tradicional ecocardiograma en modo M, que no permite evaluar las anormalidades frecuentes del ápex ventricular. No hay estudios que comparen directamente si hay diferencias en la expresión del daño cardíaco entre las regiones al sur o al norte del río Amazonas, como ocurre con el daño digestivo, desconocido al norte de América del Sur o en Centroamérica.
CONCLUSIONES
Los pacientes con miocarditis aguda chagásica deben ser evaluados de rutina mediante ecocardiografía, y en especial si presentan síntomas y signos de IC para excluir la presencia de derrame pericárdico y en particular taponamiento cardíaco. En la fase crónica, los sujetos con ECG normal tienen a largo plazo un buen pronóstico, la mayor parte tienen una función sistólica normal pero pueden tener anormalidades contráctiles y de la función diastólica, cuyo significado clínico de progresión de la enfermedad actualmente se desconoce. Los pacientes crónicos sintomáticos pueden tener como única anormalidad desde un pequeño aneurisma apical aislado hasta un corazón dilatado globalmente sin cicatrices segmentarias. Entre los diagnósticos diferenciales de miocardiopatía debe considerarse una posible etiología chagásica en pacientes con historia epidemiológica y serología positiva, con anormalidades ECG sugestivas y con aneurisma apical. Una disminución de la FEVI y un aumento en las dimensiones internas del VI han mostrado que tienen valor predictivo como factores de riesgo de morbimortalidad en los diferentes estudios de sobrevida de esta enfermedad. Las diversas modalidades de imagen se complementan mutuamente en el diagnóstico, el pronóstico y el seguimiento de estos pacientes.
Declaración de conflicto de intereses
Los autores declaran que no poseen conflicto de intereses.
1. Rassi Jr A, Rassi A, Marin-Neto JA. Chagas disease. Lancet 2010;375:1388-402. http://doi.org/bjmxcg [ Links ]
2. Rosenbaum MB, Alvarez AJ. The electrocardiogram in chronic cha-gasic myocarditis. Am Heart J 1955;50:492-527. http://doi.org/cr8rvr [ Links ]
3. Dias E, Laranja FS, Nobrega G, Miranda A. Chagas' disease; a clinical, epidemiologic, and pathologic study. Circulation 1956;14:1035-60. http://doi.org/kth [ Links ]
4. Elizari MV. Chagasic myocardiopathy: historical perspective. Medicina (B Aires) 1999;59(Suppl 2):25-40. [ Links ]
5. Hagar JM, Rahimtoola SH. Chagas' heart disease in the United States. N Engl J Med 1991;325:763-8. http://doi.org/cw4qtv [ Links ]
6. Acquatella H. Echocardiography in Chagas heart disease. Circulation 2007;115;1124-31. http://doi.org/bq7pr6 [ Links ]
7. Hunt SA; American College of Cardiology; American Heart Association Task Force on Practice Guidelines (Writing Committee to Update the 2001 Guidelines for the Evaluation and Management of Heart Failure). ACC/AHA 2005 guideline update for the diagnosis and management of chronic heart failure in the adult: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Update the 2001 Guidelines for the Evaluation and Management of Heart Failure). J Am Coll Cardiol 2005;46:e1-82. http://doi.org/b3m9qc [ Links ]
8. Puigbó JJ, Rhode JR, Barrios H, Suárez JA, Yepes C. Clinical and epidemiologic study of chronic heart involvement in Chagas' disease. Bull World Health Organ 1966;34:655-69. [ Links ]
9. Acquatella H, Schiller NB, Puigbó JJ, Giordano H, Suárez JA, Casal H, et al. M-mode and two dimensional echocardiography in chronic Chagas' heart disease. A clinical and pathologic study. Circulation 1980;62:787-99. http://doi.org/ktj [ Links ]
10. Acquatella A, Catalioti F, Gómez-Mancebo JR, Dávalos V, Villalobos L. Long-term control of Chagas disease in Venezuela: effects on serologic findings, electrocardiographic abnormalities, and clinical outcome. Circulation 1987;76:556-62. http://doi.org/dnnx6z [ Links ]
11. Parada H, Carrasco HA, Añez N, Fuenmayor C, Inglessis I. Cardiac involvement is a constant finding in acute Chagas' disease: a clinical, parasitological and histopathological study. Int J Cardiol 1997;60:49-54. http://doi.org/ft8kmt [ Links ]
12. Carme B, Aune I, Nguyen G, Aznar C, Beaudet B. Four cases of acute chagasic myocarditis in French Guiana. Am J Trop Med Hyg 2001;64:162-3. [ Links ]
13. Pinto AY, Valente SA, Valente Vda C. Emerging acute Chagas disease in Amazonian Brazil: case reports with serious cardiac involvement. Braz J Infect Dis 2004;8:454-60. http://doi.org/cpd4bw [ Links ]
14. Alarcón de Noya B, Díaz-Bello Z, Colmenares C, Ruiz-Guevara R, Mauriello L, Zavala-Jaspe R, et al. Large urban outbreak of orally acquired acute Chagas disease at a school in Caracas, Venezuela. J Infect Dis 2010;201:1308-15. http://doi.org/bqr7d4 [ Links ]
15. Moia B, Rosenbaum MB, Hojman D. Aneurismas ventriculares en la miocarditis crónica chagásica. Rev Argent Cardiol 1955;22:113. [ Links ]
16. Suárez JA, Puigbó JJ, Nava-Rhode JR, Valero JA, Gil-Yepes C. Pathological study of 210 cases of cardiomyopathies in Venezuela. Acta Med Venez 1968;15:320-30. [ Links ]
17. Andrade ZA. Anatomia patológica da doença de Chagas. Rev Goiania Med 1958;4:103-19. [ Links ]
18. Oliveira JS, Mello De Oliveira JA, Frederigue U Jr, Lima Filho EC. Apical aneurysm of Chagas' heart disease. Br Heart J 1981;46:432-7. http://doi.org/bmt684 [ Links ]
19. Viotti RJ, Vigliano C, Laucella S, Lococo B, Petti M, Bertocchi G, Ruiz Vera B, Armenti B. Value of echocardiography for diagnosis and prognosis of chronic Chagas disease cardiomyopathy without heart failure. Heart 2004;90:655-60. http://doi.org/dnpr2v [ Links ]
20. Rodríguez-Salas LA, Klein E, Acquatella H, Catalioti F, Dávalos V, Gómez-Mancebo JR, González H, Bosch F, Puigbó JJ. Echocardiogra-phic and clinical predictors of mortality in chronic Chagas' disease. Echocardiography 1998;15:271-8. http://doi.org/bszkmx [ Links ]
21. Pereira-Barreto AC, Serro-Azul LG, Mady C, Ianni BM, Vianna CB, Belloti G, Pileggi F. Indeterminate form of Chagas' disease. A polymorphic disease. Arq Bras Cardiol 1990;55:347-53. [ Links ]
22. Migliore RA, Adaniya ME, Tamagusuku H, Lapuente A. Assessment of diastolic function in Chagas' disease with pulsed Doppler tissue imaging. Arch Cardiol Mex 2004;74:31-8. [ Links ]
23. Câmara EJN. Segmental changes in contractility of the left heart ventricle in Chagas cardiomyopathy with and without ventricular dilatation. Arq Bras Cardiol 1993;60:151-5. [ Links ]
24. Acquatella H. Present status of Chagas disease in Venezuela and therapeutic management. Gac Méd Caracas 2003;111:136-56. [ Links ]
25. Xavier SS, de Sousa AS, do Brasil PEAA, Gabriel FG, de Holanda MT, Hasslocher-Moreno A. Apical aneurysm in the chronic phase of Chagas disease: prevalence and prognostic value in an urban cohort of 1053 patients. SOCER. 2005;18:351-6. [ Links ]
26. Nunes MCP, Barbosa MM, Rocha MOC. Peculiar aspects of cardiogenic embolism in patients with Chagas' cardiomyopathy: a transthoracic and transesophageal echocardiographic study. J Am Soc Echocardiogr 2005;18:761-7. http://doi.org/bqf2gd [ Links ]
27. Ortiz J, Pereira-Barreto AC, Matsumoto AY, Mônaco CAF, Ianni BA, Marotta RHQ, et al. Segmental contractile changes in indeterminate form of Chagas' disease: echocardiographic study. Arq Bras Cardiol 1987;49:217-20. [ Links ]
28. Maciel BC, de Almeida-Filho OC, Schmidt A, Marin-Neto JA. Ventricular function in Chagas' heart disease. São Paulo Med 1995;113:814-20. http://doi.org/fnk7vm [ Links ]
29. Ianni BM, Arteaga E, Frimm CC, Barreto ACP, Mady C. Chagas' heart disease: evolutive evaluation of electrocardiographic and echo-cardiographic parameters in patients with the indeterminate form. Arq Bras Cardiol 2001;77:59-62. http://doi.org/b2ps6h [ Links ]
30. Xavier SS, Sousa AS, Hasslocher-Moreno A. Application of the new classification of cardiac insufficiency (ACC/AHA) in chronic Chagas cardiopathy: a critical analysis of the survival curves. SO-CERJ 2005;18:227-32. [ Links ]
31. Barros MVL, Rocha MOC, Ribeiro ALP, Machado FS. Doppler tissue imaging to evaluate early myocardium damage in patients with undetermined form of Chagas' disease and normal echocardiogram. Echocardiography 2001;18:131-36. http://doi.org/bj4gbj [ Links ]
32. Barros MVL, Ribeiro ALP, Santana-Machado F, Rocha MOC. Doppler tissue imaging to assess systolic function in Chagas' disease. Arq Bras Cardiol 2003;80:36-40. http://doi.org/c55b7d [ Links ]
33. Barros M V, Machado FS, Ribeiro AL, Da Costa Rocha MO. Detection of early right ventricular dysfunction in Chagas' disease using Doppler tissue imaging. J Am Soc Echocardiogr 2002;15:1197-201. http://doi.org/d7hsqz [ Links ]
34. Acquatella H, Pérez J, Condado JA, Sánchez I. Limited myocardial contractile reserve and chronotropic incompetence in patients with chronic Chagas' disease. J Am Coll Cardiol 1999;33:522-9. http://doi.org/bd9tk7 [ Links ]
35. Almeida-Filho OC, Maciel BC, Schmidt A, Pazin-Filho A, Marin--Neto JA. Minor segmental dyssynergy reflects extensive myocardial damage and global left ventricle dysfunction in chronic Chagas disease. J Am Soc Echocardiogr 2002;15:610-6. http://doi.org/d5czhr [ Links ]
36. Garcia-Alvarez A, Sitges M, Pinazo MJ, Regueiro-Cueva A, Posada E, Poyatos S, et al. Chagas cardiomiopathy: the potential of diastolic dysfunction and brain natriuretic peptide in the early identification of cardiac damage. PLoS Negl Trop Dis 2010;4:e826. http://doi.org/bc88kj [ Links ]
37. Quiñones MA, Otto CM, Stoddard M, Waggoner A, Zoghbi WA. Recommendations for quantification of Doppler echocardiography: a report from the Doppler quantification task force of the nomenclature and standards committee of the American Society of Echocardiogra-phy. J Am Soc Echocardiogr 2002;15:167-84. http://doi.org/bhqc8j [ Links ]
38. Barros MVL, Rocha MOC, Ribeiro ALP, Machado FS. Tissue Doppler imaging enables the identification of diastolic dysfunction of pseudonormal pattern in Chagas' disease. J Am Soc Echocardiogr 2001;14:353-9. http://doi.org/fg8g2b [ Links ]
39. Combellas I, Puigbó JJ, Acquatella H, Tortoledo F, Gómez JR. Echocardiographic features of impaired left ventricular diastolic function in Chagas' heart disease. Br Heart J 1985;53:298-309. http://doi.org/dkdhd5 [ Links ]
40. Migliore RA, Guerrero F T, Armenti A, Fernández C, Adaniya ME, Iannariello J, et al. Diastolic function in Chagas disease. Medicine (B Aires) 1990;50:537-42. [ Links ]
41. Tei C, Ling LH, Hodge DO, Bailey KR, Oh JK, Rodeheffer RJ, Tajik AJ, Seward JB. New index of combined systolic and diastolic myocardial performance: a simple and reproducible measure of cardiac function study in normals and dilated cardiomyopathy. J Cardiol 1995;26:357-66. [ Links ]
42. Yacoub S, Birks EJ, Slavik Z, Henein M. Early detection of myo-cardial dysfunction in Chagas disease using novel echocardiographic indices. Trans R Soc Trop Med Hyg 2003;97:528-34. http://doi.org/dr4qsh [ Links ]
43. Silva CE, Ferreira LD, Peixoto LB, Monaco CG, Gil MA, Ortiz J, et al. Evaluation of segmentary contractility in Chagas' disease by using the integral of the myocardial velocity gradient (myocardial strain) obtained through tissue Doppler echocardiography. Arq Bras Cardiol 2005;84:285-91. http://doi.org/fss83t [ Links ]
44. Maciel BC, Almeida-Filho OC, Schmidt A, Marin-Neto JA. Ventricular function in Chagas' heart disease. São Paulo Med J 1995;113:814-20. http://doi.org/fnk7vm [ Links ]
45. Marin-Neto JA, Bromberg-Marin G, Pazin-Filho A, Simoes M V, Maciel BC. Cardiac autonomic impairment and early myocardial damage involving the right ventricle are independent phenomena in Chagas' disease. Int J Cardiol 1998;65:261-69. http://doi.org/b3vs97 [ Links ]
46. Nunes MCP, Barbosa MM, Brum VAA, Rocha MOC. Morpho-functional characteristics of the right ventricle in Chagas' dilated cardiomyopathy. Int J Cardiol 2004;94:79-85. http://doi.org/cjwrj3 [ Links ]
47. Nunes MCP, Rocha MOC, Ribeiro ALP, Colosimo EA, Rezende RA, Carmo GAA, et al. Right ventricular dysfunction is an independent predictor of survival in patients with dilated chronic Chagas' cardiomyopathy. Int J Cardiol 2008;127:372-9. http://doi.org/b7w74c [ Links ]
48. Salles G, Xavier S, Sousa A, Hasslocher-Moreno A, Cardoso C. Prognostic value of QT interval parameters for mortality risk stratification in Chagas' disease. Results of a long-term follow-up study. Circulation 2003;108:305-12. http://doi.org/c9tzmd [ Links ]
49. Salles G F, Cardoso CLR, Xavier SS, Sousa AS, Hasslocher-Moreno A. Electrocardiographic ventricular repolarization parameters in chronic Chagas' disease as predictors of asymptomatic left ventricular systolic dysfunction. PACE 2003;26:1326-35. http://doi.org/b8327f [ Links ]
50. Bestetti RB, Dalbo CM, Freitas OC, Teno LA, Castilho OT, Oliveira JS. Noninvasive predictors of mortality for patients with Chagas' heart disease: a multivariate stepwise logistic regression study. Cardiology 1994;84:261-67. http://doi.org/dk5x55 [ Links ]
51. Mady C, Cardoso RH, Barretto AC, da Luz PL, Bellotti G, Pileggi F. Survival and predictors of survival in patients with congestive heart failure due to Chagas' cardiomyopathy. Circulation 1994;90:3098-102. http://doi.org/kd3 [ Links ]
52. Rassi Jr A, Rassi A, Little WC, Xavier SS, Rassi SG, Rassi AG, et al. Development and validation of a risk score for predicting death in Chagas' heart disease. N Engl J Med 2006;355:799-808. http://doi.org/dkz2g8 [ Links ]
53. Nunes MCP, Barbosa MM, Ribeiro ALP, Fenelon LMA, Rocha MOC. Factores predictivos de la mortalidad en pacientes con miocardiopatía dilatada: importancia de la enfermedad de Chagas como etiología. Rev Esp Cardiol 2010;63:788-97. http://doi.org/ftrq6n [ Links ]
54. Nunes MCP, Barbosa MM, Ribeiro ALP, Colosimo EA, Rocha MOC. Left atrial volume provides independent prognostic value in patients with Chagas cardiomyopathy. J Am Soc Echocardiogr 2009;22:82-8. http://doi.org/d2992n [ Links ]
55. Mancuso FJ, Almeida DR, Moisés VA, Oliveira WA, Mello ES, Poyares D, et al. Left atrial dysfunction in Chagas cardiomyopathy is more severe than in idiopathic dilated cardiomyopathy: a study with real-time three-dimensional echocardiography. J Am Soc Echocardiogr 2011;24:526-32. http://doi.org/bxk5s5 [ Links ]
56. Kuschnir E, Sgammini H, Castro R, Evequoz C, Ledesma R. Miocardiopatía chagásica crónica: efectos del dipiridamol sobre la dinámica ventricular. Arq Bras Cardiol 1983;41:373-8. [ Links ]
57. Marin-Neto JA, Marzullo P, Marcassa C, Gallo Júnior L, Maciel BC, Bellina CR, et al. Myocardial perfusion abnormalities in chronic Chagas' disease as detected by thallium-201 scintigraphy. Am J Car-diol 1992;69:780-4. http://doi.org/fhsvr3 [ Links ]
58. Simões M V, Pintya AO, Bomberg-Marin G, Sarabanda A V, Antloga CM, Pazin-Fliho A, et al. Relation of regional sympathetic denervation and myocardial perfusion disturbance to wall motion impairment in Chagas' cardiomyopathy. Am J Cardiol 2000;86:975-81. http://doi. org/c759xr [ Links ]
59. Hiss FC, Lascala T F, Maciel BC, Marin-Neto JA, Simões M V. Changes in myocardial perfusion correlate with deterioration of left ventricular systolic function in chronic Chagas' cardiomyopathy. J Am Coll Cardiol Img 2009;2;164-72. [ Links ]
60. Bocchi EA, Kalil R, Bacal F, de Lourdes Higuchi M, Meneghetti C, Mag-alhaes A, Belotti G, et al. Magnetic resonance imaging in chronic Chagas' disease: correlation with endomyocardial biopsy findings and gallium-67 cardiac uptake. Echocardiography 1998;15:279-88. http://doi.org/bqjhhc [ Links ]
61. Rochitte CE, Oliveira P F, Andrade JM, et al. Myocardial delayed enhancement by magnetic resonance imaging in patients with Chagas' disease: a marker of disease severity. J Am Coll Cardiol 2005;46:1553-8. http://doi.org/d2f5zx [ Links ]
62. Barbosa MM, Nunes MD, Ribeiro AL, Barral MM, Rocha MO. N-terminal proBNP levels in patients with Chagas disease: a marker of systolic and diastolic dysfunction of the left ventricle. Eur J Echo-cardiogr 2006:S1525-2167. http://doi.org/c8zxcv [ Links ]
63. da Silva Menezes A. Outcome of right ventricular bifocal pacing in patients with permanent atrial fibrillation and severe dilated cardiomiopathy due to Chagas disease: three years of follow-up. J Interv Card Electrophysiol 2004;11:193-8. [ Links ]
64. Cardinalli-Neto A, Greco O T, Bestetti RB. Automatic implant-able cardioverter-defibrillators in Chagas' heart disease patients with malignant ventricular arrhythmias. Pacing Clin Electrophysiol 2006;26:467-70. http://doi.org/dr8vxn [ Links ]
65. Szajnbok FE, Barretto AC, Mady C, Parga Filho J, Gruppi C, Alfieri RG, et al. Beneficial effects of enalapril on the diastolic function in Chagas cardiomyopathy. Arq Bras Cardiol 1993;60:273-8. [ Links ]
66. Viotti R, Vigliano C, Lococo B, Bertocchi G, Petti M, Alvarez MG, et al. Long-term cardiac outcomes of treating chronic Chagas disease with benznidazole versus no treatment. A nonrandomized trial. Ann Int Med 2006:144:724-34. [ Links ]
67. Marin-Neto JA, Rassi A Jr, Morillo CA, Avezum A, Connolly SJ, Sosa-Estani S, et al. BENEFIT Investigators. Rationale and design of a randomized placebo-controlled trial assessing the effects of etiologic treatment in Chagas' cardiomyopathy: the BENznidazole Evaluation For Interrupting Trypanosomiasis (BENEFIT). Am Heart J 2008;156:37-43. http://doi.org/dbrt2v [ Links ]














