Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista argentina de cardiología
On-line version ISSN 1850-3748
Rev. argent. cardiol. vol.81 no.4 Ciudad Autónoma de Buenos Aires Aug. 2013
PRESENTACIÓN DE CASOS
Tratamiento percutáneo de cardiopatías congénitas en el síndrome de Rubinstein-Taybi
Percutaneous Treatment of Congenital Heart Defects in the Rubinstein-Taybi Syndrome
Alejandro ContrerasMTSAC, 1, Ana Masciarelli1, Analía Bontempo2, Aníbal Gentiletti2, Alejandro PeironeMTSAC, 1
MTSAC Miembro Titular de la Sociedad Argentina de Cardiología
1 Hospital Privado Centro Médico de Córdoba
2 Hospital Italiano de Rosario
Recibido: 18/11/2012
Aceptado: 23/01/2013
Dirección para separatas: Dr. Alejandro Peirone
Hospital Privado Centro Médico de Córdoba Naciones Unidas 346 Barrio Parque Vélez Sarsfield (X5016KEH) Córdoba, Argentina
Declaración de conflicto de intereses
Los autores declaran que no poseen conflicto de intereses.
RESUMEN
El síndrome de Rubinstein-Taybi es producido por una anomalía genética y se caracteriza por una facies típica, anomalías de manos y pies, microcefalia y retraso mental. Alrededor del 30% de los individuos afectados tienen defectos cardíacos congénitos asociados. En esta presentación se describen los casos de dos pacientes con diagnóstico de síndrome de Rubinstein-Taybi asociado con alteraciones cardíacas congénitas. Uno de ellos, de 25 años, presentaba coartación de la aorta nativa, localizada en la región yuxtaductal, y el otro, de 11 meses de edad, mostraba un conducto arterioso permeable de tamaño grande. Ambos pacientes recibieron tratamiento intervencionista percutáneo exitoso, con evolución alejada satisfactoria.
Palabras clave: Síndrome de Rubinstein; Taybi; Cardiopatía congénita; Coartación de la aorta; Ductus arterioso permeable; Tratamiento percutáneo
ABSTRACT
Percutaneous Treatment of Congenital Heart Defects in the Rubinstein-Taybi Syndrome
The Rubinstein-Taybi syndrome is a genetic disorder charac-terized by distinctive facial features, anomalies in hands and feet, microcephaly and mental disability. Approximately 30% of subjects affected with this syndrome have associated congenital cardiac defects. This presentation describes two cases of Rubistein-Taybi syndrome with congenital cardiac disorder: a 25-year old patient with native juxtaductal coarctation of the aorta and an 11-month old infant, with large patent ductus arteriosus. Both patients underwent successful percutaneous intervention, with satisfactory long-term outcome.
Key words: Rubinstein-Taybi Syndrome; Congenital Heart Disease; Coarctation of Aorta; Patent Ductus Arteriosus; Percutaneous Treatment
Abreviaturas
MMII Miembros inferiores
MMSS Miembros superiores
SRT Síndrome de Rubinstein-Taybi
INTRODUCCIÓN
El síndrome de Rubinstein-Taybi (SRT) es producido por una alteración genética, habitualmente esporádica; se caracteriza por una facies típica, anomalías de manos y pies, microcefalia y retraso mental. Esta alteración se manifiesta por una deleción submicroscópica a nivel de la región cromosómica 16p 13.3, y el defecto molecular subyacente es una mutación o una deleción de un gen llamado CREB-binding protein (CBP) o E1A binding protein (p300). (1)
La prevalencia del síndrome es de 1 en 100.000 a 125.000 nacimientos y la expectativa de vida es normal. Los afectados padecen con frecuencia meningiomas, tumores cerebrales y leucemia. Alrededor del 30% de los individuos con este síndrome tienen defectos cardíacos congénitos, principalmente conducto arterioso permeable, comunicación interventricular y comunicación interauricular. (2)
En esta presentación se describen los casos de dos pacientes con SRT asociado con alteraciones cardíacas congénitas (conducto arterioso permeable y coartación de la aorta) que fueron tratadas exitosamente por vía intervencionista percutánea.
CASOS CLÍNICOS
Caso 1
Paciente varón de 25 años, nacido de término con un peso de 3.250 gramos, primogénito de una pareja sin antecedentes familiares patológicos. Se le diagnosticó coartación de la aorta al mes de vida y se indicó manejo conservador. Se confirmó SRT al año de vida mediante estudios genéticos solicitados por falta de descenso de ambos testículos y sospecha clínica de síndrome genético: facies peculiar, alteraciones en manos y pies y retraso mental.
A la edad de 24 años fue evaluado en su ciudad natal por disnea y mala tolerancia a la actividad física y se le rediagnosticó coartación de la aorta nativa. Fue derivado a nuestro servicio para evaluar la posibilidad de realizar tratamiento percutáneo. En el examen físico presentó un R1 normal, soplo sistólico eyectivo 2/6 en el borde esternal izquierdo bajo y dorso y R2 normal. Los pulsos femorales estaban ausentes. La tensión arterial en los miembros superiores (MMSS) fue de 130/80 mm Hg y en los inferiores (MMII) de 80/40 mm Hg. El electrocardiograma evidenció ritmo sinusal e hipertrofia ventricular izquierda por voltaje. La telerradiografía de tórax mostraba ligera cardiomegalia a expensas del ventrículo izquierdo. Se solicitó una resonancia magnética nuclear que mostró el arco aórtico izquierdo con emergencia normal de los vasos del cuello y una coartación de la aorta yuxtaductal grave con escasa circulación colateral.
Bajo anestesia general se realizó la colocación percutánea de un stent CP insuflado con balón BIB (NuMed®, USA), sin complicaciones (Figura 1). Los controles posintervención a los 15 días, 3 meses y 6 meses evidenciaron mejoría clínica significativa, con cifras tensionales sin diferencias comparando MMSS y MMII (110/60 mm Hg) y recuperación de palpación de pulsos en los MMII. Durante su último control se realizó una telerradiografía de tórax en la que se visualizó el stent en normoposición, sin fracturas.
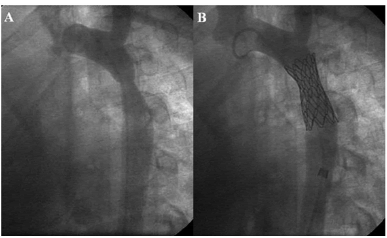
Fig. 1. Angiografías en proyección oblicua anterior izquierda (60°) precolocación (A) y poscolocación (B) de stent por coartación de la aorta nativa de grado moderado-grave, localizada, con escasa presencia de circulación colateral. El arco aórtico es de tipo izquierdo con emergencia normal de los vasos del cuello. Luego de la colocación del stent se observa una mejoría significativa del calibre aórtico, al igual que una abolición de gradiente a través de la región previamente coartada.
Caso 2
Paciente de sexo femenino, de 11 meses de edad y peso de 6.300 gramos, nacida pretérmino (34 semanas) con un peso al nacer de 1.700 gramos. Se le realizó diagnóstico genético de SRT al mes de vida debido a sospecha clínica por fenotipo. Presentaba además taquipnea, perspiración profusa, ganancia inadecuada de peso e infecciones respiratorias frecuentes. En el examen físico mostraba un R1 normal, clics múltiples, soplo continuo 3/6 en BEI alto y un R2 ligeramente intenso. El hígado se palpaba a 2 cm debajo del reborde costal derecho. Estaba siendo medicada con digoxina y furosemida diariamente. Un ecocardiograma Doppler color mostró persistencia de un conducto arterioso permeable de 4,5 mm de diámetro, dilatación de cavidades izquierdas e hipertensión arterial pulmonar moderada.
Bajo anestesia general se realizó el cierre percutáneo del conducto arterioso permeable por vía anterógrada implantando un dispositivo Nit-Occlud PDA-R (pfm®, Alemania), con oclusión inmediata del defecto (Figura 2). Los controles durante el seguimiento a los 10 días, 3 meses y 6 meses posintervención fueron normales, descartando cortocircuitos residuales a través del dispositivo y evidenciando una mejoría clínica significativa además de una tendencia ascendente en la curva de peso.
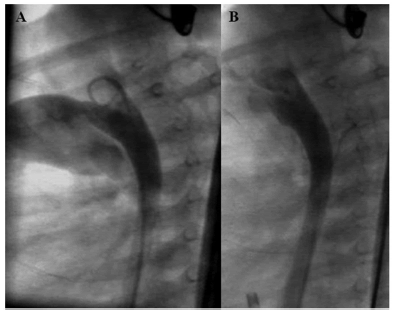
Fig. 2. Angiografías en proyección lateral izquierda (90°) precierre (A) y poscierre (B) del conducto arterioso permeable mediante implante de dispositivo. En A se observa un conducto arterioso permeable con buen desarrollo de ámpula aórtica y estrechamiento pulmonar, de tamaño grande. Se observan opacificación completa del tronco y ramas de arterias pulmonares, las cuales están dilatadas. Luego del implante (B), se observa el dispositivo in situ con oclusión completa del defecto.
DISCUSIÓN
Las malformaciones cardíacas congénitas representan la causa más significativa de la enfermedad cardiovascular pediátrica, constituyendo el mayor porcentaje de defectos clínicamente importantes al nacimiento. Su prevalencia aproximada es de 6-8 por 1.000 nacidos vivos. (3)
Aunque la mayoría de las malformaciones cardíacas congénitas ocurren aisladas, aproximadamente el 25% se presentan en asociación con otros defectos congénitos y a menudo son parte de un patrón específico o un síndrome genético. (4)
Inicialmente descripto por Michail y colaboradores en 1957 como broad thumb-hallux syndrome (síndrome de pulgar-dedo gordo anchos) y luego redescripto por Rubinstein y Taybi en 1963, (5) esta enfermedad se encuadra entre los síndromes con facies característica y anormalidades en las extremidades. Son frecuentes una facies con nariz prominente y columela que sobrepasa las alas nasales asociada con pulgares y primeros ortejos anchos y cortos y con frecuencia bífidos. (1) A menudo presentan cardiopatías congénitas, con una prevalencia aproximada del 33%. Stevens y Bhakta describieron específicamente la frecuencia de defectos cardíacos encontrados entre los 138 individuos con diagnóstico de SRT incluidos en su estudio, estimando que 45 de ellos (32,6%) mostraban alguna anomalía cardíaca. La mayoría de los pacientes tenían, en orden decreciente, un defecto único: comunicación interauricular, comunicación interventricular, conducto arterioso permeable, coartación de la aorta, estenosis valvular pulmonar o válvula aórtica bicúspide. Defectos cardíacos congénitos complejos que incluían dos o más anomalías estuvieron presentes en 16 pacientes. La estenosis valvular pulmonar se halló en tan solo un paciente como anomalía aislada. (6)
El conducto arterioso permeable constituye alrededor del 10% de todas las cardiopatías congénitas y se ubica segunda en frecuencia, luego de la válvula aórtica bicúspide.
Casos ocasionales están vinculados a defectos genéticos específicos como las trisomías 21 y 18 y síndromes delecionales 4q-, 16p 13.3 (SRT) y 9p-. Pacientes que presentan un conducto de tamaño moderado-grande manifiestan repercusión hemodinámica, con síntomas de insuficiencia cardíaca de alto gasto y probabilidad de desarrollar hipertensión arterial pulmonar a largo plazo. En la actualidad, el cierre percutáneo de este defecto muestra excelentes resultados, con tasas de oclusión inmediata mayores al 90% y raras complicaciones, siendo este método el tratamiento de elección. El cierre quirúrgico es otra alternativa y está indicado en pacientes prematuros que no responden al tratamiento médico inicial, en lactantes pequeños con defectos de gran tamaño o cuando el cierre percutáneo no ha sido exitoso. (7)
La coartación de la aorta es la quinta cardiopatía en orden de frecuencia, con una incidencia de 1 en 2.500 nacidos vivos. La etiología es controversial y se han descripto casos familiares y asociación con varias deleciones genéticas. Algunos pacientes pueden evolucionar asintomáticos hasta la adolescencia, debido a una coartación menos grave o al desarrollo de circulación colateral prominente. La angioplastia con balón fue comunicada por primera vez en 1982, con resultados iniciales alentadores, pero tasas altas de recoartación y desarrollo de alteraciones mecánicas de la pared aórtica (aneurismas, disecciones y/o desgarros intimales significativos) durante el seguimiento. El implante de stent ha mejorado los resultados, con disminución en la incidencia de recoartación de la aorta y de alteraciones mecánicas de la pared arterial. En la actualidad es el tratamiento preferido en niños mayores y adultos. (8) El implante de stent cubierto, inicialmente indicado para pacientes con coartación de la aorta grave con disminución muy significativa del calibre del segmento a tratar, coartación de la aorta asociada con conducto arterioso permeable y recoartación de la aorta asociada con aneurismas u otras alteraciones mecánicas de la pared arterial (ya sea poscirugía o posangioplastia previa con balón), actualmente se sugiere también como "de preferencia" en pacientes mayores de 40 años o en mujeres con síndrome de Turner. (9, 10)
El tratamiento percutáneo de cardiopatías congénitas en pacientes con SRT se ha descripto muy raramente en la bibliografía disponible hasta la actualidad. Esta experiencia resalta el tratamiento percutáneo de cardiopatías congénitas simples como el cierre mediante dispositivo del conducto arterioso permeable y la colocación de stent en la coartación de la aorta en pacientes con SRT. Estos procedimientos pueden llevarse a cabo exitosamente con una tasa alta de seguridad en este tipo de pacientes. Estamos convencidos de que es muy importante la comunicación de estos casos para confirmar que en un síndrome de baja incidencia el tratamiento percutáneo de cardiopatías congénitas asociadas puede realizarse con resultados satisfactorios.
1. Ruggieri VL, Arberas CL. Síndromes genéticos reconocibles en el período neonatal. Medicina (Buenos Aires) 2009;69:15-35. [ Links ]
2. Hennekam CM. Rubinstein-Taybi syndrome. Eur J Hum Genet 2006;14:981-85. http://doi.org/bx76hd
3. Pierpont ME, Basson CT, Benson W, Gelb BD, Giglia TM, Gold-muntz E, et al. Genetic basis for congenital heart defects: Current knowledge. Circulation 2007;115:3015-35. http://doi.org/d543ww
4. Goldmuntz E, Paluru P, Glessner J, Hakonarsen H, Biegel JA, White PS, et al. Microdeletions and microduplications in patients with congenital heart disease and multiple congenital anomalies. Congenit Heart Dis 2011;6:592-602. http://doi.org/frzhjs
5. Rubinstein JH, Taybi H. Broad thumbs and toes and facial abnor-malities. A possible mental retardation syndrome. Am J Dis Child 1963;105:588-608.
6. Stevens CA, Bhakta MG. Cardiac abnormalities in the Rubinstein-Taybi syndrome. Am J Med Genet 1995;59:346-8. http://doi.org/c6t8tb
7. Forsey JT, Elmasry OA, Martin R P. Patent arterial duct. Orphanet J Rare Dis 2009;4:17.
8. Kenny D, Hijazi ZM. Coarctation of the aorta: from fetal to adult-hood. Cardiol J 2011;18:487-95. http://doi.org/brzc43
9. Zanjani KS, Thanopoulos BD, Peirone A, Alday L, Giannakoulas G. Usefulness of stenting in aortic coarctation in patients with the Turner syndrome. Am J Cardiol 2010;106:1327-31.
10. Pedra C, Peirone A, Costa R, Bruckheimer E. Covered-stent implantation in coarctation of the aorta: indications, materials, techniques and outcomes. Interv Cardiol 2011;3:67-77. http://doi.org/dk39sj














