Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista argentina de cardiología
versión On-line ISSN 1850-3748
Rev. argent. cardiol. vol.82 no.3 Ciudad Autónoma de Buenos Aires jun. 2014
ARTÍCULO ORIGINAL
Caveolinas y modulación del sistema del óxido nítrico en el hipotiroidismo según avanza la edad
Age-related Influence of Hypothyroidism on Caveolins and Nitric Oxide Modulation
Florencia Detomaso, Paula Braga, Lourdes Rodríguez, Noelia Arreche, Lorena Sarati, Ana M. Balaszczuk, Andrea L. Fellet
Cátedra de Fisiología, Facultad de Farmacia y Bioquímica, Universidad de Buenos Aires - IQUIMEFA - CONICET
Dirección para separatas: Florencia Marina Detomaso Cátedra de Fisiología - Facultad de Farmacia y Bioquímica, Universidad de Buenos Aires Junín 956 - 7° Piso (C1113AAD) CABA, Argentina Tel. 011 4964-8279 int. 305 Fax 011 4964-8279 int. 309 e-mail: florenciadetomaso@gmail.com
Recibido: 20/02/2014
Aceptado: 12/03/2014
Declaración de conflicto de intereses
Los autores declaran que no poseen conflicto de intereses.
RESUMEN
Introducción
El hipotiroidismo y la edad impactan sobre la producción de óxido nítrico (NO) cardíaco y renal. Las caveolinas, moduladores negativos de la actividad enzimática de la NO sintetasa (NOS), se afectan con ambos factores.
Objetivos
Evaluar la implicación de las caveolinas (cav) en la modulación de la actividad de la NOS cardíaca y renal en animales hipotiroideos adultos.
Material y métodos
Se utilizaron ratas macho Sprague-Dawley eutiroideas e hipotiroideas [metimazol 0,02% (v/v) en el agua de bebida durante 28 días]. Los animales fueron sacrificados para extraer el corazón y los riñones.
Resultados
La actividad de la NOS en la aurícula derecha disminuyó con la edad y el hipotiroidismo. La expresión de cav-1 aumentó con la edad y el hipotiroidismo. La actividad de la NOS en el ventrículo izquierdo aumentó con el avance de la edad y el hipotiroidismo. La expresión de ambas caveolinas disminuyó en los grupos adulto e hipotiroideo. En la médula renal, el hipotiroidismo disminuyó la actividad de la NOS en jóvenes y la aumentó en adultos. La expresión de cav-1 disminuyó con la edad y en jóvenes hipotiroideos. Los niveles proteicos de cav-3 disminuyeron en animales adultos hipotiroideos.
Conclusiones
El hipotiroidismo impacta sobre la actividad de la NOS y de sus moduladores, las caveolinas, en el sistema cardiovascular y renal. El hipotiroidismo intensifica los efectos del avance de la edad en ambos sistemas.
Palabras clave: Caveolinas; Óxido nítrico; Hipotiroidismo; Edad
ABSTRACT
Age-related Influence of Hypothyroidism on Caveolins and Nitric Oxide Modulation
Introduction
Hypothyroidism and age impact on cardiac and renal nitric oxide (NO) production. Caveolins, which are negative modulators of NO synthase (NOS) activity, are affected by both factors.
Objectives
The aim of this study was to evaluate caveolin (CAV) participation in the modulation of renal and cardiac NOS activity in adult hypothyroid animals.
Methods
Euthyroid and hypothyroid [methimazole 0.02% (v/v) in the drinking water during 28 days] male Sprague-Dawley rats were used. Animals were sacrificed to remove the heart and kidneys.
Results
Right atrial NOS activity decreased with age and hypothyroi-dism. Caveolin-1 expression increased with age and hypothyroidism. Conversely, left ventricular NOS activity increased with aging and hypothyroidism and the expression of both CAV isoforms decreased in adult and hypothyroid groups. In the renal medulla, hypothyroidism reduced NOS activity in young and raised it in adult animals and CAV-1 expression decreased with age and in hypothyroid young animals. Caveolin-3 protein levels decreased in adult hypothyroid animals.
Conclusions
Hypothyroidism impacts on NOS activity and on that of its modulators, caveolins, in the cardiovascular and renal systems. Hypothyroidism enhances the effects of aging in both systems.
Key words: Caveolins; Nitric Oxide; Hypothyroidism; Aging
Abreviaturas
cav-1 Caveolina 1
cav-2 Caveolina 2
cav-3 Caveolina 3
eNOS Óxido nítrico sintetasa endotelial
iNOS Óxido nítrico sintetasa inducible
nNOS Óxido nítrico sintetasa neuronal
NO Óxido nítrico
NOS Óxido nítrico sintetasa
T4 Tiroxina total
TSH Hormona estimulante de la tiroides
INTRODUCCIÓN
El déficit de hormonas tiroideas impacta sobre todos los sistemas fisiológicos; las alteraciones de los sistemas cardiovascular y renal se encuentran entre las más relevantes. (1) Las hormonas tiroideas afectan ambos sistemas induciendo cambios hemodinámicos y alteraciones en la función y el manejo renal de sodio y agua. (2-4) En los últimos años se ha descripto una interacción funcional que involucra a las hormonas tiroideas, las células endoteliales y al óxido nítrico (NO). El NO es sintetizado a partir de L-arginina y oxígeno molecular por una familia de enzimas denominadas NO sintetasas (NOS). En el tejido cardíaco y en el renal se conocen tres isoformas de la NOS: neuronal (nNOS), inducible (iNOS) y endotelial (eNOS). La nNOS y la eNOS son constitutivas y son activadas por el complejo Ca2+/calmodulina. La expresión de la iNOS es estimulada por la liberación endógena de citocinas proinflamatorias y/o endotoxinas. (5) En un estudio previo hemos demostrado que las hormonas tiroideas regulan la actividad marcapaso intrínseca del corazón a través de un mecanismo que involucra al menos en parte al NO. (6-8) En otros estudios se sugiere que el hipotiroidismo se acompaña de una disponibilidad de NO reducida y, en consecuencia, de una deficiente vasodilatación dependiente del endotelio. (9) Esta menor capacidad de respuesta vascular sería consecuencia de una disfunción en la cascada de señalización del NO o de una alteración en la regulación de la actividad de la NOS por parte de las proteínas reguladoras caveolinas. (10, 11) Las caveolinas se encuentran asociadas con invaginaciones de la membrana plasmática denominadas cavéolas. Se han descripto tres isoformas: caveolina 1 (cav-1), caveolina 2 (cav-2), localizadas principalmente en las células endoteliales, y caveolina 3 (cav-3), localizada en las células del músculo esquelético y cardíaco. (12) La cav-1 y la cav-3 regulan negativamente la actividad catalítica de la NOS tanto en el corazón como en el riñón. (13, 14) En relación con el tejido renal, se ha descripto que el hipotiroidismo se asocia con cambios pronunciados en la hemodinamia renal y la función tubular. (15, 16) Sin embargo, el mecanismo mediante el cual se inducen estas alteraciones en el estado tiroideo aún no se ha dilucidado totalmente. Madrid y colaboradores han observado que el flujo sanguíneo en la médula renal se encuentra regulado principalmente por el NO y que la actividad de la NOS es manifiestamente más alta en la médula que en la corteza renal. (17)
Por otra parte, numerosos estudios han demostrado que el avance de la edad constituiría un factor determinante en el desarrollo de los trastornos endocrinos, como alteraciones en el eje tiroideo. (18-20) Además, modificaciones en la abundancia y/o funcionalidad de las caveolinas, así como en la interacción caveolinas-NOS, podrían relacionarse con las alteraciones en la actividad de la NOS que se observa con el avance de la edad y en situaciones con alteraciones en el estado tiroideo. (21, 22) Teniendo en cuenta lo expuesto, el objetivo del presente trabajo fue evaluar la participación de las caveolinas cardíacas y renales en la modulación del sistema del NO en animales hipotiroideos conforme al avance de la edad.
MATERIAL Y MÉTODOS
Animales
Todos los animales incluidos en los protocolos experimentales se trataron de acuerdo con los lineamentos y principios de la Disposición N° 6344-96 de la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica, Ministerio de Salud y Ambiente de la Nación. Se utilizaron ratas Sprague-Dawley macho de 2 meses (jóvenes) y 18 meses (adultas) de edad provenientes de la Facultad de Farmacia y Bioquímica (Universidad de Buenos Aires). Los animales se mantuvieron en un ambiente con humedad y temperatura controlada con un ciclo de luz/oscuridad de 12/12 horas. Fueron alimentados con una dieta balanceada provista por Nutrimentos Purina, Buenos Aires, Argentina, y con agua ad libitum hasta el día de los experimentos. Las ratas fueron divididas al azar en dos grupos: eutiroideas e hipotiroideas.
Tratamiento
El hipotiroidismo fue inducido mediante el tratamiento con una solución de metimazol 0,02% (v/v) en el agua de bebida durante 28 días. (23)
Determinación de la eficacia del tratamiento
La alteración en el estado tiroideo se evaluó a través de la medición de los niveles plasmáticos de la hormona estimulante de la tiroides (TSH) y de la tiroxina total (T4) mediante radioinmunoensayo en muestras obtenidas al finalizar el tiempo experimental. (24) El kit utilizado para la medición de la TSH fue provisto por el National Institute of Diabetes and Digestive and Kidney Diseases of the National Institute of Health (Bethesda, USA). Los resultados se expresaron en términos del estándar de TSH para rata (rTSH-RP-2). Los coeficientes de variación intraensayos e interensayos para la variación de TSH fueron 8,7% y 13,4%, respectivamente.
Protocolo experimental
Luego de sacrificar a los animales con una sobredosis de anestesia, se extrajeron el corazón y ambos riñones con el objeto de separar la aurícula derecha, el ventrículo izquierdo y la médula renal. En estos tejidos se determinaron la actividad de la NOS mediante el método de la conversión de [14C (U)]-L-arginina en [14C (U)]-L-citrulina, (25) los niveles proteicos de las isoformas de la NOS y de las proteínas reguladoras cav-1 y cav-3 (Western blot).
Actividad de la óxido nítrico sintetasa
Los homogenatos tisulares provenientes de la aurícula derecha, el ventrículo izquierdo y la médula renal (aproximadamente de 50 µg de proteína) se incubaron con buffer Tris-HCl (pH 7,4) conteniendo 1 µg/ml de L-arginina, [14C (U)]-L-arginina (346 µCi/ml), L-valina (67 mmol/L), NADPH (1 mmol/L), calmodu-lina (30 nmol/L), tetrahidrobiopterina (5 µmol/L) y CaCl2 (2 mmol/L) durante 60 minutos a temperatura ambiente. Al final del período de incubación, la actividad de la NOS se interrumpió con el agregado de una solución buffer 20 mmol/L HEPES y 20 mmol/L EDTA pH 5,5. La mezcla de reacción se cargó en una columna de intercambio catiónico (Dowex AG 50W-X8, forma Na+; Bio-Rad) y la [14C (U)]-L-citrulina se eluyó con 0-50 ml ddH2O. La cantidad de [14C (U)]-L-citrulina eluida se cuantificó utilizando un contador de centelleo líquido (Wallac 1414 WinSpectral; EG&G, Turku, Finland). (25) Todos los componentes, excepto [U–14C]-L-monoclorhidrato de arginina (346 mCi/mmol, Amersham Life Science), fueron adquiridos a través de Sigma Chemie. La determinación de proteínas se realizó mediante el método de Lowry utilizando como estándar seroalbúmina bovina.
Western blot
Las muestras de tejidos provenientes de la aurícula derecha, el ventrículo izquierdo y la médula renal se homogeneizaron sobre hielo con Tissue Tearor (Biospec Products) en buffer de homogeneización (50 mmol/L Tris, 0,1 mmol/L EDTA, 0,1 mmol/L EGTA, 1% Triton, 1 mmol/L PMSF, 1 µmol/L pepstatina, 2 µmol/L de leupeptina, 1× cóctel de inhibidores de proteasas de Roche Diagnostics. La concentración de proteínas de los homogenatos se determinó utilizando el ensayo de Lowry. Cantidades equivalentes de proteínas (100 µg proteínas/calle) se separaron por electroforesis en geles de 7,5% SDS-poliacrilamida (Bio-Rad, Munich, Germany), luego se transfirieron a una membrana de nitrocelulosa (Bio-Rad) y se incubaron con anticuerpos primarios anti-NOS y anti cav-1 y cav-3, todos diluidos 1:500. Los anticuerpos primarios fueron: policlonal de conejo anti-NOS inducible (iNOS) (epítope carboxilo terminal), anti-NOS endotelial (eNOS) (epítope amino terminal), anti-NOS neuronal (nNOS) (epítope amino terminal); policlonales de conejo anti-cav-1 (H-97, sc-7875) y anti-cav-3 (H-100, sc-28828). Finalmente, se realizó una inmunorreacción secundaria con anticuerpo conjugado de cabra anticonejo con peroxidasa de rábano picante (dilución 1:5.000). Las muestras se revelaron por quimioluminiscencia usando el reactivo ECL por 2-4 minutos. La densidad de las respectivas bandas se cuantificó por densitometría, escaneando el Western blot, con un escáner Hewlett-Packard y analizador Totallab (Biodynamics, Seattle, WA, USA), y las cantidades de proteínas se calcularon comparándolas con los valores de la densitometría usando los correspondientes estándares. Los niveles de proteínas se expresaron como promedio de la densidad óptica de las isoformas de las caveolinas y de la banda de ß-actina (usando actina antibeta, clon EP1123Y, anticuerpo monoclonal de conejo) para controlar cualquier tipo de alteraciones en la carga de las proteínas.
Análisis estadístico
La información que se presenta en la Tabla 1 y en los gráficos de las Figuras 1 a 4 son valores medios ± error estándar de la media. Esta información fue evaluada mediante análisis de una sola variable y de muchas variables (multivariado) bajo un diseño completamente al azar, con una estructura de dos factores (edad y hormona tiroidea). Para cada variable se realizó un análisis ANOVA o MANOVA, según fuera apropiado. Se emplearon las pruebas de Levene y de Shapiro-Wilk para evaluar la homogeneidad de varianzas y la normalidad de los datos, respectivamente. Cuando la normalidad y la homogeneidad de las supuestas varianzas dieron correctamente, se realizó la prueba de comparación múltiple de Bonferroni. En el caso de que no se contara con una varianza homogénea, se utilizó la prueba de comparación múltiple de Tamhane. Para todos los procedimientos estadísticos se usó el software SPSS versión 16.0. La significación estadística se estableció en p < 0,05.

Fig. 1. Actividad total de la óxido nítrico sintetasa (NOS) en la aurícula derecha (A), el ventrículo izquierdo (B) y la médula renal (C) de ratas eutiroideas (Eut) e hipotiroideas (Hipo). Los valores están expresados como media ± error estándar de la media; n = 15; * p < 0,05 vs. ratas eutiroideas de la misma edad; † p < 0,05 vs. joven.

Fig. 2. Western blots representativos de eNOS (A), iNOS (B), nNOS (C), caveolina-1 (D) y caveolina-3 (E) realizados en muestras provenientes de tejido de la aurícula derecha de ratas eutiroideas (Eut) e hipotiroideas (Hipo). Los histogramas ilustran los valores medios para cada grupo. Todos los experimentos se realizaron por triplicado. Cada medida fue normalizada con la expresión de p-actina proveniente del mismo gel. Los valores están expresados como media ± error estándar de la media; n = 15; * p < 0,05 vs. eutiroideas de su respectiva edad; T p < 0,05 vs. joven.
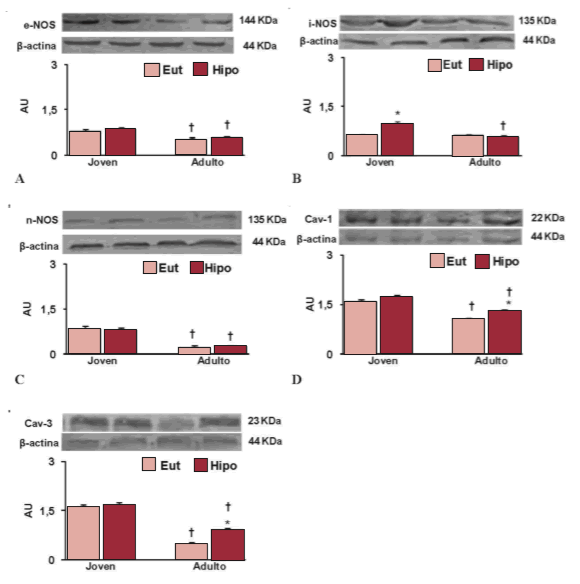
Fig. 3. Western blots representativos de eNOS (A), iNOS (B), nNOS (C), caveolina-1 (D) y caveolina-3 (E) realizados en muestras provenientes de tejido de ventrículo izquierdo de ratas eutiroideas (Eut) e hipotiroideas (Hipo). Los histogramas ilustran los valores medios para cada grupo. Todos los experimentos se realizaron por triplicado. Cada medida se normalizó con la expresión de ß-actina proveniente del mismo gel. Los valores están expresados como media ± error estándar de la media; n = 15; * p < 0,05 vs. eutiroideas de su respectiva edad; † p < 0,05 vs. joven.

Fig. 4. Western blots representativos de eNOS (A), iNOS (B), nNOS (C), caveolina-1 (D) y caveolina-3 (E) realizados en muestras provenientes de tejido de médula renal de ratas eutiroideas (Eut) e hipotiroideas (Hipo). Los histogramas ilustran los valores medios para cada grupo. Todos los experimentos se realizaron por triplicado. Cada medida fue normalizada con la expresión de p-actina proveniente del mismo gel. Los valores están expresados como media ± error estándar de la media; n = 15; * p < 0,05 vs. eutiroideas de su respectiva edad; f p < 0,05 vs. joven.
RESULTADOS
Eficacia del tratamiento
El metimazol fue eficaz para establecer el estado hipotiroideo. Como puede observarse en la Tabla 1, las ratas adultas presentaron niveles menores de TSH que las jóvenes, mientras que los niveles de T4 no se modificaron con la edad. Además, los animales hipotiroideos presentaron niveles mayores de TSH y menores de T4 que los eutiroideos de la misma edad. Asimismo, puede observarse que el tratamiento hormonal indujo modificaciones en el peso corporal de los animales.
Actividad de la óxido nítrico sintetasa
En la aurícula derecha, el avance de la edad redujo la actividad de la NOS en los animales eutiroideos. El déficit hormonal disminuyó este parámetro en ambos grupos etarios. Sin embargo, los adultos hipotiroideos presentaron una actividad enzimática mayor que los jóvenes (Figura 1, panel A). Por el contrario, en el ventrículo izquierdo, la edad incrementó la actividad enzimática en los animales eutiroideos. El hipotiroidismo aumentó este parámetro en ambos grupos etarios. Los animales adultos hipotiroideos presentaron mayor actividad de la NOS que los jóvenes (Figura 1, panel B). En la médula renal, los resultados muestran que el avance de la edad no modificó la actividad enzimática en ratas eutiroideas. El hipotiroidismo disminuyó la actividad enzimática en los animales jóvenes pero la incrementó en los adultos (Figura 1, panel C).
Niveles proteicos de las isoformas de la óxido nítrico sintetasa y de las caveolinas
En la Figura 2 puede observarse el análisis Western blot de muestras de aurícula derecha. El avance de la edad disminuyó los niveles proteicos de las tres isoformas en el grupo eutiroideo. El hipotiroidismo redujo la expresión de las tres isoformas de la NOS en los animales jóvenes, mientras que en los adultos incrementó únicamente los niveles de eNOS e iNOS (Figura 2, paneles A, B y C). El avance de la edad ocasionó un aumento en los niveles de cav-1 (Figura 2, panel D). El hipotiroidismo indujo un incremento en este parámetro solo en las ratas adultas. No se observaron cambios en los niveles proteicos de cav-3 (Figura 2, panel E) con el avance de la edad ni con el hipotiroidismo. Al evaluar el ventrículo izquierdo, se observó que la edad disminuyó los niveles de las isoformas constitutivas de la NOS. En animales jóvenes, el hipotiroidismo provocó un aumento de iNOS, mientras que en adultos no se observaron cambios en las distintas isoformas (Figura 3, paneles A, B y C). En los paneles D y E de la Figura 3 puede observarse que la edad disminuyó los niveles proteicos de ambas caveolinas. El hipotiroidismo solo aumentó estos niveles en los animales adultos.
En la médula renal, la edad no modificó los niveles proteicos de ninguna de las isoformas en los animales eutiroideos. El hipotiroidismo provocó una disminución en los niveles de eNOS en animales jóvenes, mientras que no modificó la expresión de ninguna de las isoformas de la NOS en adultos (Figura 4, paneles A, B y C). Los niveles proteicos de cav-1 disminuyeron con la edad y con el hipotiroidismo solo en las ratas jóvenes (Figura 4, panel D). No se observaron cambios en los niveles de expresión de cav-3 en las ratas eutiroideas con el avance de la edad (Figura 4, panel E). El hipotiroidismo únicamente disminuyó los niveles de cav-3 en animales adultos.
DISCUSIÓN
El presente estudio demuestra que la implicación del sistema del NO y de las caveolinas sobre la función cardiovascular y renal en el hipotiroidismo depende del tejido y de la edad. El normal avance de la edad se acompaña por cambios a nivel histológico, bioquímico y morfológico en los sistemas cardiovascular y renal. (26) Los resultados muestran que la edad disminuyó los niveles plasmáticos de TSH en los animales eutiroideos. Estos hallazgos concuerdan con los de varios autores, que han observado una disminución en los valores plasmáticos de TSH asociada con el envejecimiento. (27, 28) Esta disminución de la secreción de TSH observada en los animales adultos podría deberse tanto a un incremento en la sensibilidad de las células tirotrofas al feedback negativo que ejerce la T4 como a una síntesis menor de hormona liberadora de tirotropina (TRH) hipotalámica.
Por otra parte, en las últimas décadas, el NO ha sido implicado en numerosos procesos que controlan varios aspectos tanto de la función cardiovascular como de la renal. (29) Sin embargo, se conoce poco acerca del mecanismo involucrado en esta regulación. En este trabajo mostramos que el envejecimiento influye sobre la actividad de la NOS. En la aurícula derecha, la disminución en la actividad de la NOS observada en los animales adultos eutiroideos sería consecuencia de una reducción de los niveles proteicos de las tres isoformas de la NOS, en concomitancia con un aumento en los niveles proteicos de cav-1. Estos resultados coinciden con los observados por Muñoz y colaboradores, quienes demostraron que el avance de la edad induce un aumento de la expresión de caveolinas en el tejido muscular. (30) Además, la menor actividad de la NOS que se halló en los animales jóvenes se asoció con una disminución en los niveles proteicos de las tres isoformas de la NOS, sin cambios en los niveles proteicos de los moduladores negativos. Por el contrario, los animales hipotiroideos adultos presentaron un incremento de los niveles proteicos de eNOS e iNOS, sin modificaciones de la nNOS. Sin embargo, la disminución de la actividad enzimática de estos animales podría vincularse a niveles proteicos mayores de cav-1. Estos hallazgos reafirmarían el hecho de que el hipotiroidismo modifica los niveles proteicos de la NOS en los animales jóvenes y de caveolinas en los adultos. Ratajczak y colaboradores han mostrado una disociación de las caveolinas de las cavéolas con el envejecimiento. (21, 22) En el ventrículo izquierdo, tanto el avance de la edad como el hipotiroidismo actuaron aumentando la actividad de la NOS. Este efecto se asocia tanto con la disminución de los niveles proteicos de eNOS y nNOS como de cav-1 y cav-3. En el grupo joven hipotiroideo, el incremento en la actividad de la NOS fue acompañado por un aumento en los niveles proteicos de la iNOS. Por el contrario, en los animales adultos hipotiroideos se presentó una expresión mayor de ambas caveolinas sin modificaciones en los niveles proteicos de las isoformas de NOS. Los hallazgos de este trabajo estarían en concordancia con los encontrados por Quesada y colaboradores, quienes mostraron un aumento de la actividad de la NOS ventricular en el hipotiroidismo. (31) Además, Carreras y colaboradores sugieren que la mayor producción de NO en el hígado y en el músculo de ratas hipotiroideas jóvenes proviene principalmente de la isoforma inducible de la enzima. (32) Nuevamente, la modulación de la actividad enzimática ejercida por las caveolinas parece ser más relevante que la alteración de la expresión de la proteína en la adultez.
En relación con los efectos del NO sobre la función renal, (6-8) los resultados muestran que en la médula renal el sistema del NO se encuentra regulado tanto por las hormonas tiroideas como por la edad. En los animales jóvenes hipotiroideos, la menor actividad de la NOS podría deberse a niveles menores de eNOS respecto de los animales eutiroideos del mismo grupo etario. El incremento en la actividad enzimática observada en adultos hipotiroideos sería consecuencia de niveles proteicos menores de cav-1 y cav-3. Estos resultados sugieren nuevamente que las caveolinas tendrían un papel fundamental en la adultez. Estos hallazgos son consistentes con la hipótesis de que el hipotiroidismo impactaría diferencialmente sobre la homeostasis.
1. Ojamaa K, Klein I, Sabet A, Steinberg S F. Changes in adenylyl ciclase isoforms as a mechanism for thyroid hormone modulation of cardiac ß-adrenergic receptor responsiveness. Metabolism 2000;49:275-9. http://doi.org/bbr94d [ Links ]
2. Iglesias P, Díez JJ. Thyroid dysfunction and kidney disease. Eur J Endocrinol 2009;160:503-15. http://doi.org/d7r5g3 [ Links ]
3. Mariani LH, Berns JS. The renal manifestations of thyroid disease. J Am Soc Nephrol 2012;23:22-6. http://doi.org/dd6wn7 [ Links ]
4. Vargas F, Rodríguez-Gómez I, Vargas-Tendero P, et al. The renin– angiotensin system in thyroid disorders and its role in cardiovascular and renal manifestations. J Endocrinol 2012;213:25-36. http://doi.org/dmpxvh [ Links ]
5. Kibbe M, Billiar T, Zeng E. Inducible nitric oxide synthase and vascular injury. Cardiovasc Res 2006;43:650-7. http://doi.org/bbmfjr [ Links ]
6. Fellet AL, Arza PR, Arreche ND, Arranz C, Balaszczuk AM. Nitric oxide and thyroid gland: modulation of cardiovascular function in autonomic-blocked anaesthetized rats. Exp Physiol 2004;89:303-12. http://doi.org/fgw78f [ Links ]
7. Fellet AL, Balaszczuk AM, Arranz C, López-Costa JJ, Boveris A, Bustamante J. Autonomic regulation of pacemaker activity: role of heart nitric oxide synthases. Am J Physiol Heart Circ Physiol 2006;291:1246-54. http://doi.org/bgqts6 [ Links ]
8. Fellet AL, Boveris A, Arranz C, Balaszczuk AM. Cardiac mitocondrial nitric oxide: a regulator of heart rate? AmJ Hypertens 2008;21:377-81. http://doi.org/ch24cj [ Links ]
9. Taddei S, Caraccio N, Virdis A, Dardano A, Versari D, Ghiadoni L, et al. Impaired endothelium dependent vasodilatation in subclinical hypothyroidism: beneficial effect of levothyroxine therapy. J Clin Endocrinol Metab 2003;88:3731-7. http://doi.org/bjxnc9 [ Links ]
10. Muller-Delp JM, Spier SA, Ramsey MW, Delp MD. Aging impairs endothelium-dependent vasodilatation in rat skeletal muscle arterioles. Am J Physiol Heart Circ Physiol 2002; 283:H1662-72. [ Links ]
11. Magerko KA, Seals DR, Durrant JR. Age-related impairment in endothelium-dependent dilation is related to diminished sirT deacetlylase expression and increased eNOS acetylation. FASEB J 2010;24:1039-42. [ Links ]
12. Schwencke C, Braun-Dullaeus R, Wunderlich C, Strasser R. Caveolae and caveolin in transmembrane signaling: Implications for human disease. Cardiovasc Res 2006;70:42-9. http://doi.org/cg5k6d [ Links ]
13. Feron O, Balligand J. Caveolins and the regulation of endothelial nitric oxide synthase in the heart. Cardiovasc Res 2006;69:788-97. http://doi.org/bn8q9j [ Links ]
14. Bruce C. Kone, Teresa Kuncewicz, Wenzheng Zhang, and Zhi-Yuan Yu, Protein interactions with nitric oxide synthases: controlling the right time, the right place, and the right amount of nitric oxide, Am J Physiol Renal Physiol 2003;285:F178–F190. [ Links ]
15. Emmanouel DS, Lindheimer MD, Katz AI. Mechanism of impaired water excretion in the hypothyroid rat. J Clin Invest 1974;54:926-34. http://doi.org/dgfdbx [ Links ]
16. Park C W, Shin YS, Ahn SJ, Kim SY, Choi EJ, Chang YS, et al. Thyroxine treatment induces upregulation of renin-angiotensin-aldosterone system due to decreasing effective plasma volume in patients with primary myxoedema. Nephrol Dial Transplant 2001; 16:1799-806. http://doi.org/cj2dgj [ Links ]
17. Madrid M, García-Salom M, Tornel J, de Gasparo M, Fenoy F. Interactions between nitric oxide and angiotensin II on renal cortical and papillary blood flow. Hypertension 1997;30:1175-82. http://doi.org/rn4 [ Links ]
18. Magri F, Muzzoni B, Cravello L, Fioravanti M, Busconi L, Camozzi D, et al. Thyroid function in physiological aging and in centenarians: possible relationships with some nutritional markers. Metabolism 2002;51:105-9. http://doi.org/cq4t89 [ Links ]
19. Iordanidou A, Hadzopoulou-Cladaras M, Lazou A. Nongenomic effects of thyroid hormone in adult cardiac myocytes: relevance to gene expression and cell growth. Mol Cell Biochem 2010;340:291-300. http://doi.org/cj5k9n [ Links ]
20. Maselli M, Inelmen EM, Giantin V, Manzato E. Hypothyroidism in the elderly: diagnostic pitfalls illustrated by a case report. Arch Gerontol Geriatr 2012;55:82-4. http://doi.org/bjmdc3 [ Links ]
21. Ratajczak P, Damy T, Heymes C, Oliviéro P, Marotte F, Robidel E, et al. Caveolin-1 and -3 dissociations from caveolae to cytosol in the heart during aging and after myocardial infarction in rat. Cardiovasc Res 2003;57:358-69. http://doi.org/ffv5ft [ Links ]
22. Ratajczak P, Oliviéro P, Marotte F, Kolar F, Ostadal B, Samuel JL. Expression and localization of caveolins during postnatal development in rat heart: implication of thyroid hormone. J Appl Physiol 2005;99:244-51. http://doi.org/fvcxtg [ Links ]
23. Franco MC, Antico-Arciuch VG, Peralta JG, Galli S, Levisman D, López LM, et al. Hypothyroid phenotype is contributed by mitochondrial complex I inactivation due to translocated neuronal nitric-oxide synthase. J Biol Chem 2006;281:4779-86. http://doi.org/dmnzwf [ Links ]
23. Britton KE, Quinn V, Brown BL, Ekins R P. A strategy for thyroid function tests. Br Med J 1975;3:350-2. http://doi.org/d5pzbq [ Links ]
24. Costa MA, Elesgaray R, Caniffi C, Fellet A, Arranz C. Role of cardiovascular nitric oxide system in C-type natriuretic peptide effects. Biochem Biophys Res Commun 2007;359:180-6. http://doi.org/b8dq55 [ Links ]
26. Willems L, Ashton KJ, Headrick J P. Adenosine-mediated cardio-protection in the aging myocardium. Cardiovasc Res 2005; 66:245-55. http://doi.org/ckmw45 [ Links ] Helvetica, sans-serif">27. Mariotti S, Cambuli V. Cardiovascular risk in elderly hypothyroid patients. Thyroid. 2007;17:1067-73. http://doi.org/d3w9gc [ Links ]
28. Adler S, Burman K. The aging thyroid. Abnormalities in thyroid function parameters and subclinical thyroid disease in the elderly. Endocr Rev 2007;16:686-715. [ Links ]
29. Drew B, Leeuwenburgh C. Aging and the role of reactive nitrogen species. Ann N Y Acad Sci 2002; 959: 66-81. http://doi.org/cqpmhk [ Links ]
30. Muñoz P, Mora S, Sevilla L, Kaliman P, Tomas E, Guma A, et al. Expression and insulin-regulated distribution of caveolin in skeletal muscle. J Biol Chem 1996;271:8133-9. http://doi.org/d99nff [ Links ]
31. Quesada A, Sainz J,Wangensteen R, Rodriguez-Gomez I, Vargas F, Osuna A. Nitric oxide synthase activity in hyperthyroid and hypothyroid rats. Eur J Endocrinol 2002;147:117-22. http://doi.org/fn3g3q [ Links ]
32. Carreras M, Peralta J, Converso D, Finocchietto P, Rebagliati I, Zaninovich A, et al. Modulation of liver mitochondrial NOS is implicated in thyroid-dependent regulation of O2 uptake. Am J Physiol Heart Circ Physiol 2001;281:H2282-8. [ Links ]
33. Pardee K, Reinking J, Krause H. Nuclear Hormone receptors, metabolism, and aging: what goes around comes around. Sci Aging Knowl Environ 2004; re8:1-9. [ Links ]
34. Estébanez-Perpiñá E, Arnold LA, Jouravel N, Togashi M, Blethrow J, Mar E, et al. Structural insight into the mode of action of a direct inhibitor of coregulator binding to the thyroid hormone receptor. Mol Endocrinol 2007; 21:2919-28. http://doi.org/dggspx [ Links ]















