Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista argentina de cardiología
versión On-line ISSN 1850-3748
Rev. argent. cardiol. vol.82 no.4 Ciudad Autónoma de Buenos Aires ago. 2014
ARTÍCULO ORIGINAL
Control hormonal de las corrientes de la fase 1 del potencial de acción cardíaco en el síndrome de Brugada
Hormonal Control of Cardiac Action Potential Phase 1 Currents in the Brugada Syndrome
Mariana Argenziano1, 2, Gisela Tiscornia1, 2, Rosalía Moretta1, Carlos E. Amorena1, 2, Eduardo García Gras1, 2
1 Centro de Estudios en Salud y Medio Ambiente (CESyMA), Escuela de Ciencia y Tecnología (ECyT), Universidad Nacional de General San Martín (UNSAM)
2 CONICET. Buenos Aires, Argentina
Financiación: Este estudio fue apoyado por becas de la ANPCyT (PICT 1754/2006), UNSAM (A107) y CONICET (2283-09).
Dirección para separatas: Eduardo A. García Gras - Edificio 23, INTI - General Paz 5445 - (1650) San Martín, Pcia. de Buenos Aires, Argentina -Tel. 54-11-4580-7289 x105 - e-mail: eaggras@yahoo.com
Recibido: 30/01/2014
Aceptado: 07/05/2014
Declaración de conflicto de intereses
Los autores declaran que no poseen conflicto de intereses
RESUMEN
Introducción
El síndrome de Brugada es una canalopatía hereditaria con un patrón de transmisión autosómico dominante que presenta un marcado sesgo de género en la expresión del fenotipo, con una proporción hombre:mujer de 9:1. Un modelo celular de la enfermedad propone una distribución heterogénea de la amplitud de la fase 1 del potencial de acción ventricular como la base para el desarrollo del sustrato arritmogénico.
Objetivo
Investigar el papel de los andrógenos en la regulación de la fase 1 del potencial de acción cardíaco en ratas y sus consecuencias electrofisiológicas en un modelo experimental murino del síndrome de Brugada.
Material y métodos
Se estudió el control de la expresión génica por andrógenos en células HL-1 y en corazones de rata por reacción en cadena de la polimerasa (PCR) en tiempo real. Para los estudios de electrofisiología se reprodujo un modelo experimental del síndrome de Brugada en un sistema de Langendorff utilizando solución de Tyrode suplementada con pinacidil y terfenadina.
Resultados
El tratamiento de células HL-1 con dihidrotestosterona produjo un aumento en la expresión del canal del potasio Kv4.3 y del intercambiador de sodio/calcio (NCX). Se evaluó este efecto en ratas tratadas con testosterona y finasterida. La expresión de ambos genes se redujo con la finasterida, mientras que la testosterona aumentó el nivel de ácido ribonucleico mensajero (ARNm) del NCX. La testosterona produjo un acortamiento de la duración del potencial de acción a 90% de la repolarización (APD90) y del tiempo al pico (TTP), lo cual en modelos del síndrome de Brugada se correlaciona con un aumento de la arritmogenicidad. En nuestro modelo, este fenómeno se observó como un incremento en los potenciales de acción ventriculares ectópicos, esporádicos y sostenidos. La frecuencia de aparición de potenciales de acción ectópicos inducida con terfenadina y pinacidil en el grupo control se redujo en un orden de magnitud con el tratamiento con finasterida.
Conclusiones: Los andrógenos controlan la expresión de componentes clave del potencial de acción cardíaco, con el resultado de un aumento de la arritmogenicidad. El tratamiento con finasterida revierte estos efectos.
Palabras clave: Síndrome de Brugada; Arritmias cardíacas; Andrógenos; Finasterida
ABSTRACT
Introduction
The Brugada syndrome is an inherited channelopathy with autosomal dominant genotype transmission pattern presenting marked gender bias in phenotype expression, with a male to female ratio of 9:1. A cellular model of the disease suggests a heterogeneous distribution in the phase 1 amplitude of the ventricular action potential as the origin for the development of the arrhythmogenic substrate.
Objective
The aim of this study was to investigate the role of androgens on the cardiac action potential phase 1 regulation and its electrophysiological consequences in an experimental murine model of Brugada syndrome.
Methods
Androgen control of gene expression was studied in HL-1 cells and rat hearts using real time polymerase chain reaction (PCR). For the electrophysiological studies, an experimental model of the Brugada syndrome was reproduced in a Langendorff system using Tyrode solution supplemented with pinacidil and terfenadine.
Results
Treatment of HL-1 cells with di-hydro-testosterone increased the expression of the Kv4.3 potassium channel and the sodium/calcium exchanger (NCX). This effect was assessed in rats treated with testosterone and finasteride. The expression of both genes decreased with finasteride, whereas testosterone increased NCX messenger ribonucleic acid (mRNA) level. Testosterone produced action potential shortening at 90% repolarization (APD90) and decreased time to peak (TTP), which in Brugada syndrome models correlate with increased arrhythmogenesis. In our model, this phenomenon was observed both as an increase of sporadic and sustained ectopic ventricular action potentials. The frequency of ectopic action potentials induced with terfenadine and pinacidil in the control group was reduced by an order of magnitude with finasteride treatment.
Conclusions
Androgens control the expression of key components of the cardiac action potential resulting in increased arrhythmogenesis. Finasteride treatment reverses these effects.
Key words: Brugada Syndrome; Cardíac Arrhythmías; Androgens; Finasteride
Abreviaturas
APD90 Duración del potencial de acción a 90% de la repolarización
ARN Ácido ribonucleico
ARNm Ácido ribonucleico mensajero
CPAVES Corridas de potenciales de acción ventriculares extrasistólicos sostenidos
DHT Dihidrotestosterona
NCX Intercambiador de sodio/calcio
PAVE Potenciales de acción ventriculares ectópicos
PCR Reacción en cadena de la polimerasa
RA Receptor de andrógenos
TTP Tiempo al pico
INTRODUCCIÓN
El síndrome de Brugada se caracteriza por una elevación del segmento ST en las derivaciones precordiales derechas del electrocardiograma, a menudo acompañada por un bloqueo de rama derecha. Clínicamente se presenta como un aumento del riesgo de arritmias cardíacas y muerte súbita en ausencia de anomalías estructurales. (1)
El síndrome de Brugada es una canalopatía hereditaria con un patrón de transmisión autosómico dominante. En el 20% de los individuos afectados se han observado mutaciones en la subunidad alfa del canal del sodio SCN5A. (2) La expresión de la enfermedad es variable y es 8 a 10 veces más frecuente en hombres que en mujeres. (3)
Al margen de la diversidad genética, existe un mecanismo común subyacente que explica la aparición de las arritmias ventriculares: una pérdida no homogénea del domo de la fase 2 en el epicardio da lugar a una dispersión de la repolarización transmural y epicárdica. El sustrato arritmogénico se genera como consecuencia de la propagación del domo desde los lugares en que persiste hacia aquellos donde se ha perdido. (4, 5)
La predominancia del síndrome de Brugada en la población masculina tiene una base hormonal. Matsuo y colaboradores (2003) observaron la reversión del fenotipo del síndrome de Brugada en dos pacientes con cáncer de próstata luego de la castración quirúrgica, resaltando el papel de los andrógenos en el desarrollo de la afección. (6) En concordancia con esto, se ha comunicado que los pacientes varones con síndrome de Brugada tienen niveles más altos de testosterona que sujetos control de la misma edad. (7)
La corriente Ito es el resultado de la actividad de una serie de canales y reguladores. Entre ellos, el canal del potasio Kv4.3 desempeña un papel central. (10) Se observa que la expresión de Kv4.3 es mayor en hombres que en mujeres, en el ventrículo derecho que en el ventrículo izquierdo y en el epicardio que en el endocardio. (8, 9, 11) En seres humanos, la actividad de Kv4.3 constituye prácticamente la totalidad de Ito, mientras que en la rata Kv4.2 participa de Ito en forma equitativa con Kv4.3 con una contribución menor de Kv1.4. En este caso, el gradiente transmural de Ito no depende de un gradiente en la actividad de Kv4.3, sino en la expresión de Kv4.2. (12)
Otro componente de la corriente de repolarización de fase 1 es el intercambiador Na+/Ca++ (NCX) funcionando en modo inverso. Durante la fase 1 y el principio de la fase 2, el potencial de equilibrio del NCX está por encima del potencial de membrana. Esto hace que el intercambiador funcione en modo inverso expulsando 3 Na+ a cambio de 1 Ca++, constituyendo una corriente hiperpolarizante que contribuye a la magnitud de la fase 1. (13)
Basándonos en estos antecedentes, planteamos la hipótesis de que la regulación por andrógenos de las corrientes iónicas del potencial de acción cardíaco podría ser un factor determinante en la expresión del fenotipo del síndrome de Brugada. Para probar esta hipótesis evaluamos: 1) la regulación diferencial de los andrógenos sobre los componentes de fase 1 y el canal del Ca++ Cacna1c (principal componente de IcaL) y 2) los efectos que tiene la actividad androgénica sobre la arritmogenicidad en un modelo experimental del síndrome de Brugada.
MATERIAL Y MÉTODOS
Cultivos celulares
Se cultivaron células HL-1 a 37 °C y 5% de CO2 en medio Claycomb (Sigma Aldrich, USA) suplementado con 100 mM de noradrenalina, 4 mM de L-glutamina y 10% de suero fetal bovino, en presencia o en ausencia de 1 μM dihidrotestosterona (DHT, Steraloids, USA).
Animales
Mantenimiento: se utilizaron 15 ratas Wistar macho de tres meses de edad. Los animales se mantuvieron en condiciones de temperatura y humedad controladas con ciclos de luz-oscuridad de 12 horas y agua y comida ad libitum.
Eutanasia: los animales fueron anestesiados por inhalación de 5% de enflurano (Inhelthran®, Abbott, Italia) hasta observar la ausencia de reflejos y sacrificados por dislocación cervical.
Esta investigación fue aprobada por el Comité de Evaluación Ética de la Universidad Nacional de General San Martín y se ajusta a la Guía revisada para el cuidado y uso de animales de laboratorio (NIH GUIDE, Volumen 25, Número 28, 16 de agosto de 1996).
Administración de fármacos
Se conformaron tres grupos de ratas (n = 5 cada uno) asignadas al azar: grupo control, que no recibió ningún tratamiento; grupo finasterida, que recibió una inyección intramuscular de 2 mg de finasterida (Sigma Aldrich, USA) y grupo testosterona, que recibió una inyección intramuscular de 5 mg de testosterona (Sigma Aldrich, USA). Las inyecciones se administraron una vez al día durante una semana y las dosis fueron supramáximas con el objeto de saturar los receptores.
Aislamiento del ácido ribonucleico y reacción en cadena de la polimerasa en tiempo real
Las muestras se trataron con Trizol (Invitrogen) para la extracción del ARN total. La transcripción inversa se llevó a cabo utilizando cebadores al azar (Biodynamics) y RevertAid M - MuLV (Fermentas), de acuerdo con las instrucciones del fabricante.
Para el análisis de la expresión génica por reacción en cadena de la polimerasa (PCR) en tiempo real se utilizó la mezcla de reacción SYBR Green Master Rox (Roche) y cebadores específicos para cada gen (Tabla 1).
Tabla 1. Cebadores específicos para cada gen
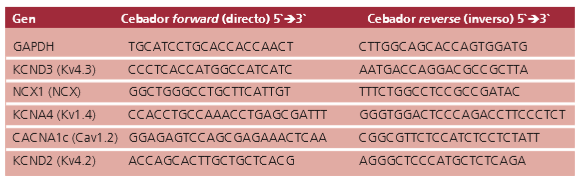
Las reacciones de PCR se realizaron en un equipo StepOne® (Applied Biosystems®) con un ciclo inicial de desnaturalización de 2 minutos a 95 °C, seguido del ciclado: 95 °C 20 segundos, 60 °C 1 minuto, 72 °C 20 segundos.
La abundancia de los ARNm se normalizó a la expresión del gen constitutivo de la gliceraldehído-3-fosfato deshidrogenasa (GAPDH) de acuerdo con el método descripto por Pfaffl. (14)
Mediciones electrofisiológicas en el ventrículo derecho aislado y perfundido
El ventrículo derecho aislado fue perfundido a través de la arteria aorta usando solución de Tyrode oxigenada a 37 °C. Se registraron los potenciales de acción epicárdicos utilizando un microelectrodo flotante de KCl 3 M (electrómetro FD223, WPI, Sarasota, Florida). Todos los fármacos se disolvieron en solución de Tyrode y se perfundieron en la preparación a través de la aorta.
La preparación se estimuló utilizando un pulso cuadrado de 30 ms a 5 Hz (Pulsemaster A300, WPI, Sarasota, Florida). El protocolo de la arritmia fue: 10 Hz durante 10 segundos, 20 Hz durante 10 segundos y 1 minuto a 0,5 Hz (cuando se hicieron las mediciones).
El protocolo descripto por Di Diego y colaboradores (8) para emular el síndrome de Brugada se adaptó para su uso con ratas Wistar macho. Después de la estabilización, los ventrículos se perfundieron con solución de Tyrode, 5 μM pinacidil, 5 μM terfenadina. Las preparaciones que no mostraron potenciales de acción ventriculares ectópicos (PAVE) durante dos horas de estimulación y protocolos de arritmia se consideraron negativos. En el contexto de este modelo definimos corridas de potenciales de acción ventriculares extrasistólicos sostenidos (CPAVES) a una secuencia de 20 o más potenciales de acción espontáneos y se consideraron por separado de los PAVE que nunca superaron los 10 potenciales de acción consecutivos.
Análisis estadístico
Los resultados se expresan como media ± error estándar, previa evaluación de la distribución normal con una prueba de bondad de ajuste. Los datos se analizaron mediante ANOVA con la prueba de Student-Newman-Keuls a posteriori o corrección de Bonferroni cuando fue apropiado. Las diferencias se consideraron estadísticamente significativas a valores de p < 0,05 para dos colas. Los cálculos se realizaron con el software estadístico SPSS Statistics 17.0.
RESULTADOS
Control de Kv4.3 y NCX por andrógenos
La dihidrotestosterona regula los canales de fase 1 en células cardíacas
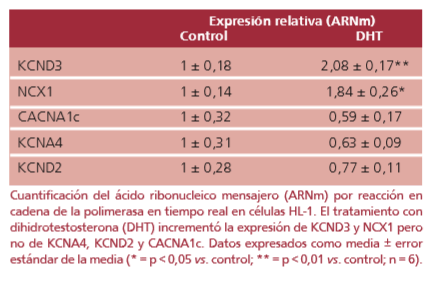
Se utilizó la línea celular HL-1 derivada de cardiomiocitos murinos para evaluar el papel de la DHT en la regulación de la expresión de los genes de interés por PCR en tiempo real. La suplementación del medio de cultivo con DHT causó un aumento significativo en los niveles de ARNm de KCND3 y NCX1. La expresión de CACNA1c, KCNA4 y KCND2 no se vio modificada por el tratamiento (Tabla 2).
Tabla 2. Cambios en la expresión génica inducidos por la dihidrotestosterona en la línea celular HL-1
Expresión de KCND3 y NCX1 en el corazón de la rata: efecto del tratamiento con testosterona y finasterida
En base a los resultados obtenidos con la línea celular planteamos un experimento en ratas Wistar macho para evaluar el efecto de la testosterona y la DHT sobre la expresión de KCND3 y NCX1. Para ello, además del grupo control y el tratado con testosterona exógena, añadimos el grupo tratado con finasterida, un inhibidor de la 5-α-reductasa, responsable de la formación de DHT a partir de testosterona. Los niveles de testosterona en sangre se mantuvieron dentro del rango normal en los grupos control y finasterida (1,36 ± 0,21 y 1,50 ± 0,17 ng/ml, respectivamente). En el grupo tratado con testosterona a saturación se observaron concentraciones > 15 ng/ml en todos los casos.
A nivel transcripcional, la finasterida redujo significativamente la expresión de ambos genes. En el caso del grupo tratado con testosterona se observó el aumento en la expresión de NCX1, pero no de KCND3 (Tabla 3).
Tabla 3. Efecto de los andrógenos sobre la expresión génica en el ventrículo derecho de la rata

Efecto de las hormonas androgénicas en un modelo del síndrome de Brugada El protocolo para simular síndrome de Brugada descripto por Di Diego y colaboradores (8) se adaptó para generar una respuesta arritmogénica moderada en ratas control (no tratadas). Se utilizó la terfenadina (bloquea canales del sodio y del calcio) combinada con pinacidil (activa canales K-ATP). En el marco de este modelo, se registraron los potenciales de acción en respuesta a un protocolo de arritmia para evaluar los efectos electrofisiológicos del tratamiento con testosterona y finasterida.
Variación en los parámetros generales del potencial de acción
La acción antagónica de la testosterona y la finasterida se vio reflejada en el tiempo al pico (TTP) y el APD90 (Figura 1 A y B). Sin embargo, si bien se observó la misma tendencia en ambos parámetros, el tratamiento con finasterida no aumentó significativamente el APD90 con respecto al grupo control.
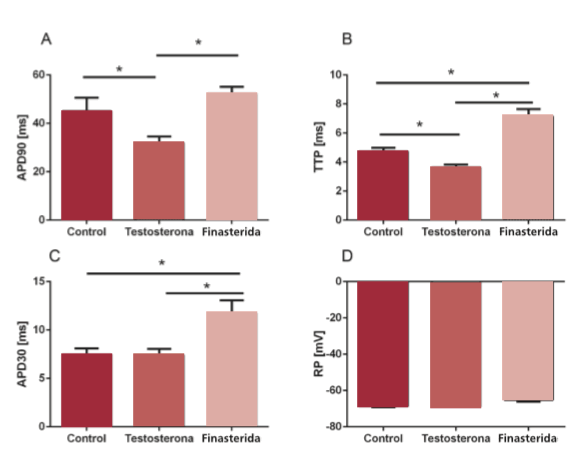
Fig. 1. Cambios en los parámetros generales del potencial de acción en el ventrículo derecho de la rata. APD90: Duración del potencial de acción a 90% de la repolarización. APD30: Duración del potencial de acción a 30% de la repolarización. TTP: Tiempo al pico. RP: Potencial de membrana en reposo. * = p < 0,05; n = 5.
En el caso de la fase inicial de repolarización (APD30), solo el tratamiento con finasterida indujo cambios significativos (Figura 1 C). No se observaron cambios en el potencial de reposo (RP, Figura 1 D).
Inducción de arritmias en el modelo murino del síndrome de Brugada
En la Figura 2 se muestran potenciales de acción representativos de los obtenidos en el ventrículo derecho en los distintos grupos después de la administración de los fármacos y del protocolo de la arritmia.
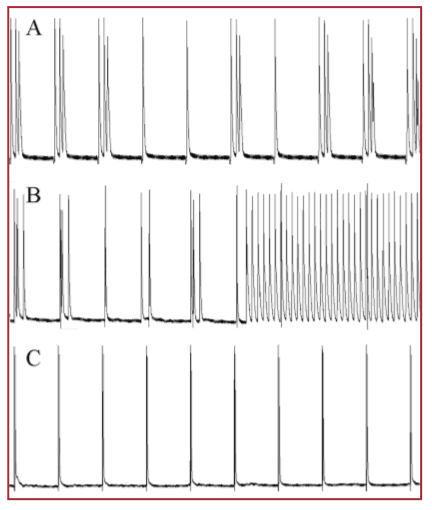
Fig. 2. Registro de los potenciales de acción luego del tratamiento con terfenadina y pinacidil y el protocolo de arritmias. A, B y C muestran los potenciales de acción representativos registrados después de aplicar el protocolo de arritmia (10 Hz durante 10 segundos, 20 Hz durante 10 segundos y 1 minuto a 0,5 Hz) en el ventrículo derecho aislado y perfundido con solución de Tyrode suplementada con terfenadina y pinacidil de ratas control (A), de ratas tratadas con testosterona (B) y de ratas tratadas con finasterida (C).
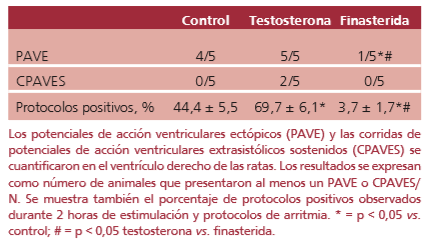
La respuesta a la estimulación por el protocolo de arritmias varió entre los grupos (Tabla 4). El resultado de referencia producido por el grupo control fue que 4 de las 5 ratas desarrollaron PAVE en respuesta al protocolo. En este grupo no se observaron CPAVES. El tratamiento con testosterona produjo un claro incremento en la arritmogenicidad, ya que todos los corazones de las ratas de este grupo mostraron PAVE mientras que 2 de cada 5 presentaron CPAVES. El tratamiento con finasterida redujo significativamente los potenciales de acción ectópicos, ya que ninguno de los corazones del grupo desarrolló CPAVES y solo uno PAVE (véase Tabla 4).
Tabla 4. Inducción de arritmias en el modelo del síndrome de Brugada
DISCUSIÓN
Se ha propuesto que el síndrome de Brugada surge como resultado de cambios en las corrientes al inicio del potencial de acción, en particular de aquellas de fase 0 y fase 1. (8) En el presente trabajo se utilizó un modelo de rata para describir la acción de los andrógenos en la regulación de los genes que podrían afectar el desarrollo de la enfermedad. Observamos que la DHT aumentó la expresión de Kv4.3 y NCX1 en células HL-1 en forma específica y que la finasterida produjo una reducción notable en el ARNm de estos genes en el corazón de la rata. Por otro lado, la acción de la testosterona se vio restringida al gen de NCX1. Con respecto a esto, se ha observado que Kv4.3 es regulado también por estrógenos, (15, 16) lo cual junto con nuestros resultados sugiere que el nivel de expresión resultante estaría sujeto al balance hormonal y no directamente a la acción de la hormona androgénica.
A nivel electrofisiológico, el tratamiento con testosterona produjo un acortamiento del APD90 y del TTP, lo cual en modelos del síndrome de Brugada se correlaciona con un aumento de la arritmogenicidad. (17) Dado que la finasterida indujo el efecto inverso (APD90: 31,91 ± 2,72 vs. 52,89 ± 2,80 y TTP: 3,73 ± 0,21 vs. 7,15 ± 0,50 testosterona vs. finasterida; p < 0,01), podemos concluir que en nuestro modelo la actividad androgénica se correlaciona directamente con un incremento de los parámetros para evaluar la arritmogenicidad. Esto también se vio reflejado en la respuesta a la estimulación por el protocolo de arritmias, donde la finasterida logró reducir en un orden de magnitud la frecuencia de protocolos positivos con respecto al grupo control.
Una de las mayores limitaciones en el estudio del síndrome de Brugada es la falta de un modelo en animales pequeños de laboratorio. Esto se debe a que tanto el potencial de acción como la actividad de los canales que lo conforman varían entre especies. (18, 19) El potencial de acción de la rata no presenta el domo de fase 2 del ser humano y la corriente Ito actúa principalmente sobre la fase temprana de repolarización. En este sentido, el aumento que se observó en el APD30 inducido por la finasterida puede ser atribuido a la disminución de la actividad de Kv4.3 y NCX1.
En este trabajo se propone un papel relevante para el NCX en el desarrollo de la patología del síndrome de Brugada. En la rata, el NCX actúa en modo inverso durante la fase 1 generando una corriente hiperpolarizante hasta que la membrana atraviesa su potencial de equilibrio. En los seres humanos, el NCX continúa trabajando en modo inverso durante parte de la fase 2. (20) Por lo tanto, consideramos posible que un aumento en la actividad del NCX incremente la intensidad de la fase 1 y contribuya a la pérdida del plateau de Ca++ de la fase 2. Si bien no es posible una extrapolación directa de estos resultados al potencial de acción del humano, es razonable pensar que la atenuación de la Ito podría evitar la pérdida del domo.
En el contexto de esta evidencia nuestros resultados en cuanto a la regulación androgénica de Kv4.3 y NCX indican un mecanismo por el cual los niveles de andrógenos facilitan el desarrollo del síndrome de Brugada.
La actividad transcripcional del receptor de andrógenos (RA) es el resultado de su interacción con sus agonistas, la testosterona y la DHT. Ambos agonistas muestran efectos aditivos sobre el RA. La testosterona es más abundante que la DHT, pero la DHT tiene una afinidad más alta por el RA. (21) Así, la finasterida disminuye indirectamente la actividad transcripcional del RA, lo que se refleja en una reducción en la expresión tanto de Kv4.3 como de NCX en el ventrículo derecho de la rata. Durante los últimos años se han realizado numerosos esfuerzos por encontrar un tratamiento para el síndrome de Brugada. Sin embargo, mientras que los fármacos antiarrítmicos como la amiodarona y los betabloqueantes resultaron ineficaces, inhibidores específicos de la Ito con mayor potencial curativo (entre ellos, 4-aminopiridina y quinidina) acarrean efectos secundarios que imposibilitan su uso terapéutico. Consideramos que nuestros resultados (dentro de las limitaciones que impone el modelo en rata) ameritan futuros estudios para analizar el efecto de la finasterida en pacientes con síndrome de Brugada. Cabe destacar que la finasterida es en la actualidad un medicamento de venta libre, del cual no se han descripto efectos adversos serios.
1. Benito B, Brugada R, Brugada J, Brugada P. Brugada syndrome. Prog Cardiovasc Dis 2008;51:1-22. http://doi.org/ddg7kw [ Links ]
2. Nielsen MW, Holst AG, Olesen S P, Olesen MS. The genetic component of Brugada syndrome. Front Physiol 2013;15:179. [ Links ]
3. Berne P, Brugada J. Brugada syndrome. Circ J 2012;76:1563-71. http://doi.org/ddg7kw [ Links ]
4. Antzelevitch C. Molecular biology and cellular mechanisms of Brugada and long QT syndromes in infants and young children. J Electrocardiol 2001;34 Suppl:177-81. http://doi.org/b6sg45 [ Links ]
5. Antzelevitch C, Yan GX, Shimizu W. Transmural dispersion of repolarization and arrhythmogenicity: the Brugada syndrome versus the long QT syndrome. J Electrocardiol 1999;32 Suppl:158-65. http://doi.org/cjtn39 [ Links ]
6. Matsuo K, Akahoshi M, Seto S, Yano K. Disappearance of the Brugada-type electrocardiogram after surgical castration: a role for testosterone and an explanation for the male preponderance. Pacing Clin Electrophysiol 2003;26(7 Pt 1):1551-3. http://doi.org/dw79m3 [ Links ]
7. Shimizu W, Matsuo K, Kokubo Y, Satomi K, Kurita T, Noda T, et al. Sex hormone and gender difference-role of testosterone on male predominance in Brugada syndrome. J Cardiovasc Electrophysiol 2007;18:415-21. http://doi.org/cbsr26 [ Links ]
8. Di Diego JM, Cordeiro JM, Goodrow RJ, Fish JM, Zygmunt AC, Pérez GJ, et al. Ionic and cellular basis for the predominance of the Brugada syndrome phenotype in males. Circulation 2002;106:2004-11. http://doi.org/bhfhnm [ Links ]
9. Di Diego JM, Sun ZQ, Antzelevitch C. I(to) and action potential notch are smaller in left vs. right canine ventricular epicardium. Am J Physiol 1996;271:H548-61. [ Links ]
10. Kong W, Po S, Yamagishi T, Ashen MD, Stetten G, Tomaselli G F. Isolation and characterization of the human gene encoding Ito: further diversity by alternative mRNA splicing. Am J Physiol 1998;275:H1963-70. [ Links ]
11. Zicha S, Xiao L, Stafford S, Cha TJ, Han W, Varro A, Nattel S. Transmural expression of transient outward potassium current subunits in normal and failing canine and human hearts. J Physiol 2004;561(Pt 3):735-48. [ Links ]
12. Teutsch C, Kondo R P, Dederko DA, Chrast J, Chien KR, Giles WR. Spatial distributions of Kv4 channels and KChip2 isoforms in the murine heart based on laser capture microdissection. Cardiovasc Res 2007;73:739-49. http://doi.org/bf7qrd [ Links ]
13. Carmeliet E. Intracellular Ca(2+) concentration and rate adaptation of the cardiac action potential. Cell Calcium 2004;35:557-73. http://doi.org/bvdscr [ Links ]
14. Pfaffl M W. A new mathematical model for relative quantification in real-time RT-PCR. Nucleic Acids Res 2001;29:2002-7. http://doi.org/b7shzz [ Links ]
15. Saito T, Ciobotaru A, Bopassa JC, Toro L, Stefani E, Eghbali M. Estrogen contributes to gender differences in mouse ventricular repolarization. Circ Res 2009;14;105:343-52. http://doi.org/dq299z [ Links ]
16. Song M, Helguera G, Eghbali M, Zhu N, Zarei MM, Olcese R, et al. Remodeling of Kv4.3 potassium channel gene expression under the control of sex hormones. J Biol Chem 2001;24;276:31883-90. http://doi.org/d4js7n [ Links ]
17. Sabir IN, Li LM, Jones VJ, Goddard CA, Grace AA, Huang CL. Criteria for arrhythmogenicity in genetically-modified Langendorff-perfused murine hearts modelling the congenital long QT syndrome type 3 and the Brugada syndrome. Pflugers Arch 2008;455:637-51. http://doi.org/c7z63x [ Links ]
18. Patel S P, Campbell DL. Transient outward potassium current, ‘Ito', phenotypes in the mammalian left ventricle: underlying molecular, cellular and biophysical mechanisms. J Physiol 2005;569:7-39. http://doi.org/cgjhtw
19. Akar FG, Wu RC, Deschenes I, Armoundas AA, Piacentino V 3rd, Houser SR, et al. Phenotypic differences in transient outward K+ current of human and canine ventricular myocytes: insights into molecular composition of ventricular Ito. Am J Physiol Heart Circ Physiol 2004;286:H602-9. http://doi.org/btzdph [ Links ]
20. Janvier NC, Boyett MR. The role of Na-Ca exchange current in the cardiac action potential. Cardiovasc Res 1996;32:69-84. http://doi.org/d3nn6j [ Links ]
21. Ohno S. Testosterone and cellular response. Birth Defects Orig Artic Ser 1977;13:99-106. [ Links ]














