Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista argentina de cardiología
versión On-line ISSN 1850-3748
Rev. argent. cardiol. vol.83 no.4 Ciudad Autónoma de Buenos Aires ago. 2015
ARTÍCULO ORIGINAL
La función sistólica longitudinal del ventrículo izquierdo, la poscarga y la contractilidad en la estenosis aórtica grave
Left Ventricular Systolic Longitudinal Function, Afterload and Contractility in Severe Aortic Stenosis
Ricardo A. MiglioreMTSAC, María E. AdaniyaMTSAC, Miguel BarrancoMTSAC, Silvia González, Guillermo Miramont†, Horacio TamagusukuMTSAC
Hospital Interzonal de Agudos “Eva Perón”, San Martín, provincia de Buenos Aires
MTSAC Miembro Titular de la Sociedad Argentina de Cardiología
† Para optar a Miembro Titular de la Sociedad Argentina de Cardiología
Dirección para separatas: Dr. Ricardo A. Migliore - Moreno 3518 - 4° E - (1650) San Martín, provincia de Buenos Aires, Argentina - e-mail: rmigliore@ intramed.net
Recibido: 03/02/2015
Aceptado: 20/05/2015
RESUMEN
Introducción: En pacientes con estenosis aórtica (EAo) grave, la función sistólica longitudinal (FSL) del ventrículo izquierdo puede estar disminuida a pesar de presentar fracción de eyección (FEy) preservada. Sin embargo, la FSL, como todo índice de acortamiento, es dependiente de la poscarga y su relación con la contractilidad no se ha estudiado suficientemente.
Objetivo: Evaluar en pacientes con EAo grave las alteraciones de la FSL y su relación con la poscarga y la contractilidad miocárdica.
Material y métodos: Se estudiaron 101 pacientes con EAo grave (AVA < 1 cm2) y 63 individuos normales con Doppler cardíaco. La FSL se evaluó por medio de la excursión sistólica del anillo mitral lateral (ESAM) y la velocidad pico de la onda S (Doppler tisular). La contractilidad se evaluó mediante la relación entre la fracción de acortamiento mesoparietal (FAm) – estrés de fin de sístole (EFS) en los individuos normales. El nivel de contractilidad (NC) se definió como la FAm medida menos la FAm predicha para un valor determinado de EFS.
Resultados: La ESAM y la onda S se correlacionaron directamente con índices de acortamiento como la FEy y la FAm e inversamente con índices de poscarga como el EFS. No hubo correlación entre la FSL y el NC. En el análisis multivariado, el EFS y la FEy fueron predictores de la FSL.
Conclusiones: En pacientes con EAo grave, la FSL se relacionó inversamente con la poscarga. La presencia de disminución de la ESAM o de la onda S no se asoció con anormalidades de la contractilidad del ventrículo izquierdo.
Palabras clave: Estenosis de la válvula aórtica; Función ventricular izquierda; Ecocardiografía Doppler
ABSTRACT
Background: In patients with severe aortic stenosis (AS), left ventricular systolic longitudinal function (SLF) is impaired despite normal ejection fraction (EF). However, similarly to other shortening indexes, SLF depends on afterload and its relationship with contractility has not been thoroughly studied.
Objective: The aim of this study was to evaluate SLF alterations and their relationship with afterload and myocardial contractility in patients with severe AS.
Methods: One hundred and one patients with severe AS (AVA <1 cm2) and 63 normal control subjects were studied with Doppler echocardiography. Left ventricular systolic longitudinal function was evaluated by lateral mitral annulus systolic displacement (MASD) and peak S wave velocity (tissue Doppler imaging). Contractility was assessed by the midwall fractional shortening (mFS)–end-systolic stress (ESS) relationship in control subjects. Contractility level (CL) was defined as measured mFS minus predicted mFS for a defined ESS value.
Results: Lateral mitral annulus systolic displacement and S wave correlated directly with shortening indexes as EF and mFS and inversely with afterload indexes as ESS. There was no correlation between SLF and CL. In the multivariate analysis ESS and EF were predictors of SLF.
Conclusions: In patients with severe AS, SLF correlated inversely with afterload. The presence of decreased MASD or S wave was not associated with abnormal left ventricular contractility.
Key words: Aortic Valve Stenosis; Ventricular Function, Left; Echocardiography, Doppler
Abreviaturas
AVA Área valvular aórtica
C Control
EAo Estenosis aórtica
EE Error estándar
EFS Estrés de fin de sístole
EPR Espesor parietal relativo
ESAM Excursión sistólica del anillo mitral
FAe Fracción de acortamiento endocárdica
FAm Fracción de acortamiento mesoparietal
FEy Fracción de eyección
FSL Función sistólica longitudinal
GM Gradiente medio
GP Gradiente pico
IM índice de masa
NC Nivel de contractilidad
PFS Presión de fin de sístole
VFD Volumen de fin de diástole
VFS Volumen de fin de sístole
VI Ventrículo izquierdo
VS Volumen sistólico
INTRODUCCIÓN
En la estenosis aórtica (EAo) grave asintomática, la presencia de fracción de eyección (FEy) disminuida (< 50%) es una indicación de tratamiento quirúrgico debido a la mayor morbimortalidad que presentan estos pacientes. (1-3) La disminución de la FEy puede deberse a un aumento de la poscarga con contractilidad preservada (mismatch) (4) o a una depresión de la contractilidad secundaria a la fibrosis que acompaña a la hipertrofia o a enfermedad coronaria asociada. (5, 6) Se ha comunicado que la función sistólica longitudinal (FSL) del ventrículo izquierdo (VI) puede estar disminuida en los pacientes con EAo grave y FEy normal, sugiriendo que el deterioro de la FSL precede a la disminución de la FEy. (7, 8) Utilizando diversas técnicas como el desplazamiento sistólico del anillo mitral (modo M), la onda S del Doppler tisular y la deformación miocárdica (strain), dicho hallazgo se ha interpretado como un deterioro incipiente de la contractilidad en presencia de FEy normal. (9-12) Sin embargo, todos los parámetros mencionados se relacionan con el acortamiento de las fibras longitudinales, las cuales dependen del nivel de contractilidad (NC), pero también de la geometría, (13) la precarga y sobre todo de la poscarga. (14-16) La influencia que podría tener el aumento de la poscarga o la disminución de la contractilidad en los pacientes con EAo grave sobre la FSL no está completamente estudiada. El objetivo del presente trabajo fue analizar la FSL del VI y su relación con la poscarga y la contractilidad en la EAo grave.
MATERIAL Y MÉTODOS
Se estudiaron prospectivamente 101 pacientes con edad promedio de 70 ± 11 años, 61 hombres y 40 mujeres, portadores de estenosis valvular aórtica grave definida como área valvular aórtica (AVA) < 1 cm2, a los cuales se les había solicitado un eco-Doppler. Se excluyeron los pacientes que presentaban calcificación del anillo mitral, insuficiencia aórtica o mitral de grado moderado o grave. El antecedente de cardiopatía isquémica se basó en si el paciente había presentado uno o más de los siguientes criterios: 1) antecedentes de infarto agudo de miocardio, angioplastia o cirugía de revascularización, 2) obstrucciones mayores del 50% en las arterias coronarias determinadas por angiografía y 3) acinesia en el ecocardiograma. Los datos de la coronariografía se obtuvieron en 39 pacientes, presentando enfermedad coronaria 14 pacientes.
Como grupo control (C) se estudiaron 63 pacientes con edad promedio de 69 ± 13 años, sin antecedentes cardiológicos, factores de riesgo cardiovascular ni enfermedades sistémicas. A todos los pacientes se les realizó un eco-Doppler completo, precedido por el interrogatorio para detectar la presencia de factores de riesgo coronario y síntomas, un examen físico cardiovascular, la medición de la presión arterial y el registro del pulso carotídeo.
Ecocardiograma y Doppler cardíaco
El estudio se realizó con un ecocardiógrafo Toshiba SSH140A con transductor de 2,5 MHz, con el paciente en decúbito lateral izquierdo, utilizando la derivación DII del electrocardiograma como referencia. Las mediciones del ecocardiograma bidimensional en modo M, cálculo de la fracción de acortamiento endocárdica (FAe) del VI, espesor parietal relativo (EPR), volumen de fin de diástole (VFD) (método área – longitud), volumen de fin de sístole (VFS), FEy e índice de volumen sistólico (VS) se realizaron de acuerdo con los criterios de la ASE (American Society of Echocardiography). (17) La fracción de acortamiento mesoparietal (FAm) del VI se calculó con la fórmula de Koide. (18) La masa del VI se calculó de acuerdo con la fórmula de Devereux (19) y el índice de masa (IM), como la masa normalizada a la superficie corporal. Según el IM y el EPR, la geometría ventricular se clasificó en normal, remodelación concéntrica, hipertrofia concéntrica e hipertrofia excéntrica. (20) Mediante el modo M del anillo mitral obtenido desde la vista de 4 cámaras se midió la excursión sistólica del anillo mitral (ESAM) lateral. (21) Con Doppler continuo se registró el gradiente transvalvular aórtico pico (GP), medio (GM) y la integral de la curva de flujo desde las vistas apical, paraesternal derecha, subxifoidea y supraesternal. Utilizando el transductor de 5 MHz se registró el Doppler tisular pulsado del anillo mitral, midiéndose la velocidad pico de la onda. Para cada parámetro evaluado se consideró el promedio de tres mediciones consecutivas.
Carotidograma calibrado
Luego de realizar el ecocardiograma se registró el carotidograma con un transductor de pulso TPW-01A y se midió la presión arterial con esfigmomanómetro en el brazo derecho con el paciente en decúbito lateral izquierdo. El carotidograma se calibró de acuerdo con el método utilizado en nuestro laboratorio (22) para obtener la presión de fin de sístole (PFS). Como índice de poscarga se estimó el estrés meridional de fin de sístole (EFS) mediante la fórmula de Grossman. (23)
Evaluación de la función sistólica longitudinal del ventrículo izquierdo
Se realizó utilizando la ESAM y la velocidad pico de la onda S del Doppler tisular.
Evaluación de la contractilidad del ventrículo izquierdo
La contractilidad se evaluó mediante la relación FAm – EFS en el grupo control con la siguiente ecuación de regresión: FAm = 28,15 – 0,12 × EFS, con un error estándar (EE) de estimación de 3,75% (r = 0,41; p < 0,001). Para un nivel determinado de EFS (poscarga), un valor inferior a la FAm predicha por la ecuación de regresión menos 2 veces el EE se consideró contractilidad disminuida en los pacientes con EAo. El NC se definió como la FAm medida menos la FAm predicha para un valor determinado de EFS, de manera que un valor positivo indica contractilidad normal y un valor negativo, contractilidad disminuida. Posteriormente, para evaluar la relación entre el NC y el punto de corte de FEy para indicar intervención (< 50%), se dividió a los pacientes en dos grupos: FEy ≥ 50% (n = 54) y FEy < 50% (n = 47).
Evaluación de la estenosis aórtica
El AVA efectiva se calculó utilizando la ecuación de continuidad. (24)
Análisis estadístico
Las variables continuas se expresaron como media ± desviación estándar, previa demostración de la normalidad con una prueba de bondad de ajuste. Para la comparación de los grupos se utilizó el análisis de la varianza y para la correlación, el cálculo del coeficiente r (Pearson). Como límite de significación se consideró una p < 0,05. Para el análisis multivariado se utilizó el método stepwise escalonado hacia adelante. Las variables no métricas se expresaron como porcentajes y se compararon con la prueba de chi cuadrado.
RESULTADOS
En los pacientes con EAo grave, el AVA efectiva fue de 0,66 cm2 ± 0,12 cm2, el GP de 71 ± 31 mm Hg y el GM de 42 ± 19 mm Hg. Comparado con el grupo C, los pacientes con EAo presentaron disminución de la FEy, la FAe y la FAm (Tabla 1). La PFS y el EFS promedio fueron similares en ambos grupos, si bien en este último el coeficiente de variación (desviación estándar/ promedio × 100) fue mayor en los pacientes con EAo que en el grupo C (57% vs. 10%; p < 0,01), indicando mayor dispersión de los valores en dicho grupo. La ESAM estuvo disminuida en los pacientes con EAo al igual que la onda S del Doppler tisular (véase Tabla 1).
Tabla 1. Parámetros ecocardiográficos de función sistólica y poscarga
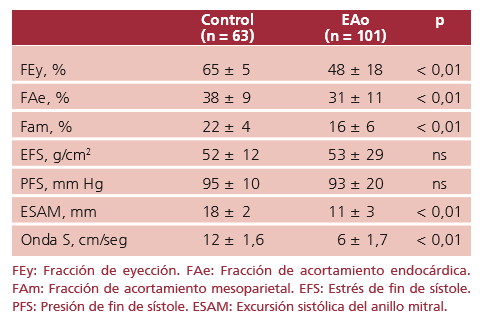
En los pacientes con EAo, la ESAM y la onda S se correlacionaron directamente con índices de acortamiento como la FEy (véase Figura 1) e inversamente con índices de poscarga como el EFS (Figura 2). Como era esperable, la FAm también se correlacionó inversamente con el EFS (r = -0,65 p < 0,00001). En el análisis multivariado, el EFS y la FEy fueron predictores de la FSL, pero no el NC.

Fig. 1. Correlación entre fracción de eyección (FEy) y excursión sistólica del anillo mitral (A), FEy y onda S (B), fracción de acortamiento mesoparietal (FAm) y excursión sistólica del anillo mitral lateral (C), FAm y onda S (D).
Fig. 2. Correlación entre el estrés de fn de sístole (EFS) y la excursión sistólica del anillo mitral lateral (A), el EFS y la onda S (B) y la fracción de acortamiento meso-parietal (FAm) y el EFS (C).
Al analizar el NC de los pacientes con EAo en el sistema acortamiento – poscarga (FAm – EFS), solo un tercio de ellos (32/101) tenían contractilidad disminuida con respecto al grupo C (Figura 3). Si bien la FAm fue menor en los pacientes con NC disminuido (32/101) con respecto a los pacientes con NC normal (69/101) (12% ± 4% vs. 18% ± 5%; p < 0,01), la superposición de valores dada por la media ± 2 desviaciones estándar no permitió establecer un valor de corte entre los dos grupos sin estar acompañado del correspondiente valor de EFS. No hubo correlación entre el NC y los índices de FSL, sugiriendo que el mayor determinante de la disminución de la FSL es el aumento de la poscarga.

Fig. 3. Correlación entre la fracción de acortamiento mesoparietal (FAm) y el estrés de fin de sístole (EFS) en los pacientes con estenosis aórtica grave.
Comparación entre pacientes con fracción de eyección < 50% y > 50% (Tabla 2)
Tabla 2. Características clínicas y parámetros ecocardiográficos en pacientes con estenosis aórtica con fracción de eyección < 50% y ≥ 50%
Los pacientes con FEy < 50% presentaron una incidencia mayor de enfermedad coronaria, disnea III-IV y, con menor frecuencia, síncope y ausencia de síntomas. En dicho grupo, la FEy y el índice de VS fue significativamente menor y el VFD y el VFS fueron mayores en comparación con los pacientes con FEy > 50%. Con respecto a la geometría ventricular, los pacientes con FEy disminuida tuvieron mayor frecuencia de hipertrofia excéntrica e IM y menor EPR que los pacientes con FEy preservada. La poscarga (EFS) se halló significativamente incrementada en los pacientes con FEy < 50% correspondiéndose con FAm disminuida, manteniendo la relación FAm – EFS una correlación inversa (FAm = 19 – 0,09 × EFS, r = -0,51; p < 0,001). Los pacientes con FEy ≥ 50% presentaron un EFS menor y una FAm mayor, manteniendo también la correlación inversa entre los dos parámetros (FAm = 23 – 0,23 × EFS, r = -0,41 p < 0,001), de manera similar a lo observado en el grupo total de EAo (véase Figura 2 C). El NC fue menor y mayor el porcentaje de pacientes con contractilidad disminuida en los pacientes con FEy < 50%, indicando la presencia de mismatch en el 53,2% de los pacientes de este grupo. La ESAM y la onda S del Doppler tisular estuvieron significativamente disminuidos en los pacientes con FEy < 50% de manera similar a los otros índices que dependen del acortamiento de la fibra (FEy y FAm), correlacionándose inversamente con el EFS. Sin embargo, los pacientes con FEy ≥ 50% presentaron disminución de la ESAM, la onda S y la FAm con respecto al grupo C a pesar de tener un EFS menor.
Relación entre enfermedad coronaria y fracción de eyección < 50% (Tabla 3)
Tabla 3. Características clínicas y parámetros ecocardiográficos en pacientes con fracción de eyección < 50% con y sin enfermedad coronaria
En este grupo se evidenció enfermedad coronaria en el 23% de los pacientes (11/47). La FEy, la presencia de insuficiencia cardíaca (disnea III-IV), la ESAM y la onda S del Doppler tisular fueron similares en ambos grupos con y sin enfermedad coronaria. El NC fue mayor en los pacientes con enfermedad coronaria, aunque la diferencia entre los dos grupos no fue significativa (2,3 ± 3,2 vs. 0,25 ± 4,8; p = 0,06), sugiriendo mayor proporción de mismatch en los pacientes con enfermedad coronaria. Debido a la baja proporción de enfermedad coronaria en pacientes con FEy ≥ 50% (3/54), no se realizó comparación entre los dos grupos. Se debe tener en cuenta que en el grupo con FEy ≥ 50%, el 50% (28/54) no tenían indicación de coronariografía por ser asintomáticos.
DISCUSIÓN
El principal hallazgo de este trabajo es que la disminución de la FSL del VI en la EAo grave se correlaciona con el aumento de la poscarga y que en solo un tercio de los pacientes la contractilidad está disminuida. Diversas publicaciones han comunicado que la FSL puede estar disminuida en presencia de FEy normal, siendo una alteración que precedería a la disminución de la FEy. (25-27) En general se presume que dicho hallazgo implicaría una disminución de la “función miocárdica”, lo cual podría interpretarse como pérdida de la contractilidad. (28-30) En la hipertrofia ventricular que acompaña a la EAo, la isquemia de las fibras subendocárdicas puede producir disminución del acortamiento longitudinal. Pero se debe tener en cuenta que en dichos pacientes la poscarga global del VI expresada a través de la impedancia valvuloarterial también está incrementada, (31) lo cual implica una mayor presión sistólica del VI, y por lo tanto mayor consumo miocárdico con la consiguiente isquemia sub-endocárdica. En la hipertrofia ventricular en ausencia de obstrucción de las arterias coronarias epicárdicas, la curva de autorregulación del flujo coronario se desplaza hacia la derecha y aumenta la compresión miocárdica por el incremento de la presión sistólica, factores que determinan el desarrollo de isquemia subendocárdica. (32, 33) Los índices de FSL como la ESAM y la onda S del Doppler tisular se correlacionaron inversamente con la poscarga evaluada a través del EFS, al igual que otros índices relacionados con el acortamiento, como la FAm y la FEy. En el análisis multivariado, la poscarga representada por el EFS y la FEy fueron los únicos predictores de los parámetros de FSL, no siendo predictor el NC. Es conveniente puntualizar que los índices de acortamiento deben ser relacionados con la poscarga para poder inferir que su disminución es secundaria a un déficit de contractilidad. (34) En el presente trabajo se utilizó como límite inferior de contractilidad el valor determinado por la resta de dos EE para el valor correspondiente a la FAm que le corresponde a un valor determinado de EFS. Utilizando esta metodología, solo un tercio de los pacientes presentaron disminución de la contractilidad.
Como evaluación de la FSL se utilizaron la velocidad pico de la onda S y la ESAM, esta última descripta hace más de 25 años (20) y que ha demostrado ser de utilidad en la evaluación de los pacientes con EAo. (7, 11) Si bien dicho parámetro podría considerarse “antiguo” frente a nuevas tecnologías como el strain, se debe tener en cuenta que en la evaluación de la FSL no es inferior al strain, tal como sostienen Luzcsak y colaboradores, (35) quienes destacan la factibilidad de la evaluación con modo M y Doppler tisular en todos los pacientes, aunque tengan pobre ventana ultrasónica.
El hallazgo más significativo fue que el 53,2% de los pacientes con FEy < 50% tuvieron contractilidad conservada a pesar de presentar remodelación ventricular (predominio de hipertrofia excéntrica, aumento del VFD y del VFS), indicando que la disminución de la FEy se debió al exceso de poscarga (mismatch), como queda evidenciado por el EFS aumentado. Por otra parte, el NC fue normal en el 81,5% de los pacientes con FEy ≥ 50%, mientras que solo el 18,5% presentaron contractilidad disminuida, sugiriendo que si bien la FEy preservada no asegura contractilidad normal en todos los pacientes, probablemente dicho hallazgo estaría relacionado con diferencias en el grado de fibrosis. (36) Un hallazgo para considerar en el grupo con FEy ≥ 50% es que los índices de FSL y la FAm se hallaron disminuidos con respecto al grupo C a pesar de que el EFS fue menor (36 ± 19 g/cm2 vs. 52 ±12 g/cm2; p < 0,05), para lo cual se debe tener en consideración que el EFS es una simplificación del estrés total que soporta el VI desde el comienzo hasta el final de la eyección con diferentes efectos sobre el comienzo, la mitad y el fin de la sístole, (37, 38) siendo por lo tanto una limitación del estudio. Sin embargo, la disminución de la FSL en este grupo está en concordancia con los reportes de disminución del strain en pacientes con FEy preservada, en los cuales no se analizó el NC. (11, 12) La correlación inversa entre FAm – EFS y FSL – EFS en los pacientes con FEy < 50% o ≥ 50% fue similar a la observada en el grupo total de pacientes con EAo. Al considerar la influencia que podría tener la enfermedad coronaria en los pacientes con FEy < 50%, no se hallaron diferencias significativas en cuanto a FEy, desarrollo de insuficiencia cardíaca, índices de FSL y NC, si bien en este último parámetro se observó una tendencia a ser menor, sin alcanzar valores de significación, en los pacientes sin enfermedad coronaria, probablemente porque tenían mayor tiempo de evolución de su valvulopatía con el consiguiente desarrollo de fibrosis.
Limitaciones
Los datos de la presencia de enfermedad coronaria se pudieron evaluar en el 39% de los pacientes mediante coronariografía; si bien el 28% eran asintomáticos, con FEy ≥ 50% y no tenían por lo tanto indicación del estudio, no puede descartarse en el 33% restante. No se realizó strain por no estar disponible en el equipo utilizado en el estudio.
CONCLUSIONES
En pacientes con EAo grave, la FSL se relacionó inversamente con la poscarga (EFS). La presencia de disminución de la ESAM o de la onda S no se asoció con anormalidades de la contractilidad del VI. La contractilidad se observó disminuida en un tercio del total de los pacientes con EAo y en el 46,8% de los pacientes con FEy < 50%, sugiriendo la presencia de exceso de poscarga (mismatch) en el 53,2% restante.
Declaración de conflicto de intereses
Los autores declaran que no poseen conflicto de intereses.
(Véanse formularios de conflicto de intereses de los autores en la web/ Material suplementario).
1. Tarantini G, Buja P, Scognamiglio R, Razzolini R, Gerosa G, Isabella G, et al. Aortic valve replacement in severe aortic stenosis with left ventricular dysfunction: determinants of cardiac mortality and ventricular function recovery. Eur J Cardiothorac Surg 2003;24:879-85. http://doi.org/bjkk8z [ Links ]
2. Mihaljevic T, Nowicki ER, Rajeswaran J, Blackstone EH, Lagazzi L, Thomas J, et al. Survival after valve replacement for aortic stenosis: implications for decision making. J Thorac Cardiovasc Surg 2008;135:1270-9. http://doi.org/bvn96s [ Links ]
3. Clark MA, Arnold S V, Duhay FG, Thompsom AK, Keyes MJ, Svensson LG, et al. Five-year clinical end economic outcomes among patients with medically managed severe aortic stenosis. Circ Cardiovasc Qual Outcomes 2012;5:697-704. http://doi.org/5cg [ Links ]
4. Ross J Jr. Afterload mismatch and preload reserve: a conceptual framework for the analysis of ventricular function. Prog Cardiovasc Dis 1976;18:255-64. http://doi.org/d7z9k2 [ Links ]
5. Huber D, Grimm J, Koch R, Krayenbuehl H P. Determinants of ejection performance in aortic stenosis. Circulation 1981;64;126-31. http://doi.org/c649m7 [ Links ]
6. Green GR, Miller DC. Continuing dilemmas concerning aortic valve replacement in patients with advanced left ventricular systolic dysfunction. J Heart Valve Dis 1997;6:562-79. [ Links ]
7. Takeda S, Rimington H, Smeeton N, Chambers J. Long axis excursion in aortic stenosis. Heart 2001;86:52-6. http://doi.org/fm8hkq [ Links ]
8. Delgado V, Tops L F, van Bommel RJ, van der Kley F, Marsan NA, Klautz RJ, et al. Strain analysis in patients with severe aortic stenosis and preserved left ventricular ejection fraction undergoing surgical valve replacement. Eur Heart J 2009;30:3037-47. http://doi.org/cpwvg9 [ Links ]
9. Rydberg E, Gudmunsson P, Kennedy L, Erhardt L, Willenheimer R. Left atrioventricular plane displacement but not left ventricular ejection fraction is influenced by the degree of aortic stenosis. Heart 2004;90:1151-5. http://doi.org/fjc6bn [ Links ]
10. Vinereanu D Khokhar D, Tweddell AC, Cinteza M, Fraser A. Estimation of global left ventricular function from the velocity of longitudinal shortening. Echocardiography 2002;19:177-85. http://doi.org/fk3xtr [ Links ]
11. Kearney LG, Lu K, Ord M, Patel SK, Profitis K, Matalanis G, et al. Global longitudinal strain is a strong independent predictor of all-cause mortality with aortic stenosis. Eur Heart J Cardiovasc Imaging 2012;13:827-33. http://doi.org/5cj [ Links ]
12. Dahl JS, Videbaek L, Poulsen MK, Rudbaek TR, Pellikka PA, Moller JE. Global strain in severe aortic stenosis. Circ Cardiovasc Imaging 2012;5:613-620. http://doi.org/5ck [ Links ]
13. Cramariuc D, Gerdts E, Davidsen ES, Segadal L, Matre K. Myo-cardial deformation in aortic valve stenosis: relation to left ventricular geometry. Heart 2010;96:110-2. http://doi.org/ckrt6q [ Links ]
14. Abraham T P, Laskowski C, Zhan WZ, Belohlavek M, Martin EA, Greenleaf J F, et al. Myocardial contractility by strain echocardiography: comparison with physiological measurements in an in vitro model. Am J Physiol Heart Circ Physiol 2003;285:H2599-H2604. http://doi.org/5cm [ Links ]
15. Donal E, Bergerot C, Thibault H, Ernande L, Loufoua J, Augeul L, et al. Influence of afterload on left ventricular radial and longitudinal systolic functions: a two-dimensional strain imaging study. Eur J Echocardiogr 2009;10:914-21. http://doi.org/cqskvv [ Links ]
16. Burns AT, La Gerche A, Prior DL, Maclassac AL. Left ventricular torsion parameters are affected by acute changes in load. Echocardiography 2010;27:407-14. http://doi.org/dvvbss [ Links ]
17. Sahn DJ, De Maria AN, Kisslo J, Weyman AE. Recommendations regarding quantitation in M-mode echocardiography: results of a survey of echocardiographic measurements. Circulation 1978;58:1072-8. http://doi.org/5cn [ Links ]
18. Koide M, Nagatsu M, Zile M, Hamawaki M, Swindle M, Keech G, et al. Premorbid determinants of left ventricular dysfunction in a novel model of gradually induced pressure overload in the adult canine. Circulation 1997;95:1601-10. http://doi.org/5cp [ Links ]
20. Devereux RB, Alonso DR, Lutas EM, Gottlieb GJ, Campo E, Sachs I, et al. Echocardiographic assessment of left ventricular hypertrophy: comparison to necropsy findings. Am J Cardiol 1986;57:450-8.http://doi.org/cbvbw9 [ Links ]
21. Devereux R. Left ventricular geometry, pathophysiology and prognosis. J Am Coll Cardiol 1995;25:885-7. http://doi.org/fwr69c [ Links ]
22. Simonson JS, Schiller NB. Descent of the base of the left ventricle: an echocardiographic index of left ventricular function. J Am Soc Echocardiogr 1989;2:25-35. http://doi.org/5cq [ Links ]
23. Migliore RA, Guerrero F T, Adaniya ME, Ianariello J, Tamagusuku H, Posse RA. Estimación de la pre y poscarga ventricular izquierda en la enfermedad de Chagas. Rev Argent Cardiol 1990;58:252-9. [ Links ]
24. Otto C. Echocardiographic evaluation of left and right ventricular systolic function. En: Otto C. Textbook of clinical echocardiography. 2nd ed. Philadelphia: WB Saunders; 2000. p. 104. [ Links ]
25. Otto CM. Aortic stenosis: echocardiographic evaluation of disease severity, disease progression, and the role of echocardiography in clinical decision making. En: Otto CM. The practice of clinical echocardiography. 1st ed. Philadelphia, USA: WB Saunders Company; 1997. p. 405-32. [ Links ]
26. Galema T W, Yap S, Soliman OII, van Thiel RJ, ten Cate FJ, Brandenburg HJ, et al. Recovery of long-axis left ventricular function after aortic valve replacement in patients with severe aortic stenosis. Echocardiography 2010;27:1177-81. http://doi.org/b9v4c3 [ Links ]
27. Hyodo E, Arai K, Koczo A, Shimada YJ, Fujimoto K, Di Tullio MR, et al. Alteration in subendocardial and subepicardial myocardial strain in patients with aortic valve stenosis: an early marker of left ventricular dysfunction? J Am Soc Echocardiogr 2012,25:153-9. http://doi.org/c7r546 [ Links ]
28. Kusunose K, Goodman A, Parikh R, Barr T, Agarwal S, Popovic ZB, et al. Incremental prognostic value of left ventricular global longitudinal strain in patients with aortic stenosis and preserved ejection fraction. Circ Cardiovasc Imaging 2014;7:938-45. http://doi.org/5cr [ Links ]
29. Burns AT, La Gerche A, D’hooge J, Maclassac AL, Prior DL. Left ventricular strain and strain rate: characterization of the effect of load in human subjets. Eur J Echocardiogr 2010;11:283-9. http://doi.org/cg3s5q
30. Ozkan A, Kapadia S, Tuzcu M, Marwick TH. Assessment of left ventricular function in aortic stenosis. Nat Rev Cardiol 2011;8:494-50. http://doi.org/fp56vf [ Links ]
31. Adda J, Mielot C, Giorgi R, Cransac F, Zirphile X, Donal E, et al. Low-flow, low-gradient severe aortic stenosis despite normal ejection fraction is associated with severe left ventricular dysfunction as assessed by speckle-tracking echocardiography. Circ Cardiovasc Imaging 2012;5:27-35. http://doi.org/fdnmsh [ Links ]
32. Lancelotti L, Magne J, Donal E, Davin L, O’Connor K, Rosca M, et al. Clinical outcome in asymptomatic severe aortic stenosis. J Am Coll Cardiol 2012;59:235-43. http://doi.org/fzrdfc
33. Roy M. Evidence for aggressive blood pressure-lowering goals in patients with coronary artery disease. Curr Atheroscler Rep 2010;12:134-9. http://doi.org/d3c4j9 [ Links ]
34. Ohara Y, Fukuoka Y, Tabuchi I, Sahara S, Hosogi S, Nishimoto M, et al. The impairment of endocardial radial strain is related to aortic stenosis severity in patients with aortic stenosis and preserved LV ejection fraction using two-dimensional speckle tracking echo-cardiography. Echocardiography 2012;9:1172-80. http://doi.org/5cs [ Links ]
35. Baicu C F, Zile MR, Aurigemma G P, Gaasch WH. Left ventricular systolic performance, function and contractility in patients with diastolic heart failure. Circulation 2005;111:2306-12. http://doi.org/dk2dg8 [ Links ]
36. Luszcsak J, Olszowska M, Drapisz S, Plazak W, Kaznica-Wiatr M, Karch I, et al. Assessment of left ventricle function in aortic stenosis: mitral annular plane systolic excursion is not inferior to speckle tracking echocardiography derived global longitudinal peak strain. Cardiovasc Ultrasound 2013;11:45-53. http://doi.org/5ct [ Links ]
37. Milano AD, Faggian G, Dodonov M, Golia G, Tomezzoli A, Bortolotti U, et al. Prognostic value of myocardial fibrosis in patients with severe aortic valve stenosis. J Thorac Cardiovasc Surg 2012;144:830-7. http://doi.org/fzd789 [ Links ]
38. Burkhoff D, Mirsky I, Suga H. Assessment of systolic and diastolic properties via pressure-volume analysis: a guide for clinical, translational, and basic researchers. Am J Physiol Heart Circ Physiol 2005;289;H501-12. http://doi.org/djv7b5 [ Links ]
39. Chirinos J. Ventricular-arterial coupling: invasive and non-invasive assessment. Artery Res 2013;7:1016-32. http://doi.org/5cv [ Links ]














