Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista argentina de cardiología
versión On-line ISSN 1850-3748
Rev. argent. cardiol. vol.84 no.4 Ciudad Autónoma de Buenos Aires ago. 2016
ARTÍCULO ORIGINAL
Evidencia de miocardiopatía incipiente con strain en la enfermedad de Chagas
Evidence of Early Cardiomyopathy with Strain in Chagas Disease
MATILDE B. DEL CAMPO CONTRERAS1 2, \ GRACIELA ROUSSE2, MARCELA G. SUN2, GARLOS R. KILLINGERMTSAG, GUSTAVO CABREJOS2, SANDRA FERRADAS3, MÁXIMO SENESI4
RESUMEN
Introducción: En la enfermedad de Chagas, la miocardiopatía es la afección más grave provocada por esta parasitosis; su lenta evolución ha llevado a numerosas investigaciones en búsqueda de parámetros que permitan detectar daño miocárdico incipiente. Actualmente, la incorporación del strain por speckle tracking abre un nuevo horizonte.
Objetivo: Investigar el rol del strain bidimensional en la enfermedad de Chagas y en la detección de miocardiopatía incipiente. Material y métodos: Estudio transversal, realizado de diciembre de 2009 a marzo de 2011, en el que se incluyeron 93 pacientes con enfermedad de Chagas, 45 hombres, edad promedio 46 ± 12 años, que se dividieron en tres grupos (G): G1 (n = 40) sin cardiopatía demostrada, G2 (n = 17) con electrocardiograma anormal y G3 (n = 36) con miocardiopatía. Se conformó un grupo control de 35 sujetos, 19 hombres, edad promedio de 40 ± 10 años. Por eco-Doppler cardíaco se evaluaron: diámetros del ventrículo izquierdo, área auricular izquierda, fracción de eyección del ventrículo izquierdo (Simpson), excursión sistó-lica del plano de los anillos mitral y tricuspídeo. Por flujograma mitral: ondas E y A, tiempo de desaceleración de la onda E, relación E/A. Entre el grupo control y el grupo sin cardiopatía demostrada se compararon el Doppler pulsado tisular de los anillos mitral y tricuspídeo (ondas E', A', relación E'/A' y onda S') y el strain longitudinal pico sistólico global y segmentario. Resultados: El strain longitudinal pico sistólico global se correlacionó con la excursión sistólica del plano del anillo mitral (r: 0,75) en los pacientes con enfermedad de Chagas tomados en conjunto. El análisis del strain longitudinal pico sistólico segmentario discriminó dos o más segmentos anormales (valor inferior -12%) en 10 pacientes del grupo sin cardiopatía demostrada. Este subgrupo (n = 10) mostró inferior strain longitudinal pico sistólico global (-19,78% vs. -22,28%; p = 0,009), menor valor E'/A' en los anillos mitral (1,23 ± 0,59; p = 0,021) y tricuspídeo (0,73 ± 0,3; p = 0,019), con inversión de la relación E'/A' tricuspídea respecto del resto del grupo (n = 30).
Conclusiones: El strain longitudinal pico sistólico global se correlacionó con la excursión sistólica del plano del anillo mitral. El strain longitudinal pico sistólico segmentario discriminó en el grupo sin cardiopatía demostrada una subpoblación con segmentos anormales, valores inferiores de strain longitudinal pico sistólico global y disfunción diastólica biventricular por Doppler pulsado tisular; la implicación clínica de este hallazgo requiere seguimiento longitudinal.
Palabras clave: Ecocardiografía, métodos - Miocardiopatía chagásica - Enfermedad de Chagas - Eco-Doppler cardíaco - Insuficiencia cardíaca diastólica
ABSTRACT
Background: In Chagas' disease, cardiomyopathy is the most severe affection produced by this parasitic disease; its slow progression had led to several investigations in search of parameters capable of detecting incipient myocardial damage. Cur-rently, the incorporation of strain by speckle tracking echocardiography opens a new horizon.
Objective: The aim of this study was to investigate the role of two-dimensional echocardiography in Chagas' disease and in the detection of incipient cardiomyopathy.
Methods: A cross-sectional study was performed between December 2009 and March 2011; 93 patients with Chagas' disease were included; 45 were men and mean age was 46±12 years. The patients were divided in three groups (G): G1 (n=40) with-out demonstrable heart disease, G2 (n=17) with abnormal electrocardiogram and G3 (n=36) with cardiomyopathy. A control group was made up of 35 subjects, 19 were men and mean age was 40±10 years. Doppler echocardiography was performed to evaluate left ventricular dimensions, left atrial area, left ventricular ejection fraction (Simpson), mitral annular plane systolic excursion and tricuspid annular plane systolic excursion. Mitral inflow pattern evaluated E wave, A wave, mitral E wave deceleration time and E/A ratio. Pulsed tissue Doppler imaging was used to measure and compare velocities at the lateral mitral annulus and tricuspid annulus (E' wave, A' wave, E'/A' ratio and S' wave) in the control group and in the group without heart disease.
Rev Argent Cardiol 2016;84:335-342. http://dx.doi.org/10.7775/rac.es.v84.i4.8715 Recibido: 16/05/2016 - Aceptado: 25/06/2016
Dirección para separatas: Dra. Matilde B. del Campo Contreras - Campichuelo 272 PB - (1405) CABA - e-mail: matildelcampo@yahoo.com.ar
Results: Global longitudinal peak systolic strain correlated with mitral annular plane systolic excursión (r: 0.75) in the pool of patients with Chagas' disease. Segmental longitudinal peak systolic strain differentiated two abnormal segments or greater (value below -12%) in 10 patients of the group without demonstrable heart disease. This subgroup (n=10) had lower values of global longitudinal peak systolic strain (-19.78% vs. -22.28%; p=0.009), lower E'/A' ratio in the mitral annulus (1.23 ±0.59; p=0.021) and tricuspid annulus (0.73±0.3; p=0.019) with inverted E'/A' ratio in the tricuspid annulus compared with the rest of the group (n=30).
Conclusions: Global longitudinal peak systolic strain correlated with mitral annular plane systolic excursion. Segmental longitudinal peak systolic strain differentiated a subpopulation in the group without demonstrable heart disease with abnormal segments, low values of global longitudinal peak systolic strain and biventricular diastolic dysfunction at Doppler tissue imaging. The clinical value of this finding requires longitudinal follow-up.
Key words: Echocardiography/methods - Chagas Cardiomyopathy - Chagas Disease - Echocardiography, Doppler, Color - Heart Failure, Diastolic
Abreviaturas
| BNP | Péptido natriurético cerebral | FEy | Fracción de eyección |
| CCI | Coeficiente de correlación intraclase | GSCD | Grupo sin cardiopatía demostrada |
| DDVI | Diámetro diastólico del ventrículo izquierdo | SLPSG | Strain longitudinal pico sistólico global |
| DPT | Doppler pulsado tisular | SLPSS | Strain longitudinal pico sistólico segmentario |
| DSVI | Diámetro sistólico del ventrículo izquierdo | TDE | Tiempo de desaceleración de la onda E mitral |
| ECG | Electrocardiograma | VD | Ventrículo derecho |
| ESPAM ESPAT | Excursión sistólica del plano del anillo mitral Excursión sistólica del plano del anillo tricuspídeo | VI | Ventrículo izquierdo |
INTRODUCCIÓN
La enfermedad de Chagas constituye la infección parasitaria endémica de Latinoamérica de mayor morbimortalidad. Su agente etiológico, Trypanosoma cruzi, se transmite al ser humano por distintas vías: vectorial, transfusional y transplacentaria; una menos conocida es la vía oral (contaminación de comida o jugos) reportada por primera vez en 1965. (1) La primera de ellas es la forma más frecuente y su reservorio, un vector hematófago, Triatoma infestans, encuentra un hábitat favorable en condiciones de pobreza. Su control se considera un serio problema de salud pública. Si bien la prevalencia de esta enfermedad se redujo en las dos últimas décadas, según estimaciones más recientes (2016) de la Organización Mundial de la Salud, existen entre 6 y 7 millones de infectados en todo el mundo y solo durante el 2008 se registraron 11.000 defunciones debido a miocardiopatía chagásica. (2) Como consecuencia de la migración global hay además 300.000 infectados en los Estados Unidos (3) y 100.000 en Europa. (4)
La miocardiopatía chagásica es por lejos la más grave de las afecciones provocada por esta parasitosis. La mayoría de los pacientes que la padecen permanecen asintomáticos durante 10 a 30 años. Luego de este período "latente" de la fase crónica, un 30% a 40% desarrolla enfermedad cardíaca. (5, 6) Su progresión es heterogénea, impredecible y de lenta evolución, y su mortalidad se relaciona con la gravedad de la disfunción miocárdica. (7) Su patogenia no está completamente definida y se atribuye a distintos factores, como presencia del agente etiológico o de componentes antigénicos de este en tejido cardíaco, y asimismo a la respuesta del sistema inmunitario (mediador de daño celular y de disfunción endotelial). (8-10) Diversos investigadores, entre ellos nuestro grupo, han analizado factores genéticos reguladores de esta respuesta inmune mediante técnicas de histocompatibilidad, pero su gran pleomorfismo y variables a las que está sujeto dificultan resultados concluyentes. (11, 12)
El Consenso Internacional 2010 de la Enfermedad de Chagas modificó los términos "indeterminado" y "portador sano" de los pacientes asintomáticos en la fase crónica de la enfermedad por el de "pacientes crónicos sin patología demostrada", (13) jerarquizando el hallazgo de cardiopatía según la sensibilidad del método diagnóstico empleado. Estudios previos han demostrado alteraciones en la función diastólica, (14) en la motilidad regional y en el Doppler pulsado tisular (DPT), (15, 16) como también una respuesta anormal ante las pruebas de eco estrés farmacológico. (17, 18) Marcadores biológicos como el péptido natriurético cerebral (BNP) y la troponina, (19) sumados a los nuevos avances tecnológicos de la ecocardiografía, como el strain bidimensional, buscan detectar daño miocárdico incipiente. En ese sentido, la técnica de speckle tracking es promisoria. Sabemos que la deformación miocárdica puede registrarse a través del strain longitudinal (fibras predominantemente subendocárdicas), el circunferencial y el radial, aunque estas últimas requieren para su alteración una afección transmural de la pared analizada. (20) Teniendo en cuenta que el subendocardio es la capa más sensible a episodios isquémicos de distinto tipo (alteraciones microvasculares, disfunción endotelial, estímulos vasoconstrictores coronarios en arterias coronarias angiográficamente normales), es posible que el strain longitudinal pueda alterarse ya en las etapas iniciales de la miocardiopatía chagásica debido a que las alteraciones mencionadas pueden estar presentes en los distintos estadios de la enfermedad.
El propósito de este estudio fue investigar la utilidad del strain bidimensional por speckle tracking en la etapa crónica de la enfermedad de Chagas y en la detección de daño miocárdico incipiente en pacientes sin cardiopatía identificada por parámetros ecocardio-gráficos empleados de rutina.
MATERIAL Y MÉTODOS PoblaciónEntre diciembre de 2009 y marzo de 2011 se estudiaron 100 pacientes con diagnóstico de enfermedad de Chagas derivados a nuestro laboratorio para control cardiológico periódico, provenientes de zona endémica y con diagnóstico serológico positivo de al menos dos pruebas: inmunofluorescencia indirecta (IFI), enzimoinmunoensayo (ELISA) y hemaglutinación indirecta.
Se realizaron examen clínico, electrocardiograma (ECG) y eco-Doppler cardíaco y se compararon con un grupo control. Se excluyeron los pacientes con hipertensión arterial (HTA), enfermedad coronaria, valvulopatías, miocardiopatía, enfermedades metabólicas, toxicológicas, fibrilación auricular, portadores de marcapasos y los pacientes con tratamiento antiparasitario previo.
Los pacientes se clasificaron en tres grupos y se compararon con un grupo control (35 sujetos con edad promedio de 40,51 ± 10,8 años y serología negativa).
Grupo 1: 43 pacientes con ecocardiograma y ECG normales, grupo sin cardiopatía demostrada (GSCD).
Grupo 2: 18 pacientes con ecocardiograma normal y ECG anormal por bloqueo de rama derecha, hemibloqueo anterior izquierdo, extrasístoles ventriculares, anormalidades primarias de la repolarización, zonas eléctricamente inactivas, bradicardia sinusal.
Grupo 3: 39 pacientes con ecocardiograma anormal por alteraciones de la motilidad regional y/o global, aumento de los diámetros del ventrículo izquierdo (VI) y disfunción sistólica variable.
Eco-Doppler cardíacoPara el ecocardiograma Doppler se utilizó un equipo VIVID7 Health Care General Electric con transductor matricial M4S 1,7-3,4 MHz. Fue evaluado por dos observadores independientes. Se evaluaron los diámetros diastólico y sistólico del VI (DDVI, DSVI), la fracción de acortamiento, la fracción de eyección (FEy) por el método de Simpson, los espesores parietales, el área de la aurícula izquierda, la excursión sis-tólica del plano de los anillos mitral (ESPAM) y tricuspídeo, (ESPAT). Por flujograma mitral: ondas A y E, relación E/A y tiempo de desaceleración de la onda E mitral (TDE). Por DPT a nivel del anillo mitral lateral (E'm, A'm, E'm/A'm y S'm) y tricuspídeo (E't, A't, E't/A't y S't). Se evaluó el strain longitudinal pico sistólico desde las vistas apicales, con un frame rate de 50 a 70 cuadros por segundo. El mejor de tres ciclos cardíacos se analizó on line con la técnica de función de imagen automática. (21) Se determinaron el strain longitudinal pico sistólico global (SLPSG), definido como el promedio de los 16 segmentos analizados y en formato de ojo de buey (bull eye), y el strain longitudinal pico sistólico segmentario (SLPSS), definido como el correspondiente a cada uno de esos segmentos. Ambos fueron analizados. La denominación de los segmentos de este trabajo sigue las indicaciones de la American Society of Echocardiography (ASE). (22)
Dado que el objetivo de nuestro estudio fue también la búsqueda de daño miocárdico incipiente (y los Grupos 2 y 3 presentaban manifestaciones de miocardiopatía chagásica), entre el grupo control y el Grupo 1 se compararon: flujogra-ma mitral, DPT de los anillos mitral y tricuspídeo y strain.
Análisis estadísticoLas variables continuas se presentan como media ± desviación estándar o mediana y rango intercuartil; las categóricas se expresan como porcentaje. Las diferencias entre grupos para variables continuas se analizaron con la prueba de la t
0 con ANOVA seguido de la prueba de Bonferroni o de Mann-Whitney; para variables categóricas se emplearon la prueba de chi cuadrado o la exacta de Fisher. Correlación, con coeficiente r de Pearson. Se calculó variabilidad intraobservador e interobservador mediante el coeficiente de correlación intraclase (CCI). Se consideró significativa una p < 0,05. Se utilizó el programa SPSS versión 18 (SPSS Inc. 5 Chicago, IL).
Consideraciones éticasEl protocolo fue evaluado y aprobado por el Comité de Ética de la institución
RESULTADOSDe los 100 estudios iniciales, se excluyeron 7 pacientes por imagen ultrasónica inadecuada para realizar strain (factibilidad 94%). Las características de la población y los resultados del ecocardiograma se describen en
la Tabla 1.
Los pacientes con miocardiopatía chagásica (Grupo 3) presentaron mayor edad promedio (diferencia espe-rable considerando el prolongado período de latencia de esta enfermedad), mayor diámetro ventricular, mayor área auricular izquierda y disfunción sistólica variable reflejada en valores inferiores de ESPAM y FEy respecto de los grupos restantes (p < 0,05) (Tabla 1). Las alteraciones de la motilidad parietal más frecuentemente observadas en este grupo fueron: apical en 13 pacientes (28%), inferoseptal e inferior en 3 pacientes (6%), otras localizaciones (anteroseptal, anterior, anterolateral) en 6 pacientes (12%) y aneurisma inferoapical en solo
1 paciente (2%). Se observó hipocinesia global en 22 pacientes (45%).
No se observaron diferencias significativas entre el grupo control, Grupo 1 (GSCD) y Grupo 2 (ECG anormal) en cuanto a diámetros de cavidades y función ventricular. Respecto de la función diastólica del VI, el TDE fue más prolongado y la relación E/A menor en relación con la gravedad de los grupos, pero no significativas.
Comparando el grupo control y el GSCD, no mostraron diferencias significativas el flujograma mitral ni el DPT del anillo mitral. El DPT del anillo tricuspídeo mostró una disminución significativa de la onda E't y una relación E't/A't significativamente inferior, con inversión de esta relación en el 38% del grupo control versus el 69% del GSCD (p = 0,007) (Tabla 2).
Strain bidimensionalSe observó buena correlación entre el SLPSG y la ES-PAM (r: 0,75) en el conjunto de los pacientes (Figura 1).
Tabla 1. Características de la población y ecocardiograma. Controles y pacientes con enfermedad de Chagas
| Control n = 35 | Grupo 1 n = 40 | Grupo 2 n = 17 | Grupo 3 n = 36 | p | |
| Edad, años | 40,51 ± 10,8 | 40,67 ± 15 | 45,35 ± 13,5 | 52,83 ± 12,9 | < 0,0001 |
| Sexo masculino, n (%) | 19 (54) | 5 (12) | 5 (29) | 16 (44) | 0,001 |
| FC, lpm | 69,48 ± 7,38 | 66,06 ± 7,68 | 69,23 ± 10,07 | 67,11 ± 10,53 | ns |
| DDVI, cm | 4,8 ± 0,4 | 4,7 ± 0,4 | 4,8 ± 0,5 | 5,9 ± 1,0 | < 0,0001 |
| AAI, cm2 | 15,6 ± 2,4 | 16,6 ± 4,5 | 16,20 ± 563,8 | 20,7 ± 6,9 | < 0,0001 |
| FEy, % | 63,86 ± 7,09 | 60,09 ± 8,18 | 59,08 ± 7,45 | 37,41 ± 13,61 | < 0,0001 |
| ESPAM, cm | 2,0 ± 0,2 | 1,8 ± 0,2 | 1,8 ± 0,2 | 1,3 ± 13,61 | < 0,0001 |
| E/A mitral | 1,37 ± 0,38 | 1,32 ± 0,44 | 1,26 ± 0,49 | 1,15 ± 0,66 | ns |
| TDE, ms | 211,97 ± 40,7 | 224,15 ± 54,9 | 229,56 ± 52,4 | 230,91 ± 130,07 | ns |
| ESPAT, cm | 2,29 ± 0,27 | 2,27 ± 0,22 | 2,32 ± 0,48 | 2,01 ± 0,46 | 0,002 |
FC: Frecuencia cardíaca. Ipm: Latidos por minuto. DDVI: Diámetro diastólico del ventrículo izquierdo. AAI: Área de la aurícula izquierda. FEy: Fracción de eyección. ESPAM.: Excursión sistólica del plano del anillo mitral. E/A mitral: Relación E/A del flujograma mitral. TDE. Tiempo de desaceleración de la onda E mitral. ESPAT: Excursión sistólica del plano del anillo tricuspídeo. ns: No significativo.
Tabla 2. Flujograma mitral, Doppler pulsado tisular de los anillos mitral y tricuspídeo, strain longitudinal pico sistólico global. Grupo control versus Grupo 1
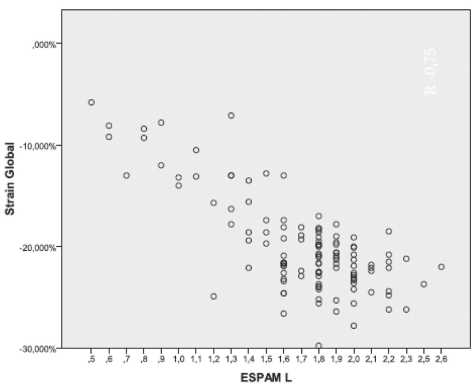
Fig. 1. Correlación strain longitudinal pico sistólico global (SLPSG)-excursión sistólica del plano (longitudinal) del anillo mitral (ESPAM L) (r = 0,75) en la población total de pacientes con enfermedad de Chagas (n = 93).
| Grupo control (n = 35) | Grupo 1 (n = 40) | p | |
| E | 0,76 ± 0,16 | 0,75 ± 0,13 | ns |
| A | 0,6 ± 0,23 | 0,61 ± 0,17 | ns |
| E/A mitral | 1,37 ± 0,38 | 1,32 ± 0,44 | ns |
| TDE, ms | 211 ±40 | 224 ± 55 | ns |
| S'm | 10,40 ± 2,12 | 9,65 ± 2,64 | ns |
| E'm | 14,37 ± 4,12 | 13,89 ± 4,15 | ns |
| A'm | 9,11 ± 2,65 | 9,12 ± 2,47 | ns |
| E'm/A'm | 1,71 ± 0,73 | 1,63 ± 0,64 | ns |
| S't | 13,03 ± 1,85 | 12,58 ± 2,20 | ns |
| E't, m/s | 14,14 ± 2,29 | 11,97 ± 3,73 | 0,007 |
| A't, m/s | 12,60 ± 3,11 | 13,38 ± 3,51 | ns |
| E't/A't | 1,19 ± 0,39 | 0,94 ± 0,34 | 0,005 |
| Strain global, % | -22,19 ± 2,54 | -21,56 ± 2,63 | ns |
E: Onda E mitral. A: Onda A mitral. E/A mitral: Relación E/A del flujograma mitral. TDE: Tiempo de desaceleración de la onda E mitral. S'm, E'm y A'm: Ondas S, E y A del Doppler pulsado tisular del anillo mitral. S't, E't y A't: Ondas S, E y A del Doppler pulsado tisular del anillo tricuspídeo.
Cuando se comparó el grupo control con el Grupo 1, el SLPSG presentó valores inferiores, aunque sin alcanzar significación estadística. El análisis de la media del SLPS de cada segmento entre ambos grupos tampoco mostró diferencias significativas. Sin embargo, mostró valores anormales de SLPSS, inferiores a -12%, en dos
0 más segmentos contiguos en 10 pacientes del Grupo
1 versus ningún segmento anormal en el grupo control (p < 0,05). La distribución de los segmentos anormales por SLPS fue la siguiente: inferiores 40% (inferoseptal, inferior e inferolateral), anteriores 40% (anteroseptal, anterior, anterolateral) y apicales 29% (Figura 2).
La variabilidad intraobservador e interobservador evaluada por CCI fue de 0,93 y 0,9, respectivamente.
Resultados del análisis del Grupo 1Ante el hallazgo de SLPSS igual o inferior a -12% en dos o más segmentos en 10 pacientes, se subdividió al Grupo 1 en: 1a (pacientes con segmentos normales) y 1b (pacientes con segmentos anormales) y se compararon: flujograma mitral, DPT mitral, DPT tricuspídeo y strain (Tabla 3).
En el Grupo 1b, el TDE fue más prolongado, aunque sin alcanzar significación estadística, y la onda
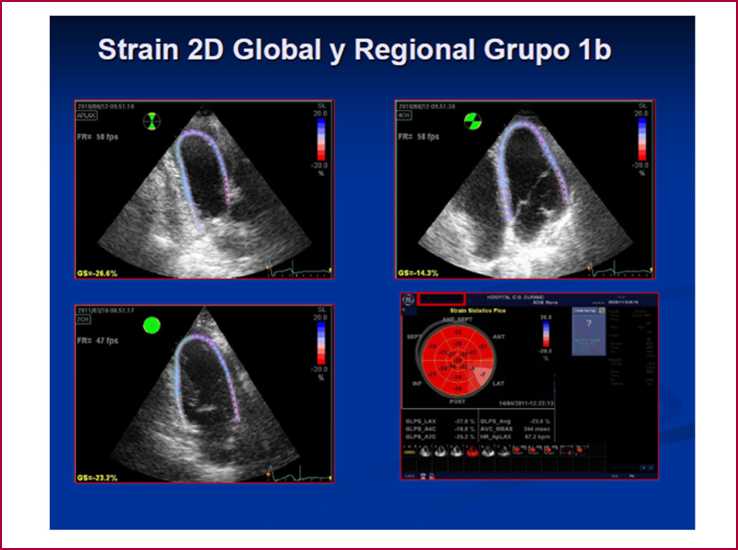
Fig. 2. Strain 2D longitudinal por speckle tracking obtenido en un paciente del Grupo 1b desde vista apical. Arriba, izquierda: Eje largo con valores de strain segmentarios normales. Arriba, derecha: En 4 cámaras se observan en los segmentos anterolateral basal y anterolateral medio valores de strain inferiores a -12% (coloración rosada; véase imagen color en la web). Abajo, izquierda: Corte de 2 cámaras con valores de strain segmentarios normales. Abajo, derecha: Ojo de buey obtenido con valores de strain longitudinal pico sistó-lico de cada segmento y el valor de strain global (promedio de todos los segmentos).
A aumentó significativamente (0,73 ± 0,22 vs. 0,58 ± 0,13; p = 0,013). La relación E/A del flujograma mitral así como la relación E'm/A'm del DPT del anillo mitral disminuyeron significativamente. Se observó inversión de la relación E't/A't en el DPT del anillo tricuspídeo (0,73 ± 0,31 Grupo 1b vs. 1,02 ± 0,33 Grupo 1a; p = 0,005) y una disminución significativa de la onda E't (9,4 ± 0,96 cm/seg vs. 12,83 ± 3,91 cm/ seg; p = 0,007).
El SLPSG en el Grupo 1b fue significativamente inferior al del Grupo 1a (-19,78% ± 2,4% vs. -22,28% ± 2,4%; p = 0,009). Esto podría explicar el menor valor de SLPSG del GSCD (Tabla 3).
DISCUSIÓN
La miocardiopatía chagásica es la manifestación más importante y grave de la enfermedad de Chagas. El hallazgo anatomopatológico principal es la miocarditis fibrosa, progresiva y crónica, miocarditis focal que ocurre aun en la forma indeterminada de la enfermedad y que se intensifica a medida que esta avanza. La pérdida de los cardiomiocitos y su sustitución por tejido fibroso favorece la aparición de arritmias ventriculares y distintos grados de disfunción diastólica y sistólica durante su progresión. (23) La cardiopatía chagásica produce disfunción en ambas fases del llenado ventricular: inicialmente altera la relajación y progresivamente provoca trastornos relacionados con la distensibilidad de cámara, ya que afecta a distintos componentes, no solo a la fibra miocárdica, sino también al intersticio, al sistema de conducción, al sistema nervioso autónomo y a la integridad vascular. (16)
Tabla 3. Flujograma mitral, Doppler pulsado tisular de los anillos mitral y tricuspídeo y strain longitudinal pico sistólico global. Grupo 1a versus Grupo 1b
| Grupo 1a (n = 30) | Grupo 1b (n = 10) | p | |
| E, m/s | 0,77 ± 0,13 | 0,71 ± 0,11 | ns |
| A, m/s | 0,58 ± 0,13 | 0,73 ± 0,22 | 0,013 |
| E/A mitral | 1,41 ± 0,43 | 1,08 ± 0,41 | 0,04 |
| TDE, ms | 214,73 ± 50,87 | 252,40 ± 59,63 | 0,059 |
| S'm, cm/s | 9,90 ± 2,7 | 8,90 ± 2,4 | ns |
| E'm, cm/s | 14,77 ± 3,78 | 10,90 ± 3,95 | 0,09 |
| A'm, cm/s | 9 ± 2,62 | 9,5 ± 2,01 | ns |
| E'm/A'm | 1,76 ± 0,61 | 1,23 ± 0,59 | 0,021 |
| S't | 12,90 ± 2,1 | 11,60 ± 2,3 | ns |
| E't | 12,83 ± 3,91 | 9,4 ± 0,96 | 0,001 |
| A't | 12,93 ± 2,59 | 14,70 ± 5,37 | ns |
| E't/A't | 1,02 ± 0,33 | 0,73 ± 0,31 | 0,019 |
| SLPSG | -22,28 ± 2,4 | -19,78 ± 2,4 | 0,009 |
E: Onda E mitral. A: Onda A mitral. E/A mitral: Relación E/A del flujograma mitral. TDE: Tiempo de desaceleración de la onda E mitral. S'm, E'm y A'm: Ondas E, A y S del Doppler pulsado tisular del anillo mitral. S't, E't y A't: Ondas E, A y S del Doppler pulsado tisular del anillo tricuspídeo. SLPSG: Strain longitudinal pico sistólico global.
Considerando que la miocardiopatía chagásica se desarrolla durante décadas, la búsqueda de algún parámetro ecocardiográfico que pueda alertar sobre esta evolución clínica en la etapa crónica sin cardiopatía demostrada llevó a múltiples trabajos de investigación con las herramientas disponibles. En ese sentido, se analizaron el flujograma mitral, el DPT del anillo mitral (en reposo y por eco estrés con dobutamina) y también el DPT del anillo tricuspídeo. (14-18) Actualmente, la incorporación del strain por speckle tracking abre un nuevo horizonte.
En nuestro trabajo, la disfunción diastólica, reflejada por la prolongación del TDE y un valor E/A menor en el GSCD respecto del control, no fue estadísticamente significativa, coincidente con el trabajo de Pazin-Filho y colaboradores (6) y contrariamente al de Cianciulli y colaboradores. (14) Otros autores, como García-Álvarez y colaboradores, (19) encontraron que, asociado con niveles anormales de BNP (> 37 pg/ml), solo la mitad de los pacientes de la forma indeterminada presentaban esta patente de disfunción diastólica.
Los resultados obtenidos con DPT en distintas investigaciones, en cambio, son más homogéneos. En nuestra población, el valor de la onda E' mitral fue inferior en el GSCD, pero su disminución no fue significativa respecto del grupo control. Nascimento y colaboradores (24) señalan a la onda E' mitral como una herramienta útil para el seguimiento de pacientes con cardiopatía y sin ella, coincidente con las publicaciones de Migliore y colaboradores (25) y Barros y colaboradores. (26)
En cuanto a la evaluación de la función diastólica del ventrículo derecho (VD) por DPT del anillo tri-cuspídeo, los pacientes del GSCD mostraron menor valor de onda E' y de la relación E'/A' respecto del grupo control (véase Tabla 2). Este hallazgo también se menciona en una publicación de Barros y colaboradores. (27) Esto avalaría la afección concomitante de la función diastólica ventricular derecha, ya sea por interdependencia ventricular y/o por daño precoz en los estadios iniciales. Por lo tanto, su determinación debería tenerse en cuenta como parte de la evaluación habitual de los pacientes con cardiopatía chagásica, ya que la función diastólica del VD se encuentra alterada tempranamente.
Respecto del valor de la onda S' en el DPT del anillo mitral en pacientes con enfermedad de Cha-gas sin cardiopatía demostrada, en este estudio no encontramos variación significativa entre el GSCD y el grupo control; Barros y colaboradores observaron una disminución de su valor relacionada con la gravedad de la cardiopatía en condiciones basales; (28) y con estrés con dobutamina, Killinger y colaboradores (17) y Acquatella y colaboradores (18) mostraron en estos pacientes un comportamiento anormal de la respuesta inotrópica (insuficiente incremento de la onda S' pos estrés), además de una incompetencia cronotrópica.
Considerando que la disfunción diastólica precede y/o acompaña a la disfunción sistólica, su hallazgo induce a la búsqueda de alteraciones en la contractilidad miocárdica, global y/o segmentaria, que pudieran estar presentes y no hubieran sido detectadas por métodos convencionales. En ese sentido, la técnica de speckle tracking es promisoria.
En nuestro estudio observamos un valor menor de SLPSG en los pacientes sin cardiopatía demostrada, pero no alcanzó significación estadística respecto del grupo control. Resultado similar obtienen Barbosa y colaboradores en 78 pacientes asintomáticos, donde el SLPSG y el circunferencial global, aunque inferiores, no son estadísticamente significativos, pero el análisis segmentario mostró diferencias significativas en distintas regiones, mientras que el strain radial global y segmentario disminuyeron significativamente. (29) También Silva y colaboradores encontraron valores inferiores de strain radial y longitudinal a mayor grado de compromiso miocárdico. (30) En el estudio de García-Álvarez y colaboradores, en el análisis del strain circunferencial se observaron valores inferiores de strain global a mayor grado de afección miocárdica. En este último, comparados los controles con el GSCD, el strain radial global evidenció disminución de su valor y menor valor de strain radial en el segmento medio inferior del VI. (31)
El análisis segmentario del strain longitudinal nos permitió discriminar dos subgrupos: uno con dos o más segmentos contiguos con valores anormales de SLPS inferiores a -12% (20) y otro con valores normales en todos sus segmentos. Este subgrupo que presentaba SLPS anormal en dos o más segmentos contiguos (predominantemente en región inferior y apical) mostró mayor disfunción diastólica biventricu-lar, reflejada en el flujograma mitral por mayor onda A y menor relación E/A; menor relación E'm/A'm en el DPT del anillo mitral y en el VD por menor relación E't/A't y marcada disminución de la onda E't del anillo tricuspídeo.
En nuestro estudio, la buena correlación del SLPSG con la ESPAM en todos los grupos de pacientes con enfermedad de Chagas fue un hallazgo adicional, medición que debería reconsiderarse por la sencillez y reproducibilidad de su obtención.
En todos los casos mencionados, el strain mejoró la sensibilidad diagnóstica para detectar anormalidades de la contractilidad miocárdica. Dado que dentro del GSCD solo un 30% eventualmente desarrollará miocardiopatía, es necesario investigar variables que permitan esta diferenciación. Nuestro estudio encontró dentro del GSCD un subgrupo de pacientes con strain longitudinal segmentario anormal en los que se detectó disminución significativa del SLPSG asociada con disfunción diastólica biventricular, hallazgo que convalida la utilidad del método en pacientes con enfermedad de Chagas sin cardiopatía demostrada.
CONCLUSIONES
El strain miocárdico permitió identificar en el GSCD a un subgrupo de pacientes con alteraciones segmentarias del strain longitudinal y menor SLPSG que presentaba disfunción diastólica biventricular asociada. Es necesario un futuro estudio clínico dirigido al GSCD para analizar su evolución y las implicaciones de este hallazgo en la progresión a una miocardiopatía.
AgradecimientosA la Dra. Stella Maris Luna (in memoriam), por su valiosa colaboración como médica del Consultorio de Enfermedad de Chagas, Consultorios Externos de Cardiología del Hospital General de Agudos "Carlos G. Durand".
Declaración de conflicto de interesesLos autores declaran que no poseen conflicto de intereses.
(Véanse formularios de conflicto de intereses de los autores en la web/ Material suplementario).
BIBLIOGRAFÍA
1. Toso A, Vial F, Galanti N. Transmisión de la enfermedad de Chagas por vía oral. Rev Med Chile 2011;139:258-66. http://doi.org/c9gnjg [ Links ]
2. http://www.who.int/mediacentre/factsheets/fs340/es/
3. Bern C, Montgomery SP An estimated of the burden of Chagas' disease in the United States. Clin Infect Dis 2009;49:e52-4. http:// doi.org/fkd63c [ Links ]
4. Schumuni GA, Yadon ZE. Chagas disease: A Latin American health problem becoming a world heart problem. Acta Trop 2010;115:14-21. http://doi.org/chhkm8
5. Prata A. Clinical and epidemiological aspects of Chagas disease. Lancet Infect Disease 2001;1:92-100. http://doi.org/d7kbm
6. Pazin-Filho A, Romano MM, Gomes Furtado R, de Almeida Filho OC, Schmidt A, Marin-Neto JA, et al. Left ventricular global performance and diastolic function in indeterminate and cardiac forms of Chagas' disease. J Am Soc Echocardiogr 2007;20:1338-43. http:// doi.org/b82dhd
7. WHA63/2010/REC/1 ORGANIZACIÓN MUNDIAL DE LA SALUD 63.- ASAMBLEA MUNDIAL DE LA SALUD GINEBRA, 17-21 DE MAYO DE 2010 RESOLUCIONES Y DECISIONES ANEXOS.
8. Viotti R, Vigliano C, Lococo B, Petti M, Bertocchi G, Alvarez MG, et al. [Clinical predictors of chronic chagasic myocarditis progression]. Rev Esp Cardiol 2005;58:1037-44. http://doi.org/ddhqgr
9. Marin-Neto JA, Rassi A Jr. Update on Chagas heart disease on the first centenary of its discovery. Rev Esp Cardiol 2009;62:1211-6. http://doi.org/bg9mc2
10. Acquatella H, Gómez Mancebo J, Catalioti F, Puigbó J. Imageno-logía en el diagnóstico y el pronóstico de la enfermedad de Chagas. Rev Argent Cardiol 2013;81:184-95.
11. Del Campo M, Sun M, Cabrejos G, Rousse G, Killinger C, Bierfast G, et al. Histocompatibilidad en la enfermedad de Chagas: distribución de los alelos HLA Clases I y II en pacientes con y sin miocardiopatía. XXXVIII Congreso de la Sociedad Argentina de Cardiología en CABA, 2012, Abstract 168.
12. García Borrás S, Racca L, Cotorruelo C, Biondi C, Beloscar J, Racca A. Distribution of HLA-DRB1 alleles in Argentinean patients with Chagas' disease cardiomyopathy. Immunological Investigations 2009;38:268-75. http://doi.org/fdxnr2
13. Clasificación Enfermedad de Chagas. Consenso Internacional Buenos Aires 2010.
14. Cianciulli TF, Lax JA, Saccheri MC, Papantoniou A, Morita LA, Prado NG, et al. Early detection of left ventricular diastolic dysfunc-tion in Chagas' disease. Cardiovasc Ultrasound 2006;4:18. http://doi. org/c5wjk2
15. Barros M, Rocha M, Ribeiro A, Machado F. Doppler tissue imag-ing to evaluate early myocardium damage in patients with unde-terminated form of Chagas' disease and normal echocardiogram. Echocardiography 2001;18:131-6. http://doi.org/bj4gbj
16. Nascimento CA, Gomes VA, Silva SK, Santos CR, Chambela MC, Madeira FS, et al. Left atrial and left ventricular diastolic function in chronic Chagas disease. J Am Soc Echocardiogr 2013;26:1424-33. http://doi.org/bkdn
17. Killinger C, Lozano D, Castro E, De Rosa M, del Campo M, Lapresa S, et al. Apremio farmacológico en la enfermedad de Chagas. Estudio con eco-Doppler. Rev Argent Cardiol 2007;75:35-42.
18. Acquatella H, Perez J, Condado JA, Sanchez I. Limited myocardial contractile reserve and chronotropic incompetence in patients with chronic Chagas' disease. JACC 1999;33:522-9. http://doi.org/bd9tk7
19. Garcia-Alvarez A, Sitges M, Pinazo MJ, Regueiro-Cueva A, Posada E, Poyatos S, et al. Chagas cardiomyopathy: the potential of diastolic dysfunction and brain natriuretic peptide in the early identification of cardiac damage. PLoS Negl Trop Dis 2010;4:e826. http://doi.org/bc88kj
20. Mor Avi V, Lang R, Badano L, Belohalavek M, Cardim N, De-rumeaux G, et al. Current and evolving echocardiographic techniques for the quantitative evaluation of cardiac mechanics: ASE/EAE Consensus Statement on Methodology and Indications. J Am Soc Echocardiogr 2011;24:277-313. http://doi.org/dkm94m
21. Amundsen BH, Helle-Valle T, Edvardsen T, Torp H, Crosby J, Lyseggen E, et al. Noninvasive myocardial strain measurement by speckle tracking echocardiography: validation against sonomicrom-etry and tagged magnetic resonance imaging. J Am Coll Cardiol 2006;47:789-93. http://doi.org/fgf695
22. Lang R, Badano L, Mor-Avi V Afílalo J, Armstrong A, Ernande L, et al. Recommendations for Cardiac Chamber Quantification by Echocardiography in Adults: An Update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. J Am Soc Echocardiogr 2015;28:1-39. http://doi.org/bhj5
23. Marin-Neto JA, Cunha-Neto E, Maciel BC, Simoes MV Pathogen-esis of chronic Chagas heart disease. Circulation 2007;115:1109-23. http://doi.org/cnstwr
24. Nascimento CA, Gomes VA, Silva SK, Santos CR, Chambela MC, Madeira FS, et al. Left atrial and left ventricular diastolic function in chronic Chagas disease. J Am Soc Echocardiogr 2013;26:1424-33. http://doi.org/bkdn
25. Migliore R, Adaniya M, Tamagusuku H, Lapuente A. Evaluación de la función diastólica en la enfermedad de Chagas con Doppler tisular pulsado. Medicina 2003;63:692-6.
26. Barros MV, Machado FS, Ribeiro AL, Rocha MO. Diastolic function in Chagas' disease: an echo and tissue Doppler imaging study. Eur J Echocardiogr 2004;5:182-8. http://doi.org/brq7j8
27. Barros MV, Machado FS, Ribeiro AL, Da Costa Rocha MO. Detec-tion of early right ventricular dysfunction in Chagas' disease using Doppler tissue imaging. J Am Soc Echocardiogr 2002;15:1197-201. http://doi.org/d7hsqz
28. Barros MV Ribeiro AL, Machado FS, Da Costa Rocha MO. Doppler tissue imaging to assess systolic function in Chagas' disease. Arq Bras Cardiol 2003;80:36-40. http://doi.org/c55b7d
29. Barbosa MM, Costa Rocha MO, Vidigal DF, Bicalho Carneiro R de C, Araújo RD, et al. Early detection of left ventricular contractility abnormalities by two-dimensional speckle tracking strain in Chagas' disease. Echocardiography 2014;31:623-30. http://doi.org/bkdp
30. Silva CE, Ferreira LD, Peixoto LB, Monaco CG, Gil MA, Ortiz J, et al. [Evaluation of segmentary contractility in Chagas' disease by using the integral of the myocardial velocity gradient (myocardial strain) obtained through tissue Doppler echocardiography]. Arq Bras Cardiol 2005;84:285-91. http://doi.org/fss83t
31. Garcia-Alvarez A, Sitges M, Regueiro A, Poyatos S, Jesus Pinazo M, Posada E, et al. Myocardial deformation analysis in Chagas heart disease with the use of speckle tracking echocardiography. J Cardiac Fail 2011;17:1028-34. http://doi.org/cxcwwf
Hospital General de Agudos "Carlos G. Durand" - CABA MTSAC Miembro Titular de la Sociedad Argentina de Cardiología
Para optar a Miembro Titular de la Sociedad Argentina de Cardiología
1 Jefa del Laboratorio de Ecocardiografía y Doppler Cardíaco - División Cardiología
2 Médicos de Planta del Laboratorio de Ecocardiografía y Doppler Cardíaco - División Cardiología
Técnica de Planta de la División Cardiología
Jefe de la División de Cardiología














