Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista argentina de cardiología
versión On-line ISSN 1850-3748
Rev. argent. cardiol. vol.84 no.5 Ciudad Autónoma de Buenos Aires oct. 2016
ARTÍCULO ORIGINAL
Impacto clínico y ecocardiográfico en pacientes sometidos a cierre percutáneo de fugas paravalvulares
Clinical and Echocardiographic Impact in Patients Undergoing Percutaneous Closure of Paravalvular Leaks
GUSTAVO PEDERNERAMTSAC 1, GERARDO NAUMTSAC 1, GUSTAVO AVEGUANOMTSAC-2, RICARDO RONDEROSMTSAC-2, GERMÁN HENESTROSA1, JUAN M. VRANCICMTSAC-3, FERNANDO PICCININIMTSAC-3, MARCELO TRIVIMTSAC-4, FERNANDO CURAMTSAC-'
MTSAC Miembro Titular de la Sociedad Argentina de Cardiología
1 Servicio de Cardiología Intervencionista y Terapias Endovasculares
2 Servicio de Diagnóstico por Imágenes
3 Servicio de Cirugía Cardíaca
RESUMEN
Introducción: El desarrollo de fugas paravalvulares luego del reemplazo valvular es un fenómeno poco frecuente, pero de gran repercusión clínica y morbimortalidad. El cierre percutáneo es una alternativa a la cirugía en pacientes con riesgo quirúrgico alto; sin embargo, estas intervenciones se realizan esporádicamente debido a su complejidad, por lo que contamos con escasa información sobre su eficacia y seguridad.
Objetivos: Evaluar la efectividad y seguridad del procedimiento, la evolución a mediano plazo y comunicar las técnicas utilizadas. Material y métodos: Se analizaron la evolución clínica y ecocardiográfica tanto hospitalaria como a mediano plazo y las complicaciones del procedimiento de todos los pacientes sometidos a cierre de fugas paravalvulares.
Resultados: Se trataron 13 fugas paravalvulares en 9 pacientes (6 en posición aórtica y 7 mitrales). El éxito técnico se logró en el 100% de los casos, evidenciando una marcada mejoría de la clase funcional y de parámetros de laboratorio. Esto permitió que la regurgitación perivalvular, evaluada por ecocardiograma Doppler, fuera mínima o leve luego del procedimiento y a mediano plazo. En el seguimiento alejado (22 meses, rango intercuartil: 3-44), todos los pacientes sobrevivieron sin eventos mayores y mantuvieron una buena clase funcional. Dos pacientes en los que se practicó el acceso transapical requirieron transfusión de glóbulos rojos luego del procedimiento, con buena evolución.
Conclusiones: El cierre percutáneo de fugas paravalvulares es un procedimiento seguro y eficaz, que permite una mejoría sustancial de la clase funcional. Este tratamiento debería considerarse una opción para pacientes que poseen un riesgo quirúrgico elevado.
Palabras clave: Dehiscencia paravalvular - Disfunción protésica - Ecocardiograma transesofáglco
ABSTRACT
Background: The development of paravalvular leaks after surgical valve replacement is a rare complication but with high morbidity and mortality Percutaneous closure is an alternative to surgery in high-risk surgical patients. However, as it is sporadically performed due to its complexity, there is limited information on its effectiveness and safety
Objectives: The aim of this study was to assess the mid-term effectiveness and safety of the procedure and to report the techniques employed.
Methods: Both in-hospital and mid-term clinical and echocardiographic evolution and procedural complications of all patients undergoing percutaneous leak closure were analyzed.
Results: Percutaneous closure of 13 leaks (6 aortic and 7 mitral) was performed in 9 patients. Technical success was achieved in 100% of cases, with a marked improvement in functional class and laboratory parameters. Paravalvular regurgitation as- sessed by Doppler echocardiography was minimal or mild after the procedure as well as during mid-term follow-up. In the long-term follow-up (22 months, interquartile range: 3-44), all patients survived with no major events and good functional class.
Two patients operated-on via transapical access, required red cell transfusion after the procedure, with favorable outcome.
Conclusions: Percutaneous closure of paravalvular leaks is a safe and efficient procedure, enabling a substantial improvement of functional class. This treatment should be considered an option for high-risk surgical patients.
Key words: Prosthetlc Leak - Prosthetlc Dysfunctlon - Transesophageal Echocardiography
INTRODUCCIÓN
Las fugas paravalvulares (FPV) son una complicación poco frecuente luego de una cirugía valvular cardíaca. Sin embargo, estudios ecocardiográficos revelan su presencia en un 2-17% de las cirugías valvulares, con una incidencia del 2% al 10% en posición aórtica y del 7% al 17% en posición mitral. (1-4) Solo el 5-10% de las FPV requerirán tratamiento, evidenciándose por signos y síntomas de insuficiencia cardíaca, anemia hemolítica, arritmias y endocarditis infecciosa. (1)
La intervención quirúrgica con una nueva reoperación ha sido el tratamiento de elección. Sin embargo, esta opción conlleva una elevada morbimortalidad y resultados clínicos muy dispares, que llegan a una mortalidad del 15% y 37%. (4-6) Aunque la reparación percutánea de las FPV se realizó por primera vez en 1992, hubo un creciente interés en la última década con el desarrollo e innovación de dispositivos, técnicas de catéteres y de imágenes. Actualmente, en la literatura se describen escasos reportes de casos, con un éxito clínico y técnico que varía entre el 63% y el 100%, una mortalidad del 9% al 20% y con un variado porcentaje de conversión a cirugía. (2, 7-12) Asimismo, el seguimiento a mediano y a largo plazos es incierto, limitándose los datos existentes a la etapa aguda o subaguda. (10, 13-16)
Este análisis se realizó para determinar la eficacia clínica y la seguridad más allá del período agudo del cierre, la durabilidad del beneficio clínico y la evolución funcional de la regurgitación valvular residual. Además, se describen las técnicas de evaluación, el abordaje terapéutico y las técnicas de cierre para cada tipo de FPV con el objetivo de que potencialmente ayuden a establecer normas de atención para el tratamiento de esta entidad.
MATERIAL Y MÉTODOS
Entre agosto de 2010 y octubre de 2015 se realizó el cierre percutáneo de 13 FPV en 9 pacientes consecutivos seleccionados como aptos para el procedimiento. La edad promedio de la población fue de 64 ± 13,8 años. Se evaluó el riesgo quirúrgico a través del EuroSCORE logístico con una puntuación promedio de 29% (17) (Tabla 1).
La indicación del procedimiento fue por insuficiencia cardíaca en la mayoría de los pacientes (89%), encontrándose en clase funcional (CF) III-IV, y por anemia hemolítica (11%), en ausencia de endocarditis infecciosa. En todos los casos, la decisión del tratamiento fue evaluada por los médicos intervinientes hasta la conformación del Heart Team en el año 2011, en el que la estrategia de tratamiento fue decisión de un grupo de profesionales especializados en cardiología clínica, intervencionistas, electrofisiólogos, cirujanos, expertos en insuficiencia cardíaca y en imágenes, concluyendo que la reintervención quirúrgica plantea un riesgo excesivo.
| Tabla 1. Características basales de la | población (n | = 9) | |
| Edad, años | 64 ± 13,8 | ||
| Sexo masculino, % | 55 | ||
| Comorbilidades | |||
| HTA, % | 55 | ||
| DM, % | 22 | ||
| Fibrilación auricular, % | 22 | ||
| IRC (FG < 60 ml/min), % | 55 | ||
| EuroSCORE logístico, % | 29 | ||
| Tiempo desde última cirugía al procedimiento 165 (RIC 51-280) de cierre, meses (mediana) | |||
| Portadores de MCP, % | 33 | ||
| Prótesis valvulares | |||
| Mecánicas, % | 67 | ||
| Biológicas, % | 33 | ||
| Aórticas mecánicas, % | 22,2 | ||
| Aórticas biológicas, % | 22,2 | ||
| Mitrales mecánicas, % | 44,4 | ||
| Mitrales biológicas, % | 11,2 | ||
| Localización de las FPV (hora)* Aórticas Mitrales | |||
| 11-3 | 12 | ||
| 11-3 | 1 | ||
| 3-7 | 6 | ||
| 12 | 12-3 | ||
| 6 | |||
| Sintomatología | |||
| ICC, % | 88,8 | ||
| Anemia hemolítica, % | 11,2 | ||
| Antecedentes de endocarditis previa, | % | 33 | |
| Función ventricular (ETT), % | 52 ± 6 | ||
| Presión sistólica pulmonar (ETT), mm | Hg | 54,2 ± 11 | |
HTA: Hipertensión arterial. DM: Diabetes mellitus. IRC: Insuficiencia renal crónica. FG: Filtrado glomerular. RIC: Rango intercuartil. MCP: Marcapasos. FPV: Fugas paravalvulares. ICC: Insuficiencia cardíaca congestiva. ETT: Eco-cardiograma Doppler transtorácico.
* Localización de las fugas periprotésicas según la clasificación utilizada previamente por Ruiz y colaboradores. (12)
No se excluyó ningún paciente de los que se había decidido el tratamiento percutáneo ni se debió rotar de acceso o estrategia de cierre. Para la realización del procedimiento, los pacientes debían cumplir con ciertas características clínicas, ecocardiográficas y angiográficas, que se describen a continuación. La CF se definió según la escala de la New York Heart Association (NYHA), mientras que se definió anemia hemolítica sintomática a un valor de hemoglobina plasmática ≤ 10 g/dl, asociado con datos de perfil hemolítico (lactato deshidrogenasa ≥ 600 U/L, haptoglobina ≤ 10 mg/dl), sin ninguna otra fuente de pérdida de sangre. (12-18)
En todos los pacientes se realizó una evaluación ecocardio-gráfica previa, transtorácica y posteriormente transesofágica tridimensional (3D). Estos estudios fueron efectuados por un cardiólogo especializado con un ecocardiógrafo IE33 Philips Medical Systems equipado con transductores transtorácicos S5-1 y X3-1 y transesofágico X7-1 de 7-2 MHz. Con ecocar-diografía bidimensional (2D) transtorácica se obtuvieron imágenes en distintos planos de proyección, paraesternal, apical, subxifoideo y supraesternal, y mediante Doppler pulsado, continuo y color, se definió el sitio de la fuga y se cuantificó su repercusión hemodinámica. Mediante ecocardiograma transesofágico (ETE) se confirmaron los datos obtenidos por vista transtorácica y se realizó la evaluación mediante ETE 3D y 3D color. Esto permitió visualizar la totalidad de la válvula protésica desde ambas caras y determinar la localización, el número de defectos, morfología y tamaño de estos. Las Figuras 1 y 2 ilustran el cierre en dos casos de FPV aórtica y mitral, respectivamente).
Se definió FPV a la presencia de un chorro de regurgitación originado entre el borde del anillo protésico y el tejido circundante. La gravedad de la regurgitación se definió según los parámetros establecidos por la Sociedad Americana de Ecocardiografía. (19)
La localización de las FPV está basada en la adaptación de la modalidad quirúrgica de visualización de la válvula mitral o aórtica desde la aurícula izquierda o la aorta, respectivamente, usando la referencia del reloj desde la visión del cirujano; (18, 20-22) asimismo, el ecocardiograma permitió durante el cierre guiar el procedimiento o complementar a la radioscopia, acompañando el avance de los catéteres, el pasaje de la cuerda a través del defecto, el despliegue y liberación del dispositivo garantizando la ausencia de interferencia con
la prótesis valvular y la ausencia de flujo a través del dispositivo. Este tipo de intervenciones se realizan mayormente sin utilización de contraste.
Se realizó una cinecoronariografía para descartar enfermedad coronaria asociada. Los estudios angiográficos fueron efectuados por un cardiólogo intervencionista especializado con un angiógrafo Philips Clarity-Allura o Philips Allura.
Se definió éxito técnico cuando se logró implantar el dispositivo correctamente sin producir interferencia con el funcionamiento protésico y disminución de la regurgitación valvular ≥ 1 grado. Se consideró éxito clínico cuando se logró mejoría de la CF ≥ 1 grado y de los parámetros de hemólisis que permitieran permanecer libre de transfusiones luego del cierre y en el seguimiento. (12-15)
Seguimiento clínico y ecocardiográfico intrahospitalario, a los 30 días y a largo plazo
Se evaluó la mortalidad relacionada con el procedimiento, muerte cardiovascular, eventos neurológicos (ataque isquémico transitorio y accidente cerebrovascular), infarto agudo de miocardio, taponamiento cardíaco, complicaciones del acceso vascular como hemorragia que requiere intervención y/o transfusiones de glóbulos rojos y la conversión urgente a cirugía convencional. Todos los pacientes fueron seguidos en consulta externa a cargo de un cardiólogo clínico. Se determinaron la CF y/o síntomas asociados y los eventos evaluados en la etapa aguda. Se realizaron además nuevos ecocardio-gramas Doppler transtorácicos para evaluar los parámetros antes descriptos.
Técnica de cierre de la fuga paravalvular aórtica
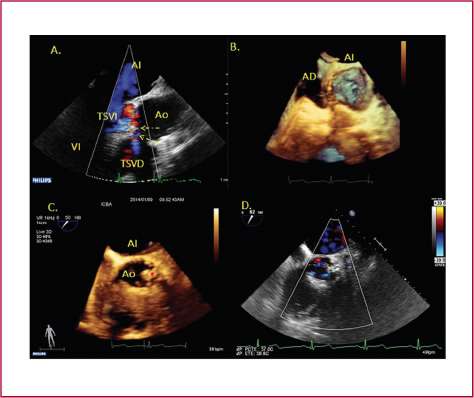
Fig. 1. Caso de cierre de fuga periprotésica grave en válvula mecánica aórtica. A. Ecocardio-grama transesofágico. Corte longitudinal a 120° con Doppler color, donde se evidencia una fuga periprotésica grave (flechas). B. Ecocardiograma trans-esofágico 3D. Vista desde la aorta en posición oblicua para evaluar el seno coronariano izquierdo. Nótese la presencia de una dehiscencia paravalvular (flechas) de morfología semilunar y que está cruzada por dos hilos de sutura. C. Ecocardio-grama transesofágico 3D. Se evidencia la posición correcta del dispositivo de cierre (asterisco). D. Ecocardiograma tran-sesofágico. Corte transversal a 45° ligeramente por encima de la válvula aórtica, donde se evidencia una fuga mínima o trivial residual. VI: Ventrículo izquierdo. TSVI: Tracto de salida del ventrículo izquierdo. TSVD: Tracto de salida del ventrículo derecho. Ao: Aorta. AI: Aurícula izquierda. AD: Aurícula derecha.
En la sala de hemodinamia, todos los pacientes reciben anestesia general o sedación profunda con neuroleptoanalgesia a cargo de un anestesiólogo para poder guiar el procedimiento con ETE 3D. (23-29) Para este cierre se utiliza el acceso retrógrado mayormente por la arteria femoral u ocasionalmente por acceso braquial o transapical. En todos los casos se administraron 100 UI/kg de heparina por vía intravenosa o arterial. Inicialmente se avanza un catéter vertebral sobre una cuerda hidrófila de 0,035"; con posterioridad se cruza el defecto hacia el ventrículo izquierdo y se intercambia por una cuerda de alto soporte (0,035" o 0,038" de 260 mm con una punta recta flexible y pasible de curvar de 1 cm de largo) para mayor estabilidad y soporte, a través de la cual se desliza la vaina de entrega del dispositivo, para presentarlo en el defecto.
Se confirma el posicionamiento correcto por ETE y radioscopia, evaluando la ausencia de flujo residual, sin interferencias con la prótesis valvular ni otras estructuras cardíacas, decidiéndose su liberación definitiva.
Técnica de cierre de la fuga paravalvular mitral
En este caso se utiliza el acceso transapical retrógrado mayo-ritariamente, por toracotomía quirúrgica u ocasionalmente por punción transeptal anterógrada, retrógrada femoral o transaórtica retrógrada. Para lograr este acceso se realiza una tomografía multicorte torácica para localizar el sitio de mejor acceso al ápex cardíaco; con la guía del ETE se realiza una minitoracotomía anterior izquierda. La punción se realiza guiada por ecocardiograma y radioscopia colocando un introductor de 6 o 7 Fr con punta brite tip.
Seguidamente, se avanza un catéter JR o vertebral sobre una cuerda guía hidrófila de 0,035", cruzando el defecto hacia la aurícula izquierda guiados por el ETE 3D. Posteriormente se intercambia la cuerda por una de mayor soporte. En casos de defectos múltiples es posible dejar una cuerda de 0,014" o 0,035" en los defectos contiguos para facilitar el cierre una vez implantado el dispositivo en el defecto mayor. Luego, se avanza la vaina liberadora del dispositivo hacia la aurícula izquierda y el dispositivo oclusor, mientras que para su liberación y guía se prosigue igual que para el acceso transfemoral (30, 31) (Figura 3).
Tipos de dispositivos
Mayoritariamente se utilizan dispositivos oclusores vasculares de nitinol, ya que se adaptan a diversas anatomías y son relativamente conformables. El Amplatzer® Vascular Plug tipo II presenta un rango de dimensiones de 3 a 22 mm, longitud de 6 a 18 mm y un sistema de entrega generalmente de 5 Fr; sin embargo, el Amplatzer® Vascular Plug III es el primer dispositivo específicamente diseñado para este tipo de cierre con resultados muy prometedores. Está conformado por un mallado más compacto, cuerdas más delgadas, forma elíptica que se adapta mejor a la morfología semilunar muy frecuente de estos defectos y genera mayor superficie de contacto favoreciendo un sellado más eficiente. El Amplatzer® Vascular Plug IV es mucho más pequeño y se entrega por sistemas de 5 Fr. Al carecer de un disco de retención tiende a prolapsar en el momento de aposicionarse en el defecto.
Análisis estadístico
Las variables continuas se expresan como media ± desviación estándar y mediana ± intervalo intercuartil según su distribución y las variables categóricas, como porcentajes. Se utilizaron la prueba de la t para datos apareados y la de Wilcoxon para el análisis de las variables continuas según correspondiera. Se consideró estadísticamente significativo un valor de p < 0,05 a dos colas. El análisis estadístico se realizó con el programa SPSS versión 21.0.
Consideraciones éticas
El estudio se llevó a cabo con el derecho de protección de datos del paciente.
RESULTADOS
Se analizaron 9 pacientes consecutivos seleccionados para cierre de 13 FPV en localización aórtica o mitral
Fig. 2. Caso de cierre de fuga periprotésica grave en válvula biológica mitral. A. Ecocar-diograma transesofágico 3D. Imagen 3D en tiempo real. Se evidencian la válvula mitral biológica en el centro y la dehiscencia paravalvular en hora 10 frente a la orejuela izquierda. B. Ecocardiograma transesofágico 3D durante el procedimiento. Imagen 3D en tiempo real. Vista desde la aurícula izquierda que muestra el ingreso correcto del catéter por la dehiscencia. C. Ecocardiogra-ma transesofágico 3D durante el procedimiento. Imagen 3D en tiempo real. Vista desde la aurícula izquierda con el dispositivo correctamente po-sicionado y liberado. D. Ecocar-diograma transesofágico. Corte longitudinal a 100° con Doppler color, donde no se evidencia fuga residual. VI: Ventrículo izquierdo. AI: Aurícula izquierda. Oi: Orejuela izquierda. PM: Prótesis mitral.
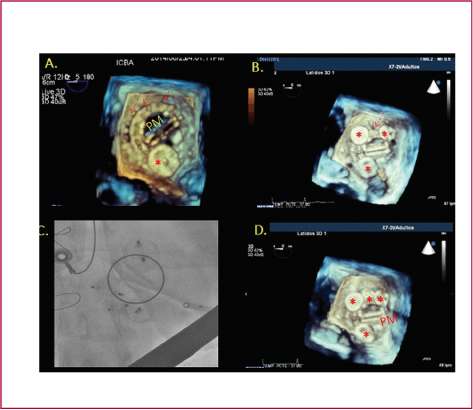
Fig. 3. Cierre de fuga peripro-tésica grave y compleja en válvula mitral mecánica de doble hemidisco. A. Ecocardiograma transesofágico 3D. Imagen de 3D en tiempo real desde la aurícula izquierda con el primer dispositivo correctamente colocado (asterisco) y presencia de dehiscencias (flechas). B. Ecocardiograma transesofági-co 3D. En este momento del procedimiento se colocaron dos nuevos dispositivos (asteriscos). Mediante la guía de la ecocardiografía transesofágica 3D se consiguió enhebrar la cuerda por el centro de los dos dispositivos para la colocación del cuarto (flecha). C. Imagen angiográfica de los dispositivos liberados. D. Ecocardiograma transesofágico 3D. Vista auricular izquierda, que muestra los cuatro dispositivos correctamente colocados sin interferencia con la movilidad de los discos de la prótesis mitral. PM: Prótesis mitral.
entre agosto de 2010 y octubre de 2015. En 3 pacientes se utilizó más de un dispositivo para lograr la reducción exitosa de la regurgitación, debido a la presencia de más de un defecto. En 5 pacientes en los que la localización de la fuga fue perimitral, el abordaje utilizado fue transapical y en los casos aórticos se eligió el transaórtico retrógrado. En todos los pacientes la cinecoronariografía no evidenció lesiones coronarias significativas.
Se implantaron en total 13 dispositivos oclusores, mayoritariamente del tipo Amplatzer St Jude Medical modelos II y III, logrando el cierre efectivo de la FPV, con un éxito técnico del 100% y sin evidencia de regurgitación significativa por ETE 3D y angiografía (Tabla 2). El cierre de los accesos femorales se realizó por compresión manual y quirúrgica en el transapical, sin complicaciones.
Durante la internación se realizó un ecocardio-grama transtorácico evidenciándose la ausencia de movilización del dispositivo, embolización, flujo a través de él, interferencia con la prótesis valvular y otras estructuras cardíacas, sin presencia de derrame pericárdico. Dentro de los parámetros ecocardiográfi-cos, la insuficiencia valvular residual fue mínima y la presión sistólica pulmonar pasó de 54,2 ± 11 mm Hg a 36,1 ± 8 mm Hg (p = 0,03) tras el cierre.
Ningún paciente requirió cirugía de emergencia ni se registraron muertes, accidente cerebrovascular o infarto de miocardio en la etapa intrahospitalaria. Dos pacientes en los que se utilizó la vía transapical
Tabla 2. Características del procedimiento (n = 9)
| Acceso | |||
| Femoral, n | 4 | ||
| Transapical, n | 5 | ||
| Técnica utilizada | |||
| Aórtica retrógrada, n | 4 | ||
| Transapical, n | 5 | ||
| Tamaño del dispositivo, | mm | Plug II 10 Plug II 12 | |
| Plug | II 12 / Plug IV 5 Occluder 6 Plug III 14 | ||
| Plu | j III 16 / 14 / 10 | ||
| Plug II 10 / 12 | |||
| Plug III 12 | |||
| Plug II 9 | |||
| Regurgitación valvular luego del | implante | ||
| Leve, % | 100 | ||
| Moderada, % | 0 | ||
| Grave, % | 0 | ||
presentaron sangrado a través del acceso, que requirió transfusión de glóbulos rojos, con buena evolución.
A los 30 días no se registraron eventos cardiovasculares mayores y la sintomatología de todos los pacientes mejoró significativamente, encontrándose en CF I, con un éxito clínico del 100%. El caso que presentó anemia hemolítica normalizó los valores de laboratorio. En el seguimiento a mediano plazo (22 meses, rango intercuartil 3-44), todos los pacientes sobrevivieron y mantuvieron la CF y los parámetros ecocardiográficos y de laboratorio.
DISCUSIÓN
En la actualidad, el cierre de las FPV puede realizarse por vía percutánea en la gran mayoría de los casos. Si bien los reportes en la literatura son escasos y dispares, de muestras generalmente pequeñas, mayormente son realizados en centros de alta complejidad, ya que representan un desafío para la interacción de diferentes especialidades cardiovasculares con expertos en imágenes, cirujanos cardíacos e intervencionistas especializados en patología estructural.
Los procedimientos suelen ser prolongados y requieren conocimientos especializados en una variedad de técnicas complejas de catéteres. La selección de la vía de acceso depende principalmente de la localización de las FPV y la experiencia de los operadores. En nuestra experiencia hemos elegido la transaórtica retrógrada en los casos aórticos y la transapical en los mitrales, debido a la localización medial y superolateral de las fugas.
Uno de los principales hallazgos del estudio es el alto porcentaje de éxito clínico y técnico, similares a reportes de centros de referencia a nivel mundial, como los reflejados por Ruiz y colaboradores (86%) y Sorajja y colaboradores (81%). (12, 32)
Este elevado porcentaje de éxito puede explicarse por diferentes motivos. En esta serie, todos los procedimientos fueron guiados con ETE 3D. En este sentido, la participación de especialistas en ecocardiografía, ampliamente familiarizados con la visualización de estos defectos, y el aporte de las imágenes tridimensionales en tiempo real tienen un verdadero rol protagónico, ya que sirven de guía al operador en diferentes etapas. Esta tasa de éxito fue similar para ambas prótesis mecánicas y biológicas, aórticas y mitrales, lo que difiere de algunos reportes que describen una tasa menor de éxito en posición mitral. (10) En el análisis de la serie se observó sobrevida de todos los pacientes intervenidos durante el seguimiento, quizás debido al éxito del cierre de todas las fugas y a la ausencia de regurgitación residual, siendo superior a lo descripto en la bibliografía disponible hasta el momento. (4-7)
No se reportaron complicaciones vasculares, muertes, infarto agudo de miocardio ni accidente cerebro-vascular a los 30 días y en el seguimiento. La ausencia de complicaciones no refleja la complejidad de este tipo de intervención ni la de los pacientes incluidos en el estudio. Solo se trata de una pequeña muestra de pacientes altamente seleccionados. En todos los casos, la mejoría de la sintomatología se mantuvo en el seguimiento alejado, muy probablemente debido a la ausencia de regurgitación valvular residual, lo que
indica que el cierre percutáneo de las FPV puede ser una alternativa completamente válida a la cirugía de reemplazo valvular, con una marcada y sostenida mejoría de la C F.
Los avances en el campo de la cardiopatía estructural han aportado la adaptación de muchos progresos técnicos y de intervención, en un intento de mejorar en mayor medida el éxito de las técnicas percutáneas, al tiempo que se reduce el riesgo de complicaciones. En términos de perspectivas futuras, la posibilidad de contar con imágenes de multimodalidad, como la fusión de la angiografía, la tomografía computarizada y la ecocardiografía 3D, junto con el uso de la ecografía intracardíaca probablemente permitirá determinar la vía y la localización exacta de la fuga en tiempo real y así guiar su cierre. (4, 21-35) El aprovechamiento de técnicas de acceso alternativas, como la punción trans-apical directa, aportará la posibilidad de continuar avanzando en esta intervención percutánea.
Limitaciones
Los resultados analizados corresponden a una pequeña cohorte de pacientes altamente seleccionados con un seguimiento a mediano plazo. La insignificante tasa de eventos de la serie no permitió comparaciones entre subgrupos de pacientes.
CONCLUSIONES
El cierre percutáneo de FPV es un procedimiento seguro y eficaz, que permite una mejoría sustancial de la regurgitación valvular y de la CF con una tasa baja de eventos adversos. El éxito del procedimiento tiene una íntima relación con un claro entendimiento de la anatomía, localización, morfología de la/s fuga/s con estudios de imágenes adecuadas en tiempo real y con el entrenamiento de un equipo multidisciplinario para el manejo preprocedimiento, intraprocedimiento y posprocedimiento.
Estos datos apoyan la reparación percutánea como parte de una estrategia terapéutica integral para el manejo de este grupo desafiante de pacientes, que generalmente tienen un riesgo quirúrgico elevado.
Declaración de conflicto de intereses
Los autores declaran que no poseen conflicto de intereses.
(Véanse formularios de conflicto de intereses de los autores en la web/ Material suplementario).
BIBLIOGRAFÍA
1. Ionescu A, Fraser AG, Butchart EG. Prevalence and clinical signifi-cance of incidental paraprosthetic valvar regurgitation: a prospective study using transoesophageal echocardiography. Heart 2003;89:1316-21. http://doi.org/ff77gz
2. Hammermeister K, Sethi GK, Henderson WG, Grover FL, Oprian C, Rahimtoola SH, et al. Outcomes 15 years after valve replacement with a mechanical versus a bioprosthetic valve: Final report of the veterans affairs randomized trial. J Am Coll Cardiol 2000;36:1152-8. http://doi.org/cdzzvw
3. Krishnaswamy A, Tuzcu EM, Kapadia SR. Percutaneous paravalvular leak closure. Interventional Cardiology Review 2013;9:44-8. http://doi.org/bqmm
4. Bartel T, Müller S. Intraprocedural guidance: which imaging technique ranks highest and which one is complementary for closing paravalvular leaks? Cardiovasc Diagn Ther 2014;4:277-8.
5. Echevarria JR, Bernal JM, Rabasa JM, Morales D, Revilla Y, Revuelta JM, et al. Reoperation for bioprosthetic valve dysfunction. A decade of clinical experience. Eur J Cardiothorac Surg 1991;5:523-6. http://doi.org/bwt4jk
6. Emery RW, Krogh CC, Mc Adams S, Emery AM, Holter AR, et al. Long-term follow up of patients undergoing reoperative surgery with aortic or mitral valve replacement using a St Jude medical prosthesis. J Heart Valve Dis 2010;19:473-84.
7. Álvarez JA, Alonso JL, Leiva GA, Baglioni P, Fernández Recalde ML, Rivas C y cols. Aplicaciones no convencionales de dispositivos endovasculares en cardiopatías estructurales adquiridas. Rev Argent Cardiol 2013;81:159-63. http://doi.org/bqmn
8. Shapira Y, Hirsch R, Kornowski R, Hasdai D, Assali A, Vaturi M, et al. Percutaneous closure of perivalvular leaks with Amplatzer occluders: feasibility, safety, and short-term results. J Heart Valve Dis 2007;16:305-13.
9. Sorajja P, Cabalka AK, Hagler DJ, Rihal CS. Long-term follow-up of percutaneous repair of paravalvular prosthetic regurgitation. J Am Coll Cardiol 2011;58:2218-24. http://doi.org/fqtqwb
10. Sorajja P, Cabalka AK, Hagler DJ, Rihal CS. Percutaneous repair of paravalvular prosthetic regurgitation: acute and 30-day outcomes in 115 patients. Circ Cardiovasc Interv 2011;4:314-21. http://doi. org/c3hdgx
11. Alonso-Briales JH, Muñoz-García AJ, Jiménez-Navarro M F, Domínguez-Franco AJ, Melero-Tejedor JM, Rodríguez-Bailón I, et al. Utilización de los dispositivos Amplatzer para el cierre de fugas perivalvulares. Rev Esp Cardiol 2009;62:442-6. http://doi. org/fps5k9
12. Ruiz CE, Jelnin V, Kronzon I, Dudiy Y, Del Valle-Fernández R, Einhorn BN, et al. Clinical outcomes in patients undergoing percuta-neous closure of periprosthetic paravalvular leaks. J Am Coll Cardiol 2011;58:2210-7. http://doi.org/bh5vm8
13. Charanjit S, Rihal, Sorajja P, Booker JD, Hagler DJ, Cabalka AK, et al. Principles of percutaneous paravalvular leak closure. J Am Coll Cardiol Intv 2012;5:121-30. http://doi.org/bqmp
14. Sánchez-Recalde A, Moreno R, Galeote G, Jiménez-Valero S, Calvo L, Hernández Sevillano J, et al. Evolución inmediata y a medio plazo de las dehiscencias paravalvulares cerradas percutáneamente. Rev Esp Cardiol 2014;67:615-23. http://doi.org/f2skk5
15. Cruz-González I, Rama-Merchan JC, Arribas-Jiménez A, Rodríguez-Collado J, Martin-Moreiras J, Cascon-Bueno M, et al. Cierre percutáneo de fugas periprotésicas con el dispositivo Amplatzer Vascular Plug III: resultados inmediatos y a corto plazo. Rev Esp Cardiol 2014;67:608-14. http://doi.org/f2pz76
16. Sorajja P, Cabalka AK, Hagler DJ, Rihal CS. The learning curve in percutaneous repair of paravalvular prosthetic regurgitation. J Am Coll Cardiol Intv 2014;7:521-9. http://doi.org/bqmq
17. Roques F, Nashef SA, Michel P, Gauducheau E, de Vincentiis C, Baudet E, et al. Analysis of the EuroSCORE multinational database of 19030 patients. Eur J Cardiothorac Surg 1999;15:816-22. http:// doi.org/fhjhx8
18. De Cicco G, Russo C, Moreo A. Mitral valve periprosthetic leakage: anatomical observations in 135 patients from a multicentre study. Eur J Cardiothorac Surg 2006;30:887-91. http://doi.org/b8nzv3
19. Zoghbi WA, Chair F, Chambers JB, Dumesnil JG, Foster E, Gottdiener JS, et al. Recommendations for Evaluation of Prosthetic Valves With Echocardiography and Doppler Ultrasound A Report From the American Society of Echocardiography's Guidelines and
Standards Committee and the Task Force on Prosthetic Valves, Developed in Conjunction With the American College of Cardiology Cardiovascular Imaging Committee, Cardiac Imaging Committee of the American Heart Association, the European Association of Echo-cardiography, a registered branch of the European Society of Cardi-ology, the Japanese Society of Echocardiography and the Canadian Society of Echocardiography, Endorsed by the American College of Cardiology Foundation, American Heart Association, European As-sociation of Echocardiography, a registered branch of the European Society of Cardiology, the Japanese Society of Echocardiography, and Canadian Society of Echocardiography. J Am Soc Echocardiogr 2009;22:975-1014. http://doi.org/dzfv8k
20. De Cicco G, Lorusso R, Colli A. Aortic valve periprosthetic leak-age: anatomic observations and surgical results. Ann Thorac Surg 2005;79:1480-5. http://doi.org/d43msd
21. Ruiz CE, Cohen H, Del Valle-Fernandez R, Jelnin V, Perk G, Kronzon I, et al. Closure of prosthetic paravalvular leaks: a long way to go. Eur Heart J Supp 2010;12:E52-E62. http://doi.org/djf5rt
22. Vivancos-Delgado R, Gómez de Diego JJ, Río Aguilar-Torres, Forteza-Alberti JF. Novedades en técnicas de imagen cardiaca. Rev Esp Cardiol 2011;64:30-41. http://doi.org/fmw22x
23. Hein R, Wunderlich N, Robertson G, Wilson N, Sievert H. Catheter closure of paravalvular leak. EuroInterv 2006;2:318-25.
24. García E, Sandoval J, Unzue L, Hernández-Antolin R, Almería C, Macaya C. Paravalvular leaks: mechanisms, diagnosis and manage-ment. EuroIntervention 2012;8:Q41-Q52. http://doi.org/bqmr
25. Gafoor S, Steinberg DH, Franke J, Bertog S, Vaskelyte L, Hofmann I, et al. Tools and Techniques - Clinical: Paravalvular leak closure. EuroIntervention 2014;9:1359-63. http://doi.org/bqms
26. Buellesfeld L, Meier B. Treatment of paravalvular leaks through interventional techniques. Multimedia manual of cardiothotacic surgery.mmcts. http://mmcts.oxfordjournals.org/content/2011/0924/ mmcts.2010.004895.full.pdf
27. Kim MS, Casserly I P, Garcia JA, Klein AJ, Salcedo EE, Carroll JD. Percutaneous transcatheter closure of prosthetic mitral paravalvular leaks. Are we there yet? J Am Coll Cardiol Intv 2009;2:81-90. http:// doi.org/b2m87b
28. Pate GE, Thompson CR, Munt BI, Webb JG. Techniques for percu-taneous closure of prosthetic paravalvular leaks. Catheter Cardiovasc Interv 2006;67:158-66. http://doi.org/d35jb3
29. Kliger C, Eiros R, Isasti G, Einhorn B, Jelnin V, Cohen H, et al. Review of surgical prosthetic paravalvular leaks: diagnosis and cath-eter-based closure. Eur Heart J 2013;34:638-49. http://doi.org/bqmt
30. Larman M, Lasa G, San Martín JC, Gaviria K. Vía transapical como alternativa para el cierre del leak paravalvular. Rev Esp Cardiol 2011;64:75-83. http://doi.org/dpgkhm
31. Nau G, Albertal M, Vrancic M, Ronderos R, Sánchez G, Navia
D, et al. Cierre percutáneo de fuga paravalvular mitral. Rev Argent Cardiol 2011;79:537-40.
32. Sorajja P, Cabalka AK, Hagler DJ, Reeder GS, Chandrasekaran K, Cetta F, et al. Successful percutaneous repair of perivalvular prosthetic regurgitation. Catheter Cardiovasc Interv 2007;70:815-23. http://doi.org/d6td9k
33. Kliger C, Ruiz C. Reconsideración del cierre percutáneo de la fuga paravalvular: ¿hacia dónde vamos ahora? Rev Esp Cardiol 2014;67:593-6. http://doi.org/f2r9jk
34. Hoffmayer KS, Pharm D, Zellner C, Kwan DM, Konety S, Foster
E, et al. Closure of a para-valvular aortic leak with the use of 2 AM-PLATZER devices and real-time 2- and 3-dimensional transesopha-geal echocardiography. Tex Heart Inst J 2011;38:81-4.
35. Kliger C, Cruz-González I, Ruiz CE. Presente y futuro de la eco-cardiografía intracardiaca para guiar las intervenciones en cardiopatía estructural. Rev Esp Cardiol 2012;65:791-4. http://doi.org/f2fmkb














