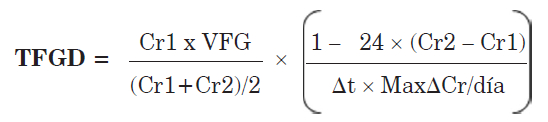INTRODUCCIÓN
La insuficiencia cardíaca descompensada (ICD) es una de las causas más importantes de internación en unidad coronaria y se estima que su prevalencia aumentará en la medida en que se incremente la expectativa de vida de la población. 1 Para su tratamiento, es habitual la necesidad de realizar balance negativo con diuréticos, tanto si la insuficiencia cardíaca es producto de la falla ventricular izquierda sistólica como diastólica.
En algunos casos, la ICD puede coexistir con insuficiencia renal y esta última puede estar presente ya desde el ingreso o bien desarrollarse durante la internación. 2 La insuficiencia renal aguda (IRA) como complicación del tratamiento de la ICD durante la evolución hospitalaria conlleva internaciones más prolongadas y mayor mortalidad. 3,4,5 Poder identificar en forma sencilla a los pacientes que desarrollarán IRA y muerte durante la internación nos podría permitir realizar cambios en el tratamiento y así modificar el curso de la enfermedad. Hasta el momento, no hay variables que nos permitan predecir el desarrollo de IRA en forma inequívoca. Nuestro objetivo fue evaluar si una nueva fórmula para medir el clearance renal en forma dinámica, con los valores de creatinina del ingreso y a las 24 h, nos permitiría predecir la presentación de eventos adversos (IRA y muerte) en la internación.
MATERIAL Y MÉTODOS
Se realizó un estudio observacional y retrospectivo en el cual se incluyeron en forma consecutiva los pacientes con diagnóstico de ICD ingresados en la unidad coronaria de dos centros de la Ciudad de Buenos Aires, siempre que estuvieran disponibles para cada uno de estos pacientes dos valores de creatinina plasmática obtenidos en días diferentes: al ingreso y a las 24 h de internación. Se analizaron las variables demográficas, los factores de riesgo vascular, la presencia de comorbilidades y los antecedentes patológicos. Se consignó la incidencia de pacientes con valores de creatinina ≥1,5 mg/ dl y ≥ 2 mg/dl; se calculó el clearance de creatinina mediante la fórmula MDRD (Modification of Diet in Renal Disease) y la ecuación CKD-epi (Chronic Kidney Disease Epidemiology Collaboration), y la TFGD (tasa de filtrado glomerular dinámico) según la fórmula de Chen S. y cols. 6, según se indica a continuación
donde Cr1 y Cr2 son los valores de creatinina plasmática al ingreso y a las 24 horas, respectivamente; VFG es el volumen de filtrado glomerular calculado por la fórmula MDRD, con el valor de creatinina plasmática del ingreso; Δt es la diferencia de tiempo en horas entre ambas mediciones de creatinina; y MaxΔCr/día es el máximo aumento de creatinina plasmática que puede producirse en un día si la función renal está completamente perdida (valor promedio para la mayoría de los adultos: 1,5 mg/dl). Este cálculo se hace en forma sencilla mediante una aplicación para smartphones (https://qxmd.com/calculate/calculator_367/kinetic-egfr-kegfr).
Se evaluó un punto final combinado de desarrollo de IRA o muerte por cualquier causa durante el seguimiento hospitalario. Se definió la IRA de acuerdo a la guía KDIGO, como un aumento de la creatinina ≥ 0,3 mg/dl o un incremento ≥ 50% con respecto al basal. 7
Se excluyeron los pacientes en los que no se disponía de los dos valores de creatinina y aquellos con antecedentes de insuficiencia renal crónica, diálisis o que por cuestiones administrativas tuvieron que ser derivados a otro centro.
Análisis estadístico
Las variables continuas se expresaron con su media aritmética y su desviación estándar o con la mediana y su intervalo intercuartilo 25-75%, según la distribución fuera gaussiana o no, mientras que las variables discretas se expresaron en porcentaje. Los datos continuos con distribución gaussiana se compararon con el test t de Student y aquellos sin distribución gaussiana con el test Rank-sum de Wilcoxon. Los datos discretos se compararon con la prueba de Chi cuadrado o el test de Fisher.
Se efectuó un análisis univariado y de regresión múltiple de Cox para determinar predictores independientes de desarrollo de IRA y mortalidad. Se aceptó como estadísticamente significativa una diferencia de p < 0,05. Asimismo, se construyó una curva ROC con los valores de TFGD para hallar el valor que, con mejor relación sensibilidad/especificidad, predijera el evento combinado, y luego se realizó un análisis uniy multivariado para hallar los predictores independientes de la TFGD que resultaran de la curva ROC. Todos los análisis fueron realizados con el programa estadístico SPSS versión 21.
RESULTADOS
El total de pacientes internados por ICD en dos unidades coronarias, en el período mayo 2010-mayo 2017, fue de 813. Se excluyeron del análisis 190 pacientes que tenían insuficiencia renal crónica y 15 que no contaban con los valores de creatinina evolutiva, por lo que los pacientes analizados fueron 608. Edad (mediana): 81 años (RIC 25-75%: 73-87), hombres: 48%, diabéticos: 25,5%, hipertensos: 76%, infarto previo: 19,4%, disfunción sistólica (fracción de eyección <45% por ecocardiograma): 46,8%, creatinina de ingreso (mediana): 1,05 mg/dl.
La mortalidad intrahospitalaria fue del 4,1% y la incidencia de IRA durante la internación fue del 40,5%. La incidencia del evento combinado fue del 41,2%.
Los pacientes que presentaron IRA/muerte durante la internación no difirieron en edad, sexo, comorbilidades y filtrado glomerular calculado por MDRD y CKD-epi. Solo la TFGD fue significativamente menor en los que evolucionaron con IRA/muerte (mediana: 50,7 ml/ min, vs. 57,9 ml/min; p < 0,01) (Tabla 1).
Tabla 1 Análisis univariado para evento combinado muerte+IRA
| Evento n: 250 (41,12%) | No evento n: 358 (58,88%) | p | OR (IC95%) | |
|---|---|---|---|---|
| Edad (mediana) años | 82 (72-87) | 80 (73-87) | 0,68 | |
| Hombres | 49,2% | 46,9% | 0,29 | 0,91 (0,66-1,26) |
| Diabéticos | 26,5% | 24,8% | 0,32 | 1.09 (0,75-1,57) |
| HTA | 76,4% | 75,7% | 0,42 | 1,03 (0,71-1,51) |
| Disfunción sistólica | 45,5% | 47,5% | 0,31 | 0,92 (0,66-1,27) |
| Antecedentes vasculares (IAM, CRM, ATC, ACV) | 35,6% | 37,15% | 0,34 | 0,93 (0,66-1,3) |
| MDRD ml/min/1,73 m2 Mediana (RIC 25-75%) | 61,7 (49,5-80,3) | 61,5 (46,9-76,5) | 0,32 | |
| MDRD < 60 ml/min/1,73 m2 | 46,8% | 47,8% | 0,4 | 0,96 (0,69-1,32) |
| CKD-epi ml/min/1,73 m2. Mediana (RIC 25-75%) | 56,4 (44,3-77) | 57,5 (43-74,4) | 0,69 | |
| CKD-epi <60 ml/min/1,73 m2 | 56% | 55,6% | 0,46 | 1,01 (0,73-1,4) |
| TFGD ml/min. Mediana (RIC 25-75%) | 50,7 (38,3-66,4) | 57,9 (45,1-74,4) | < 0,01 | |
| TFGD < 60 ml/min | 67,2% | 53% | < 0,01 | 1,81 (1,29-2,53) |
| Creatinina ingreso mg/dl. Mediana (RIC) | 1,025 (0,9-1,3) | 1,075 (0,9-1,3) | 0,75 | |
| Creatinina ingreso ≥ 1,5 mg/dl | 12% | 11,45% | 0,41 | 1,05 (0,36-1,74) |
| Creatinina ingreso ≥ 2 mg/dl | 4,4% | 3,35% | 0,25 | 1,32 (0,57-3,05) |
HTA: hipertensión arterial, DBT: diabetes, IAM: infarto agudo de miocardio, CRM: cirugía de revascularización miocárdica, ATC: angioplastia coronaria, ACV: accidente cerebrovascular, disfunción sistólica: Fey < 45%.
Mediante curva ROC, el valor de TFGD que mostró mejor precisión pronóstica para eventos fue de 60 ml/ kg/min, con un área bajo la curva de 0,60 (0,55-0,64, p < 0,01). La sensibilidad para predecir evento combinado fue del 67% y la especificidad del 46%.
Hubo 250/608 pacientes (41,1%) con TFGD mayor/ igual de 60 ml/min y 358/608 pacientes (58,9%) con TFGD menor de 60 ml/min. En el grupo de pacientes con un TFGD menor que 60 ml/min hubo mayor prevalencia de mujeres (58,6% vs. 42,8%, p < 0,01) y los sujetos fueron más añosos, con una edad (mediana) de 83 años, vs. 76 años en el primer grupo (p < 0,001). Además, estos pacientes tuvieron más antecedentes de hipertensión arterial (79,3% vs. 71,2%, p = 0,011) y una similar incidencia de diabetes (23% vs. 29,2%, p = 0,051) y de disfunción sistólica (45,2% vs. 49%, p = 0.18) que aquellos con TFGD mayor/igual de 60 ml/min.
El filtrado glomerular, calculado con los valores de creatinina al ingreso por las fórmulas MDRD y CKD epi, fue significativamente menor en los pacientes con TFGD < 60 ml/min/1,73 m2 (Tabla 2). La mortalidad IH en los pacientes con TFGD < 60 ml/min fue de 4,75%, versus 3,2% en el grupo con TFGD ≥ 60 ml/min (p = 0,17) y el desarrollo de IRA fue de 46,1% versus 32,4%, respectivamente (p < 0,001). En el modelo multivariado para predecir TFGD < 60 ml/min/1,73 m2, que incluyó la edad, el sexo femenino, la presencia de hipertensión arterial y DBT y un filtrado glomerular al ingreso por MDRD y CKD-epi <60 ml/min/1,73 m2, fueron predictores independientes la edad y el bajo filtrado glomerular calculado al ingreso (Tabla 3).
Tabla 2 Características de la población global de acuerdo al cálculo de la función renal mediante la tasa dinámica de filtrado glomerular mayor o menor de 60 ml/kg/min.
| TFGD ≥ 60 ml/min n: 250 (%) | TFGD < 60 ml /min n: 358 (%) | P | OR (IC95%) | |
|---|---|---|---|---|
| Edad mediana (RIC) 25-75%) años | 76 (67-83) | 83 (78-88) | < 0,001 | |
| Sexo femenino | 107 (42,8) | 210 (58,7) | <0,01 | 1,89 (1,36-2,63) |
| HTA | 178 (71,2) | 284 (79,3) | 0,01 | 1,55 (1,06-2,25) |
| DBT | 73 (29,2) | 82 (23) | 0,051 | 0,72 (0,5-1,04) |
| Antecedentes vasculares (IAM, CRM, ATC, ACV). | 94 (37,6) | 128 (35,75) | 0,35 | 0,92 (0,66-1,29) |
| Fey < 45% | 119 (49) | 160 (45,2) | 0,18 | 0,85 (0,61-1,19) |
| Creatinina de ingreso (mg/dl) | 0,9 (0,75-1) | 1,2 (1-1,45) | 0,001 | |
| MDRD < 60 ml/min/1,73 m2 | 20 (8) | 268 (75) | 0,0001 | 34,2 (20-57) |
| CKD-epi < 60 ml/min/1,73 m2 | 38 (15,2) | 301 (84%) | 0,0001 | 29,5 (19-46) |
| Mortalidad IH | 8 (3,2) | 17 (4,75) | 0,17 | 1,5 (0,64-3,55) |
| IRA | 81 (32,4) | 165 (46,1) | < 0,001 | 1,73 (1,27-2,49) |
| Muerte/IRA | 82 (32,8) | 168 (46,9) | < 0,001 | 1,81 (1,29-2,53) |
HTA: hipertensión arterial, DBT: diabetes, IAM: infarto agudo de miocardio, CRM: cirugía de revascularización miocárdica, ATC: angioplastia coronaria, ACV: accidente cerebrovascular, Disfunción sistólica: Fey < 45%:
Tabla 3 Análisis multivariado para predecir TFGD < 60/ml/ min.
| Variable | OR | IC95% | P |
|---|---|---|---|
| Edad (x año) | 1,03 | 1,01-1,05 | <0,002 |
| Género femenino | 1,15 | 0,72-1,85 | 0,056 |
| HTA | 1,12 | 0,65-1,94 | 0,67 |
| DBT | 0,91 | 0,52-1,54 | 0,70 |
| MDRD < 60 ml/min/1,73 m2 | 8,85 | 4,2-18,6 | < 0,001 |
| CKD-epi < 60 ml/min/1,73 m2 | 4,95 | 2,55-9,57 | < 0,001 |
DISCUSIÓN
La insuficiencia cardíaca descompensada (ICD) es una de las causas más frecuentes de internación en las unidades coronarias y se asocia a internaciones prolongadas, reinternaciones frecuentes y elevada mortalidad, tanto intrahospitalaria como en el seguimiento, lo que conlleva un elevado costo para los sistemas de salud. 8
En los pacientes con ICD es frecuente la coexistencia de insuficiencia renal 9,10, ya sea desde el ingreso o la que se desarrolla durante la internación. 11 En un metaanálisis de gran envergadura se demostró que ambas presentaciones de la insuficiencia renal se asocian a un peor pronóstico 4 y que, incluso, a mayor deterioro de la función renal, peor evolución. 5 Sin embargo, recientemente se reportó que el deterioro de la función renal en el contexto del balance negativo por ICD no va necesariamente asociado con una mala evolución clínica. 12,13,14
La mortalidad intrahospitalaria en nuestro trabajo fue del 4,1%, similar a la de los grandes registros americanos ADHERE 15, que abarcó 65 000 pacientes (4%), y OPTIMIZE HF 16, con 48 000 pacientes (3,4%). La prevalencia de insuficiencia renal aguda fue en nuestro análisis de 40,5%. En otras series, la prevalencia de IRA se sitúa entre 23% 17 y 60% 18; sin embargo, es sabido que la prevalencia de IRA puede variar de acuerdo a las definiciones utilizadas y al grupo etario analizado, ya que es más prevalente a mayor edad. 19 Nuestra población tuvo una edad mediana de 82 años, más elevada que la de los registros argentinos, que en promedio es de 70 años. 20 No cabe duda de que la insuficiencia renal es un evento indeseable que prolonga las internaciones y dificulta la titulación de la medicación, importante en el tratamiento de los pacientes con ICD, independientemente de su real valor pronóstico.
Poder predecir qué pacientes desarrollarán IRA sería de suma utilidad para poder evitarla. En este sentido, múltiples trabajos han demostrado asociación de características clínicas como la edad o la diabetes con su desarrollo, pero ninguna de ellas puede modificarse. De los factores que podrían eventualmente ser modificados, el grado de balance negativo, la dosis o la forma de administración del diurético empleado son de índole tan personal, propios de cada paciente, que ningún trabajo científico podría analizarlos o compararlos. Con respecto a los marcadores que se pueden medir en sangre u orina, ni la cistatina C ni el Ngal han demostrado poder cumplir ese rol 21,26, razón por la cual encontrar capacidad predictiva en algo sencillo de obtener como lo son dos muestras de sangre tomadas en días consecutivos sería de gran utilidad.
En el contexto de los pacientes crónicos, ya se ha reemplazado el uso aislado de los valores de creatinina como elementos diagnósticos de insuficiencia renal por el cálculo del filtrado glomerular mediante fórmulas 3, ya que se ha demostrado que pueden ocurrir importantes reducciones en los valores de filtrado glomerular sin que los valores de creatinina salgan de los rangos normales. Estas fórmulas han sido descriptas y validadas en poblaciones ambulatorias, con creatininas estables y sin ascitis o edemas, escenario diferente al de los pacientes internados por ICD, en los que los valores de creatinina (y de filtrado) pueden variar de acuerdo al grado de congestión venosa, volumen minuto, la activación neurohormonal, la actividad inflamatoria, al efecto del balance negativo con diuréticos o al uso de medicamentos potencialmente nefrotóxicos, entre otros factores. 27,28
Se han hecho varios intentos para calcular un “clearance dinámico” 6,29,30,31,32. Estas fórmulas se basan en el principio del balance de la masa de creatinina, que relaciona su producción con su pérdida, objetivada por un cambio de concentración plasmática de creatinina en diferentes tomas, y varían en su cálculo matemático. Poder calcular un clearance dinámico de forma simple, a partir de mediciones accesibles y ampliamente disponibles -como ocurre con la fórmula de Chen y cols. 18, disponible incluso en aplicaciones para celular 33-, parece ser una forma lógica de evaluar la función renal cambiante en el escenario agudo. Esta fórmula se ha evaluado en otros escenarios clínicos, como en los posoperatorios de cirugía cardíaca 34 o en los pacientes de terapia intensiva 35,36, con buenos resultados, y ya se está incorporando a las guías de manejo de los pacientes renales. 37,38
En nuestro trabajo, la TFGD demostró poder identificar a los pacientes que desarrollarían el evento combinado en la internación en forma estadísticamente significativa (p < 0,01). Sin embargo, la mediana de la TFGD del grupo con IRA/muerte vs. sin IRA/muerte fue de 50,7 (RIC 25-75%: 38,3-66,4) vs. 57,5 (RIC 25-75%: 44,7-72,3) ml/kg/min. Esta superposición de valores en los intervalos de confianza hace que, pese a ser significativa la diferencia hallada, esta carezca de relevancia clínica. 39 Asimismo, el área de 0,6 obtenida mediante curva ROC también refleja una pobre correlación con eventos, con una sensibilidad del 67% y una especificidad del 43% . Dicho de otra manera, se podría detectar a casi 7 de cada 10 pacientes que desarrollarían IRA+muerte, pero nos equivocaríamos en el pronóstico en más de la mitad. Lamentablemente, no existe por el momento ningún factor pasible de eventual modificación que nos permita predecir el desarrollo de IRA/muerte en los pacientes internados por ICD.
Limitaciones del estudio
Quizá la mayor limitación es la falta de un gold standard para definir la IRA en la actualidad y que se tengan que utilizar valores de creatinina para ello. Además, dado que se requieren valores de creatinina evolutivos, no podría aplicarse en los pacientes que fallecen en las primeras 24 horas del ingreso hospitalario.
CONCLUSIONES
La tasa dinámica del filtrado glomerular es una variable sencilla de obtener y de bajo costo que, si bien resulta ser un predictor independiente de desarrollo de insuficiencia renal y mortalidad intrahospitalaria en pacientes internados por insuficiencia cardíaca descompensada, carece de relevancia clínica por su baja especificidad.