INTRODUCCIÓN
En el síndrome coronario agudo (SCA) el mecanismo fisiopatológico principal es la activación, adhesión y posterior agregación plaquetaria luego de la rotura de placa 1,2. La doble antiagregación con aspirina (AAS) y un inhibidor del receptor P2Y12 (iP2Y12) ha demostrado reducir las complicaciones trombóticas, por lo que se ha convertido en el pilar del tratamiento del SCA 3,4. Sin embargo, alrededor de un tercio de los pacientes presentan reactividad plaquetaria aumen-tada (RPA) a pesar del tratamiento antiagragante con AAS y/o clopidogrel. 5,6 También se ha observado RPA con ticagrelor 7 y al prasugrel 8. Esta falta de inhibición de la actividad plaquetaria in vitro, denomi-nada resistencia a antiagregantes, se ha asociado a un mayor riesgo de eventos trombóticos. 6,9,10
A su vez, la mayor reactividad plaquetaria se asocia a un aumento del volumen plaquetario 2 y se han encontrado niveles mayores de factores procoagulantes y mayor expreción de glicoproteínas Ib y IIb/IIIa en pacientes con volumen plaquetario medio (VPM) aumentado. 11,12 Por otro lado, el VPM se encuentra incrementado en pacientes con infarto agudo de miocardio respecto a controles y ha resultado ser predictor tanto de mortalidad como de otros eventos cardiovasculares en pacientes con SCA. 13,14
También se ha evidenciado que el VPM se incremen-a con la edad en pacientes con enfermedad coronaria. 15 La asociación entre el VPM y la resistencia a los antiagregantes ha sido poco estudiada en pacientes ancianos. El objetivo primario de este estudio es evaluar si existe asociación entre el VPM y la resistencia a la doble antiagregación en pacientes mayores de 65 años con SCA. Además, se plantea como objetivo secundario evaluar si estos parámetros se asocian a eventos que ocurrieron durante el seguimiento.
MATERIALES Y MÉTODOS
Se realizó un estudio observacional, prospectivo, unicéntrico donde se incluyeron pacientes internados en unidad coronaria desde enero de 2014 a julio de 2017 con diagnóstico de SCA, mayores de 65 años a los que se les realizó tratamiento con AAS y carga de un iP2Y12. Los criterios de exclusión fueron la imposibilidad de realizar medición de VPM o de agregación plaquetaria dentro de los tiempos requeridos y no recibir carga de iP2Y12. Los pacientes fueron divididos en tres grupos de acuerdo con la presencia de resistencia a los antiagregantes: grupo 1, con resistencia a ambos antiagregantes; grupo 2, con resistencia a uno de los antiagregantes, y grupo 3, sin resistencia a los antiagregantes.
Tratamiento antiplaquetario
Todos los pacientes fueron tratados con AAS y carga de iP2Y12 al ingreso. La decisión de utilizar clopidogrel o tica-grelor, así como las dosis de carga de los antiagregantes, se realizó según el criterio del médico tratante. El servicio de Cardiología de la Institución sugiere seguir las recomendacio-nes de las guías tanto de SCA sin elevación del ST 3, como con elevación del ST. 4
Extracción de muestras
En el laboratorio de ingreso se les realizó hemograma con re-cuento de plaquetas y VPM en una muestra de sangre venosa anticoagulada en EDTA, utilizando un contador hematológico Sysmex XT-2000i.
La agregación plaquetaria in vitro se realizó entre las 12 y las 24 horas poscarga del iP2Y12 (clopidogrel o icagrelor) y AAS. Las muestras se procesaron dentro de las 4 horas de la extracción utilizando el método de light transmission aggregometry (LTA) en un equipo AggRAm aggregometer© (Helena Laboratories). El fundamento del método consiste en medir el promedio de la agregación plaquetaria proveniente de la diferencia de densidad óptica que hay entre el plasma rico en plaquetas (PRP) y el plasma pobre en plaquetas (PPP) cuando se agrega un agonista. Para evaluar la reactividad plaquetaria a la AAS se utilizó el ácido araquidónico (ARA) en una concentración de 500 µg/ml, y para los iP2Y12 se uti-lizó el adenosín difosfato (ADP) en una concentración de 10 µM. Se consideró resistencia a iP2Y12 al porcentaje máximo de agregación (PMA) con ADP > 60% y a la AAS a un PMA con ARA > 20%.
Seguimiento
El seguimiento que se realizó a los pacientes dados de alta se llevó a cabo mediante seguimiento telefónico o por entrevista médica. Se consideró el punto final combinado de muerte por cualquier causa y reinternación cardiovascular (por SCA, insuficiencia cardíaca, arritmias y revascularización).
Análisis estadístico
Las variables continuas se muestran como media ± desvío estándar y las categóricas como porcentaje. Las comparacio-nes entre los tres grupos de variables continuas se realizaron mediante el test de análisis de varianza (ANOVA), cuando la distribución fue normal, y mediante el test de Kruskal-Wallis cuando la distribución fue no normal. Para las comparaciones de variables categóricas se utilizó el test de chi2.
Para evaluar la asociación entre VPM y la resistencia a antiagregantes se realizó análisis univariado utilizando como variable dependiente el grupo 1 (resistencia a ambos antiagregantes) y como variables independientes el VPM como variable continua, el score GRACE y otras variables conocidas asociadas a resistencia como la creatininemia, la glucemia, el índice leuco-glucémico (índice L/G), el sexo fe-menino, el antecedente de diabetes y de dislipidemia 7,10. Posteriormente se realizó un análisis multivariado mediante un modelo de regresión logística analizando en conjunto las variables que fueron significativas en el univariado.
Para establecer la capacidad de discriminación del VPM y predecir la resistencia a ambos antiagregantes se construyó una curva Receiver Operating Characteristic (ROC), a fin de determinar el área bajo la curva (ABC) y el punto de corte.
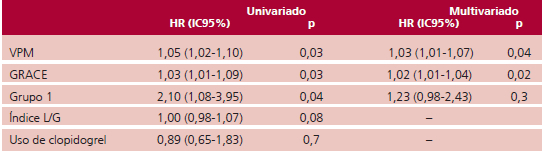
Para el seguimiento se realizó el análisis univariado para el punto combinado utilizando el VPM, el score GRACE y el índice L/G como variables continuas y el grupo 1 y el uso de clopidogrel como variables categóricas. Las variables que presentaran asociación significativa fueron analizadas en un modelo multivariado mediante el método de regresión de Cox para establecer los predictores independientes del punto combinado, informando el Hazard Ratio (HR) con el corres-pondiente intervalo de confianza del 95% (IC 95%). Además, se analizó la sobrevida libre de eventos mediante curvas de Kaplan-Meier. Por último, se calculó ABC para evaluar la capacidad de discriminación para el punto combinado del VPM. Se consideró significativa un valor de p < 0,05. Para el análisis general se utilizó el software Statistix 7 y para la curva ROC el Epidat 3.1.
RESULTADOS
Durante el período del estudio ingresaron 287 pacientes, de los cuales 50 fueron excluidos por no haberse podido realizar alguna de las mediciones, y 42 por no haber recibido carga de iP2Y12, por lo que finalmente fueron incluidos 195 pacientes (40 SCA con elevación ST y 155 SCA sin elevación del ST). La edad fue de 74 ± 7 años y el 43% fueron mujeres. El 100% recibió carga de AAS y de iP2y12 (120 recibieron clopidogrel y 75 ticagrelor). Dosis de AAS: el 84,6% (n = 165) recibió carga de 200 mg y el resto de 300 mg. Dosis de clopidogrel: el 76,1% (n = 95) recibió carga de 600 mg y el 20,9% (n = 25) recibió 300 mg. Todos los pacientes que recibieron ticagrelor, tuvieron carga de 180 mg.
El 19% (n = 37) de los pacientes presentó resistencia a ambos antiagregantes (grupo 1), el 34,4% (n = 67) presentó resistencia a uno de los antiagregantes (grupo
y el 46,7% (n = 91) no presentó resistencia a ningún antiagregante. En el grupo 2, la mayoría de los pacientes presentaron resistencia a la AAS (n = 50), mientras que 17 pacientes presentaron resistencia a iP2Y12 (13 a clopidogrel y 4 a ticagrelor). La prevalencia en toda la población de resistencia a la AAS fue de 42,9%, al clopidogrel 36,6% y al ticagrelor 13,3%.
En la Tabla 1 se muestran las características basales de la población. Se destaca que los pacientes del grupo 1 presentaron mayor VPM (10.9 ± 0,3 versus 10,6 ± 0,4, versus 10,2 ± 0,5 fL, p = 0,04), mayor score GRACE (142 ± 30 versus 138 ± 32 versus 131 ± 27, p = 0,04) y mayor uso de clopidogrel (83,7% versus 61,2% versus 51,6%, p = 0,003) que los grupos 2 y 3. Por otro lado, los pacientes que presentaron resistencia a algún antiagregante (grupos 1 y 2) presentaron mayor índice leuco-glucémico (índiceL/G) que los pacientes que no presentaron resistencia (1.287 ± 812 versus 1.236 ± 1.000 versus 951 ± 514, p = 0,02).
Tabla 1 Características basales de la población

**IECA: inhibidores de la enzima convertidora de angiotensina. ARA II:
En la Tabla 2 se muestra análisis univariado y multivariado para la presencia de resistencia a ambos antiagregantes. El VPM y el tratamiento con clopidogrel fueron predictores independientes de resistencia a ambos antiagreagantes (OR 1,02 (1,01-1,04), p = 0,02) y (4,11 (1,62-10,4), p < 0,01), respectivamente. El VPM presentó un ABC de 0,62 (IC 95% 0,51-0,72) y se estableció un punto de corte de VPM > 10,7 fL, presentando un OR 2,71 (IC 95% 1,25-5,87), p = 0,01, ajustado con tratamiento con clopidogrel (Figura 1).
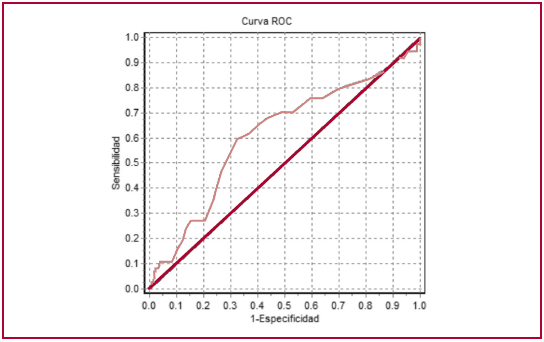
Fig. 1 Curva ROC. VPM para predecir resistencia a ambos antiagregantes. Se estableció un punto de corte de VPM > 10,6 fl. OR 2,71 (IC 95% 1,25-5,87), p = 0,01.
Seguimiento y eventos
El seguimiento promedio fue de 259 ± 170 días. El punto combinado se encontró en el 10,3% de los pacientes (n = 20), con una mortalidad del 2,56% (n = 5). El VPM y el GRACE fueron predictores independientes (HR 1,03 (IC 95% 1,01-1,07), p = 0,04 y HR 1,02 (IC 95% 1,01-1,04), p = 0,02), respectivamente (Tabla 3).
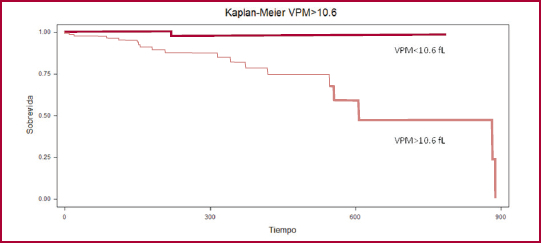
El ABC del VPM para predecir el punto combinado fue de 0,75 (IC 95% 0,65-0,85) y se estableció un punto de corte de VPM > 10,6 fL. En el análisis ajustado por GRACE el VPM > 10,6 presentó un HR de 3,82 (IC 95% 1,20-7,31), p = 0,01. En la Figura 2 se muestra la curva de kaplan-Meier del VPM > 10,6 fL respecto al punto combinado.
DISCUSIÓN
El objetivo principal de este estudio fue evaluar la asociación entre el VPM y la presencia de resistencia a la AAS y a los iP2Y12 (clopidogrel y ticagrelor) en pacientes mayores de 65 años con SCA. Encontramos que el VPM se asocia a la presencia de RPA poscarga de AAS e iP2Y12 y, además, es un factor de riesgo independiente de resistencia a ambos antiagregantes. Sin embargo, la capacidad de discriminación del VPM para predecir resistencia a ambos antiagregantes fue pobre (ABC 0,61).
Nuestros hallazgos concuerdan con trabajos de otros autores. Uzel et al 16 evaluaron la relación entre la respuesta al clopidogrel y el VPM en 185 pacientes internados por SCA y encontraron que el VPM fue predictor de RPA con una moderada capacidad de discriminación (ABC 0,70). En este sentido, Jakl et al 17 presentaron resultados similares en 190 pacientes con SCA, donde el VPM se asoció a resistencia a la doble antiagregación (AAS y clopidogrel).
En un estudio de casos control que evaluó pacientes sometidos a angioplastia luego de un SCA con y sin trombosis temprana intrastent, 18 el VPM se asoció a mayor reactividad plaquetaria en ambos grupos. Choi et al 19 presentaron hallazgos similares en 208 pacientes sometidos a angioplastia luego de un SCA. También se encontró esta asociación en pacientes con angina estable. 20 Estos estudios presentan diferencias con el nuestro. Por un lado, nuestros pacientes son más añosos (la edad promedio de los estudios presentados no supera los 68 años) y por otro, ninguno de los estudios citados fue utilizado el ticagrelor, mientras que, en nuestra población, el 38% fue tratado con ese fármaco.
En un estudio reciente Verdoia et al. 21 no encontraron asociación significativa entre el VPM y la resistencia a AAS, Clopidogrel ni ticagrelos en 487 pacientes seguidos luego de un SCA.
Una diferencia importante con los trabajos mencionados es el tiempo en el que se realizaron las mediciones. En la mayoría la agregación fue medida entre los 3° y 5° días luego del inicio del tratamiento, mientras que en el de Verdoia fue evaluada luego del mes.
Nosotros evaluamos la reactividad plaquetaria poscarga entre las 12 y 24 horas posteriores a la dosis de carga, como han hecho otros autores. 22,23 Por otro lado, utilizamos el método de LTA, que es el que clásicamente se ha utilizado para medir actividad plaquetaria.5,24 Los estudios mencionados han utilizado otros métodos desarrollados más recientemente -como el VerifyNow ®- que han sido validados y utilizados en numerosos trabajos. 23,24
Encontramos que más de la mitad de los pacientes presentaron resistencia, al menos, a un antiagregante. Aproximadamente el 42% presentó resistencia a la AAS, el 34% al clopidogrel y el 13% al ticagrelor. Previamente se han reportado tasas muy variables de resistencia a AAS entre el 5 y 57%, 25 y al clopidogrel, entre el 4 y el 68%. 24 Respecto al ticagrelor, se ha informado la presencia de resistencia entre el 3 y el 13% 7,26.
Numerosos estudios han reportado que la presencia de RPA se asocia a mayor riesgo de eventos cardiovasculares. 9,24 En este trabajo la resistencia a ambos antiagregantes se asoció a la presencia del punto combinado en el análisis univariado, mientras que el multivariado quedó anulado por el VPM y el score GRACE. En este sentido, un metaanálisis que incluyó más de 26 mil pacientes encontró que al ajustar por confundidores, la RPA no se asoció en forma significativa a un aumento del riesgo de eventos. 27 Además, los trabajos randomizados de grandes dimensiones no pudieron demostrar que el tratamiento guiado por la reactividad plaquetaria resultara en una reducción de eventos. 22,28
Por último, el VPM fue un predictor independiente del punto combinado, con un aceptable poder de discriminación (ABC 0,75). Nuestro grupo ha reportado el valor pronóstico de eventos del VPM en pacientes añosos con SCA. 14 Estos resultados están en sintonía con los hallazgos de numerosos estudios. 13,29 Además, el hecho de que sea medido en el hemograma de rutina y no genere un costo adicional, hace que sea atractivo como marcador de eventos cardiovasculares en el seguimiento.
Este trabajo se suma a la serie de estudios que muestran relación entre el VPM y la resistencia a antiagregantes. Se ha observado que las plaquetas más grandes presentan mayor nivel de tromboxano A2 por unidad, mayor expresión de receptores GP IIb-IIIa y mayor presencia de plaquetas reticuladas que las plaquetas pequeñas 11,12,28,30. Esto podría explicar en parte esta asociación. Sin embargo, el hecho de que el VPM se asocia en forma independiente al riesgo de eventos y no así la resistencia a antiagregantes, pone en evidencia que el mecanismo fisiopatológico por el cual el VPM es un factor de riesgo no está aún dilucidado.
Limitaciones
Se trata de un estudio de pequeñas dimensiones, realizado en un solo centro que atiende exclusivamente a pacientes ancianos (es un efector propio del Instituto Nacional de Servicios Sociales para Jubilados y Pensionados, PAMI- Argentina). El método por el que se midió la reactividad plaquetaria, si bien es el clásico de LTA, requiere que el procesamiento se haga dentro de las 4 horas de la extracción, lo que produjo que muchos pacientes no pudieran ser incluidos.
CONCLUSIONES
En la población estudiada la presencia de resistencia a AAS e iP2Y12 fue alta. El VPM se asoció a la presencia de resistencia a ambos antiagregantes. En el seguimiento, el VPM y el score GRACE fueron predictores del punto combinado, pero no así la presencia de resistencia a los antiagregantes.