INTRODUCCIÓN
El tejido adiposo epicárdico (TAE) es el depósito graso visceral intratorácico localizado entre el miocardio y el pericardio, en íntimo contacto con las arterias coronarias en todo su trayecto. Considerado históricamente como un simple depósito de energía, el TAE es un tejido metabólicamente activo que ha cobrado gran interés en la última década como marcador de riesgo cardiovascular. 1 Tanto el TAE como el tejido adiposo visceral abdominal, de mismo origen embriológico, se relacionan con la producción de citoquinas proinflamatorias y de ácidos grasos libres (AGL), con la promoción de un estado de hipercoagulabilidad, y con numerosos factores de riesgo cardiometabólico. 2,3,4 En particular, los pacientes diabéticos evidencian un mayor volumen de TAE, con un perfil metabólicamente más activo y proinflamatorio independientemente de los otros factores de riesgo cardiovasculares (FRC). 5,6,7
La función del TAE en el desarrollo y progresión de la ateromatosis coronaria ha sido demostrada no solo mediante su asociación con la gravedad, sino también con la presencia y extensión de ateromatosis no obstructiva. 8,9 En paralelo, numerosos estudios han encontrado una relación entre dichos depósitos de grasa y la presencia de disfunción endotelial, fibrilación auricular y disfunción diastólica. 10,11,12,13 Más recientemente, se ha descubierto que el TAE no es homogéneo en cuanto a su distribución y composición, y que dichas diferencias se asocian a cambios regionales de la composición de las placas ateroescleróticas adyacentes, particularmente en cuanto a la presencia de inflamación coronaria. 14,15,16
En paralelo, existe una estrecha relación entre la esteatosis hepática (EH), la ateromatosis coronaria, y el riesgo cardiovascular. La EH es la enfermedad hepática crónica más frecuente, con prevalencia estimada entre el 20% y el 30% de la población general y la segunda causa de trasplante hepático. 17 La EH se encuentra asociada de forma estrecha con los distintos componentes del síndrome metabólico. 18 Asimismo, estudios recientes han demostrado una relación entre la EH y la grasa visceral. 4 Sin embargo, se desconoce si la EH ejerce un papel activo en el desarrollo y progresión de la ateromatosis, o si su presencia solo refleja la coexistencia de otros marcadores de riesgo cardiometabólico.
Considerando que el riesgo cardiovascular residual a pesar de la implementación de las mejores estrategias de prevención se atribuye en parte a inflamación coronaria, la incorporación de herramientas de monitoreo y de marcadores de vulnerabilidad que permitan valorar tanto la inflamación aguda como los cambios crónicos vasculares y perivasculares es altamente deseada. 19,20,21
Limitaciones de los marcadores generales de obesidad
La morbimortalidad cardiovascular en pacientes obesos es más elevada que la población general; esto está vinculado en mayor medida a su asociación con múltiples FRC. 22,23 Sin embargo, los marcadores generales de adiposidad como el índice de masa corporal (IMC) presentan numerosas limitaciones, que, en su conjunto, han llevado a resultados inconsistentes e, incluso, divergentes en cuanto a su capacidad de predicción de eventos. En efecto, numerosos estudios han demostrado una relación negativa entre el IMC y la enfermedad coronaria, así como una debatible asociación entre la obesidad y la sobrevida, particularmente en adultos mayores. 24,25 Este comportamiento controvertido o paradójico se debe en parte a la defectuosa definición de obesidad basada en el IMC, un índice de adiposidad pobre al ser un subrogante más del peso que de la grasa corporal, y al no poder discriminar la proporción de los distintos depósitos regionales de grasa corporal vinculados con perfiles cardiometabólicos y pronósticos divergentes. 26,27,28 Incluso la circunferencia abdominal presenta limitaciones y en ocasiones resultados contradictorios con respecto a su valor predictivo. 29,30 Esto posiblemente se atribuya a que la obesidad abdominal fue originalmente definida no por su relación con el riesgo de eventos, sino a partir del IMC como valor de referencia, y a que, a pesar de ser una aproximación a la estimación de la grasa abdominal, no logra distinguir entre grasa subcutánea y visceral. Esta disquisición previamente ignorada es fundamental en vistas de la evidencia actual, ya que, por ejemplo, solo la grasa visceral (y no así la subcutánea) se asocia a la incidencia de insuficiencia cardíaca con función sistólica preservada (ICFSP). 31
Aspectos fisiopatológicos de la grasa epicárdica
Además de adipocitos, el tejido adiposo está formado por células estromales (fibroblastos e inflamatorias), y por tejido intersticial. El tejido adiposo produce una gran cantidad de moléculas que regulan numerosos aspectos fisiológicos de los tejidos adyacentes, incluidas citoquinas proinflamatorias y antiinflamatorias, metabolitos de ácidos grasos, y especies reactivas de oxígeno. 32 El TAE, con respecto a otros tejidos adiposos viscerales, se caracteriza por presentar un aumento en la síntesis y catabolismo de ácidos grasos, por lo que ha sido propuesto como grasa buffer que sirve para proteger el corazón contra la esteatosis cardíaca generada por los AGL. 33 Sin embargo, ante la expansión e inflamación del TAE, el “diálogo” entre ambos tejidos se alteraría con interacción entre adipocitoquinas proinflamatorias y el depósito de grasa intramiocárdica, que también acompaña el proceso de insulino-resistencia (IR). 34 Recientemente, hemos demostrado que el TAE de pacientes con enfermedad coronaria y diabetes tipo II presenta mayor actividad de las enzimas encargadas del catabolismo de las lipoproteínas ricas en triglicéridos, lo que promovería un mayor flujo de AGL al interior del tejido, favoreciendo su expansión. 5
El TAE, particularmente el perivascular, actúa sobre las arterias coronarias de forma paracrina, regulando múltiples aspectos de la biología vascular que incluyen la inflamación (con secreción de citoquinas proinflamatorias como el IL-1β, IL-6, y TNF-α; y de quimioquinas como la MCP-1), el tono vascular, el estrés oxidativo, y la producción local de óxido nítrico (Figura 1). 32,35,36 En cuanto a la inflamación, el TAE puede secretar adipoquinas tanto proinflamatorias (leptina, resistina) como antiinflamatorias (adiponectina), dependiendo el balance entre estas del grado de inflamación y expansión del tejido. Existe evidencia reciente que sugiere que la grasa perivascular (GPV) podría actuar como termómetro de las placas ateroescleróticas subyacentes, registrando cambios locales en el estrés oxidativo y actuando en consecuencia (por ejemplo, secretando adiponectina ante la presencia de un incremento del estrés oxidativo). Además, ante la presencia de inflamación coronaria local y de la consecuente difusión de citoquinas hacia el intersticio perivascular, se reduce el contenido lipídico de los adipocitos (y se incrementa la fase acuosa/edema de la GPV). 37 Por lo tanto, existe una íntima relación entre las arterias coronarias y el TAE, no solo anatómica, sino en cuanto a aspectos fisiológicos bidireccionales (Figura 1). En presencia de un TAE expandido y disfuncional, el efecto proinflamatorio de la grasa epicárdica se ejerce no solo sobre el vaso subyacente, sino que los mediadores proinflamatorios son también liberados al torrente sanguíneo, y si bien el volumen de TAE es mucho menor que el del tejido adiposo visceral abdominal, contribuye también al estado proinflamatorio sistémico. Asimismo, completando el ciclo bidireccional descripto, la inflamación sistémica promueve la acumulación e inflamación de grasa epicárdica. 38 No es casual que, en los pacientes con enfermedades vinculadas a inflamación sistémica, como la psoriasis, artritis reumatoidea, VIH u obesidad, puedan observarse incrementos significativos del TAE. 39,40,41
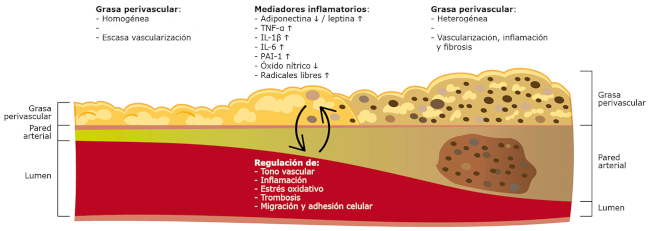
Fig. 1 Función de la grasa perivascular (GPV) en el desarrollo y progresión de la enfermedad coronaria. En el vaso sano, la GPV es homogénea, con adipocitos ricos en lípidos (escaso líquido), escasa vascularización y mínimas células inflamatorias. A medida que se desarrollan las lesiones, la GPV se vuelve heterogénea, los adipocitos reducen su tamaño en virtud de la disminución del contenido lipídico y de una menor diferenciación celular, con incremento de la fase acuosa, y se evidencian incremento de la vascularización, de células inflamatorias (incluida polarización de los macrófagos hacia una mayor concentración de macrófagos activados, M1), y fibrosis. En cuanto a la íntima, se va desarrollando un núcleo lipídico-necrótico con células espumosas y microcalcificaciones, y se evidencia adelgazamiento tanto de la media (con remodelamiento coronario positivo) como de la cubierta fibrosa. Estos fenómenos bidireccionales (desde la pared arterial hacia la GPV, y viceversa) son mediados por múltiples sustancias vasoactivas que regulan el tono vascular, la inflamación, el estrés oxidativo, la coagulación (PAI-1). IL, interleuquina; TNF, factor de necrosis tumoral; PAI, inhibidor del activador del plasminógeno.
Uno de los aspectos más paradigmáticos y generadores de hipótesis al respecto de la asociación entre la grasa epicárdica y la ateromatosis proviene del estudio de los puentes musculares y de investigaciones en animales, a los que se les resecó la grasa epicárdica. Acerca de lo primero, la ausencia de ateromatosis en el segmento intramiocárdico es característica. 42 En un estudio en el que evaluamos anomalías coronarias por angiografía coronaria por tomografía computada (ACTC) que incluyó 109 puentes musculares, ninguno de los segmentos intramiocárdicos presentó signos de ateromatosis, a pesar de la presencia de enfermedad en el 65% de los vasos hospederos. 43 En un elegante estudio que incluyó la resección de la grasa epicárdica adyacente al tercio medio de la arteria descendente anterior en cerdos bajo dieta aterogénica y evaluación seriada mediante ultrasonido intravascular, McKenney y cols. identificaron progresión de la ateromatosis de los segmentos proximales y distales, sin cambios significativos en el segmento intervenido, aislado del TAE. 44 Incluso, existe una polarización de los macrófagos encontrados en el TAE de pacientes con enfermedad coronaria en comparación con pacientes sin enfermedad coronaria; los primeros presentaron un mayor cociente de concentración entre macrófagos activados (M1) y aquellos con propiedades antiinflamatorias (M2). 45 En efecto, también se ha demostrado que el TAE de pacientes con enfermedad coronaria presenta mayor densidad vascular, infiltración de macrófagos y actividad de metaloproteasas (MMP) de tipo 2 y 9, principales enzimas encargadas de degradar las placas ateroscleróticas y vinculadas, además, al remodelamiento coronario (Figura 2). 46 En el TAE, estas enzimas participan de la expansión del tejido; si bien aún debe ser demostrado si son capaces de migrar hacia las placas ateroscleróticas subyacentes y aumentar su vulnerabilidad.
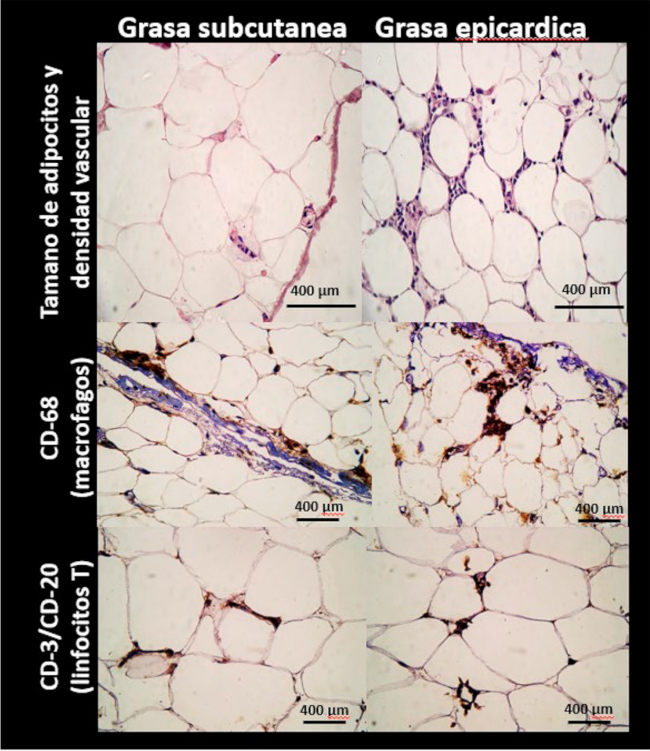
Fig. 2 Características histológicas e infiltrado inflamatorio de tejido adiposo epicárdico (región superior del ventrículo derecho) y subcutáneo (región torácica) obtenidos de pacientes con enfermedad coronaria derivados a cirugía de revascularización de miocardio. Los adipocitos del TAE son de menor tamaño y el tejido se encuentra más vascularizado que el TAS. Por inmunohistoquímica se comprueba que el TAE presenta infiltrado de macrófagos (CD68+) y de linfocitos T (CD 3/ CD20). La tinción marrón indica inmunohistoquímica positiva.
Por otra parte, y por razones que aún no se encuentran elucidadas, el tejido adiposo subcutáneo ha sido asociado a un menor riesgo de ateromatosis coronaria, periférica y de mortalidad. 47,48,49 En un trabajo seminal que incluyó pacientes con cirugía electiva de revascularización de miocardio, Mazurek y cols. recolectaron muestras pareadas de TAE adyacentes al tercio proximal de la arteria coronaria derecha y del tejido celular subcutáneo adyacente a las venas safenas, y compararon la expresión de distintos marcadores inflamatorios. 50 En dicho estudio, el TAE mostró niveles significativamente mayores de mediadores inflamatorios que la grasa subcutánea, que incluyen IL-1, IL-6, TNF-α, MCP-1, independientemente de la presencia de obesidad, diabetes o de la medicación de base. En cuanto al contenido celular, se identificaron engrosamientos septales e infiltrados celulares inflamatorios en el TAE, incluidos linfocitos T, macrófagos y mastocitos; mientras que no se identificaron células inflamatorias en la grasa subcutánea. Además, no se identificaron asociaciones entre dicha inflamación local y los niveles plasmáticos de citoquinas.
Recientemente, el estudio molecular y lipidómico de biopsias de TAE demostró que los pacientes con enfermedad coronaria presentan un perfil lipidómico con predominio de lípidos proinflamatorios, con mayor concentración de ceramidas, diglicéridos (saturados y monoinsaturados) y monoglicéridos que los pacientes sin enfermedad coronaria. 51
Por lo tanto, el TAE funciona como un órgano endocrino íntimamente relacionado con el riesgo cardiovascular a través de la regulación de la inflamación.
En paralelo, en un estudio poblacional que incluyó 3291 individuos asintomáticos con edad media de 50 años, Sung y cols. identificaron una asociación entre medidas de grasa visceral (TAE, grasa periaórtica y EH) y la presencia de marcadores inflamatorios como la proteína C reactiva y el cociente neutrófilos/linfocitos. 4 Además, ese trabajo demostró una asociación entre la gravedad de la EH y otros marcadores de adiposidad visceral como marcadores inflamatorios.
Aspectos fisiopatológicos de la esteatosis hepática
La EH es el resultado de la acumulación de triglicéridos sintetizados en el hígado, a partir de AGL liberados del tejido adiposo (lipólisis), de exceso de carbohidratos (lipogénesis de novo) o de los triglicéridos provenientes de la dieta. 52 El hígado graso no alcohólico (HGNA) se define como la presencia de esteatosis (>5% de hepatocitos por histología) en ausencia de causas secundarias que puedan generarlo, como consumo crónico de alcohol, infección crónica por hepatitis virales, consumo de medicamentos (ej. corticoides, metotrexato, valproato, etc.) o enfermedades hepáticas autoinmunes. 53 El mecanismo fisiopatológico subyacente para el desarrollo de HGNA se relaciona con alteraciones en el metabolismo intermedio (lípidos y glucosa) y con la IR 18. La insulina es la hormona lipogénica y, en condiciones normales, suprime la producción hepática de glucosa, principalmente eliminando la gluconeogénesis hepática. 54 La IR es mayor en los individuos con HGNA y cumple un papel central en el desarrollo y progresión de la enfermedad. 55) En los pacientes con esteatosis existe una mayor producción hepática de glucosa, en particular a partir de la gluconeogénesis, a pesar de los niveles elevados de insulina. 56 Una de las consecuencias de la IR es el aumento de la lipolisis periférica, principalmente en el tejido adiposo visceral, con aumento de los niveles séricos de AGL, que lleva a un incremento de lípidos tóxicos para el hepatocito, como los diaacilgliceroles y ceramidas, que están involucrados en vías inflamatorias. El espectro histológico del HGNA se extiende desde esteatosis simple, esteatohepatitis, fibrosis y cirrosis (Figura 3).
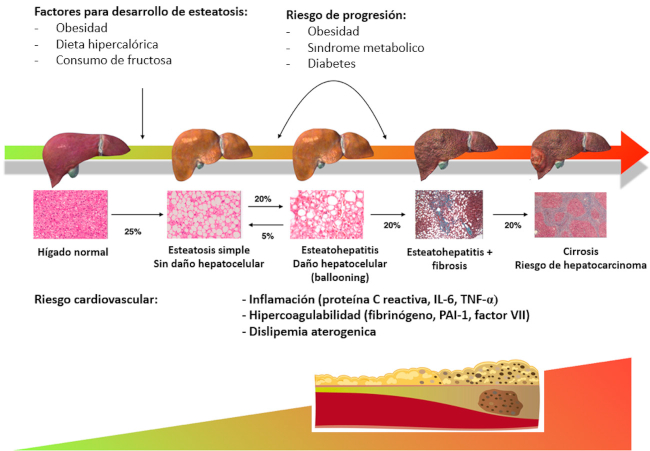
Fig. 3 Historia natural del hígado graso no alcohólico (HGNA). Se resumen los principales factores de riesgo que condicionan el desarrollo de esteatosis: obesidad, dieta hipercalórica y el consumo de fructosa (componente del azúcar y principal componente de jarabe de maíz de alta fructosa). Los factores que favorecen el desarrollo de esteatohepatitis, fibrosis y cirrosis son la obesidad, los componentes del síndrome metabólico y la diabetes. En el panel inferior, se grafica la relación entre la progresión del HGNA, la aterogénesis y el riesgo de evento cardiovasculares. A medida que progresa la enfermedad hepática aumentan los marcadores de inflamación, factores procoagulantes y lípidos aterogénicos que favorecen el desarrollo de ateromatosis y eventos cardiovasculares.
Si bien el mecanismo no se encuentra del todo elucidado, se cree que la asociación entre el HGNA y la ateroesclerosis se vincula a múltiples factores que implican en distinta medida a la IR, alteración del metabolismo lipoproteico, inflamación de bajo grado, estrés oxidativo, y una disminución de las concentraciones de adiponectina (Figura 3). 57,58,59
La activación de la vía NF-kB en pacientes con esteatohepatitis conduce un aumento en la transcripción de diversos genes proinflamatorios. 60 En la misma línea, numerosos marcadores inflamatorios (proteína C reactiva, IL-6 y TNF-α), oxidativos y procoagulantes (PAI-1, fibrinógeno y factor VII) se encuentran elevados en los pacientes con esteatohepatitis. 61 En un reciente subanálisis del estudio poblacional Multi-Ethnic Study of Atherosclerosis (MESA), que incluyó 668 individuos asintomáticos con HGNA, de los múltiples biomarcadores evaluados (que incluyeron la proteína C reactiva), la IL-6 fue la única identificada como predictor independiente tanto de calcificación coronaria (CAC > 0) como de calcificación coronaria moderadamente extensa (CAC >100). 62 En paralelo, y en línea con los mecanismos descriptos de la grasa epicárdica (Figura 1), los niveles elevados del inhibidor del activador tisular del plasminógeno-1 (PAI-1) en la adultez temprana se asocian de forma independiente con el HGNA en la mitad de la vida. 63
Evaluación de la grasa epicárdica por métodos de imágenes
La grasa epicárdica puede ser cuantificada en distinta medida mediante múltiples métodos no invasivos, que incluyen el ecocardiograma transtorácico, la resonancia magnética (RM), la TC, y el PET; la TC sin contraste es el método de referencia debido a su rapidez, disponibilidad, mayor resolución especial, y adquisición volumétrica (Figuras 4 y 5). 64
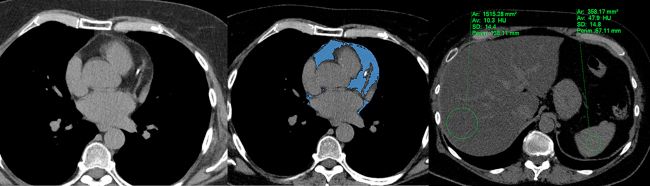
Fig. 4 Cuantificación de la grasa epicárdica, evaluación de la calcificación coronaria e identificación de esteatosis hepática mediante TC de tórax convencional. Nótese la presencia de calcificación en la arteria descendente anterior, con incremento del volumen de la grasa epicárdica (en azul), y esteatosis hepática grave (10 UH, con cociente hígado/bazo de 0,21).
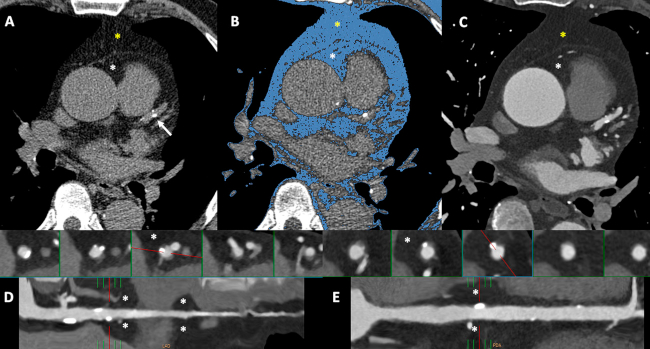
Fig. 5 Score de calcio (paneles A y B) y angiografía coronaria por TC (paneles C-E) en un paciente de sexo masculino de 72 años, hipertenso, con dolor precordial atípico. Tanto el estudio sin contraste (score de calcio) como la angiografía permiten discriminar entre la grasa epicárdica (asterisco blanco) y la grasa paracardíaca (asterisco amarillo), así como calcular su volumen y densidad. Las reconstrucciones multiplanares de las arterias descendente anterior (panel D) y coronaria derecha (panel E) se utilizan para la valoración de la grasa perivascular (asterisco).
La identificación sencilla de la grasa epicárdica mediante la TC (oscilando el límite inferior entre -190 y -250, y el superior entre -30 y -50 unidades Hounsfield) ha llevado al desarrollo de herramientas que permiten la valoración automática del volumen de grasa epicárdica (VGE) utilizando algoritmos de inteligencia artificial con una precisión comparable a revisores expertos. 65 Los límites para la evaluación del VGE no se encuentran bien establecidos, si bien la mayoría de los estudios utiliza la bifurcación de la arteria pulmonar o el punto situado 15 mm por encima del borde craneal del tronco coronario izquierdo como límite superior y el diafragma como el límite inferior. 64 La evaluación del VGE puede realizarse utilizando tanto adquisiciones de TC cardíaca sin contraste (score de calcio) como mediante ACTC (con contraste), y se sugiere en este último caso subir el umbral de detección a -15 UH, ya que los estudios contrastados suelen subestimar la grasa en aproximadamente un 30%. 64,66 Se ha demostrado, además, que las TC de tórax sin contraste convencionales (sin gatillado electrocardiográfico) (Figura 4) son igualmente reproducibles y presentan el mismo valor predictivo que los estudios gatillados (Figura 5). 67,68
Debe mencionarse que el tejido adiposo pericárdico (TAP) incluye tanto el TAE como el paracardíaco (fuera del saco pericárdico). Si bien de valoración más sencilla, estrechamente relacionado con el TAE y con valor pronóstico demostrado en numerosos estudios prospectivos, existen diferencias significativas entre el tejido adiposo paracardíaco y epicárdico en cuanto a su embriología y composición. 16,69
Sea cual fuera la estrategia de medición escogida, una de las mayores limitaciones del uso del VGE como marcador de riesgo en la práctica clínica es la ausencia de estandarización de los valores normales y distintos puntos de corte, habiéndose reportado diferencias significativas según poblaciones, sexo y superficie corporal. 68,70
Evaluación no invasiva de la esteatosis hepática
Existen múltiples métodos no invasivos para la identificación de EH, con distinta precisión, disponibilidad, costo, sensibilidad y especificidad. 71 El ultrasonido convencional es una herramienta ampliamente disponible y de bajo costo, sumamente útil para el tamizaje (screening) mediante evaluación cualitativa. Sin embargo, es de baja sensibilidad para detectar esteatosis histológica menor del 20%. La TC, de similar sensibilidad, es más específica y permite, además, cuantificar la esteatosis y detectar esteatosis focal. En estudios sin contraste, los niveles de atenuación normales del hígado son de entre 50 UH y 65 UH, y generalmente 8 UH a 10 UH más elevados que el bazo. Se han utilizado distintos puntos de corte para el diagnóstico de EH; los más aceptados son los niveles de atenuación menores que un límite de entre 48 UH y 51 UH (y menores que el bazo). El grupo del estudio MESA, entre otros, utiliza una definición más sencilla que consiste en la presencia de un cociente de atenuación hígado (UH)/bazo (UH) < 1. 62 Una atractiva particularidad de la TC es la capacidad de evaluar dentro de un mismo escaneo la porción superior/cúpula del parénquima hepático, la extensión y distribución de la calcificación coronaria y el TAE (Figura 4).
La RM es el método de mayor precisión para la evaluación de la EH, si bien presenta menor disponibilidad, mayor costo y tiempo de adquisición, y dificultad para la evaluación de pacientes con IMC muy elevado o con claustrofobia. Cada una de estas tres modalidades ha evolucionado en los últimos años, y se han desarrollado técnicas específicas para la evaluación del HGNA, que exceden el presente artículo.
Relación entre grasa epicárdica y cardiopatía no coronaria
Algunos estudios han descripto una relación entre el TAE y la fibrilación auricular (FA). 10,72 Si bien de mecanismos aún no definidos, ha sido atribuida a mecanismos probablemente mixtos vinculados en distinta medida no solo a la difusión de los productos proinflamatorios mencionados, sino a compresión mecánica externa con disminución de la complacencia, y a la afectación de propiedades diastólicas ventriculares a partir de fibrosis miocárdica. 38,73 En un estudio que incluyó pacientes en plan de ablación, el volumen de grasa pericárdica (VGP) se asoció con la presencia y gravedad de la FA, así como de recurrencia; independientemente de parámetros generales de obesidad. 74 En paralelo, en un estudio reciente, van Woerden y cols. identificaron un mayor volumen de TAE en pacientes con ICFSP comparados con un grupo control, independientemente del IMC. Además, el TAE se asoció a la presencia de diabetes tipo 2, a la FA, y a diversos marcadores inflamatorios. 75 Se ha postulado incluso que la ICFSP con frecuencia identificada en pacientes obesos se puede atribuir a la presencia de disfunción microvascular y alteración de la relajación miocárdica vinculadas en distinta medida a la fibrosis miocárdica, dilatación y FA, y estado proinflamatorio observado en estos pacientes y asociado a un incremento del TAE. 76 El reciente hallazgo de una correlación significativa entre el TAE y tanto el contenido lipídico del miocardio como la fibrosis intersticial sugiere que efectivamente el TEA infiltra de algún modo el miocardio. 77
Además, el TAE inflamado puede sintetizar aldosterona, que, a su vez, no solo perpetúa el estado inflamatorio y promueve la fibrosis, sino que también promueve la sobrecarga de volumen, lo que empeora en conjunto la ICFSP. 38
Relación entre los depósitos grasos regionales, ateromatosis y eventos
La evidencia que vincula al TAE con marcadores de ateromatosis es consistente. Incluso algunos estudios sugieren que la ateromatosis acelerada comúnmente presente en pacientes VIH positivos podría atribuirse a la observación de un TAE aumentado en esta población. 78 Recientemente demostramos una relación significativa entre la grasa pericárdica y visceral con la carga de placa ateroesclerótica coronaria y extracoronaria, mientras que los marcadores generales de adiposidad, incluso el volumen de grasa corporal total calculada por TC, no se relacionaron con la carga ateroesclerótica. 49 Estos hallazgos se encuentran en línea con una gran cantidad de estudios que demostraron relaciones entre el TAE, y no los depósitos grasos generales, con marcadores de ateromatosis coronaria y extracoronaria independientemente de los FRC. 1,3 En el Heinz Nixdorf Recall Study, que incluyó 4093 individuos de entre 45 y 75 años sin enfermedad cardiovascular conocida, los sujetos con TAE en el cuartil superior presentaron un riesgo significativamente mayor de eventos duros tras un seguimiento medio de 8 años, incluso tras el ajuste según FRC (HR 1,54; 95% CI 1,09-2,19) y del score de calcio (HR 1,50; 95% CI 1,07-2,11). 79 Este último hallazgo, en línea con resultados de otros estudios, apoya el concepto de que la relación entre la grasa epicárdica y los eventos vasculares tendría mecanismos distintos a los del riesgo vinculado a la calcificación coronaria. En una cohorte que incluyó 998 individuos de entre 45 y 85 años del estudio MESA, se encontró una asociación significativa entre el VGP y el riesgo de eventos coronarios, independientemente de los FRC y del IMC (HR 1,26; 95% CI 1,01, 1,59), mientras que no se registraron relaciones significativas entre eventos e IMC o circunferencia abdominal. 80 En el Rancho Bernardo Study, un estudio de menor tamaño (n = 343), pero de seguimiento a 12 años, los pacientes con VGP en el tertil superior presentaron un riesgo de mortalidad global 2,6 veces mayor que aquellos en el tertil inferior, independientemente de los FRC. 81 El estudio EISNER demostró en 456 individuos asintomáticos con edad media de 60 años, una relación significativa entre el TAE y la calcificación coronaria. 82 La capacidad predictiva del VGP evaluada por TC de tórax convencional también ha sido demostrada. En una cohorte retrospectiva que incluyó 1250 pacientes con TC de tórax clínicamente indicada, identificamos al VGP como predictor independiente de mortalidad de toda causa. 68
Relación entre la composición de la grasa y la manifestación de eventos
La ACTC permite la evaluación de características de placas de alto riesgo (PAR), como el remodelamiento positivo, placas de baja atenuación (<30 UH), signo de realce en anillo y microcalcificaciones. 83 Recientemente, Nerlekar y cols. publicaron un metaanálisis donde demostraron una relación entre la extensión de TAE y la presencia de PAR (OR 1,19 [95% CI 1,06-1,33]). 84
Sin embargo, se estima que los cambios estructurales tanto coronarios como de la GPV pasibles de visualización mediante métodos como la TC indicarían estadios un poco más avanzados de la enfermedad que los cambios moleculares o funcionales. Esto ha llevado a la búsqueda de métodos no invasivos que permitan una detección más precoz de cambios metabólicos. Se ha mencionado antes que la distribución y composición del TAE no es homogénea, y que se asocia a la presencia y distribución de ateromatosis y al riesgo de eventos. Estos gradientes locales pueden ser discriminados con precisión por TC mediante la medición de la densidad (UH) de la GPV (la grasa de mayor densidad, más cercana al cero, reflejaría en distinta medida un menor contenido lipídico y la presencia de edema, mayor vascularización o fibrosis). 14,15,16
Goeller y cols. reportaron niveles de atenuación de la GPV significativamente más elevados en lesiones culpables de pacientes con síndrome coronario agudo comparado con lesiones no culpables (−69,1 UH vs. −74,8 UH; p= 0,01) e, incluso, comparado con lesiones graves de controles (-76,4 UH; p= 0,01). 85
Se cree que estos cambios en la composición de la GPV (Figura 1) detectables por TC preceden a la formación de placas coronarias, y es de gran importancia la detección precoz, ya que la mayor parte de las roturas de placa y de eventos coronarios en general tienen como sustrato lesiones no obstructivas. 14,15,83 En relación con esto y a partir de análisis complejos que incluyeron estudios genéticos, inmunomarcadores y evaluaciones tomográficas avanzadas (asistidos y posteriormente entrenados mediante herramientas de machine learning) basados en biopsias de cirugías cardíacas, con validación posterior en grandes estudios prospectivos; se identificaron patrones de atenuación de grasa pericoronaria (FAI) y un perfil radiotranscriptómico de la textura de la grasa pericoronaria (PRG) que reconocerían la presencia de inflamación coronaria. 15
Utilizando dos grandes cohortes prospectivas de poblaciones completamente diferentes, este grupo de investigadores de Oxford validó al FAI como un marcador de inflamación coronaria asociado a mal pronóstico (Figura 6). En el estudio CRISP-CT, una FAI mayor (menos negativo) de -70 UH fue identificado como un robusto predictor de mortalidad cardíaca y de toda causa, independientemente de la demografía, del TAE, de la extensión de ateromatosis, y de la presencia de PAR. 14 En dicho estudio, el FAI, validado también contra el PET-TC, predijo la manifestación de eventos mayores incluso antes del desarrollo de placas. 37 El FAI (Figura 6) es un marcador no solo sensible, sino también dinámico de la inflamación coronaria, habiéndose demostrado su reducción con la administración de estatinas y aspirina. 14 La presencia de cambios crónicos en la GPV, vinculada a fibrosis y remodelamiento microvascular, puede ser valorada mediante la evaluación del perfil radiómico de la textura de la grasa asistido mediante algoritmos de machine learning (PRG). 86

Fig. 6 A. Atenuación de la grasa pericoronaria (FAI) de los segmentos proximales de los tres vasos coronarios epicárdicos principales, con los mapas de FAI correspondientes. B. Ejemplo del fenotipo de la FAI pericoronaria alrededor del tercio proximal de la arteria coronaria derecha. Se definió a la grasa pericoronaria como a la grasa localizada a una distancia radial igual al diámetro (d) del vaso. HU: unidades Hounsfield, LAD: arteria descendente anterior, LCx: arteria circunfleja, RCA: coronaria derecha. (De: Oikonomou EK, et al. Lancet 2018, 392(10151):929-939).
Estas características fueron validadas en 1575 pacientes del SCOT-HEART trial, donde mejoraron la predicción de eventos mayores más allá de los FRC, del score de calcio, y de la gravedad y PAR determinadas por la ACTC. 15 Debe destacarse que tanto el FAI, que refleja cambios agudos (inflamación), como el PRG, que indica cambios estructurales crónicos, se obtienen a partir de adquisiciones convencionales de ACTC. Por lo tanto, estos métodos complementarios posiblemente puedan combinarse en un único estudio junto con las múltiples evaluaciones conocidas (y con valor pronóstico independiente) de la ACTC.
Relación entre la esteatosis hepática y el riesgo cardiovascular
La EH simple tiene un buen pronóstico. Sin embargo, los pacientes que desarrollan esteatohepatitis tienen mayor riesgo de progresar a enfermedad hepática crónica (fibrosis/cirrosis). 87 La edad (> 50 años), la diabetes tipo II, la obesidad y el síndrome metabólico se han identificado como factores asociados a la progresión de esteatosis simple a esteatohepatitis. 88 En pacientes con HGNA, la enfermedad cardiovascular es la causa más frecuente de muerte independientemente de los estadios de la enfermedad hepática. 89 Dicho incremento del riesgo cardiovascular ha sido vinculado a diversos mecanismos, que incluyen la promoción de la ateromatosis, arritmias y disfunción sistólica y diastólica. A pesar de ello, sigue vigente la controversia acerca de si la asociación entre HGNA y la enfermedad cardiovascular es una consecuencia de los múltiples factores de riesgo que comparten o si en su defecto el HGNA contribuye independientemente a la enfermedad cardiovascular. Además, si bien la esteatohepatitis se asocia a un incremento del riesgo de eventos, esta relación no se encuentra bien establecida en cuanto a la esteatosis simple 90.
En un reciente metaanálisis que incluyó 85 395 pacientes de 26 estudios, el HGNA se asoció de forma independiente con la presencia de ateromatosis subclínica evaluada por Doppler carotídeo, score de calcio, rigidez arterial o disfunción endotelial (OR 1,6; 95% CI 1,45-1,78). 91 En particular, en los 13 estudios que incluyeron 12 269 pacientes evaluados mediante Doppler carotídeo, el HGNA se asoció a un mayor riesgo de estudios patológicos (OR 1,74; 95% CI 1,47-2,06; p < 0,00001); y, en los 7 estudios que incluyeron 29 531 pacientes con TC sin contraste, el HGNA se asoció a un incremento en el score de calcio (OR 1,40; 95% CI 1,22-1,60; p = 0,02). En otro metaanálisis, que incluyó 16 estudios y 34 043 pacientes y una mediana de seguimiento de 6,9 años, Tagher y cols. identificaron una asociación significativa entre el HGNA y la manifestación de eventos cardiovasculares fatales o no fatales (HR 1,64, 95% CI 1,26-2,13). 92 Además, los pacientes con HGNA grave (esteatosis y fibrosis) presentaron un incremento mayor en la mortalidad de origen cardiovascular (OR 3,28, 95% CI 2,26-4,77), posiblemente vinculado a inflamación crónica. 92
Perspectivas futuras
Una de las características interesantes del HGNA y diferenciales con respecto a la enfermedad coronaria es su carácter dinámico y, en cierta medida, reversible. Un descenso del 3% del peso corporal se asocia a mejoría histológica en los pacientes con HGNA, si bien para que tenga impacto en la EHNA y la fibrosis el descenso de peso debe ser mayor del 7% y 10%, respectivamente. A pesar de eso, aún se encuentra abierta la pregunta acerca de si la reducción en la esteatosis podría utilizarse como un marcador de reducción de riesgo cardiovascular.
Un aspecto interesante de la relación entre los depósitos grasos y los eventos cardiovasculares es la diferencia entre sexos. Es conocida la relación entre el sexo masculino y el riesgo de enfermedad cardiovascular. Si bien todavía no encuentran establecidos los mecanismos que los vinculan, las diferencias de riesgo entre sexos podrían atribuirse a que, a pesar de tener mayor contenido graso, las mujeres presentan una proporción de grasa visceral significativamente menor que los hombres, con mayor grasa subcutánea. 93 En conjunto, la evaluación de la extensión y composición de los depósitos grasos regionales podrían en un futuro próximo no solo ayudar a elucidar dichas diferencias de género, sino a mejorar y personalizar la estratificación de riesgo, identificando pacientes con riesgo residual elevado vinculado a inflamación. Entre todos los métodos diagnósticos disponibles, teniendo en cuenta su precisión, valoración cuantitativa y cualitativa, costo y disponibilidad; posiblemente la TC emerja como la modalidad más apropiada para la estratificación de riesgo, particularmente al permitir la evaluación conjunta de depósitos grasos y extensión de ateromatosis.
En cuanto a su factibilidad, la emergente incorporación de herramientas de cálculo automático asistidas por machine learning posiblemente permitan mediciones consistentes y reproducibles, independientemente del tipo de adquisición e interpretación, lo que facilitará su incorporación a la práctica clínica en un futuro próximo. 65
A pesar de las asociaciones descriptas con la ateromatosis y con el riesgo cardiovascular, la grasa epicárdica y el HGNA son raramente considerados como marcadores de riesgo en la práctica clínica. Si bien no hay dudas a partir del estudio bioquímico, del riesgo que estos tejidos implican a la salud cardiovascular, la complejidad e inaccesibilidad para evaluarlos a partir de muestras de tejido dificulta su estudio. En virtud de la posibilidad de evaluarse de forma simultánea y complementaria dentro de una única modalidad de imagen no invasiva, como en el caso del score de calcio o la ACTC, podrían convertirse en un futuro próximo en herramientas pronósticas que permitan reflejar tanto el estado actual cardiometabólico y cambios dinámicos/ reversibles (esteatosis), como la presencia de cambios estructurales crónicos (calcificación coronaria). Parte de este carácter dinámico y diferencial entre la EH y el TEA se reflejó en un estudio reciente realizado con una población de 1250 pacientes de entre 35 y 74 años con TC de tórax sin contraste, donde, a pesar de encontrar asociaciones significativas entre la EH y tanto la calcificación coronaria (CAC) como el VGP, los únicos predictores de mortalidad de toda causa fueron la CAC y el VGE. 68















