INTRODUCCIÓN
El uso de estatinas para reducir los niveles de colesterol unido a las lipoproteínas de baja densidad (C-LDL) y así disminuir los eventos cardiovasculares constituye uno de los pilares en la prevención cardiovascular.
En el contexto de la prevención secundaria, la evidencia proveniente de los grandes ensayos aleatorizados con estatinas demuestra que la disminución del C-LDL reduce la mortalidad cardiovascular, la incidencia de infarto agudo de miocardio (IAM) y de accidente cerebrovascular (ACV) y la necesidad de revascularización. 1,2,3,4
En los últimos años, se diseñaron estudios para evaluar la hipótesis de que con un tratamiento más intensivo con estatinas se podría lograr un beneficio mayor. Algunos de esos ensayos incluyeron específicamente pacientes con síndrome coronario agudo (SCA). 5,6 Un metaanálisis mostró que el tratamiento intensivo con estatinas de alta potencia en comparación con un tratamiento menos intensivo se asoció con una reducción significativa de los eventos cardiovasculares mayores. 7
Teniendo en cuenta la evidencia generada durante las últimas dos décadas, diferentes guías de práctica clínica establecieron recomendaciones sobre el manejo lipídico, con constantes actualizaciones y, en ocasiones, cambios radicales. En la mayoría de las guías actuales se advierte que se ha fortalecido la recomendación de administrar estatinas de alta intensidad durante la internación en los pacientes con SCA. 8,9,10 Asimismo, dado que la utilización de estatinas durante el período intrahospitalario mejora la adherencia al tratamiento a largo plazo, dicha recomendación se extendió a los pacientes que se internan para realizar una revascularización coronaria o vascular periférica programada. 11,12
Por otro lado, dado que la recomendación en pacientes de alto riesgo, además de proponer una meta terapéutica sugiere alcanzar una reducción >50% en el nivel de C-LDL, es importante medir sistemáticamente el C-LDL basal. La admisión es el momento más adecuado para evaluar el perfil lipídico basal del paciente con SCA. 13,14
Otro punto importante en el manejo luego de la externación es el monitoreo lipídico y los ajustes precoces del tratamiento que deben hacerse durante las primeras semanas después del evento agudo. 9,15 Algunos ensayos recientes realizados con drogas hipolipemiantes no estatínicas [(ezetimibe e inhibidores de la proproteína convertasa subtilisina kexina tipo 9 (iPCSK9)] en pacientes con enfermedad vascular establecida mostraron una relación directa entre los valores de C-LDL alcanzados y los eventos clínicos. 16,17,18 En consecuencia, las guías actuales consideran que se podría añadir otra droga hipolipemiante en aquellos pacientes que demuestran adherencia completa al tratamiento y se encuentran recibiendo la máxima dosis de estatinas tolerada, pero aun así, no logran alcanzar las metas terapéuticas. 8,9
Teniendo en cuenta estas consideraciones, el objetivo de nuestro trabajo fue analizar el tratamiento hipolipemiante indicado y verificar el cumplimiento de las metas lipídicas recomendadas durante la internación y en el seguimiento precoz, luego de aplicar en forma sistemática un algoritmo para el manejo lipídico basado en las recomendaciones actuales.
MATERIAL Y MÉTODOS
Se realizó un estudio observacional, unicéntrico y prospectivo, que incluyó en forma consecutiva a los pacientes internados en la unidad coronaria con diagnóstico de SCA con o sin elevación del segmento ST o con revascularización coronaria/periférica programada (quirúrgica o mediante angioplastia), entre el 15 de septiembre de 2019 y el 15 de enero de 2020. Se excluyeron los pacientes con imposibilidad de seguimiento en nuestro hospital.
Se identificaron algunas variables descriptivas, como los factores de riesgo cardiovascular al ingreso y la medicación pre- y posinternación.
Luego de una capacitación a los médicos encargados de la unidad coronaria, se aplicó de rutina un algoritmo para el manejo lipídico basado en las recomendaciones actuales. Dicho algoritmo incluyó las siguientes pautas:
Solicitar a todos los pacientes una medición de C-LDL en la admisión o durante las primeras 24 horas.
Junto con el refuerzo de las medidas higiénico-dietéticas, indicar estatinas de alta intensidad (atorvastatina 40-80 mg/día o rosuvastatina 20-40 mg/día) precozmente en la internación, siempre que fuera posible.
Solicitar un perfil lipídico 6 semanas luego del alta.
Realizar un control telefónico o por teleconsulta a las 6 semanas del alta para evaluar los resultados.
Si se confirmara la adherencia y el valor de C-LDL fuese >70 mg/dl, agregar ezetimibe. Si por algún motivo el paciente estaba recibiendo menos dosis de estatinas de la indicada, se recomendó ajustar la dosis.
Si se modificó el tratamiento en la primera consulta, solicitar un nuevo perfil lipídico a las 6 semanas de aquella (12 semanas desde el alta).
Control telefónico o por teleconsulta a las 12 semanas del alta para evaluar los resultados y considerar la necesidad de agregar un iPCSK9 si el valor de C-LDL era >100 mg/dl.
La elección de la meta de C-LDL <70 mg/l y del valor “umbral” de C-LDL >100 mg/dl para considerar la administración de un iPCSK9 se basó en los documentos publicados sobre el uso adecuado de estatinas e iPCSK9 por la Sociedad Argentina de Cardiología (SAC).. 10,19
Análisis estadístico
Los datos continuos entre dos grupos se analizaron con la prueba de la t o con la prueba de Mann-Whitney-Wilcoxon, según la distribución de las variables. El análisis de los datos categóricos se realizó con la prueba de chi cuadrado. Se definió estadísticamente significativo un valor de p <0,05 (pruebas de dos colas).
Se realizó un análisis bivariado comparando las variables entre la población que alcanzó la meta de C-LDL <70 mg/ dl y los pacientes que no cumplieron el objetivo. Se realizó posteriormente un análisis multivariado incluyendo en el modelo las variables que en el análisis bivariado mostraron una asociación significativa. Se expresó la fuerza de asociación como odds ratio (OR) con su respectivo intervalo de confianza del 95% (IC 95%).
RESULTADOS
Se incluyeron 292 pacientes (edad 70,3 ± 11,1 años; 81,4% hombres). El 23,9% y el 52,5% mostraron antecedentes de diabetes mellitus tipo 2 o enfermedad cardiovascular previa, respectivamente. Las características basales de la población pueden observarse en la Tabla 1.
Tabla 1 Características basales de la población
| Variable | N=292 | |
|---|---|---|
| Edad, años (media ± DS) | 70,3 ± 11,2 | |
| Sexo masculino, % | 81,4 | |
| Hipertensión arterial, % | 68,2 | |
| Diabetes mellitus tipo 2 | 23,9 | |
| Tabaquismo activo, % | 20,2 | |
| Enfermedad coronaria,% | 40,4 | |
| Enfermedad vascular periférica, % | 16,8 | |
| Enfermedad cerebrovascular, % | 4,5 | |
| Insuficiencia renal crónica, % | 12,3 | |
| Diagnóstico al ingreso,% | ||
| SCA sin elevación del segmento ST | 34,3 | |
| SCA con elevación del segmento ST | 13,4 | |
| Angioplastia coronaria programada | 21,2 | |
| Cirugía de revascularización miocárdica | 11,6 | |
| Enfermedad vascular periférica | 19,5 | |
| Tratamiento previo,% | ||
| Aspirina | 66,1 | |
| IECA/ARA II | 61,0 | |
| Beta bloqueantes | 55,6 | |
| Bloqueantes cálcicos | 22,2 | |
| Diuréticos | 16,5 | |
| Estatinas | 63,0 | |
| Ezetimibe | 9,6 | |
ARA II: antagonistas de los receptores de angiotensina II; DS: desvío estándar; IECA: inhibidores de la enzima convertidora de angiotensina; SCA: síndrome coronario agudo.
El nivel basal de C-LDL en la población total fue 103,0 ± 37,6 mg/dl. Dicho valor lipídico fue significativamente más elevado en la población que no estaba en tratamiento hipolipemiante (120,4 ± 31,8 mg/dl vs. 93,3 ± 37,2 mg/dl, p <0,001).
El 63% de los pacientes estaba ya en terapia con estatinas (30,1% recibía estatinas de alta intensidad). Asimismo, antes de la internación, el 9,6% de los pacientes recibía ezetimibe. Considerando el valor de C-LDL al ingreso, solo el 18,6% cumplía la meta de C-LDL <70 mg/dl.
Al momento del alta, todos los pacientes recibieron la indicación de estatinas. Se indicaron estatinas de alta intensidad en el 95,9% de los casos. Los esquemas más utilizados fueron los siguientes: rosuvastatina 40 mg (45,2%), atorvastatina 80 mg (28,4%), atorvastatina 40 mg (14,4%) y rosuvastatina 20 mg (7,9%). El 7,1% recibió ezetimibe al momento de la externación. Una representación gráfica de los esquemas hipolipemiantes registrados al ingreso y al momento del alta puede observarse en la Figura 1.
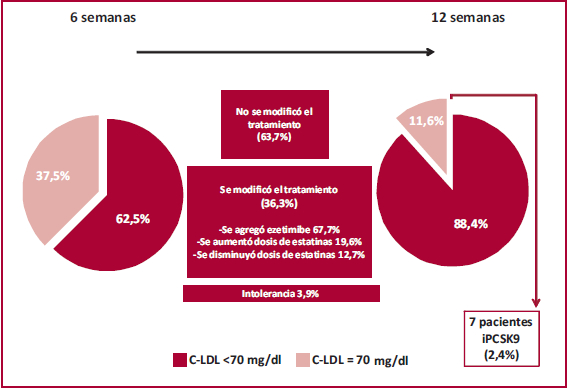
En el control a las 6 semanas, el 62,5% de los pacientes alcanzó la meta de C-LDL <70 mg/dl. Sin embargo, solo el 63,5% de dichos pacientes logró disminuir en más del 50% el valor de C-LDL con respecto al nivel basal.
Entre los pacientes que alcanzaron la meta de C-LDL a las 6 semanas, se observó una edad menor y una prevalencia mayor de sexo masculino, diabetes mellitus e hipertensión arterial. Asimismo, fue significativamente menor el nivel basal de C-LDL y significativamente mayor el uso previo de estatinas de alta intensidad en el grupo de pacientes que alcanzó la meta de C-LDL. (Tabla 2)
Tabla 2 Características de la población que alcanzó la meta de C-LDL a las 6 semanas en comparación con la que no logró ese objetivo lipídico
| Variable | C-LDL <70 mg/dl | C-LDL >70 mg/dl | p |
|---|---|---|---|
| Edad, años [media (DS) ] | 69,2 (11,2) | 72,0 (10,7) | 0,04 |
| C-LDL basal, mg/dl [media (DS)] | 91,5 (32,4) | 122,9 (37,8) | <0,0001 |
| Sexo masculino, % | 84,8 | 74,8 | 0,04 |
| Diabetes mellitus, % | 28,7 | 16,8 | 0,02 |
| Hipertensión arterial, % | 75,3 | 57,9 | 0,002 |
| Tabaquismo activo, % | 16,3 | 26,2 | 0,13 |
| Enfermedad cardiovascular previa, % | 55,1 | 52,3 | 0,65 |
| Insuficiencia renal crónica, % | 11,8 | 12,2 | 0,93 |
| Uso previo de estatinas, % | 64,5 | 62,9 | 0,79 |
| Uso previo de estatinas de alta intensidad, % | 58,9 | 33,3 | 0,001 |
| Uso previo de ezetimibe, % | 7,9 | 12,2 | 0,23 |
DS: desvío estándar.
En el análisis multivariado, el C-LDL basal más elevado (OR 0,97 IC 95% 0,96-0,98, p<0,001) y el antecedente de diabetes (OR 2,64 IC 95% 1,05-6,6, p=0,03) se asociaron significativamente con una menor y una mayor probabilidad de alcanzar el objetivo lipídico, respectivamente. En dicho control, no se modificó el esquema terapéutico en el 63,7% de los sujetos. Analizando el subgrupo de pacientes a los cuales se les modificó el tratamiento, se disminuyó o se aumentó la dosis de estatinas en el 12,7% y el 19,6% de los casos, respectivamente, mientras que se agregó ezetimibe en el 67,7% de los pacientes.
La intolerancia a las estatinas (miopatía) fue muy baja (3,9%); en todos los casos, fueron mialgias sin elevación de la creatinina-fosfoquinasa (CPK).
En el control a las 12 semanas, realizado en el subgrupo de pacientes que no había alcanzado la meta lipídica a las 6 semanas, el 69,1% de los sujetos alcanzó el objetivo de C-LDL (89,3% redujo en 50% o más dicho marcador lipídico). En ese control, considerando la adherencia, la posibilidad o no de ajustar el tratamiento basado en estatinas y/o ezetimibe y el valor umbral recomendado, se indicó un iPCSK9 en 7 pacientes (2,4% del total de la muestra).
Globalmente, a las 12 semanas, el 88,4% de toda la población alcanzó la meta de C-LDL (el 85,9% logró una reducción >50%).
La variación del tratamiento y el alcance de los objetivos lipídicos a las 6 y 12 semanas pueden observarse en la Figura 2.
DISCUSIÓN
Nuestro estudio describe, por primera vez en nuestro país, los resultados lipídicos en una población de pacientes de alto riesgo cardiovascular, luego de aplicar en forma sistemática un algoritmo para el manejo lipídico basado en las guías.
El primer punto que contempló el algoritmo fue administrar dosis elevadas de estatinas durante la internación. Las guías actuales recomiendan esta conducta, que se basa en los resultados de varios ensayos clínicos. El estudio MIRACL demostró que el uso de estatinas de alta intensidad en pacientes internados con un SCA, en comparación con placebo, se asoció con una reducción significativa de los eventos cardiovasculares a las 16 semanas. 20 En dicho estudio se indicaron las estatinas entre las 24 y 96 horas del ingreso. Los estudios PROVE-IT y TNT, desarrollados en pacientes con SCA y enfermedad coronaria estable, respectivamente, también demostraron un beneficio cardiovascular adicional al administrar estatinas de alta potencia. 5,21 Nuestros resultados mostraron que el 95,9% de los sujetos se externaron con la indicación de dosis adecuadas de estatinas. La elección del esquema hipolipemiante quedó a criterio del médico tratante.
El segundo punto incluido en el algoritmo fue contar con un valor de C-LDL basal, medido dentro de las primeras 24 h desde el ingreso. La importancia de este punto radica en que algunas guías recomiendan alcanzar una reducción del 50% o más en el nivel de C-LDL. En ese sentido, el ensayo REVERSAL mostró que el tratamiento intensivo con estatinas redujo la progresión de la aterosclerosis coronaria cuando la reducción del C-LDL alcanzó el 50%. 22 Por otro lado, conocer el valor de C-LDL al ingreso facilita el diagnóstico de hipercolesterolemia familiar. 23
Un tercer punto que incorporó este algoritmo es el seguimiento precoz. Varios autores han recomendado realizar controles cercanos en el tiempo luego del alta. 15,24 Esta estrategia permite, por un lado, verificar el cumplimiento de las metas lipídicas, pero, más importante aún, también permite ajustar el tratamiento, de ser necesario. En nuestra población, la aplicación del algoritmo determinó que el 62,5% de los pacientes alcanzaran la meta de C-LDL a las 6 semanas. La aparición de intolerancia por miopatía fue muy baja y, en todos los casos, sin elevación de la CPK. Sin embargo, alcanzar un valor de C-LDL <70 mg/dl no necesariamente implica lograr un descenso del 50% o más en dicho marcador. Los lineamientos seguidos contemplaron, como criterio para modificar el tratamiento, el objetivo de C-LDL <70 mg/dl. Esto fue así porque las recomendaciones de la SAC sugieren que la reducción porcentual del C-LDL es complementaria a la clásica meta lipídica. Las últimas guías europeas para el manejo del colesterol consideran que ambas condiciones deben cumplirse concomitantemente. 9 En consecuencia, los futuros algoritmos deberían considerar ambos datos al momento de tomar una decisión en cuanto al ajuste del tratamiento.
Nuestros hallazgos mostraron que las pacientes con un C-LDL basal más elevado alcanzaron menos frecuentemente la meta en el primer control. Esto es razonable dado que, ante una respuesta habitual acorde con la dosis, cuanto más alto es el valor inicial, más alto será el valor final. Por otro lado, la población con diabetes alcanzó más frecuentemente el objetivo lipídico. Este hallazgo se contrapone con lo que informan reportes previos, en donde los pacientes con diabetes mostraron una respuesta a las estatinas menor que la esperada (hiporrespondedores). 25 Los diabéticos podrían presentar una menor síntesis hepática de colesterol (respondiendo menos a las estatinas) y, en forma inversa, una mayor absorción intestinal. Sin embargo, otros autores han reportado que la correlación inversa entre la síntesis y la absorción de colesterol observada en los sujetos con trastornos metabólicos podría alterarse con la aparición de diabetes y llevar a una respuesta farmacológica no siempre homogénea. 26 En ese sentido, otro registro internacional que evaluó las metas de C-LDL (a los 6 y 12 meses) luego de indicar simvastatina 40 mg en forma sistemática demostró que la población con enfermedad coronaria y diabetes alcanzó más frecuentemente la meta lipídica en comparación con los sujetos con diabetes o con enfermedad coronaria, en forma separada. 27
Varios registros realizados en los últimos años mostraron que el tratamiento hipolipemiante y, en consecuencia, el cumplimiento de las metas lipídicas recomendadas es deficiente. La encuesta EUROASPIRE V, que analizó pacientes con antecedentes vasculares a los 6 meses de tener el evento, demostró que si bien el 80% estaba medicado con estatinas, solo el 50% de estos pacientes recibía las de alta intensidad. En consecuencia, el 71% de los sujetos tenía un C-LDL fuera de meta. 28 Recientemente, el estudio PURE demostró que el control de la dislipidemia es peor en los países pobres o de bajos ingresos. 29
En nuestro estudio, la modificación recomendada por el algoritmo en los pacientes que no alcanzaron la meta de C-LDL a las 6 semanas fue agregar ezetimibe (esto se efectivizó en el 67,7% de los sujetos que no alcanzaron la meta en el primer control). Dicha recomendación se fundamenta en el estudio IMPROVE-IT, el cual demostró que la asociación de ezetimibe y simvastatina comparada con la monoterapia con simvastatina en pacientes que habían tenido un SCA reciente se asoció con un modesto beneficio, a favor de los pacientes que recibieron la asociación, después de casi 7 años de tratamiento. 16
Siguiendo nuestro algoritmo, alrededor del 70% de los pacientes que no habían logrado el objetivo de C-LDL en el primer control lo hicieron a las 12 semanas. Asimismo, en este contexto, serían candidatos a recibir iPCSK9 solo un 2,4% siguiendo las recomendaciones SAC. Los estudios FOURIER y ODYSSEY OUTCO-MES demostraron la eficacia y el beneficio clínico del tratamiento con iPCSK9 (evolocumab y alirocumab, respectivamente) en pacientes con enfermedad vascular previa y C-LDL >70 mg/dl. 17,18 Sin embargo, el consenso de la SAC establece un valor umbral para el tratamiento, fundamentalmente, basado en cuestiones de costo-efectividad.
En un estudio de simulación de grandes dimensiones, se observó que solo el 25,5% de los pacientes en prevención secundaria alcanzó la meta de C-LDL (<70 mg/dl). 30 Luego de intensificar el tratamiento en la simulación (considerando un 100% de adherencia), el 99,3% de los sujetos alcanzó el objetivo lipídico utilizando estatinas (monoterapia), terapia dual (estatinas y ezetimibe) o triple esquema (agregando un iPCSK9) en la siguiente proporción, 67,3%, 18,7% y 14%, respectivamente. En otro estudio se realizó la misma simulación, pero considerando la intolerancia a las estatinas. 31 Asumiendo en la población un 10% de intolerancia parcial (intolerancia a las dosis máximas), el uso de terapia combinada con ezetimibe o con la inclusión de un iPCSK9 aumentó al 34,9% y 15,5%, respectivamente, la tasa de logro esperada del objetivo terapéutico. Cuando la intolerancia de esa fracción se asumió como total (intolerancia a cualquier dosis de estatinas), la utilización de ezetimibe e iPCSK9 aumentó las tasas de logro esperadas al 38,5% y 19,7%, respectivamente.
Al igual que dicho estudio de simulación, nuestros hallazgos mostraron que una considerable proporción de pacientes alcanzó la meta de C-LDL. Sin embargo, la indicación de iPCSK9 fue mucho más baja en nuestro trabajo. Probablemente, la explicación sea que nuestro trabajo consideró un valor umbral para indicar los anticuerpos monoclonales. Además, nuestro trabajo incorporó la teleconsulta en la fase de seguimiento del algoritmo aplicado. Esta herramienta ha sido desarrollada en los últimos años y su uso ha crecido constantemente, con aplicación en diferentes escenarios clínicos. Gabriel et al. demostraron notables mejoras en el cuidado usual de los pacientes con ACV luego de aplicar un programa de teleconsulta. 32 Asimismo, un trabajo reciente demostró que un seguimiento basado en teleconsultas en pacientes con enfermedad coronaria estable fue seguro y que el control de los factores de riesgo en estos pacientes no fue inferior que el logrado en los pacientes seguidos en forma presencial. 33 El monitoreo remoto de la medicación prescripta en pacientes con insuficiencia cardíaca también ha sido eficiente y seguro. 34
Cabe mencionar que nuestro algoritmo no contempló la utilización de drogas no estatínicas en la unidad coronaria. Ciertos grupos han recomendado agregar ezetimibe al momento del alta, considerando el C-LDL basal y el uso previo de estatinas. 35 Además, un estudio recientemente publicado demostró que el agregado de un iPCSK9 (evolocumab) en la unidad coronaria se asoció con una elevada proporción de pacientes que lograron la meta de C-LDL en el seguimiento precoz (>95%). 36
Nuestro estudio tiene ciertas limitaciones. Por un lado, evaluó la meta de C-LDL <70 mg/dl y el umbral terapéutico para indicar un iPCSK9 fue C-LDL >100 mg/dl. La aplicación de un algoritmo que contemple metas lipídicas más exigentes o estrategias no basadas en un valor umbral para indicar un iPCSK9 podrían modificar los resultados. Por otro lado, el C-LDL fue la única meta lipídica evaluada en nuestro trabajo. El análisis de otros objetivos lipídicos, como el colesterol no HDL o la apolipoproteína B, no fueron contemplados en este análisis. Finalmente, como ya se comentó, la decisión de cambiar el tratamiento se basó en el cumplimiento o no de la meta de C-LDL, sin considerar el porcentaje de reducción de dicho marcador lipídico.
CONCLUSIÓN
La aplicación sistemática de un algoritmo basado en las guías actuales, que hacen foco en la solicitud de un C-LDL en la admisión, en la indicación de estatinas de alta intensidad en la internación y en un control precoz para el ajuste de la medicación, logró que una gran proporción de sujetos de alto riesgo cardiovascular alcanzaran las metas de C-LDL a las 12 semanas de seguimiento. La indicación de iPCSK9 quedaría reservada para un grupo muy selecto de pacientes.