INTRODUCCIÓN
Desde las publicaciones de Bentall en 1968, el remplazo de aorta ascendente y válvula aórtica mediante la inserción de un tubo valvulado, biológico o mecánico, constituye el tratamiento estándar de la enfermedad aneurismática de la raíz, independientemente del grado de enfermedad valvular. 1 Esa técnica constituye un recurso válido, factible y reproducible en casos de estenosis con compromiso de raíz o aorta proximal; sin embargo, en asociación con regurgitación pura, la presencia de una válvula disfuncional, pero estructuralmente normal, pone en duda la necesidad del remplazo protésico y sus implicancias, sean la anticoagulación requerida para prótesis mecánicas, el deterioro estructural y trombosis subclínica de las bioprótesis, o el riesgo de endocarditis para ambos modelos.
En la década de 1980, Yacoub 2) introdujo el concepto de remodelación, y una década más tarde, David y Feindel publicaron su serie de reimplante valvular. 3 Desde entonces, cientos de publicaciones atestiguan la evolución de la técnica, su clasificación fisiopatológica, las condiciones anatómicas óptimas para su aplicación, la selección de pacientes y los métodos de evaluación pre y posprocedimiento, que alcanzaron resultados comparables e incluso, superiores al remplazo convencional en términos de morbimortalidad. En similitud con las plásticas mitrales, de demostradas ventajas, la aplicación y la expansión de la reparación aórtica se ve limitada por la exigencia técnica y el riesgo sustancial de falla, sumados a la escasa información sobre factibilidad y resultados en nuestro medio.
En 2005, nuestra institución inició un programa de preservación valvular que ha evolucionado al punto de constituir la primera elección en pacientes con enfermedad aneurismática, en ausencia de degeneración o estenosis valvular. El objetivo de esta presentación es revisar la clasificación fisiopatológica y los criterios de selección de los pacientes, así como reportar los resultados a corto y largo plazo, en términos de recurrencia de insuficiencia valvular y reintervención, a fin de promover su utilización, extensamente recomendada, pero escasamente aplicada.4,5
MATERIAL Y MÉTODOS
Población en estudio
Entre enero de 2005 y diciembre de 2019, fueron derivados 712 pacientes a nuestro departamento con diagnóstico de enfermedad aneurismática de la aorta ascendente e indicación quirúrgica, por guías clínicas. 6,7 Excluídos aquellos con estenosis de grado significativo, disecciones agudas, endocarditis activa, reoperación o con criterios ecocardiográficos de no reparabilidad 8, 116 P fueron consecutivamente incluídos en un programa de reparación valvular, de seguimiento anual por protocolo. Todos fueron previamente informados de la posibilidad de reparación, a la que consintieron.
Data clínica preoperatoria
Previo a la intervención se realizaron una ecografía transtorácica, ETE y tomografía multicorte de aorta torácica. Los estudios ecocardiográficos fueron realizados con equipo Philips iE33 con transductor S5-1MHz y sonda multiplanar X7-2T MHz y/o Philips EpiQ 7 con transductor x Matrix 2D/3D y sonda transesofágica 3D de 7 MHz.
Por medio de un examen ecotranstorácico se evaluó la presencia y el grado de insuficiencia aórtica (IAO), diámetros ventriculares, función sistólica y medidas de la raíz aórtica, siguiendo recomendaciones de las Asociaciones Americana y Europea de Cardiología (sin insuficiencia, leve, moderada y/o grave).9). Por ETE se obtuvieron imágenes en eje corto y eje largo, entre 0 y 180 grados. Se evaluó el número de cúspides y en bicúspide, la presencia y las características del rafe y la simetría. La movilidad valvar fue reportada como normal, excesiva o restrictiva, considerando prolapso a toda eversión o abombamiento del borde libre hacia el tracto de salida, por debajo del plano anular, en diástole; se determinó la presencia y el tipo de fibrosis o calcificación valvular. 8
Con Doppler color se evaluó la dirección del jet regurgitante. En el plano sagital se midieron los diámetros del anillo, los intersenos, la unión sinotubular (UST), y tubular ascendente (en modo 2D y 3D, con reconstrucción multiplanar), determinando el fenotipo del aneurisma. 9.
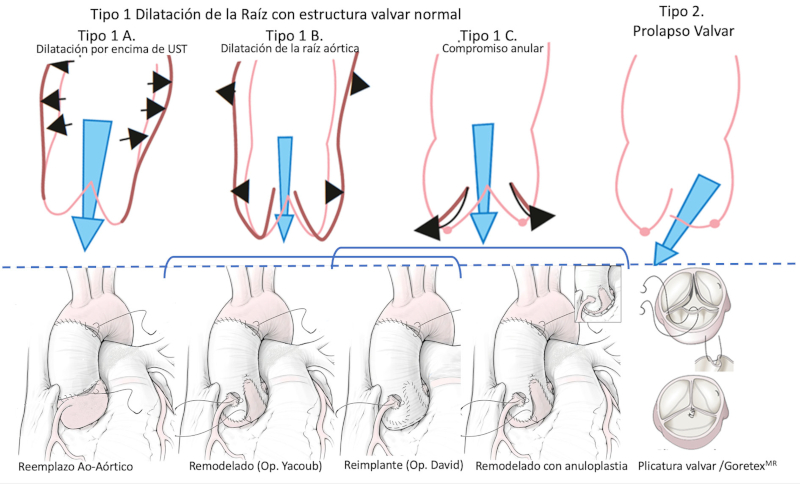
La AngioTC fue realizada con gatillado cardíaco y adquisición de tres tiempos, con tiempo arterial al 75% de fase cardíaca. Perpendicular al eje mayor del vaso se determinó el diámetro máximo en el nivel del anillo, el interseno, la UST y tubular, así como la configuración valvular, la geometría anular, la disposición de vasos supraaórticos y enfermedad coronaria. En casos no concluyentes, se realizó cinecoronariografía. Con el objetivo de facilitar la selección de técnica quirúrgica, se utilizó la clasificación anatomofuncional modificada por El Khoury (Figura 1) para fenotipo aórtico. 10
Procedimiento quirúrgico
Todas las intervenciones fueron realizadas por esternotomía mediana y circulación extracorpórea por canulación directa del arco aórtico o axilar derecha, dependiendo de la extensión distal del aneurisma. Se utilizó cardioplejía sanguínea intermitente y venteo pulmonar. Mediante aortotomía transversa alta, se procedió a la inspección valvular, y se observó el número y la disposición de las valvas, las fenestraciones, la ubicación y la extensión del rafe, fibrosis o calcificación, y la altura geométrica de las valvas determinantes de la factibilidad de reparación, así como el diámetro anular e interseno, y las características de la pared aórtica, independientemente de su diámetro.
Como se expresó, la selección de la técnica se ajustó a la clasificación anatomofuncional; los casos con dilatación por encima de la UST (subtipo 1A) fueron tratados mediante remplazo aorto-aórtico; los subtipos 1B y 1C, mediante técnica de reimplante o remodelado, inicialmente según la decisión del cirujano, y en la actualidad ligado al diámetro anular (remodelado con anillo <25 mm, reimplante si ≥25 mm), establecido por eco o mediante el uso de medidores intraoperatorios.
Excepcionalmente, la restricción anular se logró mediante anuloplastia externa con PTFE 2.0 o banda de teflon (Figura 1). Las lesiones valvares prediagnosticadas u observadas en la reparación, como prolapso (tipo 2), fueron tratadas por plicatura o resección del borde libre, a fin de ajustar su altura geométrica a 8-10 mm. Las restricciones, características de las bicúspides, se trataron con resección del rafe y cierre primario o plicatura con puntos separados de polipropilene 6.0, dependiendo de su extensión y la altura de implante a nivel de la comisura frustra.
Finalizada la reparación, fueron evaluados con equipos Philips EPIQ y Sonosite Turbo con sonda transesofágica multiplanar 8-3 MHz. Se investigó, tanto la presencia y el grado de insuficiencia residual como el mecanismo responsable, con especial atención sobre la superficie y la altura de coaptación valvar, el prolapso residual y la dirección del jet regurgitante, así como el área y el gradiente transvalvular. La conversión a remplazo fue decisión del médico interviniente, conforme al resultado ecocardiográfico, la edad, el estado clínico y las comorbilidades del paciente.
Seguimiento
La morbimortalidad perioperatoria se determinó siguiendo definiciones convencionales (Apéndice 1). Todos los pacientes fueron evaluados por ecocardiografía al alta, y seguidos por la clínica de valvulopatías; esa evaluación clínica y ecocardiográfica fue repetida a los 3, 6 y 12 meses y, anualmente, asociando AngioTC. Ante sospecha clínica de endocarditis, aumento de gradientes o progresión de IAO, se indicó ETE. En la evaluación de curvas de sobrevida y reincidencia de insuficiencia significativa, se consideró la variante valvular (bicúspide o tricúspide), asociada al resultado dispar en publicaciones previas.
Análisis estadístico
Las variables de tipo cuantitativas fueron expresadas como media ± desvío estándar o mediana (rango intercuartilo) en los casos con distribución no gaussiana. Las variables cualitativas se reportaron como porcentaje. Las curvas de sobrevida libre de eventos se construyeron por el método de Kaplan-Meier. Las diferencias de supervivencia entre grupos se analizaron mediante log rank test. Para identificar predictores de mortalidad tardía significativos se realizó un análisis univariado y multivariado con la prueba de riesgos proporcionales de Cox. Las variables clínicas detalladas en la Tabla 1 se utilizaron para el análisis univariado, incluyendo en el modelo multivariado aquellas con valor de p <0,2.
Tabla 1 Variables preoperatorias global
| Factores de riesgo | %/ n |
|---|---|
| Hipertensión | 61,8 (71) |
| Dislipemia | 30,7 (35) |
| Tabaquismo | 39,6 (46) |
| Diabetes | 1,7 (2) |
| Antecedentes, heredofamiliares | 22,4 (26) |
| Antecedentes patológicos (n = 116) | %/ n |
| Accidente cerebrovascular previo | 2,5 (3) |
| Enfermedad pulmonar moderada/grave | 6,5 (8) |
| Insuficiencia renal previa | 6,8 (8) |
| Infarto de miocardio previo | 0,8 (1) |
| Angioplastía previa | 3,4 (4) |
| Enfermedad coronaria significativa | 9,4 (11) |
| Cuadro clínico predominante | %/ n |
| Asintomáticos | 59 (66) |
| Disnea progresiva | 30 (35) |
| Angina inestable | 6 (7) |
| Insuficiencia cardíaca | 0,8 (1) |
| Síncope | 3,4(4) |
| Ecocardiografía | |
| Diámetro diastólico VI (mm) (med/DE) | 55 ± 9,1 |
| Diámetro sistólico VI (mm) (med/DE) | 34 ± 9,1 |
| Función ventricular Mod/Grave | 9,3 (35) |
| Configuración bicúspide | 21,6 (35) |
| Insuficiencia aórtica preop | 75,8 |
| - Grado 0 | 6 (7) |
| - Grado 1 | 19,8 (23) |
| - Grado 2 o mayor | 74,2 (86) |
| Fibrosis - calcificación Grado 2/3 | 5,1 (6) |
| Prolapso valvar (%) | 18,1 (21) |
| Tomografía axial computada | (med/DE) |
| Diámetro anular aórtico, (mm) | 26 ± 4,5 |
| Diámetro aórtico sinusal, (mm) | 49,5 ± 7,8 |
| Diámetro UST, (mm) | 52 ± 11,7 |
| Diámetro tabular aórtico (mm) | 42 ± 8 |
med/DE: media/ desvío estándar
UST: unión sinotubular
VI: ventrículo izquierdo
Consideraciones éticas
El estudio fue conducido de acuerdo con las normas nacionales e internacionales de investigación en seres humanos (Declaración de Helsinki y otras). La confidencialidad de los datos personales de los pacientes fue tratada de acuerdo con la ley 25 326 de Protección de Datos Personales. Los pacientes fueron identificados mediante un código numérico, y sus datos filiatorios se mantienen en forma anónima.
RESULTADOS
La mediana de edad fue de 56 ± 15,6 años (rango 1878), 73% de sexo masculino, superficie corporal 1,99 ± 0,2 m2. Las características basales se muestran en la Tabla 1. La principal indicación de intervención fue el diámetro aórtico indexado, su progresión o antecedentes heredofamiliares. Un escaso 10,3% fue categorizado como síndrome de Marfan o Loeys Dietz.
Procedimiento quirúrgico y resultados de la reparación
Acorde al fenotipo aórtico, 17 casos (15%) fueron sometidos a remplazo aorto aórtico (subtipo 1A), 16 casos (14%) a remodelado, y los restantes 83 casos (71%) a reimplante (subtipos 1B-1C).
En el grupo remodelado 2 casos (12,5%) recibieron anuloplastia externa adicional. La elección de plicar la unión ventrículo-aórtica -sea por reimplante o anuloplastía externa- fue decisión del cirujano, pero basada en mediciones previas (media de anillo de 26 ± 3,3 mm global, 23 ± 3,6 mm para el grupo remodelado vs. 27 ± 4,5 mm para el grupo reimplante). La asociación de lesión tipo 2 (prolapso por eco o inspección directa) fue del 55%, sin diferencia entre grupos. Su plicatura directa representó la variante técnica más utilizada, mayormente en el subgrupo de reimplante.
Otras variables técnicas se modificaron a lo largo de la serie, con un abandono precoz de la resuspensión con puntos subcomisurales o las suturas de Goretex® sobre bordes libres. Discontinuada la circulación extracorpórea, por ETE se reportó un 94% de pacientes sin IAO residual significativa, y 7 casos (6%) de IAO de moderada a grave, con una tasa de conversión a remplazo del 1,7% (2 casos). En los 5 casos restantes (4,3%) se toleró insuficiencia residual moderada, en contexto etario, CEC prolongada y comorbilidad asociada, todos ellos intervenidos en los primeros 5 años del programa. Los datos intraoperatorios y los resultados están resumidos en la Tabla 2.
Tabla 2 Variables intraoperatorias globales y por técnica quirúrgica
| Variable | Global N = 116 %/(n) | RAO-AO N = 17 %/(n) | Remodelado N = 16 %/(n) | Reimplante N = 83 %/(n) |
|---|---|---|---|---|
| IAO moderada/grave preop. | 74,2 (86) | 82,3 (14) | 62,5 (10) | 74,4 (62) |
| Configuración bicúspide | 21,5 (25) | 23,5 (4) | 31,2 (5) | 19,2 (16) |
| Prolapso a la inspección | 27,5 (32) | 29,4 (5) | 12,5 (2) | 30,1 (25) |
| Tto adicional valvas | 55 (64) | 58,8 (10) | 56,2 (9) | 54,2 (45) |
| -Plicatura valvar | 28,4 (33) | 11,8 (2) | 25 (4) | 32,5 (27) |
| -Resección valvar | 8,6 (10) | 11,8 (2) | 25 (4) | 4,8 (4) |
| -Puntos subcomisurales | 18,9 (22) | 52,9 (9) | 25 (4) | 10,7 (9) |
| -Sutura de PTFe | 3,4 (4) | 5,9 (1) | 0 | 3,6 (3) |
| Diámetro graft(mm)(moda/rango) | 30 (24-34) | 28 (26-34) | 38 (26-30) | 30(24-30) |
| Cirugía coronaria asociada | 10,3 (12) | 29,4 (5) | 0 | 8,4 (7) |
| Tiempo de clampeo (min)(med/DE | 153 ± 48 | 71 ± 22 | 142 ± 44 | 164 ± 34 |
| Tiempos de CEC (min) (med/DE) | 178 ± 52 | 87 ± 31 | 162 ± 47 | 183 ± 38 |
| Anuloplastía externa | 2,5 (3) | 5,9 (1) | 12,5 (2) | 0 |
| Sin insuficiencia residual | 45,7 (53) | 35,2 (6) | 37,5 (6) | 49,4 (41) |
| IAO trivial - leve | 48,3 (56) | 58,8 (10) | 56,2 (9) | 44,5 (37) |
| IAO moderada/grave | 6 (7) | 5,8 (1) | 6,2 (1) | 6 (5) |
| Conversión/remplazo | 1,7 (2) | 0 | 6 (1) | 1,2 (1) |
RAO-AO: remplazo aorto aórtico. PTFe: preguntar. med/DE: media/desvío estándar. IAO: Insuficiencia aórtica. CEC: Circulación extracorpórea
Morbimortalidad periprocedimiento
Las complicaciones periprocedimiento fueron de baja incidencia, y son reportadas en la Tabla 3.
Tabla 3 Complicaciones perioperatorias globales y por técnica quirúrgica
| Variable | Global N = 116 %/(n) | RAO-AO N = 17 %/(n) | Remodelado N = 16 %/(n) | Reimplante N = 83 %/(n) |
|---|---|---|---|---|
| Sangrado médico | 20,7 (24) | 17,6 (3) | 25 (4) | 20,4 (17) |
| Reoperación por sangrado | 4,3 (5) | 0 | 0 | 6,2 (5) |
| Fibrilación auricular | 22,4 (26) | 17,6 (3) | 37,5 (6) | 20,4 (17) |
| Inotrópicos >24 h | 24,1 (28) | 23,5 (4) | 6,25 (1) | 27,7 (23) |
| ARM prolongada | 3,4 (4) | 5,9 (1) | 6,25 (1) | 2,4 (2) |
| Marcapasos definitivo | 2,6 (3) | 0 | 0 | 3,6 (3) |
| Insuficiencia renal | 6,03(7) | 11,7 (2) | 0 | 6,02 (5) |
| Diálisis | 0,9 (1) | 0 | 0 | 1,2 (1) |
| ACV con secuela | 0,9 (1) | 0 | 0 | 1,2 (1) |
| Mortalidad | 0,9 (1) | 0 | 0 | 1,2 (1) |
| Estadía hospitalaria días | 5 ± 5.8 | 5 ± 3.8 | 5 ± 6.6 | 5.5 ± 2.8 |
| (med/std - rango) | (4-50) | (4-19) | (4-15) | (5-50) |
med/std: mediana/desvío estandar
RAO-AO: remplazo aorto-aórtico. ARM: asistencia respiratoria mecánica. ACV: accidente cerebrovascular. med/DE: media/desvío estándar
Seguimiento clínico y ecocardiográfico
La mediana de seguimiento fue 4 años (1,9-8,8), con una pérdida de 3 pacientes (2,6%). Ocurrieron 8 muertes, 2 de origen cardíaco: una muerte súbita y un óbito por insuficiencia cardíaca secundaria a disfunción valvular. La sobrevida actuarial a 10 años fue 88%, sin diferencias por fenotipo valvar (Figura 2A).

Fig. 2 A. Sobrevida actuarial (global y por fenotipo aórtico). B. Libertad de reintervención valvular (global y por fenotipo aórtico). C. Grado de IAO pre-operatoria, postop inmediata y a mediana de seg. D. Libertad de insuficiencia significativa (global y por fenotipo aórtico).
Se registraron 5 reoperaciones, todas ellas de carácter electivo: 3 casos (2,6%), secundarias a endocarditis a 4 y 6 años, 1 caso por progresión de la IAO residual a 4,9 años, y el restante por estenosis, a 10,6 años. No se registraron complicaciones mayores o muertes en las reintervenciones. Un sexto paciente, con indicación por estenosis residual, rechazó la cirugía y representa un fallecido de causa cardíaca. La libertad de reintervención fue de 91% a 10 años (Figura 2B).
Por ecocardiografía se reportó reincidencia o progresión a IAO significativa en 12 pacientes (10,4%) a 5,8 años promedio desde la intervención (Figura 2C). La libertad de IAO significativa fue de 79% a 10 años (Figura 2D). La regresión proporcional de Cox en análisis multivariado identificó al jet excéntrico como predictor independiente de progresión alejada (HR 17,6, IC 95% 3,7-84,1, p <0,0001).
El 87% de los pacientes demostró fracción de eyección del ventrículo izquierdo (FEVI) superior al 50%, con mejoría de los diámetros ventriculares izquierdos (diámetro diastólico 54 ± 9,1 mm pre a 49 ± 6,5 post; diámetro sistólico 34 ± 9 pre a 30 ± 5,8 post, p ≤0,01), estabilidad en gradientes residuales (8 ± 6,2 mmHg) y velocidad máxima transvalvular aórtica (1,4 ± 0,5 m/seg).
Clínicamente, el 92% de los sobrevivientes (99/108) se reportó en CF I, independientemente del grado de IAO residual diagnosticada por imágenes. Se reportaron en el seguimiento 4 pacientes anticoagulados por remplazo valvular alejado mecánico, sin eventos hemorrágicos o tromboembólicos clínicos asociados al tratamiento.
DISCUSIÓN
Si bien múltiples publicaciones han mostrado excelentes resultados y estabilidad a largo plazo para la preservación aórtica 11,12,13,14,15, su aplicación real sigue siendo escasa, limitada a centros de alto volumen y experiencia en cirugía valvular. Representa el 19% de las prácticas sobre aorta torácica según el registro de la Sociedad de Cirugía Torácica Americana 5, y un total de 7700 casos registrados en 5 años por el registro AVIATOR, con 55 centros europeos. Sus ventajas radican en la reducción de complicaciones asociadas al implante, especialmente anticoagulación y fenómenos embólicos, al margen de su perfil hemodinámico óptimo y estable en el tiempo. La dificultad técnica, la curva de aprendizaje y una cuestionada durabilidad son señaladas como debilidades por sus detractores, sumados a la probada eficacia y estandarización del procedimiento de Bentall.
Diversos grupos han comparado las técnicas de preservación con el tradicional tubo valvulado, sea biológico o mecánico, en términos de morbimortalidad y libertad de reintervención, con resultados dispares. 16,17,18 Si bien no existen estudios prospectivos randomizados que comparen estrategias, un metaanálisis reciente de Elbatarny, (con 6218 pacientes en 26 publicaciones) establece una considerable ventaja de la preservación: 32% de reducción de mortalidad, 71% de reducción en eventos hemorrágicos y 64% en eventos tromboembólicos, a 5,8 ± 3,0 años de seguimiento. 19
Convencido de sus ventajas, nuestro grupo estableció una rutina de estudios ecocardiográficos preoperatorios, de cuyo análisis y valoración anatomofuncional depende el éxito de la preservación 7,20,21,22,23. Emulando la plástica mitral, las lesiones tipo 3, restrictivas, tienen malos resultados alejados 7,20; la altura efectiva de las valvas inferior a 16 mm en tricúspide y 19 mm en bicúspide, se asocia a resultados subóptimos. 23 Las correcciones valvares con parche de pericardio o material sintético, a excepción de mínimas fenestraciones, presentan una tasa de recurrencia precoz elevada, particularmente en pacientes con conformación bicúspide, siendo desaconsejadas 24,25. Constituye esta la base para la exclusión de este tipo de lesiones en la siguiente serie. Asimismo, la presencia de marcada fibrosis o calcificación, especialmente a nivel del rafe en bicúspide, es un condicionante del éxito de la plástica y debe ser informada en la valoración prequirúrgica 26.
La correlación entre reporte ecocardiográfico y hallazgo intraoperatorio fue relativamente alta; se observaron variaciones en la detección de prolapso que no afectaron el resultado final. La definición del diámetro anular, sea ecocardiográfica o tomográfica, resulta esencial en la decisión de la técnica quirúrgica; los anillos superiores a 25 mm, no tratados se asocian a recurrencia de IAO, por lo cual es primordial la estabilización anular, sea por anuloplastia externa o técnica de reimplante, consideración que justifica, en nuestra serie, la utilización de esta variable en la mayoría de los casos. 27,28,29,30
Si bien no fue el objetivo de la serie comparar resultados en relación con el fenotipo aórtico, los pacientes con remplazo aorto-aórtico presentaron menor tasa de reincidencia de IAO significativa; ha sido probado que la regurgitación central (característica de este fenotipo) es estable en el seguimiento, en contraste con el reflujo excéntrico, identificado en nuestra serie como predictor de progresión de la IAO, independientemente del grado de insuficiencia al que se asocie. Lansac y col.. proponen un algoritmo de corrección en todo reflujo excéntrico superior al trivial, sea por prolapso previo insuficientemente tratado, o una sobrecorrección restrictiva. 23 Esta situación y su adecuada interpretación representan el mayor desafío y es, al margen de la destreza técnica requerida, la representación práctica de la curva de aprendizaje. 31 La asociación de lesiones tipos 1 y 2, y su compleja corrección, no tuvieron impacto en la progresión de IAO o en la tasa de reintervención, como fue publicado. 32).
La morbimortalidad de la serie es excelente, incluso por debajo de grandes series publicadas y consideradas en dos metaanálisis de la última década. (16,19,33 La reducción de los diámetros ventriculares y su contribución al mantenimiento de la FEVI, se correlacionan con la CF observada y la sobrevida alejada reportada a largo plazo.
Existe una clara limitación en la definición de durabilidad o estabilidad de la reparación; ¿es simple observación ecocardiográfica o la indicación real de intervención? Definida como progresión ecocardiográfica, la libertad de IAO significativa a 10 años varía entre 80% y 90%, independientemente del tipo de procedimiento y el fenotipo valvular: David y ElKhoury, promotores de la técnica de reimplante, reportan 89,4% y 92% a 10 años, respectivamente 34,15; Yacoub y Schafers, adeptos al remodelado 89% y 80% respectivamente, ambas series con escasa utilización de anuloplastia 35,14. En nuestro medio, Escarain reporta valores similares, 84% a 8 años. (36).. Esta recurrencia es bien tolerada en los pacientes con IAO previa significativa y ventrículo dilatado, y condicionan la indicación de reintervención. Por ende, si la durabilidad es representada por la tasa de reoperación, los resultados de nuestra serie son estimulantes. La libertad de intervención a 10 años raramente cae por debajo del 90%, a excepción de patología bicúspide en los pacientes mal seleccionados (valvas restrictivas, configuración asimétrica, anuloectasia). 37
La experiencia nos acerca a conceptos asociados al indiscutido éxito de la reparación mitral: a. adecuada valoración por imágenes; b. clasificación anatomofuncional: para cada defecto, una técnica; c. identificación de predictores de fallo; d. experiencia del cirujano; e. intolerancia a la regurgitación residual y f. curva de aprendizaje, volumen dependiente.
CONCLUSIÓN
Los procedimientos de preservación valvular aórtica son seguros y duraderos, con óptimo resultado en términos de calidad de vida, sobrevida y necesidad de reintervención, y deben ser considerados como opción en los pacientes con compromiso aneurismático de la raíz, independientemente del grado de regurgitación asociada, en especial, en aquellos que rechacen el eventual tratamiento anticoagulante o presenten contraindicación para el mismo. El reconocimiento de la anatomía funcional y su correcta tipificación ha permitido identificar aquellos pacientes no solo candidatos a la preservación valvular, sino con beneficios extendidos en el tiempo. Su correcta selección y su ejecución en centros de alto volumen y experiencia son la clave del éxito alejado.