INTRODUCCIÓN
En la última década han surgido múltiples adelantos terapéuticos en la insuficiencia cardíaca (IC) con fracción de eyección reducida. 1,2 A pesar de ello, algunos pacientes evolucionan a fases avanzadas de su enfermedad y es necesario plantearse otras opciones terapéuticas. El trasplante cardíaco (TC) continúa siendo la opción de elección en nuestro medio. Sin embargo, el creciente número de pacientes con IC (>26 millones en el mundo), la escasez de donantes (4000 donantes/ año promedio mundial) y ciertas contraindicaciones generaron la necesidad de buscar otras alternativas. 3,4 Las asistencias circulatorias mecánicas (ACM) son una opción segura y eficaz en un amplio espectro de situaciones clínicas. Desde 2003, estos dispositivos permiten un soporte vital permanente o terapia de destino, cuando el TC no puede ser considerado. 5
Se presenta el primer implante de un dispositivo de asistencia ventricular izquierda (DAVI o LVAD, por sus siglas en inglés) HeartMate 3TM (HM3), Abbott, como terapia de destino, realizado en la Argentina.
CASO CLÍNICO
Paciente de 52 años, portadora de miocardio no compacto con disfunción sistólica ventricular izquierda grave. Sin factores de riesgo cardiovascular, dos partos eutócicos, seguimiento por psicopatología por trastorno mixto ansioso-depresivo (CIE-10 = F41.2) y antecedentes de endocarditis infecciosa asociada a dispositivo endocavitario (cardiodesfibrilador resincronizador, TRC D). Evolucionó con deterioro progresivo de la clase funcional, internaciones por insuficiencia cardíaca aguda descompensada (ICAD) y deterioro de la calidad de vida. En junio de 2019, se decidió realizar evaluación para TC: peso 46 kg, talla 1,68 m, índice de masa corporal 16,4 kg/m2, superficie corporal 1,5 m2.
En el ecocardiograma Doppler color presentaba marcada dilatación ventricular izquierda, hipertrofia excéntrica, incremento del trabeculado parietal con criterios de miocardio no compacto (relación pars no compacta/pars compacta >2:1). Fracción de eyección VI 18%. Hipoquinesia global. Grave dilatación biauricular. Dilatación leve del ventrículo derecho (VD) (45 mm en vista 4 cámaras), con deterioro leve de su función sistólica (onda S del DTI a nivel del anillo tricuspídeo 10 cm/seg, acortamiento fraccional del área 0,33). Insuficiencia mitral leve a moderada, con restricción al cierre bivalvar (“tenting”). Insuficiencia tricuspídea (IT) leve a moderada, con una presión sistólica del ventrículo derecho (PSVD) de 64 mm Hg, y vena cava inferior (VCI) dilatada (23 mm), sin colapso inspiratorio. Cinecoronariografía: arterias coronarias sin lesiones significativas.
El cateterismo derecho bajo soporte inotrópico con milrinona 0,5 mcg/kg/min arrojó los siguientes datos: frecuencia cardíaca (FC)78 lpm, tensión arterial media (TAM) 70 mm Hg, presión sistólica de arteria pulmonar (PSAP) 43 mm Hg, diastólica (PDAP) 19 mm Hg y media (PMAP) 27 mm Hg; presión capilar pulmonar (PCP) 17 mm Hg y aurícula derecha (PAD) 7 mm Hg; gasto cardíaco (GC) 3,2 L/min, índice cardíaco (IC) 2,1 L/min/m2, resistencia vascular sistémica (RVS) 1575 dinas.seg.cm-5 y pulmonar (RVP) 280 dinas. seg.cm-5 (3,5 unidades Wood), con gradiente transpulmonar (GTP) 10 mm Hg. Serologías: HIV, hepatitis B, hepatitis C y Chagas negativas.
Se detectó la presencia de anticuerpos preformados contra el sistema HLA: PRA (panel reactivity antibody) Clase I 90% y Clase II 97%, fijadores de complemento (C1q positivo) con elevado índice de inmunofluorescencia (IMF). Se decidió realizar terapia de desensibilización con inmunoglobulina (IvIg) y rituximab (MabTheraTM). Se repitió el PRA, sin cambios significativos. Ante la presencia de sensibilización sin respuesta al tratamiento, y considerando que el TC es una terapéutica de elevada morbimortalidad a corto y mediano plazo, se decidió el implante de un DAVI como terapia de destino. La paciente evolucionó con deterioro clínico progresivo; logró la resolución de las fallas orgánicas bajo soporte inotrópico máximo, dosis elevada de diuréticos de asa, solución salina hipertónica y triple bloqueo tubular por congestión refractaria. Se evaluó con ecocardiograma Doppler color, en el que se apreció dilatación del VD (diámetro basal 53,5 mm), deterioro moderado a grave de su función sistólica (onda S del DTI a nivel del anillo tricuspídeo 13 cm/seg, acortamiento fraccional del área 0,20) e insuficiencia mitral leve a moderada. IT grave (Vmax de regurgitación tricuspídea: 2,5 m/s), PSVD 40 mm Hg, VCI dilatada (30 mm), sin colapso inspiratorio.
Se realizó nuevo cateterismo derecho: FC 114 lpm, TAM 81 mm Hg, PSAP 42 mm Hg, PDAP 20 mm Hg, PMAP 29 mm Hg, PCP 15 mm Hg, PAD 12 mm Hg, GC 4,24 L/min, IC 2,77 l/min/m2, RVS 1301 dinas.seg.cm-5, RVP 266 dinas.seg. cm-5 (3,3 UW), GTP 17. Se decidió el implante de un balón de contrapulsación intraaórtico, el cual debió ser retirado a las 72 horas por bacteriemia asociada a catéter e imagen compatible con vegetación adherida a dispositivo endocavitario. Se procedió al explante del TRC-D y se inició tratamiento antibiótico endovenoso. Con cultivos negativos y firma de consentimiento informado, se programó el procedimiento del implante del dispositivo de AVI como terapia de destino.
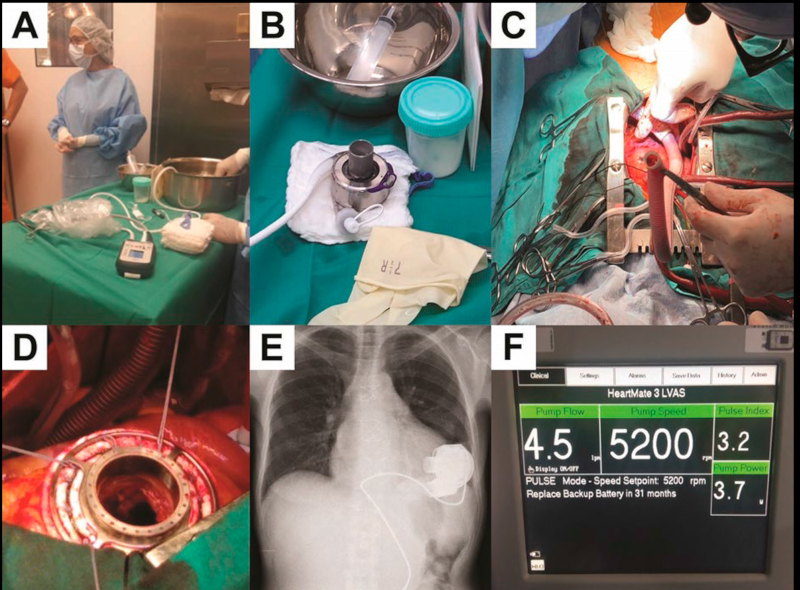
El 11 de diciembre de 2019, se realizó el implante de dispositivo de flujo continuo centrífugo con levitación magnética intracorpóreo HeartMate 3TM, Abbott (St. Jude Medical, Pleasanton, California). Su diseño permite, mediante tecnología MagLev Flow, minimizar las fuerzas de cizallamiento sobre los componentes sanguíneos a través de una interfaz biomaterial, con una baja tasa de hemólisis. Las superficies internas están texturizadas con microesferas de titanio para reducir la trombogenicidad. El dispositivo consiste en un rotor totalmente levitado con pulsatilidad intrínseca a través de un cambio de velocidad cada 2 segundos, para reducir la estasis sanguínea y minimizar el efecto trombogénico. La bomba opera a una velocidad de 3000 a 9000 rpm y un flujo máximo de 10 L/min. Recibe energía mediante un par de baterías de iones litio de 14 V o fuentes de alimentación de energía externa. Un cable que se exterioriza por tunelización subcutánea y contrabertura (cable modular o driveline) conecta el cuerpo de la bomba con el módulo de control (driver) y las baterías externas, para la transmisión de datos y energía. En comparación con el dispositivo HeartMate IITM (HM II TM), es de implante intratorácico e intrapericárdico, presenta mayor duración de la batería, software incorporado en la bomba y flujo sanguíneo calculado de acuerdo al hematocrito.
El implante se realizó mediante esternotomía mediana, en corazón batiente, utilizando bypass cardiopulmonar transitorio y técnicas de ahorro sanguíneo. El HM3TM consta de una cánula de entrada que se introduce en la cavidad VI a través del ápex. Se sutura a un anillo apical en la superficie epicárdica del ápex, que sirve como sistema de sujeción de la bomba. Mediante un cuchillo circular, se perfora la pared miocárdica a través del anillo y se liberan trabéculas que puedan obstaculizar el llenado de la bomba. Se introduce la cánula, la cual tiene continuidad con el cuerpo de la bomba, que quedará alojada en posición intrapericárdica. El cuerpo de la bomba se continúa con la cánula de salida, donde se adosa una prótesis vascular de dacrón, que se anastomosa a la aorta ascendente. El cable de alimentación de la bomba está tunelizado y exteriorizado a través de la pared abdominal y conectado al módulo de control. Debido a que la paciente presentaba disfunción VD e IT grave, con scores de riesgo de falla de VD intermedios a altos, se decidió realizar plástica tricuspídea de De Vega. Con el injerto de salida y la bomba desaireados, el flujo del bypass cardiopulmonar se comenzó a descender progresivamente mientras la bomba se encontraba a 3000 rpm. Se realizaron pruebas de velocidad en rampa para determinar un adecuado ajuste de velocidad. Se realizó monitoreo hemodinámico mediante catéter de Swan-Ganz y saturación venosa central (Figura 1). Se continuó soporte inodilatador e infusión de óxido nítrico para soporte VD durante las primeras 48 h, sin necesidad de soporte mecánico. La paciente fue desvinculada de la asistencia respiratoria mecánica a las 72 h, permaneció internada en el área de cuidados intermedios durante 16 días, y a los 30 días del implante se otorgó el egreso hospitalario. El esquema de anticoagulación y antiagregación se estableció según las indicaciones del fabricante, del Servicio de Hematología y las recomendaciones de la evidencia médica. Al momento del egreso, la paciente se encontraba en CF II (NYHA), recibiendo tratamiento médico óptimo para la disfunción sistólica VI según las guías internacionales. Se continuó tratamiento con sildenafil, con descenso progresivo de la dosis. Se indicó rehabilitación cardiovascular y plan nutricional supervisado.
Durante la estadía hospitalaria, la paciente, su familia y el equipo médico recibieron sesiones de entrenamiento (un total de 20 horas) y asesoramiento -a cargo de un cirujano y un enfermero expertos, provistos por el fabricante- relacionadas con el cambio de baterías, el cuidado del equipo, la curación del conductor eléctrico y el manejo de emergencias. Antes del egreso la paciente realizó salidas transitorias bajo supervisión médica, para confirmar el nivel de confianza y confort con el sistema. Se comprobó la total autonomía y seguridad de la paciente y su familia. Se realizó una visita domiciliaria para supervisar las instalaciones eléctricas, evaluar las condiciones generales de seguridad del domicilio, garantizar la seguridad en el suministro eléctrico y relevar los sitios alternativos de carga en su municipio. Durante el entrenamiento, se reforzaron las contraindicaciones absolutas para sumergirse en agua y para realizar estudios de resonancia magnética nuclear. Recibió entrenamiento para su aseo diario con la utilización de un equipo impermeable para protección del dispositivo. Se entrenó al equipo médico del Departamento de Emergencias en el manejo médico inicial de las posibles complicaciones.
Desde su egreso, se realizan controles médicos periódicos para evaluar la presencia de IC y de eventuales sangrados, así como para la revisión de alarmas o alertas, la verificación de los índices de pulsatilidad, del amperaje, de las revoluciones, del gasto cardíaco y la detección de eventos de succión. También se le realizan pruebas de coagulación, se le examina el sitio de salida del conductor eléctrico (cable modular) para descartar infección asociada, se le controla la presión arterial media con método Doppler, y se le efectúa electrocardiograma, exámenes de laboratorio con determinación de deshidrogenasa láctica y ecocardiograma Doppler, para optimizar los parámetros del dispositivo. A 6 meses del implante, la paciente se encontraba asintomática, autosuficiente en las actividades de la vida diaria, realizando rehabilitación cardiovascular, con marcada mejoría de su perfil nutricional y estado anímico, y mantenía niveles adecuados de anticoagulación. Se le realizó una prueba de la marcha de los 6 minutos (PM6M) con oximetría de pulso a aire ambiente, que evidenció una distancia recorrida de 480 metros, con una valoración de la escala Borg de 0.
DISCUSIÓN
En el abordaje de pacientes con IC avanzada en fase refractaria a los esquemas de tratamiento médico y dispositivos electrofisiológicos 1,2,3, el TC sigue siendo el tratamiento más eficaz para mejorar tanto la calidad de vida como la supervivencia a largo plazo (supervivencia media condicional 14,8 años). 6 Sin embargo, cuando el TC no puede ser indicado o su latencia exige aportar tiempo de estabilidad al paciente, debemos ofrecer otras alternativas. 4
Las ACM tuvieron un sofisticado desarrollo tecnológico, que las posiciona en la actualidad como una herramienta segura, capaz de brindar un sostén hemodinámico que otorga tiempo para mejorar la condición clínica como puente al TC o puente a la decisión o candidatura, cuando existen limitaciones potencialmente corregibles; en casos reversibles y temporales, como puente a la recuperación, o cuando existen contraindicaciones para el TC, como terapia de destino. 5,6,7,8 Decidir el momento adecuado de su implante es un punto crucial. La clasificación INTERMACS (Interagency Registry for Mechanically Assisted Circulatory Support) -sustentada por el National Heart-Lung and Blood Institute (NHLBI)-, que analiza los pacientes con implantes de dispositivos aprobados por la FDA (Food and Drug Administration), desde el 23 de junio de 2006 ha permitido identificar mejor los riesgos asociados según el momento del implante. 9,10 Dichos soportes mecánicos pueden proveer asistencia de corto, mediano y largo plazo en pacientes con falla cardíaca crónica y aguda.
Los sistemas de flujo pulsátil, más antiguos, fueron utilizados como asistencias de corta duración; estos fueron aprobados por la FDA en 1998 como puentes al TC, pero con el avance de la tecnología, lograron establecerse como una alternativa segura para asistencias de larga duración. 7) En 2001, el estudio REMATCH (Randomized Evaluation of Mechanical Assistance for the Treatment of Congestive Heart Failure) demostró que los pacientes no candidatos a TC presentaban mayor mortalidad con tratamiento médico que con DAVI pulsátil, ; con la asistencia se logró una reducción del 48% en la mortalidad. Aunque las complicaciones como tromboembolia, hemorragias e infecciones limitaron el tiempo de uso, este ensayo clínico apoya el empleo del soporte como terapia de destino. 11).El estudio INTrEPID (Investigation of Nontransplant-Eligible Patients Who Are Inotrope Dependent) demostró que los pacientes con asistencia circulatoria (Novacor®) tuvieron tasas de supervivencia superiores a los 6 meses (46% vs. 22%) y a los 12 meses (27% vs. 11%) en comparación con la terapia médica máxima en pacientes con IC terminal y grave deterioro de la fracción de eyección no candidatos a TC. 12
Los DAVI de flujo continuo son sistemas de bombas que generan un impulso no pulsátil de flujo axial o centrífugo, características que permitieron una reducción de su tamaño y simplificaron su implante. Desde 2007, su utilidad fue demostrada en estudios clínicos, inicialmente frente a un grupo control; posteriormente, en 2009, se demostró su ventaja en comparación con dispositivos de flujo pulsátil. 13 Estas bombas dieron paso a la actual generación de DAVI de flujo continuo centrífugo, que utiliza un solo impulsor provisto de levitación magnética. 14,15
El sistema de LVAD HM3™ está indicado para proporcionar ACM a pacientes con IC, como puente al trasplante, o como terapia de destino en pacientes con disfunción ventricular izquierda grave, por lo que se aconseja determinar los scores de falla ventricular derecha y el pronóstico antes del implante del dispositivo de asistencia univentricular en cada caso. 16 Está contraindicado para pacientes que no toleran la terapia de anticoagulación o son alérgicos a esta.
Krabatsch y col. demostraron que más del 78% de los pacientes mejoraron su CF IIIb/IV a CF I/II a 6 meses del implante, con una mejoría sostenida en el 79% de ellos a lo largo de 2 años (p <0,0001), corroborada en la PM6M (medición basal promedio de 154 m, que aumentó a 308 m a 2 años del implante, p <0,0001). 17
El ensayo clínico MOMENTUM 3 publicado en 2018 (Abbott) es un estudio aleatorizado, no ciego, que buscó demostrar no inferioridad comparando los dispositivos HM IITM (flujo axial) con HM3TM (flujo centrífugo) y su seguimiento a 2 años. El punto final primario compuesto fue supervivencia libre de discapacidad grave por evento neurológico según la escala de Rankin modificada y supervivencia libre de reintervención (recambio o remplazo por disfunción del dispositivo) a 2 años. Un total de 366 pacientes fueron aleatorizados en proporción 1:1 en dos ramas: 190 en el grupo HM3TM y 176 en el grupo HM IITM, con control mensual, al tercer mes y luego cada 6 meses hasta los 2 años. En el análisis a 6 meses, solo 3 pacientes (1,6%) del grupo HM3TM requirieron reemplazo de bomba (1 por falla eléctrica de comunicación del driveline, 1 por infección del driveline, 1 por obstrucción del injerto de salida), con ausencia de trombosis de la bomba, en comparación con una tasa de trombosis del 10,1% observada en el grupo HM IITM. El punto final primario ocurrió con HM3 en el 79,5% vs. el 60,2% con HM IITM, con lo que se cumplió la meta de no inferioridad. El 89,1% de los pacientes con HM3 estuvieron libres de eventos cerebrovasculares de cualquier nivel de gravedad, mientras que con HM IITM ello ocurrió en el 76,3%, sin diferencia estadísticamente significativa. 18. A pesar de no haberse observado diferencias significativas en la tasa de sangrado gastrointestinal, la bomba de flujo centrífugo tuvo menor tendencia a causar una deficiencia del factor de von Willebrand y malformaciones arterio-venosas que la bomba de flujo axial. 19,20,21 Los resultados con HM3TM respecto de la supervivencia libre de eventos a 2 años son comparables a los obtenidos con el TC en muchas regiones del mundo. 22
Es importante destacar que el adecuado manejo del dispositivo es elemental para garantizar el éxito de la terapia a largo plazo. Por tanto, debe destinarse el tiempo necesario para que el paciente y su familia adquieran los conocimientos y las habilidades requeridos para el cuidado cotidiano y autónomo del dispositivo.
CONCLUSIÓN
Se presenta el primer implante exitoso en el país de un DAVI como terapia de destino a una paciente con IC y contraindicación para recibir un TC.
La IC continuará siendo abordada por diversos métodos: genéticos, de reemplazo y de apoyo mecánico. Los DAVI han demostrado ser eficaces en soporte a corto y largo plazo, como puente al TC y como terapia de destino. El diseño de nuevos dispositivos y su funcionamiento mejorarán gradualmente, y, sin duda, serán más eficientes, más duraderos y menos costosos, y su empleó originará un reducido número de complicaciones. Esta terapéutica promete grandes desafíos, a la vez que va dejando de ser una terapia de excepción.