El 5-fluorouracilo (5-FU) es un agente antimetabolito de fluoropirimidina utilizado en el tratamiento de una amplia variedad de tumores sólidos y es la segunda droga más frecuente asociada a cardiotoxicidad, luego de las antraciclinas.
El vasoespasmo coronario es el principal mecanismo cardiotóxico; se manifiesta como dolor precordial asociado a cambios en el electrocardiograma (ECG), que suelen ser transitorios, y raramente produce infarto de miocardio.
Sin embargo, existen otras manifestaciones de cardiotoxicidad infrecuentes, tales como la miocardiopatía dilatada, la arritmia ventricular y la muerte súbita.
A continuación, se describe un caso de shock cardiogénico luego de la infusión de 5-FU.
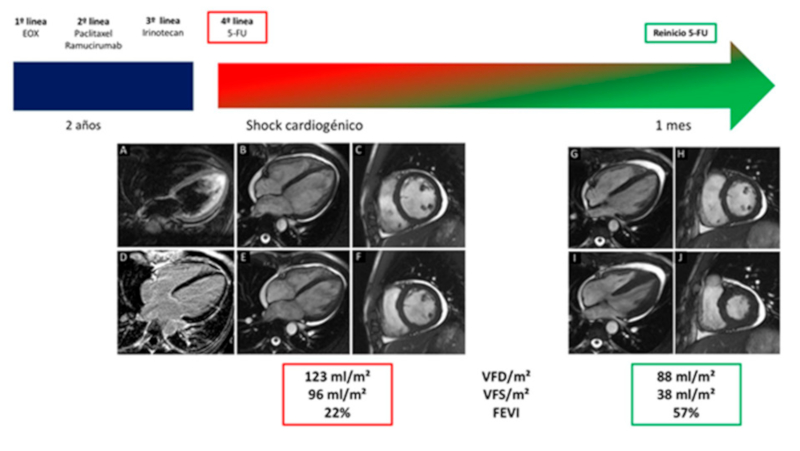
Paciente de 35 años con antecedente de adenocarcinoma gástrico en estadio IV. A lo largo de su tratamiento específico, completó diversos esquemas quimioterápicos: primera línea con esquema EOX (epirrubicina: dosis acumulativa 324 mg/m², oxaplatino y capecitabina); segunda línea con paclitaxel + ramucirumab, y tercera línea con irinotecan (Figura 1). Durante estos esquemas, no presentó signos de cardiotoxicidad; en el ecocardiograma transtorácico (ETT) la fracción de eyección (FE) del ventrículo izquierdo (VI) estaba conservada (>55 %) con strain global longitudinal normal (-18 %, rango normal: -19 % ± 2%). Finalmente, inició una cuarta línea de tratamiento con esquema FOLFOX (5-fluorouracilo, oxaplatino y ácido folínico) en infusión continua.
Durante la primera infusión de 5-FU, presentó dolor precordial típico asociado a elevación transitoria del segmento ST en el ECG, que desaparecieron una vez suspendida la droga. No se detectó elevación de troponina T ultrasensible. Se interpretó este evento como vasoespasmo coronario y se inició tratamiento con diltiazem al alta.
A las 48 h, presentó un segundo episodio de dolor precordial, esta vez asociado a diaforesis y mareos, por lo que consultó a la guardia. Al examen físico, se encontraba vigil, hipotenso y con signos de mala perfusión periférica. El laboratorio de ingreso evidenció falla renal aguda, con elevación de biomarcadores cardíacos: troponina ultrasensible 20 pg/mL (valor normal <15 pg/mL), NT-proBNP 3000 pg/mL (valor normal 125 pg/mL) e hiperlactacidemia, de 3 mmol/L. El ECG no mostraba cambios isquémicos agudos. El ETT evidenció diámetros del VI ligeramente aumentados, con hipocinesia global y deterioro grave de la FEVI: 25%.
En la unidad de cuidados intensivos cardiológicos (UCIC), el paciente requirió vasopresores, y se evidenció mejoría clínica a las 48 h. Se realizó una resonancia (RMN) cardíaca que confirmó la hipocinesia difusa y la disfunción ventricular grave (FEVI 22%). En las secuencias ponderadas en T2, no se evidenció edema miocárdico. Las secuencias de realce tardío de gadolinio (RTG) descartaron la presencia de fibrosis en el miocardio (Figura 1).
Cinco días después, dada la evolución favorable, el paciente fue dado de alta luego de haber iniciado tratamiento con betabloqueantes e inhibidores de la enzima convertidora de angiotensina. Durante el seguimiento en la unidad de cardio-oncología, se evidenció una mejoría gradual en la FEVI, que alcanzó una recuperación total (FEVI 55%) a los 15 d. Esto fue confirmado por una RMN al mes que demostró FEVI de 57%. (Figura 1). Luego de haber recuperado la FEVI, un equipo multidisciplinario decidió continuar el tratamiento con 5-FU. El paciente completó los 5 ciclos quimioterápicos pendientes en UCIC bajo monitoreo continuo y no volvió a presentar complicaciones cardiovasculares.
Describimos el caso de un paciente joven sin antecedentes cardiovasculares, que presentó shock cardiogénico luego de la infusión de 5-FU.
Los efectos adversos más comúnmente asociados al 5-FU son mucositis, diarrea y mielosupresión. La cardiotoxicidad es un efecto adverso grave que puede ir desde cambios electrocardiográficos en pacientes asintomáticos hasta angor transitorio, infarto de miocardio o, incluso, shock cardiogénico con riesgo de vida. El mecanismo preciso de la cardiotoxicidad aún se desconoce, pero se han propuesto varios a partir de modelos animales, reportes de casos y pequeños estudios clínicos.
El espasmo coronario y la isquemia aguda de miocardio son el efecto adverso más conocido de las fluoropirimidinas; se manifiesta como dolor precordial, cambios isquémicos en el ECG y elevación de biomarcadores, como la troponina ultrasensible. Se propusieron dos mecanismos para explicar este fenómeno. Mosseri y colaboradores descubrieron que la proteinquinasa C podría ser un mediador implicado en la vasoconstricción, y demostraron vasoconstricción independiente del endotelio con dosis crecientes de 5-FU en un modelo animal. 1 Además, se detectaron valores elevados de endotelina 1, un potente vasoconstrictor, en pacientes con cardiotoxicidad inducida por 5-FU. 2 Nuestro paciente manifestó dolor precordial inducido por 5-FU 48 h antes del episodio de shock cardiogénico. Sin embargo, no se detectó elevación de la troponina ultrasensible y la RNM no evidenció signos de isquemia miocárdica, ya que mostró hipoquinesia global, sin signos de edema en las secuencias ponderadas en T2, ni fibrosis en las secuencias de RTG. Por ello, se descartó que el vasoespasmo haya sido el mecanismo subyacente que ocasionó la disfunción ventricular.
Otro mecanismo propuesto es el daño tóxico directo del 5-FU en los cardiomiocitos. La alfa-fluorobeta-alanina (FBAL), un producto de degradación del 5-FU, desempeña un papel importante en este aspecto. En un reporte clínico, Muneoka y colaboradores demostraron la existencia de valores elevados de FBAL en pacientes con cardiotoxicidad inducida por 5-FU. Al recibir la prodroga S-1 (una fluoropirimidina oral que carece de FBAL como un metabolito), los pacientes no volvieron a manifestar alteraciones cardiovasculares. 3
La disfunción endotelial y la entrega inadecuada de oxígeno es otro mecanismo propuesto. La disfunción vascular asociada a la formación de microtrombos es un mecanismo que potencialmente podría producir cardiotoxicidad. La oclusión por microtrombos habitualmente no se detecta mediante cinecoronariografía. 4 Sin embargo, en nuestro paciente, no hemos podido demostrar signos de obstrucción microvascular mediante la RMN en las secuencias de RTG. Se ha propuesto el uso de anticoagulantes para mitigar este efecto adverso, pero se requiere de más investigaciones para estandarizar su indicación. Algunos autores también sugieren que la formación de radicales libres de oxígeno podría desempeñar un rol importante en la disfunción citotóxica endotelial. 5
El último mecanismo fue descrito por Spasojevic y colaboradores, quienes demostraron que el 5-FU produce cambios en la membrana eritrocitaria, que derivan en aumento de la fluidez sanguínea y transformación de la forma eritrocitaria de su forma habitual bicóncava a un equinocito. Los cambios en la membrana eritrocitaria disminuyen su capacidad de transporte de oxígeno y generan isquemia e injuria miocárdica. 6
En nuestro paciente, no fue posible reconocer un único mecanismo fisiopatológico que explicase la disfunción del VI, pero creemos que se debe a una combinación de varios de ellos.
No existe un tratamiento estandarizado para la cardiotoxicidad inducida por fluoropirimidinas. El consenso actual es discontinuar el tratamiento con 5-FU en el momento en que se sospeche la cardiotoxicidad. Si existen síntomas de vasoespasmo el paciente debe ser tratado sintomáticamente con fármacos antianginosos, (nitratos o bloqueantes cálcicos, como el diltiazem), para abortar los síntomas y prevenir recurrencias. La disfunción del VI debe ser tratada inicialmente de acuerdo a las guías internacionales. En algunos casos, la cardiotoxicidad es reversible luego de la suspensión de la droga, tal como ocurrió en nuestro caso. Un enfoque multidisciplinario de cardiólogos y oncólogos es crucial al momento de manejar este tipo de pacientes y tomar decisiones sobre continuar o no el tratamiento. Los pacientes que reinician el tratamiento con 5-FU luego de haber manifestado cardiotoxicidad, tienen un riesgo elevado de recurrencia, entre el 82% y el 100%. Nuestro paciente pudo completar los ciclos remanentes de 5-FU bajo una monitorización minuciosa en la UCIC.
Consideramos que es importante destacar este caso para resaltar la diversidad de manifestaciones clínicas de la cardiotoxicidad inducida por 5-FU, más allá del vasoespasmo, para tenerlas en cuenta al momento de planificar estrategias para la vigilancia de nuestros pacientes.
La disfunción miocárdica y el shock cardiogénico pueden ser una manifestación de cardiotoxicidad inducida por 5-FU reversible e impresionan ser independientes del vasoespasmo coronario. Es fundamental conocer este efecto adverso en el seguimiento de estos pacientes.