INTRODUCCIÓN
En la estenosis aórtica (EAo) la reducción de la fracción de eyección del ventrículo izquierdo (FEVI) por debajo de 50%, es una indicación clase I de reemplazo valvular aórtico en ausencia de síntomas de acuerdo con las guías de manejo de pacientes con enfermedad valvular 1,2,3) debido al mal pronóstico que implica a corto plazo. Sin embargo, se ha publicado que los pacientes con FEVI entre 50-60%, al igual que aquellos con FEVI <50%, tienen peor pronóstico cuando se los compara con los que tienen FEVI >60%. 4,5,6 En la EAo la FEVI puede disminuir por reducción de la contractilidad, exceso de poscarga (afterload mismatch) o una combinación de ambos mecanismos. Debido a que la FEVI expresa el movimiento endocárdico desde el final de la diástole hasta el final de la sístole, la misma está influenciada por la geometría ventricular ya que, en presencia de hipertrofia concéntrica, dicho movimiento aumenta a medida que se incrementa el espesor parietal, y puede producir un valor de FEVI normal incluso cuando hay depresión de la contractilidad. 7) Para corregir la aparente disociación entre la función de cámara (FEVI) y la función muscular, es más adecuado emplear la fracción de acortamiento mesoparietal (FAm) ajustada al nivel de poscarga (estrés de fin de sístole, EFS) en presencia de hipertrofia concéntrica para estimar el nivel de contractilidad (NC). 8,9,10,11) El objetivo del presente trabajo fue evaluar el NC, exceso de poscarga y geometría ventricular como determinantes de la FEVI en pacientes con EAo grave.
MATERIAL Y MÉTODOS
Se estudiaron prospectivamente 184 pacientes con edad promedio de 69 ± 11 años, 112 hombres y 72 mujeres portadores de EAo grave definida como índice de área valvular aórtica (IAVA) <0,6 cm2/m2, a los cuales se les había solicitado eco-Doppler cardíaco. El protocolo fue aprobado por el Comité de Docencia e Investigación del Hospital. Fueron excluidos los pacientes que presentaban calcificación del anillo mitral, insuficiencia aórtica o mitral de grado moderado o grave. Se consideró antecedente de hipertensión arterial a la necesidad de haber indicado tratamiento antihipertensivo previamente y de cardiopatía isquémica si el paciente había presentado uno o más de los siguientes criterios: 1) antecedentes de IAM, angioplastia o cirugía de revascularización, 2) obstrucciones mayores del 50% en las arterias coronarias determinadas por angiografía y 3) acinesia en el ecocardiograma. Como grupo control fueron estudiados 71 pacientes con edad promedio de 69 ± 13 años sin antecedentes cardiológicos, factores de riesgo cardiovascular ni enfermedades sistémicas. A todos los pacientes se les realizó ecocardiograma Doppler completo, además de realizarse antes del mismo el interrogatorio para detectar la presencia de factores de riesgo coronario y síntomas, examen físico cardiovascular, medición de la presión arterial y registro del pulso carotídeo.
Ecocardiograma y Doppler cardíaco: El estudio fue realizado con un ecocardiógrafo ESAOTE MyLab 40 con transductor de 2.5-3.5 MHz, con el paciente en decúbito lateral izquierdo, utilizando la derivación DII del electrocardiograma como referencia. Las mediciones en modo M, ecocardiograma bidimensional, cálculo de la fracción de acortamiento endocárdica (FAe) del VI, espesor parietal relativo (EPR), volumen de fin de diástole (VFD) (método de Simpson), volumen de fín de sístole (VFS) y FEVI se realizaron de acuerdo con los criterios de la ASE. 12. La fracción de acortamiento mesoparietal (FAm) del VI se calculó utilizando la fórmula de Koide: 13
Siendo: DD: diámetro diastólico; DS: diámetro sistólico; h: espesor diastólico combinado de la pared posterior y el septum interventicular (PPd +SIVd / 2); hfs: espesor sistólico combinado (PPs +SIVs / 2) y a´: punto mesoparietal en sístole calculado a partir de la siguiente fórmula:
La masa del VI se calculó según la fórmula de Devereux 14 y el índice de masa (IM) como la masa normalizada a la superficie corporal. De acuerdo con el IM y el EPR se clasificó la geometría ventricular como normal, remodelación concéntrica, hipertrofia concéntrica e hipertrofia excéntrica. 15 Con Doppler continuo se registró la velocidad máxima transvalvular aórtica, el gradiente medio (GM) y la integral de la curva de flujo desde las vistas apical, paraesternal derecha, subxifoideo y supraesternal. Con Doppler pulsado se obtuvo el flujo en el tracto de salida del VI desde la vista de 5 cámaras. Se calculó el AVA efectiva utilizando la ecuación de continuidad, el IAVA, el índice de pérdida de energía (IPE), el índice de volumen sistólico y el flujo aórtico de acuerdo con la ASE. 16 Se registró el Doppler tisular pulsado del anillo mitral lateral y septal, y se midió la velocidad pico de la onda e´ (promedio septal y lateral). Se registró el flujo transmitral para estimar la velocidad pico de la onda E, velocidad pico de la onda A, relación E/A y relación E/e´. Se estimó la presión sistólica de la arteria pulmonar y el índice de volumen de la aurícula izquierda (AI) de acuerdo con la ASE. 16 Para cada parámetro evaluado se consideró el promedio de 3 mediciones consecutivas. Luego de realizar el ecocardiograma Doppler se registró el carotidograma con un transductor de pulso TPW - 01 A conectando a un ecocardiógrafo TOSHIBA SSH140A y se midió la presión arterial con esfigmomanómetro en el brazo derecho estando el paciente en decúbito lateral izquierdo. El carotidograma fue calibrado de acuerdo con el método utilizado en nuestro laboratorio 17 para obtener la presión de fin de sístole (PFS). Como índice de poscarga se estimó el estrés meridional de fin de sístole (EFS) mediante la fórmula de Grossman. 18) La contractilidad fue evaluada mediante la relación FAm-EFS en el grupo control con la siguiente ecuación de regresión: FAm = 28,15-0,12 × EFS, con un error estándar de estimación (EE) de 3,75% (r = 0,41 p <0,001). Para un determinado nivel de EFS (poscarga) un valor inferior a la FAm predicha por la ecuación de regresión menos 2 veces el EE fue considerado como contractilidad disminuida en los pacientes con EAo. El nivel de contractilidad (NC) fue definido como la FAm medida menos la FAm predicha para un determinado valor de EFS, de tal manera que un valor positivo indica contractilidad normal y un valor negativo contractilidad disminuida. 19 Se consideró exceso de poscarga cuando el EFS fue >77 gr/cm2 determinado como el promedio del EFS del grupo control (53 ± 12 gr/cm2) + 2 desvíos estándar. Para evaluar el posible efecto de la geometría ventricular en la sobrestimación de la función sistólica utilizando la FEVI, se calculó la diferencia entre la FEVI medida y el NC (∆ FEVI-NC). Para la evaluación de la poscarga global del VI se calculó la impedancia valvulo-arterial (Zva) como: Zva (mm Hg/mL/m2) = (PAS (mmHg) + GMneto (mm Hg)) /IVS (mL/ m2) siendo PAS la presión arterial sistólica, GMneto el gradiente medio transvalvular aórtico corregido para la recuperación de presión de acuerdo a la fórmula de Baumgartner. 20 e IVS el índice de volumen sistólico.
La función diastólica se evaluó mediante la relación E/A, relación E/é, índice de volumen de la aurícula izquierda y presión sistólica de la arteria pulmonar. Los pacientes con EAo fueron divididos en 4 grupos: FEVI < 50% (n = 78), FEVI 5059% (n = 27), FEVI 60-69% (n = 45) y FEVI ≥70% (n = 34).
Análisis estadístico
Se realizó con el software SPSS 25. Las variables continuas se expresaron como media ± desviación estándar. Las variables categóricas se expresaron como porcentaje. Para la comparación de variables categóricas se empleó el test de chi cuadrado, para las variables continuas el análisis de la varianza, y para la correlación el cálculo del coeficiente r (Pearson). Como límite de significación se consideró una p<0,05.
RESULTADOS
No hubo diferencias significativas en la edad ni la superficie corporal de los pacientes entre los 4 grupos. El sexo masculino predominó en los pacientes con FEVI <50% y FEVI 50-59%, su prevalencia fue similar a la del sexo femenino en el grupo FEVI 60-69%, mientras que el número de mujeres fue mayor en el grupo con FEVI ≥70% (p <0,01) (Tabla 1). La presencia de cardiopatía isquémica, factores de riesgo cardiovascular y enfermedad pulmonar obstructiva crónica fue más frecuente en pacientes con FEVI <50% y similar entre los 3 grupos restantes. Con respecto a los síntomas, la disnea III-IV predominó en el grupo FEVI <50% (p <0,01), y el angor y la disnea I-II en el resto de los grupos. No hubo diferencias significativas entre los grupos al considerar la presión arterial sistólica, diastólica y de fin de sístole. La gravedad de la EAo fue similar en los 4 grupos según el AVA, IAVA, velocidad pico aórtica, GM e IPE. El IVS y el flujo aórtico fueron menores y la Zva mayor en pacientes con FEVI<50% en comparación con los de FEVI ≥60% (p <0,01) (Tabla 2).
Tabla 1 Características de los pacientes
| Fracción de eyección del VI (%) | p | |||||
|---|---|---|---|---|---|---|
| <50 | 50-59 | 60-69 | ≥70 | |||
| (n = 78) | (n = 27) | (n = 45) | (n = 34) | |||
| Edad (años) | 70 ± 12 | 65 ± 12 | 71 ± 11 | 71 ± 11 | ns | |
| Hombre / mujer | 56 / 22 | 19 / 8 | 25 / 20 | 12 / 22 | <0,001 | |
| Superficie corporal (m2) | 1,85 ± 0,21 | 1,90 ± 0,19 | 1,82 ± 0,19 | 1,76 ± 0,16 | ns | |
| Enfermedades co-existentes y FR (%) | ||||||
| Enfermedad coronaria | 31 | 22 | 15 | 8 | <0,01 | |
| Infarto de miocardio previo | 10 | 2 | 0 | 0 | ||
| Hipertensión arterial | 52 | 48 | 49 | 42 | ||
| Diabetes | 15 | 17 | 12 | 10 | ||
| Dislipemia | 22 | 23 | 22 | 23 | ||
| Tabaquismo | 25 | 28 | 26 | 25 | ||
| Obesidad (IMC >30 Kg/m2) | 27 | 33 | 20 | 24 | ||
| Enfermedad pulmonar obstructiva crónica | 5 | 2 | 0 | 015 | ||
| Síntomas (%) | ||||||
| Angor | 9 | 33 | 16 | 9 | ||
| Síncope | 0 | 11 | 11 | 0 | ||
| Disnea I-II | 23 | 22 | 20 | 26 | <0,01 | |
| Disnea III-IV | 54 | 11 | 20 | 6 | ||
| Presión arterial sistólica (mm Hg) | 122 ± 23 | 131 ± 25 | 135 ± 20 | 134 ± 21 | ns | |
| Presión arterial diastólica (mm Hg) | 72 ± 13 | 78 ± 13 | 77 ± 11 | 76 ± 12 | ns | |
| Presión de fin de sístole (mm Hg) | 91 ± 16 | 97 ± 16 | 97 ± 18 | 98 ± 19 | ns | |
VI: ventrículo izquierdo; FR: factores de riesgo; IMC: índice de masa corporal
Tabla 2 Parámetros ecocardiográficos
| Fracción de eyección del VI (%) | p | |||||
|---|---|---|---|---|---|---|
| < 50 | 50-59 | 60-69 | ≥70 | |||
| (n = 78) | (n = 27) | (n = 45) | (n = 34) | |||
| Fracción de eyección del VI (%) | 33 ± 10 | 56 ± 3 | 65 ± 3 | 75 ± 4 | <0,001 | |
| Área valvular aórtica (cm2) | 0,65 ± 0,21 | 0,66 ± 0,23 | 0,71 ± 0,20 | 0,71 ± 0,20 | ns | |
| Índice de área valvular aórtica (cm2/m2) | 0,35 ± 0,12 | 0,35 ± 0,12 | 0,39 ± 0,12 | 0,40 ± 0,12 | ns | |
| Velocidad pico aórtica (m/seg) | 4 ± 1 | 4,1 ± 0,8 | 4,3 ± 0,8 | 4 ± 0,9 | ns | |
| Gradiente medio (mmHg) | 40 ± 21 | 39 ± 15 | 44 ± 18 | 40 ± 19 | ns | |
| Índice de volumen sistólico (mL/m2) | 30 ± 12 | 32 ± 7 | 38 ± 10 * | 38 ± 11* | ||
| Flujo aórtico (ml/seg) | 174 ± 55 | 183 ± 38 | 205 ± 53 * | 191 ± 46 * | ||
| Índice de pérdida de energía (cm2/m2) | 0,40 ± 0,15 | 0,39 ± 0,15 | 0,45 ± 0,15 | 0,46 ± 0,15 | ns | |
| Impedancia valvulo-arterial (mmHg/mL/m2) | 6 ± 2 | 5,3 ± 1,5 | 4,7 ± 1,2 * | 4,7 ± 1,4 * | ||
| Diámetro diastólico VI (cm) | 5,9 ± 0,8 | 5,1 ± 0,6 | 4,9 ± 0,6 | 4,7 ± 0,6 | <0,01 | |
| Diámetro sistólico VI (cm) | 4,5 ± 0,9 | 3,4 ± 0,6 | 3,0 ± 0,6 | 2,8 ± 0,5 | <0,01 | |
| Fracción de acortamiento endocárdica (%) | 23 ± 9 | 33 ± 8 | 38 ± 7 | 39 ± 8 | <0,001 | |
| Fracción de acortamiento mesoparietal (%) | 12 ± 6 | 16 ± 5 | 20 ± 4 | 19 ± 6 | <0,001 | |
| Estrés de fin de sístole (gr/cm2) | 69 ± 28 | 41 ± 15 | 38 ± 22 | 33 ± 11 | <0,001 | |
| Nivel de contractilidad (n (%)) | ||||||
| ≥0 | 39 (50) | 15 (56) | 39 (87) | 25 (74) | ||
| <0 | 39 (50) | 12 (44) | 6 (13) * | 9 (26)* | ||
| ∆ FEVI-NC | 33 ± 11 | 55 ± 5 | 61 ± 4 | 73 ± 6 | < 0,001 | |
| Espesor parietal relativo | 0,42 ± 0,11 | 0,51 ± 0,09 | 0,52 ± 0,10 | 0,54 ± 0,11 | < 0,01 | |
| Índice de masa (gr/ m2) | 178 ± 50 | 153 ± 43 | 149 ± 39 | 136 ± 32 | <0,01 | |
| Geometría ventricular (n (%)) | ||||||
| Normal | 1 (1) | 0 | 3 (7) | 1 (2) | ||
| Remodelado concéntrico | 2 (2) | 5 (19) | 5 (11) | 6 (18) | ||
| Hipertrofia concéntrica | 29 (37) | 19 (70) | 32 (71) | 23 (68) | <0,01 | |
| Hipertrofia excéntrica | 46 (59) | 3 (11) | 5 (11) | 4 (12) | <0,01 | |
| Relación E/A | 1,8 ± 1 | 0,9 ± 0,3 | 1,0 ± 0,7 | 0,76 ± 0,25 | < 0,01 | |
| E/é | 19 ± 8 | 13 ± 5 | 16 ± 7 | 14 ± 8 | ns | |
| Índice de volumen de AI (ml/m2) | 60 ± 16 | 48 ± 13 | 54 ± 19 | 45 ± 12 | <0,01 | |
| Presión sistólica de arteria pulmonar (mmHg) | 54 ± 18 | 36 ± 15 | 35 ± 12 | 32 ± 7 | <0,01 | |
* p <0,01 vs FEVI <50 % y FEVI 50-59%
VI: ventrículo izquierdo; AI: aurícula izquierda; FEVI-NC: diferencia entre la fracción de eyección del ventrículo izquierdo y el nivel de contractilidad.
Evaluación de la contractilidad: De los 184 pacientes, 64 (35%) tuvieron contractilidad disminuida (NC <0) y 120 (65%) contractilidad conservada (NC ≥0). Al considerar los grupos según la FEVI, el 49% (51/105) de los pacientes con FEVI <60% tuvieron contractilidad disminuida, siendo estadísticamente significativa la diferencia al compararlos con los pacientes con FEVI ≥60% (50% (FEVI <50%) y 44% (FEVI 50-59%) vs 13% (FEVI 60-69%) y 26% (FEVI ≥70%) respectivamente, p<0,01) (Tabla 2). La FAm se correlacionó inversamente con el EFS tanto en los pacientes con contractilidad conservada como disminuida, siendo las dos rectas de regresión paralelas entre sí, pero difiriendo en el valor de intersección del eje Y (FAm 25% vs 16%, p <0,001) (Fig. 1A). Al dividir los pacientes de cada grupo en NC <0 y NC ≥0 se observó que a pesar de no haber diferencias significativas en los valores de FEVI y de EFS dentro de cada grupo, la FAm estuvo significativamente disminuida en todos los pacientes con NC <0, lo que implica que para similares valores de poscarga (EFS) la FEVI no pudo discriminar entre contractilidad deprimida o conservada (Tabla 3). El índice ∆ FEVI - NC, que evalúa la discrepancia entre la FEVI y el NC evidenció un incremento progresivo desde el grupo FEVI <50% a FEVI ≥70% (Tabla 2).
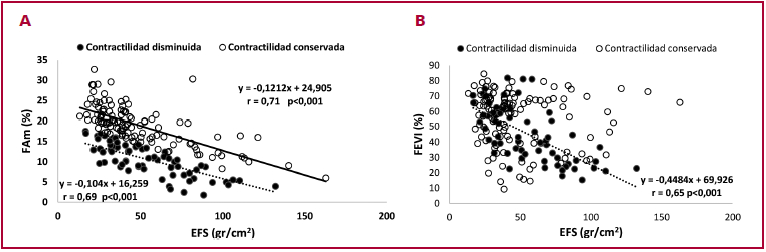
Fig.1 A Correlación entre la fracción de acortamiento mesoparietal (FAm) y el estrés de fin de sístole (EFS) en pacientes con contractilidad conservada y disminuida. B. Correlación entre la fracción de eyección ventricular izquierda (FEVI) y el estrés de fin de sístole (EFS) en pacientes con contractilidad conservada y disminuida.
Tabla 3
| Fracción de eyección del VI (%) | ||||||||
|---|---|---|---|---|---|---|---|---|
| < 50 (n=78) | 50-59 (n = 27) | 60-69 (n = 45) | ≥70 (n=34) | |||||
| NC <0 | NC ≥0 | NC <0 | NC≥0 | NC<0 | NC≥0 | NC<0 | NC≥0 | |
| n = 38 (49%) | n = 40 (51%) | n = 12 (55%) | n = 15 (45%) | n = 6 (14%) | n = 37 (86%) | n = 9 (27%) | n = 25 (73%) | |
| FEVI (%) | 32 ± 9 | 34 ± 11 | 55 ± 0,8 | 53 ± 1,3 | 62 ± 0,7 | 63 ± 1,2 | 72 ± 1,7 | 74 ± 3 |
| FAm (%) | 8 ± 3 | 16 ± 5 * | 12 ± 2 | 19 ± 5 * | 13 ± 3 | 20 ± 5 “ | 14 ± 4 | 21 ± 4 ∆ |
| EFS (gr/cm2) | 67 ± 25 | 70 ± 31 | 43 ± 20 | 37 ± 8 | 37 ± 4 | 46 ± 3,4 | 30 ± 12 | 31 ± 9 |
| EP | 13 (34 %) | 18 (45 %) | - | - | 2 (4 %) | - | ||
| EPR | 0,42 ± 0,11 | 0,41 ± 0,11 | 0,55 ± 0,11 | 0,48 ± 0,04 | 0,61 ± 0,07 | 0,49 ± 0,1^ | 0,59 ± 0,13 | 0,51 ± 0,11 |
NC<0 vs NC≥0: *p <0,0001; “p <0,0002; ^p <0,01; ∆p <0,00001
FE: fracción de eyección, VI: ventrículo izquierdo, NC: nivel de contractilidad, FAm: fracción de acortamiento mesoparietal, EFS: estrés de fin de sístole, EP:
exceso de poscarga, EPR: espesor parietal relativo
Poscarga (EFS): En el total de los 184 pacientes, la FEVI tuvo correlación inversa con el EFS solo en los pacientes con contractilidad disminuida y no en los pacientes con contractilidad conservada (Fig. 1B) a diferencia de los observado en la relación FAm - EFS. En el grupo FEVI < 50%, el exceso de poscarga (EFS >77 gr/cm2) estuvo presente en 13 (34%) de los 38 pacientes con NC <0 y en 18 (45%) de los 40 pacientes con NC ≥0 (Tabla 3). Esto implica que la causa de la FEVI <50% fue en el 23% (18/78) el exceso de poscarga, en el 32% (25/78) contractilidad disminuida y en el 17% (13/78) exceso de poscarga y contractilidad disminuida, quedando un 28% en el cual la disminución de la FEVI se relacionó con incremento del EFS (promedio 69 ± 28 gr/cm2), pero menor que el límite considerado exceso de poscarga. En el resto de los grupos solo se registró exceso de poscarga en 2 pacientes con FEVI 60-69%).
Geometría ventricular: La hipertrofia excéntrica predominó en los pacientes con FEVI < 50% mientras que la hipertrofia concéntrica fue más frecuente en el resto de los pacientes. El índice ∆ FEVI-NC tuvo una correlación logarítmica con el EPR (Figura 2) observándose un incremento de ∆ FE - NC hasta un EPR de 0,65 luego del cual muestra una disminución.

Fig. 2 Correlación entre la diferencia entre fracción de eyección ventricular izquierda y nivel contráctil (ΔFEVI-NC) y el espesor parietal relativo (EPR).
La disfunción diastólica estuvo presente en todos los grupos, pero fue más manifiesta en los pacientes con FEVI <50% (Tabla 2) caracterizada por aumento del índice de volumen de la AI (p <0,01), incremento de la presión sistólica de arteria pulmonar (p <0,01) y mayor relación E/é aunque la diferencia no fue significativa con respecto a los otros grupos. Los hallazgos mencionados indican aumento de las presiones diastólicas del VI sugiriendo la utilización de la reserva de precarga como mecanismo compensador frente al exceso de poscarga.
DISCUSIÓN
Los principales hallazgos del presente trabajo son: 1) el 49% de los pacientes con FEVI <60% presentaron contractilidad disminuida, 2) la FEVI no pudo discriminar entre contractilidad conservada y disminuida, 3) la discrepancia entre el valor de FEVI y el NC se incrementa con el grado de hipertrofia concéntrica, 4) el exceso de poscarga (con o sin contractilidad disminuida) es responsable de la FEVI <50% en 40% de los pacientes.
La FEVI es el parámetro más frecuentemente utilizado para determinar el pronóstico en la mayoría de las cardiopatías. Su valor está determinado por el nivel de contractilidad y las condiciones de carga, especialmente la poscarga. La cuantificación se realiza (independientemente del método) midiendo el volumen (a partir del contorno endocárdico) en fin de diástole y fin de sístole, normalizada al volumen de fin de diástole. En presencia de hipertrofia concéntrica, el incremento del espesor parietal ocasiona una reducción del diámetro ventricular, magnificando el movimiento endocárdico de tal forma que la FEVI puede estar dentro de límites normales en presencia de contractilidad disminuida. 21 Esto se debe a que la FEVI expresa la función de cámara influenciada por la geometría ventricular, siendo más adecuado utilizar la FAm que evalúa el desplazamiento del punto mesoparietal hacia el epicardio durante la sístole y que refleja la función muscular. 9,10,22 La contractilidad se define como la capacidad inherente del miocardio de contraerse independientemente de la pre y poscarga 23 y para evaluarla es necesario utilizar un parámetro de acortamiento (FEVI o FAm) normalizado al nivel de poscarga, representado por el EFS. Carabello 24 utilizó la relación FEVI-EFS en 14 pacientes con EAo, insuficiencia cardíaca y FEVI deprimida (28% ± 3%) y observó que en la mayoría de los pacientes mejoraba la FEVI luego del reemplazo valvular aórtico debido al exceso de poscarga (mismatch). Ito 25 estudió 445 pacientes evaluando la contractilidad con la relación FAm-EFS y encontró que la misma estaba disminuida en el 58% de los pacientes con FEVI <60% y en el 24% con FEVI ≥60% en coincidencia con nuestros hallazgos. Nosotros agregamos el grupo con FEVI ≥70% en el cual la contractilidad estuvo disminuida en el 26%, evidenciando el hecho de que una FEVI normal no permite afirmar que el inotropismo también lo es. La discrepancia entre la FEVI y el NC fue evaluada mediante el índice ∆ FEVI-NC el cual tuvo una relación logarítmica con el EPR, incrementándose en forma directamente proporcional hasta un EPR de 0,65 luego del cual disminuye, sugiriendo que dicho mecanismo compensador (hipertrofia concéntrica con aumento del EPR) se agota al llegar a ese valor, no pudiendo aumentar más la FEVI. En la EAo el aumento de la presión sistólica del VI secundario a la obstrucción valvular estimula la hipertrofia adicionando sarcómeros en paralelo con incremento del espesor parietal y, de acuerdo con la ley de Laplace, normalización del estrés parietal sistólico con hipertrofia concéntrica. 26 Dicho patrón fue más frecuente en los pacientes con FEVI >50%, pero no en los que tenían FEVI <50% en los cuales se observó predominio de la hipertrofia excéntrica. En un estudio retrospectivo, Ito 27 observó en 928 pacientes con EAo grave con FEVI reducida que tenían un ecocardiograma previo cuando la EAo era moderada, que ya tenían FEVI disminuida previamente con hipertrofia excéntrica, mientras que aquellos con FEVI ≥60% no modificaban el tipo de remodelado en el tiempo. Esto se podría deber a que los pacientes tendrían una afectación miocárdica previa, secundaria a las co-morbilidades (HTA, cardiopatía isquémica, diabetes, etc) lo que condicionaría remodelado antes que la EAo sea grave, difiriendo del concepto clásico que la sobrecarga de presión induce solamente hipertrofia concéntrica. Existen otras técnicas para evaluar la función ventricular como el strain global. 28,29 Sin embargo, en esta técnica se combina la compleja relación entre la contractilidad, 11 las condiciones de carga 30,31 y la geometría ventricular, 32 por lo cual no se la puede utilizar para estimar la contractilidad si no se la analiza relacionada con la poscarga. Stokke y col 21 estudiaron la relación entre FEVI, strain y geometría y concluyeron que la FEVI puede mantenerse preservada a pesar de la reducción del strain longitudinal y circunferencial debido al efecto de la hipertrofia concéntrica y la consiguiente disminución del volumen de fin de diástole. El strain circunferencial contribuye más que el longitudinal a mantener la FEVI preservada de acuerdo a dichos autores, lo cual avala el uso de la FAm, ya que el strain circunferencial evalúa el acortamiento de la circunferencia mesoparietal en el eje corto y la FAm el diámetro de dicha circunferencia. 33 La disminución del strain longitudinal dependería de la disfunción de las fibras subendocárdicas, mientras que la disminución del strain circunferencial y FAm traduce un compromiso transmural.
De acuerdo con nuestros hallazgos y el de otros autores, se debería reconsiderar el límite de FEVI deprimida en la EAo, probablemente a 60% teniendo en cuenta que, de todas formas, 1 de cada 4 pacientes con valores superiores a 60% podrían tener contractilidad disminuida. Se requieren más estudios para determinar el valor pronóstico que tiene la contractilidad disminuida con FEVI preservada.
CONCLUSIONES
La FEVI se correlacionó inversamente con la poscarga (EFS) solo en los pacientes con contractilidad disminuida. La mitad de los pacientes con FEVI < 60% presentó contractilidad disminuida; la proporción fue menor en el resto de los pacientes incluso hasta con FEVI ≥70%. El EP se observó en pacientes con FEVI <50% independientemente del nivel de contractilidad. La sobrestimación de la función sistólica utilizando la FEVI parece estar relacionada con el grado de hipertrofia concéntrica. Los determinantes de la FEVI pueden ser evaluados cuantitativamente mediante la relación FAm-EFS y el EPR.

















