1. INTRODUCCIÓN
1.1 Objetivo del consenso
El objetivo de este consenso es orientar a los cardiólogos/as de nuestro país en el reconocimiento de aquellas personas que padecen un infarto agudo de miocardio (IAM) sin enfermedad coronaria obstructiva y recomendar las herramientas para identificar sus posibles causas. Varios grupos de trabajo pertenecientes a sociedades científicas internacionales (ESC 2016, AHA 2019, Grupo Holandés 2019) 1,2,3 han establecido las diferentes etiologías y los diagnósticos diferenciales, pero no han dado recomendaciones específicas.
1.2 Nomenclatura
La nomenclatura recomendada por la Sociedad Argentina de Cardiología para las guías es la siguiente:
Clase de recomendación: estima el tamaño del efecto de un tratamiento a partir del riesgo/beneficio, así como de la evidencia o grado de acuerdo en que un procedimiento dado es o no efectivo, o es peligroso.
| Clase de recomendación. Clasificación | |
|---|---|
| Clase I | Evidencia y/o acuerdo general de que un determinado procedimiento diagnóstico o tratamiento es beneficioso, útil y efectivo. |
| Clase II | Existe evidencia conflictiva y/o divergencia de opinión acerca de la utilidad o eficacia del procedimiento/tratamiento |
| Clase IIa | El peso de la evidencia/opinión está a favor de la utilidad/eficacia |
| Clase IIb | La utilidad/eficacia está menos establecida por la evidencia/opinión. |
| Clase III | Evidencia o acuerdo general de que el tratamiento no es útil/efectivo y, en algunos casos, puede ser perjudicial y se desaconseja su uso. |
Nivel de evidencia: estima la certidumbre y precisión del efecto del procedimiento o tratamiento.
| Nivel de evidencia. Clasificación | |
|---|---|
| Clase A | Datos procedentes de ensayos clínicos múltiples aleatorizados o de metaanálisis. Consistencia en dirección y magnitud del efecto. |
| Clase B | Datos procedentes de un ensayo clínico único aleatorizado o de estudios no aleatorizados. |
| Clase C | Consenso de opinión de expertos o de pequeños estudios. |
1.3 Definición de infarto. “Revolución de las troponinas”
La aparición de las troponinas (Tn) como biomarcadores cardíacos más sensibles y específicos determinó que la Sociedad Europea de Cardiología (ESC), el Colegio Americano de Cardiología (ACC) y la Asociación Americana del Corazón (AHA) colaboraran para redefinir al IAM utilizando un enfoque clínico y bioquímico. Los pacientes que presentan elevación y descenso de Tn con al menos un valor por encima del límite superior normal en el contexto de isquemia miocárdica deben clasificarse como IAM. Sobre la base de estos nuevos conceptos y hallazgos, se creó la definición universal de infarto publicada por primera vez en 2000. Esta normativa engloba a todos los tipos de IAM, pero debió ser redefinida cuatro veces dada la falta de especificidad de los biomarcadores para poder diferenciar causa isquémica, lesión miocárdica no isquémica o causa no cardíaca.
En la actualidad, se encuentra vigente la 4.a definición de IAM; en ella se enfatiza que, además de la cinética de las troponinas, deben asociarse algunos de los siguientes elementos para definir IAM y poder diferenciar la injuria miocárdica de la isquemia miocárdica: 4
Síntomas (angina, equivalente anginoso).
Cambios electrocardiográficos (elevación o infradesnivel del segmento ST, cambios en la onda T o nuevas ondas Q).
Evidencia de imágenes con pérdida de miocardio viable o anomalías regionales de la motilidad.
Identificación de trombosis coronaria por angiografía o anatomía patológica. Sobre la base de estas características, se ha clasificado el IAM en 5 tipos
Tipo 1
Rotura o erosión de placa con oclusión aterotrombótica (IAMCEST)
Rotura o erosión de placa sin oclusión aterotrombótica (IAMSEST)
Tipo 2
Desequilibrio entre la oferta y la demanda de oxígeno, pero sin trombosis.
Enfermedad coronaria previa.
Espasmo coronario de arterias epicárdicas o de la microcirculación.
Disección coronaria no aterosclerótica.
Embolia coronaria.
Los restantes tipos de infartos están relacionados con la muerte súbita, la angioplastia coronaria y la cirugía de revascularización miocárdica.
1.4 MINOCA
La 4.a definición de IAM incorpora el acrónimo MINOCA, que representa el infarto agudo de miocardio sin enfermedad coronaria obstructiva (estenosis <50%) (Tabla 1). Esta entidad no es nueva: hace más de 50 años se conoce el hallazgo de IAM con “coronarias normales”.
Tabla 1 Criterios para la definición de MINOCA. 4.a definición universal de IAM
| Síndrome clínico angiográfico cuya fisiopatología es la isquemia miocárdica | |
|---|---|
| 1. Infarto agudo de miocardio | |
| Incremento y descenso de troponinas con al menos un valor por encima del límite superior de referencia del percentilo 99, más al menos uno de los siguientes criterios: | |
| a. Síntomas de isquemia miocárdica | |
| b. Nuevos cambios isquémicos electrocardiográficos | |
| c. Desarrollo de ondas Q patológicas | |
| d. Evidencia de imágenes con pérdida de miocardio viable o nuevas anomalías regionales de la motilidad. | |
| e. Identificación de trombosis coronaria por angiografía o anatomía patológica. | |
| 2. Arterias coronarias epicárdicas no obstructivas: | |
| Definidas como la ausencia de enfermedad coronaria obstructiva (≥50%) de cualquier vaso coronario epicárdico. | |
| - Arterias coronarias epicárdicas normales | |
| - Leves irregularidades intraluminales (estenosis <30%) | |
| - Moderadas lesiones coronarias ateroscleróticas (estenosis >30% y <50%) | |
| 3. Diagnósticos alternativos de lesión miocárdica descartan MINOCA | |
| - Sepsis, embolia pulmonar, miocarditis, disección aórtica, entre otros. | |
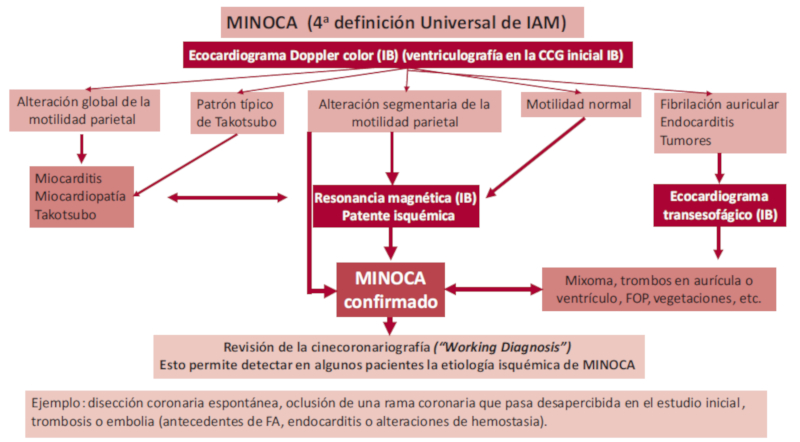
El MINOCA constituye un síndrome clínico angiográfico que, por definición, obedece a diferentes causas, pero cuya fisiopatología debe ser la isquemia miocárdica. Es necesario que exista el diagnóstico de infarto agudo de miocardio de acuerdo a la 4.a definición universal y enfermedad coronaria no obstructiva (<50% o coronarias normales). Con respecto a las causas, puede ser por infarto tipo I (rotura o erosión de placa) o tipo II (espasmo, disección coronaria o enfermedad microvascular); en este contexto, se debe diferenciar de los desajustes de oferta y demanda de oxígeno (crisis hipertensiva o taquiarritmias). Es muy importante también el diagnóstico diferencial con afecciones o daño directo del miocardio, como son las miocarditis o la enfermedad de Takotsubo, que pueden simular un MINOCA. En este sentido, el término MINOCA también puede ser pensado como una clasificación operativa que permite gatillar los algoritmos para confirmar el infarto o diferenciarlo de una enfermedad propia del miocardio (Figuras 1, 2 y 3). Es así como en la literatura se ha incorporado la expresión working diagnosis, que indica un trabajo minucioso para el diagnóstico de MINOCA descartando oclusiones ocultas, disección coronaria o causas no cardíacas. 4
Finalmente, las causas que pueden producir un MINOCA recorren todo el árbol coronario, desde las arterias coronarias epicárdicas hasta la microcirculación inclusive. Esta última tiene la particularidad de representar el 70% de la resistencia vascular miocárdica y no puede observarse en la coronariografía, dado que su calibre es menor que 0,5 mm. En forma resumida, podemos considerar las siguientes patologías que pueden causar MINOCA:
a) Arterias coronarias epicárdicas
Accidente aterotrombótico no obstructivo
Espasmo coronario
Trombosis in situ
Embolia coronaria
Disección coronaria espontánea
b) Microcirculación coronaria
La complicación de una placa aterosclerótica puede producir MINOCA como consecuencia de una obstrucción total que tuvo un proceso de lisis o embolización distal. En pacientes con coronarias normales, solo podremos saber si la causa es por espasmo si lo presenta en forma espontánea o inducida por las pruebas de vasorreactividad. Las trombosis, las embolias y la disección pueden presentarse con obstrucciones <50%, y deberá hacerse el diagnóstico diferencial con los accidentes de placa, o bien estas pueden pasar inadvertidas en la cinecoronariografía, dado que pueden ocluir ramas secundarias o distales. Ante la sospecha de esta situación, se debe revisar nuevamente la cinecoronariografía y tratar de identificar alteraciones de la motilidad parietal que nos permitan establecer cuál ha sido la rama comprometida, y es la resonancia magnética el estándar de oro para identificar la zona infartada (working diagnosis). Una alteración de la microcirculación puede ser la causa de MINOCA, tanto por espasmo como por vasodilatación inadecuada; para confirmar esta situación debemos recurrir también a diferentes pruebas invasivas o no invasivas. A lo largo de este consenso se desarrollan en profundidad cada uno de estos temas.
2. EPIDEMIOLOGÍA DEL MINOCA: prevalencia, factores de riesgo y pronóstico
En la década de 1980, De Wood informó que aproximadamente el 10% de los pacientes con infarto de miocardio no tenían enfermedad coronaria obstructiva de arterias epicárdicas que pudiera justificar el evento.5 Una revisión sistemática de Pasupathy y col. indica una prevalencia de MINOCA del 6%, con un amplio margen que va del 1% al 15%. 6 Esto se debe, principalmente, a diferencias en las poblaciones de estudio y la heterogeneidad de su definición.
En cuanto a la etiología de los MINOCA, los trabajos realizados con resonancia cardíaca (RMC), tomografía de coherencia óptica (OCT) y pruebas de vasorreactividad, comienzan a sugerir las causas más frecuentes. Usando una combinación de resonancia cardíaca y evaluación intravascular con OCT se puede definir la etiología de la isquemia en el 57,5% al 85% de los casos; las causas más frecuentes son los accidentes de placa (rotura 35%, erosión 30% y nódulo cálcico 2,5%) y, en un porcentaje menor de pacientes, la disección coronaria espontánea y la trombosis aislada. 7,8 Además, en un estudio en el que se realizó prueba de vasorreactividad a los pacientes sin etiología evidente, el resultado fue positivo en el 46%; con un 65% atribuible a espasmo de arterias epicárdicas y un 35% a espasmo de la microvasculatura. 9
El pronóstico de los pacientes que presentan MINOCA depende de la causa subyacente y, actualmente, se encuentra bajo una investigación muy activa. La revisión sistemática de Pasupathy y col. informó un mejor pronóstico en los pacientes de MINOCA en comparación con infarto con enfermedad coronaria aterosclerótica (IAM-ECE), con una mortalidad hospitalaria del 1,1% frente al 3,2% (p=0,001) y una mortalidad a los 12 meses del 3,5% y del 6,7% (p = 0,003), respectivamente. 6 El registro VIRGO, por su parte, mostró evoluciones similares entre los pacientes con y sin enfermedad epicárdica, con una mortalidad al mes del 1,1% y 1,7% (p=0,43) y a 12 meses del 0,6% y 2,3% (p = 0,68), respectivamente. Además, existe un riesgo sustancial de recurrencia de eventos durante el seguimiento de los pacientes con MINOCA, que es superior al que se observa en la población general sin enfermedad cardiovascular. 10 Aproximadamente el 25% de los pacientes con MINOCA experimentan angina en los siguientes 12 meses, frecuencia similar a la notificada en pacientes con IAM-ECE. 11
3. ESTUDIOS INVASIVOS EN MINOCA (Tabla 2)
3.1 Oclusión coronaria transitoria producida por rotura, erosión o presencia de nódulos calcificados. OCT e IVUS
La trombosis intravascular es un elemento central en el desarrollo de los síndromes coronarios agudos (SCA). En ocasiones, se trata de un proceso dinámico, con oclusiones y reperfusiones espontáneas.
Los sustratos sobre los cuales se desarrolla este proceso de trombosis suelen ser la rotura de placa (RP), la erosión de placa (EP) y la presencia de nódulos calcificados (NC).
La RP es la lesión predominante, seguida por la EP, con incidencia variable según se trate de estudios histopatológicos o realizados in vivo con OCT. 12,13
Las diferencias histopatológicas entre una placa rota y una placa erosionada se describen en la Tabla 1 del Material Suplementario.
La calcificación nodular es la protrusión del nódulo de calcio hacia la luz del vaso; en la angiografía, puede simular trombosis intraluminal; en ultrasonido y OCT, el aspecto es el de una masa convexa intravascular de superficie irregular. 14
Los métodos para la obtención in vivo de imágenes intravasculares han permitido profundizar los conocimientos relacionados con la fisiopatología de los SCA en general y del MINOCA en particular.
El ultrasonido intravascular (IVUS) es el método más utilizado en la actualidad y permite obtener una imagen bidimensional de la arteria, con una penetración de hasta 10 mm y una resolución espacial de 100 a 200 micrones, lo cual brinda una buena caracterización de la placa, pero limita su utilidad en el diagnóstico del fenotipo de accidente responsable de la trombosis. La histología virtual (tecnologías como IVUS-VH o iMap) utiliza el análisis espectral de radiofrecuencia del IVUS para crear un mapa tisular de la placa con capacidad de identificar núcleo necrótico, área fibroadiposa, área fibrosa y calcio.
La OCT tiene mayor resolución espacial (10 a 20 micrones), pero menor penetración, y requiere del desplazamiento de sangre durante la adquisición. Su mayor resolución la hace el método de elección para la caracterización de placas vulnerables y complicadas en los SCA. La descripción completa comparativa de las características técnicas y la sensibilidad para detectar lesiones ateroscleróticas de la OCT y el IVUS se pueden ver en las Tablas 2 y 3 del Material Suplementario.
En el estudio International Women’s Heart Attack Research Program (HARP) se evaluaron en forma prospectiva con RMC y OCT mujeres con IAM sin lesiones angiográficamente significativas. La OCT logró identificar una lesión posiblemente culpable en el 46% de los casos y la combinación de OCT y RMC identificó la causa probable del MINOCA en el 84,5% de los casos. 8
En el estudio EROSION, los autores sugieren que cuando la causa del SCA es una EP diagnosticada por OCT, un tratamiento de doble antiagregación plaquetaria sin stent puede ser útil en aquellos en los que, inicialmente, la estenosis es menor del 70%. 15
Evidencia más reciente sugiere una menor vulnerabilidad coronaria en pacientes con IAMCEST y lesión responsable con EP, lo que podría explicar, en parte, la mejor evolución alejada de estos pacientes con respecto a aquellos con lesión culpable por rotura de placa. 16
3.2 Disección coronaria espontánea
La disección coronaria espontánea (DCE) es una causa poco frecuente de SCA, caracterizada por una separación no traumática ni iatrogénica de las capas de la pared arterial coronaria. Se presenta con una prevalencia calculada del 1,7% al 4%, aunque en mujeres menores de 50 años, podría representar un 25% o más de los casos. 17,18,19 Un porcentaje significativo de estas pacientes tiene estenosis moderadas con flujo TIMI 3.
El diagnóstico angiográfico no siempre es simple y, en algunos casos, las arterias pueden tener un aspecto pseudonormal. En una serie reciente, la presentación inicial como hematoma intramural fue la más frecuente (62%) y el flujo TIMI 3 estuvo presente en el 64% de los casos. 20
Las técnicas de imagen intravascular (IVUS - OCT) pueden confirmar el diagnóstico en casos dudosos, pero deben realizarse con extrema cautela por la posibilidad de empeorar el traumatismo sobre una pared arterial debilitada.
3.3 Embolia coronaria
La embolia coronaria (EC) puede ser causa de SCA. Una revisión de 12 años de coronariografías en pacientes con IAM sugiere que podría tener una prevalencia de hasta el 3% 21 y su prevalencia en pacientes con MINOCA es desconocida.
El diagnóstico diferencial con la trombosis sobre una disrupción de placa es difícil; se han propuesto criterios mayores y menores que sugieren la etiología embólica. 21 (Tabla 4 del Material Suplementario).
3.4 Espasmo de arterias coronarias
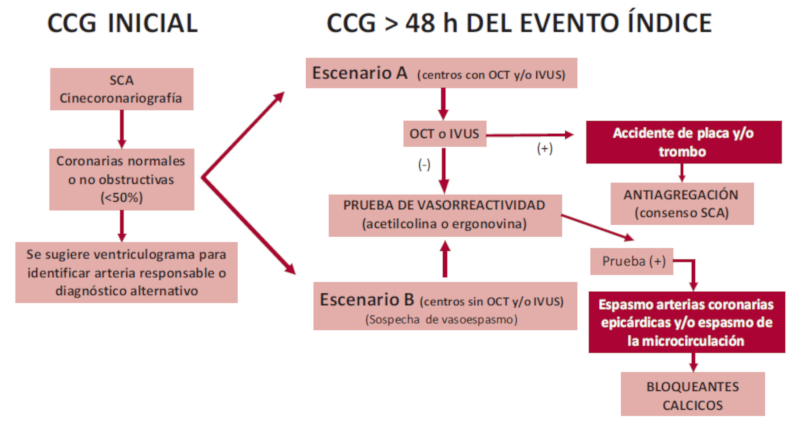
La definición de espasmo coronario ha sido estandarizada internacionalmente por el grupo COVADIS (Coronary Vasomotion Disorders International Study Group); conceptualmente, se puede definir como una intensa vasoconstricción de una arteria coronaria epicárdica (>90%) que compromete el flujo miocárdico, acompañada de angina de pecho y cambios isquémicos transitorios del ECG, que ceden con la utilización de nitratos. 22 (Tabla 5 del Material Suplementario)
El espasmo puede estar ocasionado por una hiperreactividad de la pared vascular ante estímulos endógenos, pero también exógenos (cocaína o metanfetaminas), y, actualmente, se considera de causa multifactorial. 23
Un vasoespasmo prolongado en el tiempo puede ocasionar un MINOCA. En un estudio donde se realizó prueba de vasorreactividad a pacientes con MINOCA sin causa evidente, la prueba fue positiva en el 46% de los casos (65% espasmo de arterias epicárdicas y 35% de la microvasculatura), lo que sugiere que es un mecanismo muy prevalente en esta enfermedad. 9
El diagnóstico debe sospecharse en los pacientes con reiterados episodios de angina en reposo, con patrón específico (por lo común, nocturno), particularmente con elevación transitoria del segmento ST del electrocardiograma, que responden a nitratos. Lamentablemente, esto ocurre en la minoría de los casos y se debe recurrir a las pruebas de provocación de espasmo coronario para llegar al diagnóstico. Estas pruebas pueden realizarse de forma segura con inyección intracoronaria (IC) de acetilcolina (ACh) o ergonovina (Ergo), como se destaca en una revisión sistemática de 10 estudios que comprendieron 9444 pacientes, donde no se reportaron muertes y hubo una incidencia baja de complicaciones, tanto mayores (taquicardia ventricular o fibrilación ventricular) como menores (bradicardia transitoria, bloqueo auriculoventricular avanzado o fibrilación auricular paroxística). En comparación con la Ergo, la ACh mostró una tasa significativamente mayor de complicaciones mayores (1,09% vs. 0,15%; p <0,001) y menores (5,87% vs. 2,36%; p <0,001). 24
3.4.1 Disfunción microvascular coronaria. Espasmo de la microcirculación
Los trastornos en la microcirculación, conocidos como disfunción microvascular (DMV), pueden ser causa de MINOCA, tanto por espasmo como por vasodilatación inadecuada, y se pueden poner en evidencia en el laboratorio de hemodinamia con una prueba endotelio-dependiente o endotelio-independiente, de acuerdo con la respuesta a la ACh (liberación de óxido nítrico del endotelio normal) o adenosina (estimulación de receptores A2 del músculo liso de la pared vascular), respectivamente. 25 Se ha establecido una definición estandarizada de angina microvascular que incluye a pacientes con angina de pecho, arterias coronarias sin obstrucciones y una alteración en el flujo coronario. 26 (Tabla 6 del Material Suplementario).
El diagnóstico de espasmo microvascular es indirecto, dado que la microcirculación coronaria no puede ser visualizada debido a su pequeño diámetro (500 μm). Si al utilizar la prueba de ACh o Ergo se induce la aparición de cambios isquémicos en el electrocardiograma, angina o bien elevación de ácido láctico en el seno coronario, sin alteración visible del flujo en las arterias epicárdicas, se asume el diagnóstico de espasmo microvascular.
Los trastornos clínicos de disfunción microvascular coronaria se han descrito, en gran medida, en pacientes que presentan angina estable. 27 La alteración de la reserva de flujo coronario se determina con la respuesta hiperémica a estímulos vasodilatadores, como la inyección intracoronaria de adenosina.
Los trastornos de la microcirculación también pueden medirse por el flujo coronario lento, un fenómeno angiográfico que puede ocurrir espontáneamente y se caracteriza por un retraso en el pasaje de contraste angiográfico, de tal manera que para llenar un vaso coronario epicárdico en reposo deben pasar tres o más latidos cardíacos (>25 fotogramas para teñir completamente de contraste una arteria coronaria). 28
En la práctica clínica, la evaluación de espasmo de arterias coronarias epicárdicas y de DMV podría ser más adecuada utilizando pruebas combinadas.
La disfunción microvascular coronaria se puede detectar en el 30% al 50% de los pacientes con angina crónica estable sin obstrucciones coronarias significativas en la angiografía coronaria; 27) sin embargo, su incidencia como causa de MINOCA es desconocida.
3.4.2 Pruebas invasivas evocadoras de espasmo coronario
La vasodilatación endotelio-dependiente puede ser estimulada de diferentes formas, pero la más común es la infusión de ACh, que, en condiciones normales y con un endotelio sano, produce vasodilatación por la liberación de óxido nítrico a través de receptores muscarínicos. Cuando hay daño endotelial o se bloquea la óxido nítrico sintetasa, la arteria responde a la ACh con vasoconstricción por estímulo de los receptores muscarínicos del músculo liso, sin antagonismo por la ausencia de óxido nítrico. La Ergo actúa a través de los receptores serotoninérgicos. Diferentes mediadores pueden tener el potencial de causar diferentes respuestas. Goto y col. demostraron similar respuesta con ambos fármacos en los 134 vasos de 171 pacientes con estenosis <50%. La concordancia fue del 94% en todos los vasos. La tasa de no concordancia de la coronaria derecha fue significativamente más alta que la de la coronaria izquierda (10% vs. 4%; p <0,01). Sin embargo, la ACh provocó espasmos más difusos y distales y la Ergo provocó espasmos focales y proximales.
La sensibilidad de la inyección intracoronaria (IC) de ACh fue del 90% en la angina variante y la especificidad alcanzó el 99%. A menudo se observó espasmo coronario multivaso. 29 La prueba de provocación de espasmo de ACh reemplazó a la inyección endovenosa de Ergo como la prueba estándar para la inducción de espasmo de las arterias coronarias en los laboratorios de cateterismo en Japón. La inyección IC de ACh es el estándar de oro para diagnosticar la angina variante. Este método se emplea para documentar el espasmo de las arterias coronarias.
3.4.3 Contraindicaciones para realizar una prueba de espasmo
Estenosis del tronco de coronaria izquierda (>50%).
Enfermedad coronaria de tres vasos.
Enfermedad de dos vasos con oclusión total.
Insuficiencia cardíaca (clase III o IV de la New York Heart Association).
Insuficiencia renal (creatinina >2,0 mg /dl).
Asma bronquial grave.
Cuando se observa espasmo espontáneo.
Cuando se utilizó dinitrato de isosorbida para aliviar los espasmos en la arteria coronaria examinada.
Mujeres embarazadas.
Pacientes con hipertensión no controlada.
Cuando se utiliza la vía radial para realizar la coronariografía, se recomienda utilizar introductores largos para evitar el espasmo.
Se sugiere también un período de “lavado” de 2 días o más para cualquier bloqueador de los canales de calcio y nitratos de acción prolongada siempre que sea posible, para una mayor precisión diagnóstica.
El estudio requiere la firma de consentimiento informado.
3.4.4 Interpretación de la prueba de espasmo coronario
Resultados posibles:
Prueba negativa con respuesta vasodilatadora: vasodilatación sin síntomas ni cambios en el electrocardiograma; endotelio normal.
Prueba negativa con respuesta vasoconstrictora: vasoconstricción sin síntomas ni cambios en el electrocardiograma; indicativa de disfunción endotelial, sobre todo con la dosis inicial.
Prueba positiva de espasmo epicárdico, requiere los siguientes tres criterios:
reproducción de los síntomas.
cambios electrocardiográficos sugestivos de isquemia, usualmente elevación o depresión de ST 0,1 mV. Se ha descripto también la aparición de onda U negativa.
espasmo ≥90% del diámetro del mismo segmento de la arteria respecto del basal (con administración previa de nitroglicerina); puede ser focal, multisegmentario o difuso.
Prueba positiva de espasmo microvascular: síntomas y cambios electrocardiográficos (igual que el anterior), pero sin visualización de espasmo coronario epicárdico.
Fórmula para medir el diámetro de la estenosis por vasoespamo coronario:
Diámetro de la estenosis = 100 - [(vasoconstricción con ACh-Ergo/diámetro pos-NTG) x 100]. Resultado positivo ≥90%. 30
Se recomienda usar análisis cuantitativo coronario automático (QCA) del diámetro del vaso.
3.4.5 Prueba de acetilcolina y ergonovina. Protocolo para su utilización (ver Material Suplemetario)
3.4.6 Seguridad de las pruebas de vasoespasmo
Realizadas por grupos con experiencia, las pruebas de acetilcolina y ergonovina son seguras, y, en grandes series con más de 2500 pacientes, no se registran complicaciones mayores. 31
En un metaanálisis de varios estudios con más de 6000 procedimientos, los porcentajes de complicaciones mayores (arritmias ventriculares, necesidad de reanimación cardiopulmonar o infarto) y menores (bradicardia sintomática, bloqueo auriculoventricular transitorio, aparición de arritmias auriculares o embolia aérea) fueron del 1% y 6%, respectivamente, sin que se registrara la muerte de ningún paciente. 24 (Tabla 11 del Material Suplementario).
Tabla 2 Recomendaciones para la realización de estudios invasivos en MINOCA
| Recomendación | Clase | Nivel de evidencia | |
| ( | Realizar ventriculografía en la cinecoronariografía inicial para evaluar motilidad parietal si no ha sido valorada por otro método y no hay contraindicaciones (insuficiencia cardíaca o renal). | I | B |
| ( | Realizar IVUS u OCT en pacientes con sospecha de MINOCA en el cateterismo diagnóstico inicial para identificar rotura, erosión de placa o trombosis. 15 (centro con disponibilidad). | IIa | B |
| ( | Realizar IVUS u OCT para identificar rotura o erosión de placa en pacientes en los que la RMC sugiere infarto por compromiso de vaso epicárdico. 14,15 | IIa | B |
| ( | Por su mayor definición, la OCT es preferible al IVUS en la caracterización del endotelio coronario. 32 | IIb | B |
| ( | Realizar prueba de vasorreactividad intracoronaria en pacientes con sospecha de vasoespasmo coronario, descartando otras causas de MINOCA (DCE, trombosis o embolias) luego de 48 h del evento índice. 15 | IIa | B |
| ( | No realizar prueba de vasorreactividad con FE <35% o enfermedad coronaria significativa (TCI >50% o algún vaso principal >70%). | III | C |
IVUS: ultrasonido intravascular. OCT: tomografía de coherencia óptica. MINOCA: infarto de miocardio con arterias coronarias no obstructivas. DCE: disección coronaria espontánea. FE: Fracción de eyección
4. ESTUDIOS NO INVASIVOS EN MINOCA (Tabla 3)
4.1 Ecocardiograma y Doppler cardíaco color en la evaluación de MINOCA
Debido a su amplia disponibilidad, costo relativamente bajo y ausencia de contraindicaciones, la ecocardiografía transtorácica (ETT) puede emplearse en la valoración inicial del paciente con sospecha de SCA en los servicios de emergencia. 33 El objetivo principal del estudio está orientado a la detección de trastornos de motilidad miocárdica (tanto regional como global) de ambos ventrículos que sugieran la presencia de isquemia o necrosis para el diagnóstico diferencial con miocarditis, Takotsubo, cardioembolias y causas no coronarias, entre otras.
4.1.1 Microcirculación coronaria evaluada por Doppler
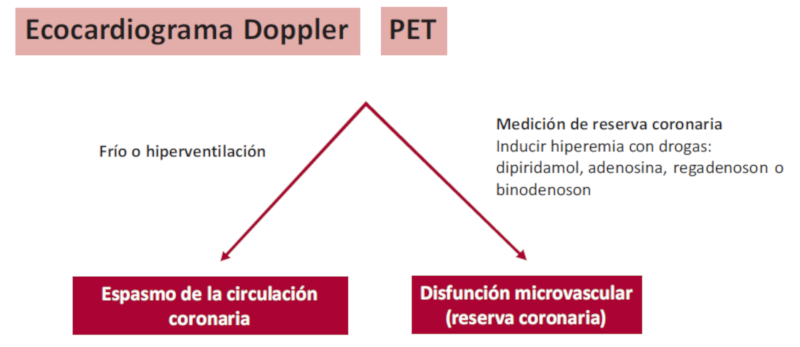
En los pacientes con MINOCA, la evidencia de disfunción microvascular permite establecer la posible causa de la isquemia. Desde el punto de vista ecocardiográfico, puede evaluarse en forma integral la circulación coronaria a través de la medición de la reserva coronaria (RC). 26 Esta resulta del cociente entre la velocidad diastólica del flujo coronario durante el apremio en relación con el basal, y se considera normal un valor mayor o igual a 2. Se lleva a cabo con una elevada factibilidad (mayor del 95%) en la porción media/distal de la arteria descendente anterior (DA), dada su proximidad con la pared torácica, y puede realizarse también sobre la arteria descendente posterior (60%) y arteria obtusa marginal (rama de la circunfleja) en aproximadamente un 40% de los pacientes explorados. La inducción de hiperemia se realiza con adenosina o dipiridamol. Hay que tener en cuenta que esta evaluación no discrimina entre enfermedad macrovascular y microvascular. El diagnóstico de DMV se establece cuando hay reducción de la RC y se descarta una lesión coronaria epicárdica subvalorada. 34
Una vez superado el cuadro agudo, los pacientes con disfunción microvascular suelen presentar un patrón de respuesta al eco estrés que consiste en angina, cambios electrocardiográficos, ausencia de alteraciones de la motilidad y eventual compromiso de la RC. La falta de trastornos de la motilidad miocárdica es consecuencia de la alteración del subendocardio de manera limitada y, posiblemente, parcheada, que no llega a alcanzar una masa crítica para producir hipocinesia. 35 Se ha postulado que la evaluación de la deformación longitudinal y circunferencial por speckle tracking (rastreo de marcas) por estratos del miocardio puede sugerir isquemia microvascular en pacientes con eco estrés con dipiridamol sin trastornos en la motilidad, pero con signos de isquemia en el electrocardiograma y síntomas. 36
En la Tabla 12 del Material Suplementario se resumen las ventajas y limitaciones de la determinación de la reserva coronaria por ecocardiografía.
4.1.2 El ecocardiograma en el estudio del espasmo vascular
En aquellos pacientes en los que se sospecha vasoespasmo coronario como causa de MINOCA, es posible su estudio no invasivo mediante ecocardiografía utilizando diferentes apremios: hiperventilación, hiperventilación combinada con ejercicio e hiperventilación combinada con frío.
La prueba de eco estrés con Ergo intravenosa no está avalada en las principales guías de recomendaciones clínicas debido al riesgo de complicaciones, que eventualmente pueden ser graves, sobre todo el espasmo coronario refractario. 37
4.2 Evaluación de la disfunción coronaria microvascular con cámara gamma
Una sustancial proporción de pacientes sintomáticos en el contexto de enfermedad epicárdica no obstructiva presenta disfunción microvascular (DMV) como sustrato funcional, la cual no puede ser diagnosticada por estudios que brindan información anatómica. 38,39 Desde la cardiología nuclear, las guías europeas recomiendan la evaluación de la reserva coronaria por tomografía por emisión de positrones (PET), con una indicación clase IIb, nivel de evidencia B, como subrogante de la DMV. 40 Más recientemente, las guías de uso apropiado de la sociedad de medicina nuclear de Estados Unidos (SNMMI) consideran como apropiada la evaluación de la microcirculación por PET en pacientes con enfermedad no obstructiva y sintomáticos por dolor precordial. 41 La PET junto con los trazadores de perfusión (N-13 amonio y Rb-82) permite la evaluación de la perfusión miocárdica, la función ventricular y la cuantificación del flujo sanguíneo miocárdico (FSM) en mililitros por gramo por minuto. Esta cuantificación absoluta de flujo se realiza en forma global, por territorio vascular coronario y por segmento del ventrículo izquierdo. 42 La evaluación del FSM durante el estrés farmacológico (adenosina, dipiridamol, regadenoson) y en reposo permite el cálculo de la RC (RC = FSM hiperémico/FSM reposo). La RC es un parámetro que evalúa los efectos de la enfermedad coronaria epicárdica, de la enfermedad aterosclerótica difusa y de la disfunción microvascular sobre la perfusión del tejido miocárdico. Se considera RC preservada cuando el valor es mayor de 2,5; cuando es de 2-2,5 se considera como zona gris y cuando es menor de 2 se asume como patológica. 43 Demostrar una disminución de la RC es hoy una parte del diagnóstico integral de la angina microvascular en pacientes con dolor precordial. 26
La estimulación simpática inducida por el test del frío nos indica, preferentemente, la vasodilatación de la microcirculación endotelio-dependiente. 42 La cuantificación absoluta del FSM en reposo y frío podría ser de utilidad para desenmascarar el espasmo microvascular como causa de dolor precordial en pacientes con EC no obstructiva. Un incremento del FSM mayor del 50% ante el frío nos refiere una función endotelial preservada. 42
La técnica de perfusión miocárdica relativa convencional con SPECT en reposo, frío y dipiridamol brinda muy poco rédito diagnóstico en la mayoría de los pacientes con angina microvascular y no se recomienda. 42,44
Ante la posibilidad de realizar un estudio de cuantificación del FSM absoluto y calcular RC o medir respuesta del FSM al frío, recomendamos realizar estos estudios a aquellos pacientes con sospecha de disfunción microvascular como causa de MINOCA, o que presenten dolor precordial persistente, a pesar del tratamiento médico óptimo. 45
4.3 Diagnóstico de MINOCA con resonancia magnética y angiotomografía coronaria
En pacientes con diagnóstico presuntivo de MINOCA, la resonancia magnética cardíaca permite la aproximación diagnóstica en el 70% de los casos; el resto presenta estudios normales. Por otro lado, cabe destacar que el paciente con MINOCA que presenta una RMC normal tiene un buen pronóstico alejado. 46
La RMC permite evaluar alteraciones de la motilidad en las secuencias cines, la presencia de edema miocárdico en las secuencias ponderadas en T2 y la presencia de inflamación y fibrosis a nivel miocárdico a través de la secuencia de tardío (RT). Las imágenes de T1 mapping permiten evaluar injuria y fibrosis difusa, y las imágenes de T2 mapping son más exactas para la cuantificación del edema que las secuencias tradicionales de T2. 47
La secuencia ponderada en T2 es conveniente efectuarla de forma temprana, dentro de las 2 semanas del inicio de los síntomas, antes que la injuria miocárdica resuelva o revierta, a fin de aumentar la performance diagnóstica, fundamentalmente en la miocarditis y el síndrome de Takotsubo. 48 La presencia de realce tardío y sus distintos patrones de distribución a nivel miocárdico otorgan la mejor performance diagnóstica de la RMC. 1,48
La angiotomografía coronaria tendría utilidad cuando existen dudas sobre la presencia de aterosclerosis o disección de las arterias coronarias, así como para valorar la extensión y caracterizar las lesiones coronarias en pacientes con MINOCA. 3 También es posible la evaluación de la reserva de flujo fraccional (FFR) de manera no invasiva por angiotomografía coronaria. 49 Los hallazgos de la angiotomografía podrían seleccionar a pacientes aptos para técnicas invasivas como la OCT o el IVUS y definir la naturaleza del MINOCA. 50
4.3.1 Infarto agudo de miocardio
Las lesiones isquémicas son reconocidas por presencia de alteraciones de la motilidad parietal (hipocinesia, acinesia o discinesia), edema y realce tardío subendocárdico o transmural en segmentos relacionados con un territorio coronario. 51 Asimismo, ante la presencia de lesiones de características embólicas, se deberá excluir la presencia de fuentes embolígenas, como el foramen oval permeable, el fibroelastoma papilar y el mixoma. 52
4.3.2 Miocarditis
La miocarditis representa un 27-33% de los pacientes con sospecha diagnóstica de MINOCA. 48,53 Los criterios de Lake Louise modificados para el diagnóstico de miocarditis con la incorporación de las secuencias de T1 y T2 mapping refuerzan el rol de la resonancia magnética, con una sensibilidad y especificidad superior al 90%. 54,55
En las secuencias ponderadas en T2 y T2 mapping, el edema puede ser localizado o difuso. El edema difuso puede no ser discernible visualmente, por lo que se recomienda realizar el análisis cuantitativo de la intensidad de señal del músculo cardíaco y el esquelético, considerando patológico un valor mayor de 1,9 de la razón entre ambos o mediante secuencia de T2 mapping. 56 Es recomendable realizar las secuencias de T2 edema de forma temprana, dentro de las 2 semanas, a fin de aumentar el rédito diagnóstico, dado que la presencia de edema es un fenómeno que desaparece con la resolución del cuadro. 48
El realce tardío miocárdico se manifiesta con dos patrones comunes de presentación, intramiocárdico a predominio septal y epicárdico/intramiocárdico, generalmente parcheado a nivel de la pared lateral del ventrículo izquierdo. 54 Por regla general, el subendocardio no se halla comprometido en pacientes con miocarditis, hecho que lo diferencia claramente de la fibrosis característica del infarto de miocardio. 56 Las secuencias de T1 mapping muestran prolongación de la señal del miocardio en las áreas de injuria por miocarditis. 55
4.3.3 Takotsubo
El síndrome de Takotsubo representa un 9-11% de los pacientes con diagnóstico inicial de MINOCA. 48,57 En las secuencias cine, es característica la hipocinesia o acinesia de los segmentos medios y apicales asociada a hiperdinamia de los segmentos basales. Otra característica distintiva del síndrome de Takotsubo es la ausencia de defectos de perfusión en reposo y realce tardío. 58,59,60
4.3.4 Miocardiopatías
Ocasionalmente, las miocardiopatías se manifiestan como MINOCA, entre ellas se encuentran la miocardiopatía dilatada y la miocardiopatía hipertrófica. 52 La RMC colaboraría en el diagnóstico diferencial en estas entidades, principalmente a través de la evaluación morfológica y la presencia de realce tardío.
Tabla 3 Recomendaciones para la realización de estudios no invasivos en MINOCA
| Recomendación | Clase | Nivel de evidencia | |
| - | Realizar ecocardiograma transtorácico en pacientes con MINOCA, con el objetivo de valorar la presencia de trastornos de motilidad regional y global de ambos ventrículos y para valorar diagnósticos alternativos (cardioembolias, miocardiopatías, síndrome aórtico agudo, entre otros). 33 | I | B |
| - | Realizar ecocardiograma transesofágico cuando se sospecha la etiología cardioembólica como causa del cuadro de MINOCA y el estudio transtorácico no es concluyente al respecto. | I | B |
| - | En pacientes con MINOCA y sospecha de disfunción microvascular, la valoración de la reserva coronaria de manera no invasiva a través del ecocardiograma transtorácico es una opción razonable. | IIa | C |
| - | En pacientes en los que se sospecha vasosespasmo como causa de MINOCA, puede utilizarse un ecocardiograma estrés con hiperventilación y/o frío para confirmar este diagnóstico. | IIa | C |
| - | En pacientes con MINOCA o que continúan con episodios de dolor precordial, a pesar del tratamiento médico óptimo, se recomienda la prueba de PET o SPECT-CZT (SPECT basado en cadmiumzinc-telluride) inducida por vasodilatadores intravenosos (dipiridamol, adenosina, regadenoson o benodenoson); esta constituye un método adecuado para cuantificar el FSM absoluto y calcular RC o medir respuesta del FSM al frío (disfunción endotelial).61 | IIb | C |
| - | No se recomienda SPECT dada su baja sensibilidad | III | B |
| - | La RMC está indicada en todo paciente con MINOCA sin una causa subyacente evidente.4,6,47,50,52 | I | B |
| - | La angiotomografía coronaria no invasiva permite dilucidar causas de MINOCA ocultas en la CCG convencional (DCE, oclusiones ocultas) y valorar en forma no invasiva FFR.50,51,62 | IIb | B |
MINOCA: infarto de miocardio con arterias coronarias no obstructivas. PET: tomografía con emisión de positrones. SPECT: tomografía computarizada por emisión de fotón único. RMC: resonancia magnética cardíaca. FSM: flujo sanguíneo miocárdico. RC: reserva coronaria. DCE: disección coronaria espontánea. FFR: reserva de flujo fraccional. CCG: cinecoronariografía
5. TROMBOSIS CORONARIA ESPONTÁNEA EN MINOCA
La trombosis aguda de una arteria coronaria puede estar asociada a un accidente de placa (rotura, erosión, ulceración, nódulo cálcico), pero también puede ocurrir sin evidencia de enfermedad aterosclerótica subyacente; como desarrollaremos en este apartado. En ambos casos, la trombosis intracoronaria puede estar relacionada con estados de hipercoagulabilidad (hereditarios o adquiridos), que deben ser sospechados y estudiados, ya que pueden tener un tratamiento específico (Tabla 4).
Tabla 4 Sospecha de estados de hipercoagulabilidad
| Sospechar la presencia de estados de hipercoagulabilidad adquirida o hereditaria en pacientes con MINOCA con las siguientes características: | |
| - | Pacientes jóvenes, especialmente mujeres sin factores de riesgo. |
| - | Anemia, trombocitopenia y esquistocitos en el frotis (PTT). |
| - | Trombosis previas, complicaciones del embarazo, accidente cerebrovascular (ACV), bajo recuento plaquetario o KPTT incrementado (síndrome antifosfolípido). |
| - | Trombosis venosas o arteriales previas (oncohematológicas). |
| - | Exposición a heparina y descenso del recuento plaquetario (>50% respecto del valor anterior al uso de heparina (HIT). |
| - | Infección por COVID o vacunación reciente con fármacos sospechados de VITT. |
PTT: Púrpura trombótica trombocitopénica. HIT: Trombocitopenia inducida por heparin. VITT: Trombocitopenia trombótica inmunitaria inducida por vacuna
5.1 Trombofilias y trombosis arteriales
Las trombofilias son alteraciones congénitas o adquiridas que predisponen a la aparición de fenómenos trombóticos arteriales y venosos.
Las trombofilias hereditarias no son infrecuentes en la población general y son halladas en el 14% de los pacientes con MINOCA. 6 Son más frecuentes en mujeres jóvenes y tienen variaciones según la raza y las etnias. 63 Son algunos ejemplos el factor V de Leiden, la elevación del factor de Von Willebrand, la resistencia o la deficiencia de proteína C o de proteína S y el polimorfismo del inhibidor del activador del plasminógeno (PAI). 64 Este último ha demostrado incrementar el riesgo de enfermedad coronaria, especialmente la variante homocigota 4G4G (la variante heterocigota es común en la población general). El resto de las trombofilias hereditarias se asocian, más que nada, a eventos venosos, por lo que no deberían estudiarse en fenómenos arteriales como el MINOCA. 65
Los pacientes con trombofilias adquiridas tienen una mayor prevalencia de infarto de miocardio (y de otras trombosis arteriales o venosas) que la población general; la entidad clínica de mayor peso fisiopatogénico es el síndrome antifosfolípido. También pertenecen a este grupo, aunque con menor prevalencia, la púrpura trombótica trombocitopénica (PTT), las enfermedades oncohematológicas y la hemoglobinuria paroxística nocturna. La exposición a heparina debe hacer considerar la presencia de una trombocitopenia inducida por heparina.
A partir de la pandemia por COVID-19, se están adquiriendo nuevos conocimientos sobre los efectos protrombóticos de la infección por coronavirus y de la trombocitopenia trombótica inducida por vacunas (VITT) en la prevalencia y la evolución de eventos cardiovasculares. 66,67 Sin embargo, aún no pueden sacarse conclusiones robustas como para comentar estos hallazgos. 68
5.2 Tratamiento (Tabla 5)
En el caso de trombosis intracoronaria sospechada o probada, es razonable continuar con doble terapia antiplaquetaria por al menos un mes o hasta hacer el diagnóstico de trombofilia. El tratamiento con aspirina debe permanecer en forma indefinida.
El tratamiento anticoagulante con antagonistas de la vitamina K está indicado solo en los pacientes con síndrome antifosfolipídico, sumado a aspirina (RIN entre 2 y 3). No está indicado el tratamiento con anticoagulantes orales directos (DOAC). 69
Tabla 5 Recomendaciones para la realización de estudios y tratamiento en pacientes con sospecha o confirmación de estados de hipercoagulabilidad
| Recomendación | Clase | Nivel de evidencia | |
| - | Ante la sospecha de un estado de hipercoagulabilidad, referir al paciente a un especialista en hematología para su estudio e indicación de tratamiento anticoagulante y otro específico, cuando corresponda. | I | C |
| - | El estudio de los factores procoagulantes debe realizarse al menos 12 semanas luego del evento agudo y debe incluir al menos los 3 test asociados con el síndrome antifosfolípido y el polimorfismo del PAI. 70 | I | B |
| - | En los pacientes con sospecha de trombosis coronaria espontánea, se debería indicar doble antiagregación plaquetaria (AAS + inhibidores P2Y12), desde la fase aguda hasta completar los estudios de trombofilias. | IIa | C |
| - | En pacientes con síndrome antifosfolípido, debe iniciarse anticoagulación con antagonistas de la vitamina K. 69 | I | B |
| - | No está indicada la utilización de anticoagulantes directos. 69 | III | B |
6. TRATAMIENTO DE LOS MINOCA
El tratamiento de MINOCA dependerá de la causa subyacente que lo produce. La importancia de utilizar algoritmos que permitan establecer la causa es fundamental. En casos en donde la etiología del MINOCA no se ha podido confirmar, el concepto de sospecha clínica (arterias con enfermedad aterosclerótica, criterios COVADIS para espasmo de arterias epicárdicas y enfermedad microvascular) juega un rol importante para el tratamiento empírico.
6.1 Tratamiento de causas específicas (Tabla 6)
6.1.1 Infarto de causa aterosclerótica
Dado que un elevado porcentaje de los casos de MINOCA tienen la misma fisiopatología que los síndromes coronarios agudos con enfermedad obstructiva significativa, es razonable considerar y son de fundamental importancia las medidas estrictas y monitoreadas de control de los factores de riesgo coronario (tabaquismo, hipertensión arterial, dislipidemia y diabetes) y el estímulo para favorecer la actividad física, el control de peso y una alimentación saludable, tal como lo establecen los consensos de prevención cardiovascular de la Sociedad Argentina de Cardiología. 71
Respecto del tratamiento farmacológico, una de las drogas más recomendadas internacionalmente en los MINOCA es la aspirina, sobre todo cuando existen evidencias o alta sospecha de erosión o accidente de placa. 1,2,72,73,74
La doble antiagregación plaquetaria (DAPT) es el tratamiento de elección en los SCA 75,76; en cambio, la evidencia en los MINOCA es contradictoria, limitada, sesgada y proviene de análisis restrospectivos de registros multicéntricos de países europeos (SWEDEHEART, Pro ACS) o de análisis post hoc de subgrupos de estudios aleatorizados con poblaciones como la del estudio CURRENT-OASIS 7, donde se evaluó el uso de DAPT en 1599 pacientes con MINOCA y se observó incluso que con altas dosis de clopidogrel aumentaba el riesgo de eventos cardiovasculares mayores sin un incremento del sangrado (HR 2,74; p=0,033). 77,78,79
El registro sueco SWEDEHEART 77 realizó un análisis de la evolución a 4 años de 9136 pacientes con diagnóstico de infarto sin obstrucciones coronarias >50%. La utilización de inhibidores de la enzima convertidora de angiotensina (IECA) o antagonistas de la angiotensina II (ARA II) demostró una reducción del 18% de eventos cardiovasculares mayores (HR 0,82; IC 95% 0,73-0,93); la utilización de estatinas demostró una reducción del 23% (HR 0,77; IC 95% 0,68-0,87). Con betabloqueantes, se encontró reducción de eventos cardiovasculares mayores, pero sin alcanzar una diferencia estadísticamente significativa (reducción del 14%; HR 0,86; IC 95% 0,74-1,01, p=ns) y con DAPT no hubo diferencias significativas para el evento combinado a 1 año (HR 0,90; IC 95% 0,74-1,08).
En todos los casos, la utilización de DAPT debe evaluarse cuidadosamente dada la ecuación riesgo-beneficio: riesgo isquémico vs. riesgo hemorrágico.
En 2021, Nordenskjöld y col. presentaron el estudio MINOCA-BAT 79, un estudio multicéntrico, prospectivo, aleatorizado, controlado y abierto, que intentará evaluar en un diseño factorial 2 x 2 la utilidad de los betabloqueantes y los IECA/ARA II para reducir el punto final compuesto de muerte de cualquier causa, reinternación por infarto, ACV o insuficiencia cardíaca en el seguimiento de pacientes sin disfunción ventricular izquierda ni insuficiencia cardíaca durante la internación.
6.1.2 Infarto de causas no ateroscleróticas
6.1.2.1 Angina vasoespástica
En la angina vasoespástica debe recomendarse la suspensión del tabaco y mantener un adecuado control de la presión arterial, de la glucemia, de los lípidos y del peso corporal. 37
Los nitratos son los fármacos de elección y los bloqueantes cálcicos, solos o combinados con nitratos, se emplean en caso de episodios refractarios a la monoterapia. Una dosis promedio de 240-360 mg/día de verapamilo o diltiazem, o de 40-60 mg/día de nifedipina, previene en un 90% el espasmo coronario.
Los betabloqueantes están desaconsejados en este tipo de angina, debido a que al bloquear el efecto β pueden dejar liberado el efecto α vasoconstrictor. 80
6.1.2.2 Angina microvascular
La angina de causa microvascular posee mecanismos distintos. El estudio BHF CorMicA (British Heart Foundation Coronary Microvascular Angina)45, analizó en una población de pacientes con isquemia con coronariopatía no obstructiva (INOCA) , si un tratamiento estratificado de acuerdo a la fisiología coronaria estudiada de forma invasiva, mejora la calidad de vida vs un tratamiento estándar. A la población con alteración microvascular se los trató con betabloqueantes (nebivolol), cambios en el estilo de vida, estatinas e IECA y a los pacientes con angina vasoespástica se los trató estimulando el cese tabáquico y cambios del estilo de vida, el uso de bloqueantes cálcicos y nitratos de larga duración. La respuesta a 6 meses fue una reducción significativa en eventos anginosos y un incremento significativo en la calidad de vida, lo cual sugiere que la evaluación de la fisiología coronaria de forma invasiva y el entendimiento fisiopatológico de los síntomas permite un tratamiento personalizado (medicina de precisión) con mejoría de la calidad de vida.
El registro REACH 81 no encontró beneficios en la utilización prolongada de betabloqueantes, tanto en pacientes con infarto previo como pacientes con enfermedad coronaria sin infarto previo y pacientes con factores de riesgo cardiovascular. Las estatinas podrían tener un mecanismo protector a través de su acción sobre el endotelio. Los bloqueantes cálcicos presentan una respuesta errática. En algunos estudios han demostrado beneficio, probablemente por el comportamiento mixto de vasoconstricción a nivel microvascular. Los nitratos, si bien pueden tener alguna utilidad en el momento anginoso, suelen ser poco tolerados en estos pacientes.
Mención aparte merecen los IECA/ARA II. Estudios de la década de los 90, como el de Kaski y col. 82, demostraron efectos beneficiosos de estos fármacos en reducción de eventos en los pacientes reconocidos en esa época como síndrome X. El mecanismo no está del todo claro. Una de las hipótesis sería que estos fármacos podrían mejorar la función microvascular al contrarrestar el efecto vasoconstrictor de la angiotensina II.
Cualquiera sea la duración del tratamiento, tampoco está determinado sobre la base de datos de estudios aleatorizados, pero en algunos registros puede encontrarse una tendencia a la reducción de los síntomas luego de 6 meses del evento, por lo que sería prudente mantener el tratamiento y reevaluarlo al cumplir dicho período, según cada caso en particular.
6.1.2.3 Disección coronaria
Una vez realizado el diagnóstico de DCE, se debe preferir el tratamiento conservador (basado en opiniones de expertos). 83,84,85,86 En el seguimiento, se debe evitar la angiografía coronaria recurrente de rutina, dado que el beneficio no supera los riesgos potenciales (disecciones iatrogénicas). Se recomienda obtener imágenes arteriales extracoronarias dada la asociación con las displasias fibromusculares en otros territorios.
No existen pautas con respecto al tratamiento médico óptimo de las DCE. Existe evidencia favorable para la utilización de betabloqueantes. 84
6.1.3 Terapéuticas antianginosas de segunda línea o elección
La trimetazidina, la ranolazina (ambas disponibles en el país) y el nicorandil (no disponible en el país) son drogas con menor evidencia sobre puntos finales duros en los MINOCA 87,88,89,90,91. El metaanálisis de Zhu y col. ha informado que la ranolazina y el nicorandil podrían tener efectos beneficiosos sobre la el índice de reserva de perfusión miocárdica y el índice de resistencia microvascular en pacientes con disfunción microvascular. 92 En todo caso, constituyen alternativas que podrían indicarse en forma escalonada en los casos refractarios a los medicamentos de primera línea anteriormente mencionados. La evidencia es aún menos firme en el caso de otras drogas como la aminofilina o el dipiridamol, explorados con escasa evidencia en los cuadros coronarios estables y mínima en los MINOCA.
Tabla 6 Tratamiento de MINOCA (trombosis en apartado específico)
| Recomendación | Clase | Nivel de evidencia | |
| - | Sospecha o evidencia de accidentes de placa o erosión: comenzar con antiagregantes, de acuerdo con las guías nacionales de síndromes coronarios agudos. 75,76 | I | C |
| - | Estatinas a dosis intensiva en todos los pacientes con MINOCA.77 | I | B |
| - | En los casos de evidencia o alta sospecha de vasoespasmo de arterias coronarias epicárdicas o espasmo microvascular, se recomienda el uso de bloqueantes cálcicos (diltiazem, verapamilo) y nitratos (endovenosos y orales). 93,94,95,96,97 | I | B |
| - | En los casos de evidencia o alta sospecha de disfunción microvascular, se recomienda el uso de betabloqueantes (nebivolol), bloqueantes cálcicos, estatinas y IECA y ARA II, salvo contraindicaciones o intolerancia. | IIa | C |
| - | En pacientes con disfunción microvascular que no responden a las recomendaciones previas, se recomienda tratamiento con trimetazidina o ranolazina. | IIa | C |
| - | En los casos de disección coronaria espontánea, se recomiendan los betabloqueantes, junto con la aspirina. | IIa | C |
MINOCA: infarto de miocardio con arterias coronarias no obstructivas. IECA: inhibidores de la enzima convertidora de angiotensina. ARA II: antagonistas de los receptores de angiotensina II
7. PERSPECTIVAS FUTURAS
La definición de MINOCA como un síndrome ha permitido englobar a una serie de patologías coronarias agudas de origen isquémico que no pueden ser explicadas por la clásica obstrucción coronaria de causa aterosclerótica. Lo sencillo y complejo de esta patología radica en seguir los algoritmos diagnósticos, para así poder determinar la causa subyacente que la produce. No caben dudas de que el desarrollo de las técnicas de imágenes ha podido consolidar el diagnóstico de esta patología. En la actualidad, en la medicina en general y en la cardiología en particular, el diagnóstico por imágenes constituye el nuevo paradigma. La RMC y la OCT permiten hoy confirmar el diagnóstico de pacientes con MINOCA y diferenciarlos de enfermedades propias del miocardio; mediante la realización de estudios de imágenes intracoronarias se puede establecer la etiología del IAM y adecuar el tratamiento correcto.
En el futuro, estas herramientas deberían utilizarse en forma sistemática para poder determinar la etiología del MINOCA. Indudablemente, a medida que pase el tiempo estas técnicas irán mejorando y facilitando aún más el diagnóstico.
Este consenso es la piedra angular para que, en el futuro, los pacientes con MINOCA puedan ser estudiados en forma adecuada en nuestro país en los centros y sistemas de salud que incorporen los algoritmos adecuados y las tecnologías de alta complejidad; también para la creación de centros de referencia especializados en esta problemática. Asimismo, debe hacerse hincapié en la necesidad de que se realicen pruebas de vasorreactividad en la sala de cateterismo y que haya disponibilidad de drogas como la ACh.
Finalmente, surge la necesidad de incrementar la evidencia con estudios aleatorizados que permitan aportar sustento científico a los tratamientos, de acuerdo a la etiología que ocasionó el MINOCA.
La microcirculación coronaria constituye un capítulo de la enfermedad coronaria muy complejo, que debe ser estudiado en forma exhaustiva y sistemática para conocer mejor su fisiopatología, diagnóstico y terapéutica.
8. LIMITACIONES
En la actualidad, son muchas las limitaciones del consenso que se pueden observar, tanto en términos de recomendaciones como en las posibilidades reales de realizar los estudios que se proponen. Sin embargo, esta situación no se da solamente en nuestro país, sino también en países desarrollados, dado que solo en los últimos años se ha incorporado el término MINOCA en forma sistemática. De todas maneras, hemos realizado un gran esfuerzo y tenemos un fuerte compromiso para avanzar en algoritmos y recomendaciones que, sin ninguna duda, pueden y deben ser perfectibles por las razones ya expuestas. Asimismo, hemos considerado el déficit de equipamiento de alta complejidad y le dimos prioridad a la realidad de la Argentina, armando dos escenarios de evaluación en detrimento de lo ideal por lo posible.
9. CONCLUSIONES
El MINOCA (infarto sin enfermedad coronaria obstructiva con estenosis <50%) es un IAM cuya prevalencia es de alrededor del 6%; esta entidad es más frecuente en pacientes jóvenes y de sexo femenino comparada con los infartos con enfermedad coronaria obstructiva aterosclerótica. Esta categoría de IAM se ha incorporado a la 4.a definición universal de infarto. Se trata de un síndrome clínico-angiográfico, dado que el diagnóstico requiere sine qua non de una angiografía coronaria y establecer la causa isquémica. La elevación de troponinas no establece la causa isquémica y estas pueden aumentar por inflamación del miocardio (miocarditis) o causas extracardíacas, como la embolia de pulmón, por lo que la resonancia magnética es una herramienta fundamental cuando la causa subyacente no es evidente. El origen de la isquemia coronaria requiere de un proceso diagnóstico, “working diagnosis”, en el que se reevalúe la angiografía, buscando disección coronaria espontánea u obstrucciones totales de ramas coronarias que pasaron inadvertidas en una primera instancia. También puede requerir de estudios intracoronarios (OCT/IVUS) para saber si es de origen aterotrombótico, por trombos in situ o cardioembolias. En caso de coronarias normales o ausencia de trombo, el espasmo coronario de arterias epicárdicas o de la microcirculación requerirán pruebas de vasorreactividad en forma invasiva o no invasiva. Asimismo, puede aportar datos adicionales la valoración de la microcirculación con pruebas de hiperemia endotelio-independiente (adenosina) o endotelio-dependiente (ACh o test de frío), lo que puede ayudar a elegir la terapéutica apropiada.
El tratamiento se debe orientar a la causa que originó el MINOCA. Si hay causa aterotrombótica, se utiliza antiagregación según las guías correspondientes. Las estatinas parecen ser drogas que mejoran la evolución y se recomiendan en forma sistemática. En caso de que se diagnostique espasmo coronario de arterias epicárdicas o de la microcirculación, los bloqueantes cálcicos son las drogas de elección. Los IECA/ARA II y betabloqueantes (nebivolol) se recomiendan en pacientes que presentan disfunción de la microcirculación coronaria. Se sugiere el tratamiento conservador en los pacientes con disección coronaria espontánea. En pacientes con factores de riesgo protrombótico, está indicada la antiagregación o anticoagulación.