INTRODUCCIÓN
La lipoproteína (a) [Lp(a)] consiste en una molécula similar a la lipoproteína de baja densidad (LDL), que contiene una molécula de apolipoproteína B y que está unida covalentemente a una glicoproteína de peso molecular variable, la apolipoproteína (a), mediante un enlace disulfuro. 1,2 Con base en la evidencia actual, queda bien establecido que los niveles elevados de Lp(a) confieren un mayor riesgo de enfermedad cardiovascular (fundamentalmente de enfermedad coronaria). La asociación entre el mayor riesgo cardiovascular y los niveles elevados de Lp(a) ha surgido de estudios epidemiológicos y genéticos. 3,4,5
La estenosis valvular aórtica se asocia con una reducción progresiva del orificio valvular y de la movilidad de las valvas. La estenosis valvular aórtica es la valvulopatía más frecuente y la más prevalente en la población de más edad, y la degeneración cálcica es la causa adquirida más común. 6
Curiosamente, se ha observado dentro de las válvulas aórticas estenóticas una acumulación de lipoproteínas o precursores lipídicos. Estas incluyen partículas de LDL convencionales, LDL oxidadas y fosfolípidos oxidados. 7,8 Asimismo, varios estudios observacionales han evaluado la relación entre los niveles de Lp(a) y la calcificación aórtica. 9 Por otro lado, varios reportes provenientes en su mayoría de estudios de cohorte, han analizado si los niveles elevados de Lp(a) constituyen un factor de riesgo independiente para la progresión de la estenosis valvular aórtica o la aparición de eventos clínicos, aunque los resultados fueron discordantes. 10,11,12,13,14,15,16,17 La identificación de la Lp(a) como un potencial factor de riesgo para desarrollar enfermedad cardiovascular (incluyendo la enfermedad valvular aórtica) ha despertado el interés de la industria en desarrollar terapias farmacológicas específicamente dirigidas a reducir sus niveles.
Por tanto, el objetivo principal de la presente revisión sistemática fue analizar la capacidad predictiva de los niveles elevados de Lp(a) sobre la ocurrencia de eventos clínicos relacionados con la estenosis valvular aórtica.
MATERIAL Y MÉTODOS
Esta revisión sistemática se realizó de acuerdo con las recomendaciones PRISMA (Preferred Reporting Items for Systematic Reviews and Meta-Analyses) y STROBE (Strengthening the Reporting of Observational Studies in Epidemiology) desarrolladas para guiar la realización de revisiones sistemáticas y analizar estudios observacionales en epidemiología, respectivamente. 18,19
Se realizó una búsqueda bibliográfica para detectar estudios que hayan evaluado la asociación entre los niveles de Lp(a) y los eventos clínicos relacionados con la estenosis valvular aórtica. Dos revisores independientes realizaron búsquedas en las bases de datos electrónicas de PubMed/ MEDLINE, Embase, Science Direct, Scopus, Google Scholar y Cochrane Controlled Trials, utilizando el término “lipoproteín (a)”, solo o combinado con los siguientes términos: “aortic valve stenosis”, “aortic valve replacement”, “aortic stenosis mortality”, “aortic stenosis hospitalization”, “aortic valvulopathy” and “aortic valve calcification”.
Los siguientes criterios de inclusión fueron utilizados para seleccionar los estudios:
Estudios observacionales con un diseño de cohorte (prospectivo o retrospectivo). No se incluyeron estudios de serie de casos, transversales o de casos y controles
Estudios que compararon pacientes con o sin niveles elevados de Lp(a). No establecimos un punto de corte específico; algunos estudios utilizaron el tercilo más alto de Lp(a), y otros analizaron puntos de corte preestablecidos (ej.: 50 mg/dL)
Estudios que evaluaron la relación entre los niveles de Lp(a) y el riesgo de eventos clínicos relacionados con enfermedad valvular.
El punto final primario del estudio fue la incidencia de eventos relacionados con la estenosis valvular aórtica. Dicho punto final, definido de acuerdo con los eventos informados en cada estudio seleccionado, fue una combinación de eventos clínicamente relevantes, como el reemplazo valvular aórtico, la muerte o la hospitalización relacionada con la enfermedad valvular. La medida de asociación utilizada fue el Hazard Ratio (HR) con su respectivo intervalo de confianza del 95% (IC 95%).
Dos revisores independientes evaluaron la calidad de los estudios incluidos mediante los criterios de la herramienta QUIPS (Quality in Prognostic Studies). 20 Cualquier discrepancia entre los dos revisores se resolvió mediante la participación de un tercer revisor.
Esta revisión sistemática fue registrada en PROSPERO.
La realización de un análisis cuantitativo (meta-análisis) no fue posible debido a la heterogeneidad de las poblaciones incluidas, los diferentes puntos de corte y métodos diagnósticos de Lp(a) utilizados y el tipo de eventos clínicos informados.
RESULTADOS
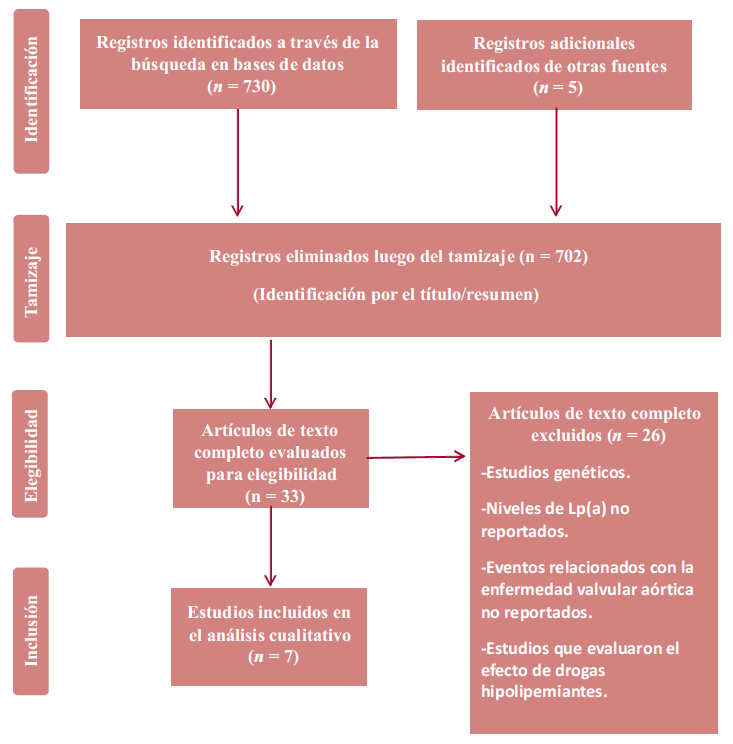
En total, 7 estudios fueron identificados y considerados elegibles para el análisis cualitativo, incluyendo 58 783 pacientes. El diagrama de flujo del proceso de selección de los estudios puede observarse en la Figura 1.
Todos los estudios incluidos fueron estudios observacionales de cohorte (prospectivos o retrospectivos). En todos los estudios se evaluó el nivel de sesgo. Un solo estudio fue identificado como de bajo riesgo de sesgo, y en los seis estudios restantes se observó un riesgo moderado. Dichos estudios tenían problemas metodológicos más frecuentemente relacionados con la deserción del estudio y el análisis o informe estadístico. La calidad de los estudios evaluados se puede observar en la Figura 2.
La edad media y la proporción de mujeres oscilaron entre 58 y 70,3 años y entre 31,7 y 72,7%, respectivamente. Tres estudios incluyeron pacientes con estenosis aórtica de leve a moderada 10,11,12, un estudio analizó sujetos con hipercolesterolemia familiar 13 y tres estudios evaluaron individuos pertenecientes a la población general. 14-16 El tiempo medio de seguimiento osciló entre 3,2 y 19,8 años.
En cuanto a los puntos de corte de Lp(a) utilizados, tres estudios consideraron el tercilo más alto del valor de Lp(a) 10,11,12, y otros tres analizaron un valor de Lp(a) preestablecido de 50 mg/dL 13,14,15. En el caso del estudio publicado por Kamstrup y col., se seleccionó para este análisis el subgrupo de pacientes con niveles de Lp(a) entre 67 y 89 mg/dL en comparación con el valor de referencia (<22 mg/dL) 16. Las características de los estudios incluidos pueden observarse en la Tabla 1.
Tabla 1 Características de los estudios incluidos.
| Estudio | N | Población | Grupos de Lp(a) evaluados (mg/dL) | Metodología usada | Eventos relacionados con la estenosis valvular aórtica evaluados | Seguimiento (años) |
|---|---|---|---|---|---|---|
| Liu y col.10 | 359 | >18 años. Estenosis valvular aórtica leve a moderada (velocidad pico >2,5 y <4m/s). Hombres: 58,3% | >38,15 vs. ≤38,15 | Regresión de Cox. Ajustado por la edad, el sexo y los factores de riesgo tradicionales. | RVA o muerte cardíaca | 3,2 |
| Capoulade y col.11 | 219 | >18 años. Estenosis valvular aórtica leve a moderada (velocidad pico >2,5 y <4m/s). Hombres: 60% | >58,5 vs. ≤58,5 | Regresión de Cox. Ajustado por la edad, el sexo y la gravedad de la estenosis aórtica basal. | RVA o muerte cardíaca | 3,5 |
| Zheng y col.12 | 145 | > 50 años. Estenosis valvular aórtica con una velocidad pico > 2,5 m/s y calcificación aórtica. Hombres: 68,3% | >35 vs. ≤35 | Regresión de Cox. Ajustado por la edad, el sexo, los factores de riesgo tradicionales, los antecedentes de ECV y la gravedad de la estenosis aórtica basal. | RVA o muerte | 5 |
| Pérez de Isla y col.13 | 3712 | >18 años. Hipercolesterolemia Familiar Hombres: 65,7%, | >50 vs. ≤50 | Regresión de Cox. Ajustado por la edad, el sexo, los antecedentes de ECV y los factores de riesgo tradicionales. | RVA | 7,5 |
| Zheng y col.14 | 17 745 | Población general. 39 -79 años. Hombres: 55,1%. | >50 vs. ≤50 | Regresión de Cox. Ajustado por la edad, el sexo, los antecedentes de ECV y el C-LDL. | Muerte u hospitalización | 19,8 |
| Arsenault y col.15 | 17 553 | Población general entre 39 y 79 años. Hombres: 44%. | ≥50 vs. <50 | Regresión de Cox. Ajustado por la edad, el sexo, tabaquismo y el C-LDL. | Muerte u hospitalización | 11,7 |
| Kamstrup y col.16 | 19050 | Población general. >20 años. Hombres: 44%. | 67-89 vs. <22 | Regresión de Cox. Ajustado por la edad, el sexo y los factores de riesgo tradicionales. | RVA | 5 |
C-LDL: Colesterol ligado a la lipoproteína de baja densidad; ECV: Enfermedad cardiovascular; RVA: Reemplazo valvular aórtico.
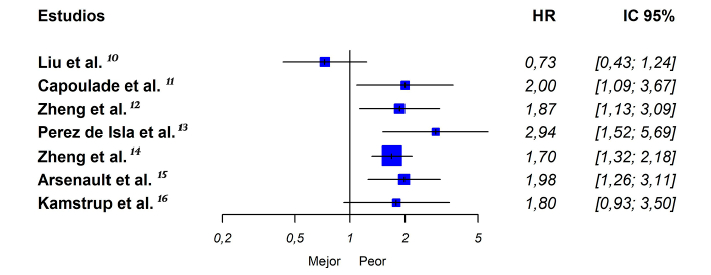
El análisis cualitativo mostró que dos estudios no informaron una asociación significativa entre los valores elevados de Lp(a) y el punto final primario, aunque la tendencia fue marcadamente a favor de la asociación en uno de ellos. Por el contrario, los cinco estudios restantes informaron un mayor riesgo de eventos relacionados con la estenosis valvular aórtica en aquellos pacientes con valores de Lp(a) más altos, en un rango entre un 70% y alrededor de 3 veces más riesgo, a pesar de ajustar por los factores de riesgo tradicionales (Figura 3).
DISCUSIÓN
En esta revisión sistemática, los niveles elevados de Lp(a), en comparación con los niveles más bajos, se asociaron con una mayor incidencia de eventos clínicos relacionados con la estenosis valvular aórtica casi en la totalidad de los estudios evaluados.
Un conjunto creciente de información sugiere que los lípidos podrían desempeñar un rol en la fisiopatología de la estenosis valvular aórtica. 6 Asimismo, un estudio genómico reveló que ciertos polimorfismos en el locus del gen de Lp(a) se asocian con un mayor riesgo de calcificación valvular. 21
El principal transportador plasmático de fosfolípidos oxidados es la Lp(a). Se ha demostrado que estos fosfolípidos modificados promueven la mineralización y la calcificación valvular a través de la regulación positiva de las especies reactivas de oxígeno y de las citocinas inflamatorias liberadas por los macrófagos. 6,22. Además, dentro de la válvula, la fosfolipasa A2 asociada a las lipoproteínas utiliza fosfolípidos oxidados para generar lisofosfatidilcolina, enzima que ha demostrado “in vitro” un efecto sobre la mineralización. 23,24 Por otro lado, otros mecanismos no relacionados con los fosfolípidos oxidados han sido propuestos: la Lp(a) aumenta significativamente la actividad de la fosfatasa alcalina, la liberación de fosfato, los depósitos de calcio, la hidroxiapatita, la apoptosis celular, la formación de vesículas en la matriz extracelular y la fosforilación de ciertas proteínas involucradas en la transducción de señales. 22
La calcificación es uno de los procesos más relevantes que determina la progresión de la estenosis aórtica. Reportes previamente publicados mostraron que la presencia de calcificación valvular tiene un valor pronóstico significativo. 25,26,27. En este sentido, valores elevados de Lp(a) podrían favorecer la calcificación valvular y, en consecuencia, aumentar el riesgo de eventos clínicos relacionados con la valvulopatía. En línea con los hallazgos fisiopatológicos previamente comentados, la mayoría de los estudios evaluados en esta revisión mostró una asociación positiva y significativa entre los valores de Lp(a) y los eventos clínicos relacionados con la enfermedad valvular aórtica.
Al analizar individualmente los estudios incluidos en esta revisión sistemática, los resultados no siempre fueron concordantes. Por un lado, cuando analizamos los estudios que evaluaron poblaciones con un grado previo de estenosis aórtica, dos estudios mostraron una asociación significativa entre los niveles elevados de Lp(a) y el punto final primario 11,12, mientras que un tercer estudio no lo hizo. 10 En este último caso, el estudio solo incluyó pacientes chinos [potencial variación étnica del efecto de la Lp(a)], el punto de corte de Lp(a) fue bajo y el tiempo de seguimiento fue menor en comparación con los otros dos estudios. Por otro lado, dos de los estudios que evaluaron la misma asociación en la población general encontraron una conexión significativa 14,15, pero no así un tercer estudio. El resultado en este último caso mostró una clara tendencia a favor de la asociación, y debe considerarse además que el tiempo de seguimiento fue notablemente más corto en este estudio en comparación con los otros dos. 16 El único estudio que evaluó pacientes con hipercolesterolemia familiar, mostró una asociación significativa entre los valores elevados de Lp(a) y los eventos valvulares. Una revisión previamente publicada mostró hallazgos similares a nuestra investigación. 9 Sin embargo, dicha revisión incluyó en su enorme mayoría estudios con un diseño de corte transversal o de casos y controles. Asimismo, un metaanálisis evaluó la asociación entre la estenosis aórtica y las diferentes variantes genéticas de Lp(a). 28 En consecuencia, hasta donde sabemos, esta es la primera revisión sistemática basada en estudios observacionales de cohorte que examinó específicamente el efecto de la Lp(a) sobre los eventos clínicos relacionados con la estenosis valvular aórtica.
Las concentraciones de Lp(a) varían ampliamente entre individuos dentro de la misma población, así como entre grupos de diferentes etnias. 29 Esta variación complica la determinación de un umbral de riesgo clínico universal, que actualmente se considera > 50 mg/dL. Los estudios incluidos en nuestro análisis consideraron diferentes puntos de corte para dicho marcador lipídico. Por tanto, no podemos establecer, a partir de nuestra revisión, cuál sería el punto de corte de Lp(a) con mayor poder predictivo. Asimismo, y tomando en cuenta las variaciones de este marcador en las diferentes poblaciones, sería de buena práctica contar con investigaciones locales y no extrapolar resultados obtenidos en otras regiones.
Hasta la fecha, no existen tratamientos médicos efectivos para la estenosis valvular aórtica. La evidencia de los ensayos controlados aleatorios mostró que la terapia hipolipemiante basada en estatinas no se asoció con una reducción de los eventos relacionados con la estenosis aórtica calcificada. 30 Como sabemos, las estatinas son ineficaces o pueden inclusive aumentar los niveles séricos de Lp(a). 31,32 La niacina reduce la Lp(a) entre un 20% y un 25%. Sin embargo, los ensayos clínicos con estos agentes no mostraron una reducción de los eventos cardiovasculares mayores y actualmente su uso no se encuentra recomendado. 33 A diferencia de la niacina, se ha demostrado que los inhibidores de PCSK9 reducen los niveles de Lp(a) y disminuyen los eventos cardiovasculares. Además, un estudio reciente con dichos fármacos ha demostrado resultados prometedores en la disminución de la tasa de progresión de la estenosis aórtica. 34 La mayor reducción de los niveles de Lp(a) con los inhibidores de PCSK9, en comparación a las estatinas, podría explicar el beneficio de estas drogas en la estenosis aórtica. 35 Nuevas terapias para reducir los niveles de Lp(a) se encuentran en desarrollo, incluyendo un oligonucleótido antisentido que se une selectivamente al ARN mensajero que codifica la apolipoproteína (a). 36 Sin embargo, su papel potencial en el tratamiento de la estenosis aórtica deberá demostrarse en futuros ensayos clínicos.
Esta revisión sistemática presenta algunas limitaciones. Primero, no pudimos realizar un análisis cuantitativo (meta-análisis) debido a la heterogeneidad clínica (características de las poblaciones, diferentes puntos de corte de Lp(a), eventos aórticos reportados y tiempos de seguimiento). En segundo lugar, aunque el número de pacientes en los estudios publicados por Zheng y col. 14 y Arsenault y col. 15 no fue exactamente el mismo y el tiempo de seguimiento era diferente, probablemente se obtuvieron de la misma base de datos. En consecuencia, no podemos descartar algún grado de superposición en los eventos identificados en los primeros años de seguimiento. En tercer lugar, nuestra revisión incluyó solo estudios observacionales. En consecuencia, es probable que existan sesgos y factores de confusión relacionados con este tipo de diseños. Finalmente, se incluyeron pocos estudios en nuestra revisión. Sin embargo, hasta que se desarrollen más estudios y de mejor calidad, nuestra revisión analizó la mejor evidencia disponible hasta la fecha.
CONCLUSIÓN
Nuestros datos sugieren que los niveles elevados de Lp(a) se asocian con una mayor incidencia de eventos clínicos relacionados con la estenosis valvular aórtica. Sin embargo, y considerando las limitaciones de esta revisión, la utilidad clínica de la Lp(a) como marcador pronóstico en la enfermedad valvular aórtica deberá confirmarse en futuras investigaciones.