INTRODUCCIÓN
El infarto agudo de miocardio con elevación del segmento ST (IAMCEST) es una patología de alta incidencia a nivel mundial y trae aparejado un aumento del riesgo de desarrollo de insuficiencia cardíaca (IC) y de mortalidad. En Estados Unidos se estima que una incidencia anual de 605 000 IAM nuevos y 200.000 eventos recurrentes. 1 En nuestro país, el registro nacional de infarto agudo de miocardio con elevación del segmento ST (ARGEN-IAM-ST) estima una incidencia de 120 infartos cada 100.000 habitantes. 2Después de un IAMCEST, la reperfusión miocárdica temprana y exitosa con el uso de terapia trombolítica o intervención coronaria percutánea (PCI) primaria es la estrategia más efectiva para reducir el tamaño del infarto y mejorar el resultado clínico. Sin embargo, el proceso de restauración del flujo sanguíneo al miocardio isquémico puede inducir lesiones. Este fenómeno, denominado daño por reperfusión miocárdica, paradójicamente puede reducir los efectos beneficiosos de la misma. La lesión culmina con la muerte de los cardiomiocitos que eran viables inmediatamente antes de la reperfusión, lo cual aumenta el tamaño del infarto. 3) (4 Esta lesión responde a diversos mecanismos, entre ellos la acumulación de neutrófilos y el incremento del estrés oxidativo por la producción de especies reactivas de oxígeno (ROS), 5 con aumento repentino del calcio intracelular secundario al daño de la membrana sarcoplásmica y la disfunción del retículo sarcoplásmico. 4 Los estudios en modelos animales de IAM sugieren que la lesión por reperfusión letal representa hasta el 50 % del tamaño final del infarto. 3A pesar de los avances en el tratamiento de la enfermedad coronaria y específicamente del IAM durante las últimas dos décadas, el mismo sigue siendo la causa más común de IC. 6El desarrollo de IC tras el alta hospitalaria de un IAM es muy frecuente. Se diagnostica en aproximadamente el 13% de los pacientes a los 30 días y en el 20-30% un año después. La incidencia de IC tras el alta de un IAM es máxima en los primeros meses, y luego desciende y se mantiene estable a una tasa del 1,3-2,2% anual. 7
EL PAPEL DE LA INFLAMACIÓN
Existen diferentes factores de riesgo y mecanismos que conducen a la IC en diferentes momentos. Entre ellos se encuentran la edad, el género femenino, la enfermedad multivaso, el IAM previo, la hipertensión arterial, la fibrilación auricular, la diabetes, la enfermedad renal crónica y el precondicionamiento. Hay cada vez más pruebas de que la prolongación o expansión de la respuesta inflamatoria posterior al IAM contribuye significativamente a la remodelación del ventrículo izquierdo (VI) y al desarrollo de IC. 8Métodos de cuantificación de la respuesta inflamatoria muestran resultados prometedores en la predicción de IC. El nivel de proteína C reactiva (PCR) predice el riesgo de eventos adversos después de un IAM, incluida la IC. 9 La proporción de neutrófilos y linfocitos, indicadores de inflamación sistémica, predijo eventos adversos cardiovasculares mayores (MACE) e IC en un metaanálisis de 14 estudios. 10Las citoquinas son reguladores estratégicos de la inflamación. En un estudio de 4939 pacientes con síndrome coronario agudo, la concentración de la citoquina proinflamatoria interleuquina 6 (IL-6) predijo independientemente MACE e IC. 11 La IL-32 es una citoquina proinflamatoria que induce la liberación de otras citoquinas inflamatorias como el factor de necrosis tumoral-α (TNF- α), IL-1β, IL-6, IL-8 e IL-18. Xuan et al. demostraron que la IL-32 es un predictor independiente de muerte cardíaca e IC en pacientes después de un IAM. 12La aparición de isquemia miocárdica aguda en el contexto de un IAM induce una respuesta proinflamatoria inicial, cuyo propósito es eliminar los restos de células necróticas de la zona del IAM, a través de varios procesos, incluida la activación de la cascada del complemento, la producción de especies reactivas de oxígeno (ROS) y los patrones moleculares asociados al daño (DAMP), que sirven como ligandos para los receptores de reconocimiento de patrones (PRR), como los receptores tipo Toll (TLR), células dendríticas e inflamasomas. Estos últimos originan la liberación de una variedad de mediadores proinflamatorios (interleuquinas y quimioquinas), que inducen el reclutamiento de células inflamatorias (neutrófilos, linfocitos, monocitos y macrófagos) en la zona del IAM y aumentan la respuesta proinflamatoria. Al dirigirse a la zona fronteriza viable del infarto, los leucocitos que se infiltran pueden inducir la muerte de los cardiomiocitos, extendiendo así la lesión isquémica más allá de la zona de infarto original (Figura 1) 13El inicio de la reperfusión miocárdica después de la angioplastia exacerba esta respuesta proinflamatoria y contribuye a la muerte de cardiomiocitos y al daño miocárdico característico de la “lesión por reperfusión miocárdica” que se manifiesta entre 6 y 24 h después de la reperfusión. 14A la respuesta proinflamatoria inicial sigue una fase reparadora antiinflamatoria, que permite la formación de tejido cicatrizal que evita la ruptura cardíaca. La fase reparadora antiinflamatoria (días 4 a 7) que sigue al IAM está orquestada por la supresión, resolución y contención de la respuesta proinflamatoria inicial (Figura 2). 13 Esto es impulsado por la activación de vías inhibidoras, que suprimen la inflamación y los cambios dinámicos en las funciones de los leucocitos infiltrantes dentro de la zona del IAM. Es esta fase actúan los linfocitos; la apoptosis y su eliminación de la zona del infarto es un sello distintivo de la resolución de la inflamación y la fase reparadora. Es un proceso activo que requiere el reclutamiento de cascadas de vías inhibidoras que da como resultado la polarización de los macrófagos M2 antiinflamatorios y la secreción de citoquinas antiinflamatorias y profibróticas, que suprimen la inflamación y promueven la reparación de tejidos a través de la acción de los fibroblastos. 15) (16) (17
INFLAMACIÓN Y REMODELADO
Después del IAM, el VI sufre cambios geométricos y funcionales, con hipertrofia de los segmentos no infartados y dilatación/adelgazamiento de los segmentos infartados, un proceso denominado remodelado adverso, y cuya aparición se asocia con peores resultados clínicos. Después del IAM, el VI sufre cambios geométricos y funcionales, con hipertrofia de los segmentos no infartados y dilatación/adelgazamiento de los segmentos infartados, un proceso denominado remodelado adverso, y cuya aparición se asocia con peores resultados clínicos. Una revisión sistemática de 37 estudios determinó que los parámetros más frecuentes para definir al remodelado ventricular son un aumento del 20% del volumen de fin de diástole (VFDVI) y/o 15% del volumen de fin de sístole (VFSVI). 18
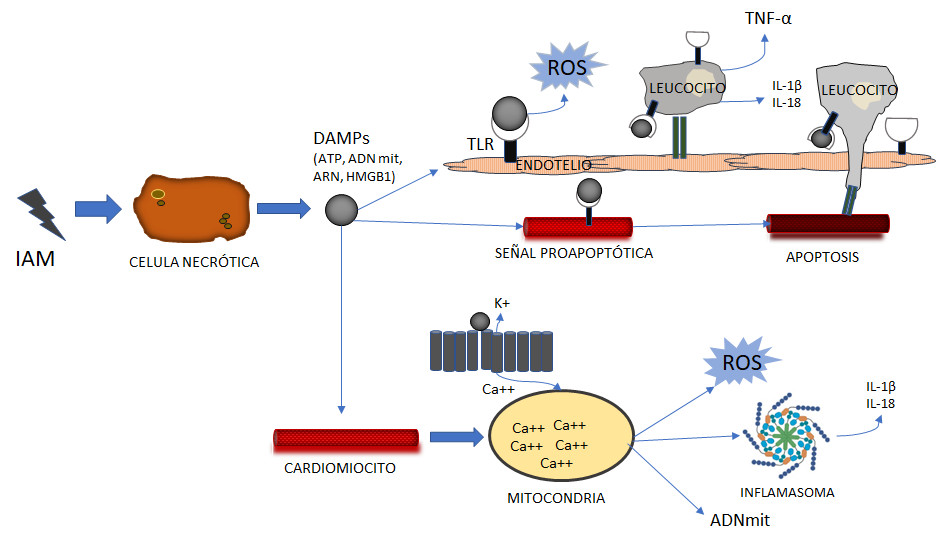
Fig. 1 La respuesta proinflamatoria inducida por patrones moleculares asociados al daño, DAMPs.Después de un IAM, la liberación de patrones moleculares asociados al daño o DAMP (como ATP, ADNmit, ARN y HMBGB1) induce una respuesta proinflamatoria que media la muerte de los cardiomiocitos a través de los receptores tipo Toll (TLR) y el reclutamiento de leucocitos en la zona del infarto, la liberación de citocinas, la disfunción mitocondrial (sobrecarga de calcio y producción de especies reactivas de oxígeno, ROS) y la formación del inflamasoma. Basado en Ong SB y cols. Pharmacol Ther. 2018;186:73-87.

Fig. 2 La fase reparadora antiinflamatoria después del infarto agudo de miocardio. Tras la respuesta proinflamatoria del IAM, la fase reparadora antiinflamatoria permite la resolución de la inflamación. La médula ósea y los monocitos circulantes se diferencian en células dendríticas que evitan la remodelación del VI mediante la activación del exosoma de los leucocitos CD4 +. La expresión de los neutrófilos apoptóticos induce la polarización de los macrófagos M2 y la secreción de citoquinas antiinflamatorias y profibróticas como IL-10 y TGF-β que suprimen la inflamación y promueven la reparación de tejidos, con cambio de monocitos Ly6c high,proinflamatorios, y macrófagos M1 localizados en la zona del IAM en respuesta al aumento de la expresión miocárdica de MCP-1 durante la fase proinflamatoria inicial, a Ly6C low antiinflamatorios, monocitos y macrófagos M2.Basado en Ong SB y cols. Pharmacol Ther. 2018;186:73-87.
Una respuesta proinflamatoria excesiva y persistente después de un IAM puede empeorar el remodelado adverso del VI a través del aumento de la expresión de citoquinas inflamatorias. Estas inducen apoptosis de cardiomiocitos, aumentan el depósito de matriz extracelular y deprimen la contractilidad, lo cual resulta en un ventrículo más rígido, con mayor disfunción diastólica, y activación de fibroblastos en el miocardio remoto que pueden expandir la fibrosis del tejido viable. 19Estudios experimentales y clínicos determinan una relación entre la expresión de interleucinas y los volúmenes del VI. 20) (21) (22La ecocardiografía bidimensional es el método de primera línea para determinar la incidencia y magnitud del remodelado ventricular. En un subestudio ecocardiográfico del ensayo VALIANT (valsartán vs captopril o su combinación en IAM complicado con disfunción sistólica o IC), la fracción de eyección del VI (FEVI), el VFDVI y el VFSVI iniciales, fueron predictores independientes del punto final primario combinado de muerte u hospitalización por insuficiencia cardíaca. 23 A su vez, en comparación con los pacientes sin evidencia de remodelado del VI, los pacientes con cualquiera de los patrones de remodelado del VI después de un infarto de miocardio tienen un mayor riesgo de muerte cardiovascular, IAM, IC, accidente cerebrovascular (ACV) y paro cardíaco reanimado. 24 Por lo tanto, aunque los volúmenes del VI siguen siendo poderosos indicadores del pronóstico cardiovascular, el patrón específico de remodelado del VI contiene información adicional.La resonancia magnética cardiaca (RMC) sigue siendo el estándar de oro para evaluar la anatomía y la función cardiaca. Además de la medición precisa de los volúmenes del ventrículo, permite definir el tamaño del IAM medido en gramos. Este último es un predictor significativo de remodelado ventricular adverso. A mayor tamaño del infarto, mayor es el aumento posterior de los VFDVI y VFSVI. El tamaño del IAM es mejor predictor de remodelado adverso que la FEVI final. 25La RMC permite la medición del T1 nativo (mapeo de T1) en el corazón sin usar contraste con gadolinio, que normalmente se requiere para delinear el tejido del infarto. El T1 está influenciado por el contenido de agua, la unión con macromoléculas y la composición celular. El contenido de agua tisular aumenta como resultado de la isquemia, lo que resulta en tiempos T1 más largos, un biomarcador de daño miocárdico más acentuado en regiones miocárdicas localizadas. 26 El T1 nativo del miocardio aumenta con la infiltración de células inflamatorias, como lo revela la histopatología en pacientes que se someten a un trasplante cardíaco con características de rechazo agudo. 27El T1 nativo en el miocardio remoto en sobrevivientes de IAMCEST se vincula de forma independiente con la inflamación sistémica y el tamaño del infarto. Los cambios en el número de monocitos circulantes después del infarto de miocardio se asocian de forma independiente con el T1 nativo en la zona remota y el remodelado posterior del VI a los 6 meses, lo que respalda un vínculo mecánico entre la inflamación y el remodelado adverso. A su vez, también se relaciona con cambios en el VFDVI a los 6 meses y se asocia de forma independiente con eventos cardíacos adversos posteriores al alta, incluidas la muerte por todas las causas y la hospitalización por IC durante el seguimiento a más largo plazo. 28
CONSIDERACIONES TERAPÉUTICAS
Dados los efectos perjudiciales de una respuesta proinflamatoria excesiva y persistente al IAM, y los efectos curativos beneficiosos de la fase reparadora antiinflamatoria que sigue, una estrategia terapéutica potencial para limitar el tamaño del IAM y prevenir el remodelado adverso del VI es atenuar la respuesta proinflamatoria y regular al alza la respuesta reparadora antiinflamatoria subsiguiente. Esto proporciona un objetivo terapéutico adicional para prevenir la IC posterior al IAM. Se investigaron varios enfoques terapéuticos dirigidos a abordar la respuesta proinflamatoria después del IAM, muchos de los cuales, lamentablemente, no logran demostrar ningún beneficio en la reducción del tamaño del mismo, o mejora de los resultados clínicos.Los primeros estudios experimentales que utilizaron agentes antiinflamatorios no específicos, como corticosteroides y AINES, mostraron una reducción en el tamaño del IAM en caninos. 29 Ello se asoció con efectos adversos como deterioro de la reparación miocárdica, adelgazamiento y ruptura cardíaca, por lo que se desestima el empleo de estos fármacos. 30La cascada del complemento es otra vía que se abordó para la modulación de la inflamación en el IAM. En estudios experimentales la inhibición de dicha cascada reduce el tamaño final del IAM. Sin embargo, en ensayos clínicos, el uso de pexelizumab, un anticuerpo del complemento C5 no demuestra beneficios clínicos y el tamaño del infarto. 31Las citoquinas inflamatorias constituyen dianas terapéuticas interesantes, debido a sus efectos pleiotrópicos sobre la respuesta inmunitaria. En el estudio VCU-ART 3, la administración de anakinra, un anticuerpo inhibidor de IL-1, por 14 días luego de un IAM, redujo de forma significativa los niveles de PCR, la incidencia de muerte o IC de novo y la hospitalización por IC. 32 Un análisis de los ensayos VCU-ART1, VCU-ART2 y VCU-ART3 es consistente con los resultados de este último. 33CANTOS fue otro ensayo que buscó inhibir la expresión de las interleuquinas, en este caso, de IL-1β, a través de un anticuerpo monoclonal, el canakinumab. Este fármaco administrado de forma subcutánea a pacientes con IAM previo y PCR elevada, previno eventos cardiovasculares recurrentes (muerte cardiovascular, IAM no fatal, ACV no fatal). 34 Posteriormente, Everett y cols. encontraron que la reducción con canakinumab de IC y el compuesto de hospitalización y muerte por IC está relacionada con la dosis. 35El metoprolol reduce la infiltración miocárdica de neutrófilos, a través de la inhibición del antagonista selectivo del receptor β1-adrenérgico (ADRB1), en animales los que se provoca un IAM. 36 En el estudio METOCARD-CNIC, la administración endovenosa de este betablqueante, redujo el tamaño del infarto y aumentó la FEVI medidos por RMC con respecto al placebo, en pacientes con IAM. 37Los inhibidores del cotransporte de sodio-glucosa 2 (iSGLT2) tienen un efecto pleiotrópico y se estudia en ensayos experimentales y clínicos su efecto antiinflamatorio. 38 Demuestran atenuar la infiltración de macrófagos, es especial, la polarización de M1, aumentando de esta manera la polaridad de M2 involucradas en la fase antiinflamatoria, con lo que queda claro que los iSGLT2 participan en la modulación de la inflamación y reparación de tejidos. 39 También se evidencia que reducen la expresión de factor TNF-α, proteína quimioatrayente de monocitos 1 (MCP-1), moléculas de adhesión plaquetaria, IL-6 e IL-1β. En ensayos clínicos con pacientes diabéticos y enfermedad coronaria crónica, el tratamiento con SGLT2i reduce de forma significativa los niveles de PCR en sangre, citocinas inflamatorias (IL-6) y TNF-α. 40 Por lo cual, el tratamiento con este fármaco puede mejorar los resultados cardiovasculares a través de sus beneficios en la modulación de la inflamación. En relación con el remodelado ventricular, en el estudio SUGAR-DM-HF el empleo de empagliflozina en pacientes con IC con FEVI reducida y diabetes, se asoció con mayor remodelado reverso medido por RMC. 41 Aún no se conoce con profundidad los efectos de la administración temprana de SGLT2i en pacientes con IAM reciente. Recientemente conocimos los resultados del estudio EMMY. En este ensayo, la administración de 10mg vía oral de empagliflozina dentro de las 72 h de la angioplastia en pacientes con IAM, se asoció de forma significativa con una disminución del NT-proBNP, mayor FEVI, disminución de los VFDVI y VFSVI que el grupo placebo. 42 Otros dos ensayos en curso están evaluando la seguridad y eficacia de SGLT2i en pacientes con IAM, el EMPACT-MI (NCT04509674) y DAPA-MI (NCT04564742).
CONCLUSIÓN
El remodelado del VI se asocia con malos resultados en pacientes con IAM. Por lo tanto, la evaluación del remodelado ventricular adverso es de gran importancia, ya que revertir, detener o al menos retrasarlo es un objetivo esencial de la terapia en la IC.La inflamación juega un papel trascendente en el desarrollo del remodelado ventricular adverso posterior al IAM. La compleja respuesta inflamatoria al IAM está orquestada por una serie de actores diferentes, cuyos roles cambian, de acuerdo con las fases reparadoras proinflamatorias y antiinflamatorias que siguen al IAM. La exposición de los mecanismos subyacentes identifica una serie de dianas terapéuticas para reducir el tamaño del IAM y prevenir el remodelado adverso. Su base es la supresión de la fase proinflamatoria y la regulación positiva de la respuesta antiinflamatoria. Se propone como un complemento del tratamiento ya conocido con grandes beneficios en los pacientes con un IAM, como la revascularización precoz y completa y el tratamiento con antagonistas neurohormonales.















