Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista electrónica de investigación en educación en ciencias
On-line version ISSN 1850-6666
Rev. electrón. investig. educ. cienc. vol.9 no.2 Tandil Dec. 2014
ARTÍCULOS ORIGINALES
Analogías en la enseñanza de la estequiometría: revisión de páginas web
Andrés Raviolo, Gabriela Lerzo
araviolo@bariloche.com.ar, glerzo@unrn.edu.ar
Universidad Nacional de Río Negro. Bariloche.
Resumen
En este trabajo se presentan los resultados de una búsqueda sobre analogías para enseñar estequiometría, realizada en páginas web. Se analizan los resultados obtenidos a la luz de una serie de preguntas que plantea la investigación y se emiten sugerencias para la enseñanza. Se revisan las confusiones o concepciones alternativas que pueden promover y la utilización que se hace de las imágenes. Se concluye que un profesor encontrará en Internet muchos ejemplos de analogías, pero pocas secuencias adecuadas y escasas propuestas sistematizadas y fundamentadas a la luz del conocimiento de la Didáctica de las Ciencias. El trabajo con la analogía debería reforzar especialmente la comprensión profunda del significado de la ecuación química.
Palabras clave: Enseñanza, Estequiometría, Analogías, Búsqueda Internet
Analogies in teaching stoichiometry: a web pages revision
Abstract
This paper presents the results of a search of analogies to teach stoichiometry, on web pages. Results are analyzed based on a series of questions posed by the research and suggestions are made for the purpose of teaching. The confusions and the alternative conceptions that these analogies may promote are reviewed, and also the use of images. It's concluded that a teacher will find on the Internet many examples of analogies but few suitable sequences and limited systematized and well-grounded proposals on the matter of Science Education. Work with analogies should specially strengthen that deep understanding of the meaning of chemical equation.
Keywords: Teaching, Stoichiometry, Analogies, Internet searching
1. INTRODUCCIÓN
Estequiometría es un tema de la química en el que los estudiantes presentan muchas dificultades dado el grado de abstracción de los modelos que lo explican y el tipo de razonamientos que exige su formalización.
Aprender estequiometría demanda la comprensión de los conceptos de reactivo limitante y en exceso, fórmula y ecuación química, para lograr un profundo entendimiento del cambio químico, objeto de estudio de la química.
Los estudiantes confunden las distintas cantidades químicas (moles, concentraciones, masas, volúmenes) que se ponen en juego en la resolución de problemas (Frazer y Servant, 1987). Otras concepciones erróneas se deben a una incompleta comprensión de la ecuación química y su relación con la situación empírica. Algunos estudiantes partiendo de la composición inicial del sistema no logran determinar el estado final empleando la ecuación química (Arasasingham y otros, 2004); otros sostienen que el reactivo limitante es la sustancia que tiene el menor coeficiente estequiométrico en la ecuación química balanceada (Huddle y Pillay, 1996); y otros afirman que para que se produzca el cambio químico es necesario que los reactivos estén en la situación inicial en una proporción particular, dado que se confunde el lado izquierdo de la ecuación química con el estado inicial del sistema (Gauchon y Méheut, 2007).
Para superar estas dificultades se requiere de un abordaje conceptual en el que prime el diálogo con los estudiantes que permita ir evaluando sus comprensiones parciales. Sin embargo, durante la enseñanza de la estequiometría se aprecia cierta monotonía metodológica centrada en la resolución de ejercicios con, generalmente, poco trabajo experimental y escaso uso de otros recursos didácticos (Gabel, 1993). Por ello, para abordar este tema los docentes son proclives a emplear estrategias de enseñanza que incluyan analogías (Aragón y otros, 2010).
Dado que Internet es una de las fuentes principales a la que acuden los docentes para buscar información y materiales para el desarrollo de sus clases, esta investigación se propone analizar las propuestas basadas en analogías, que se encuentran en Internet, para abordar la enseñanza de la estequiometría y, especialmente, el concepto de reactivo limitante.
2. MARCO TEÓRICO
Internet es una fuente de recursos didácticos muy empleada por docentes de química. Allí se encuentran gran cantidad de propuestas para enseñar estequiometría con analogías.
Una analogía es una comparación de estructuras y/o funciones entre dos dominios (Duit, 1991): un dominio conocido (análogo) y un dominio nuevo o parcialmente nuevo de conocimiento (objetivo). Entre ellos se establece un conjunto de relaciones y, además, existen atributos no compartidos que constituyen las limitaciones de la analogía (Oliva et al, 2001).
El uso de analogías en el aula llama la atención de los estudiantes y, en muchos casos, pueden ser la causa o refuerzo de confusiones o concepciones alternativas. Esto último se debe, en gran parte, a su presentación asistemática, sin un encuadre metodológico adecuado, tanto de profesores como de autores de libros (Raviolo, 2009).
Como producto de la experiencia y de la investigación se han sugerido secuencias para enseñar con analogías. Por ejemplo, la secuencia TWA (Glynn, 1991), que consta de seis pasos: (1) introducir el concepto objetivo; (2) recordar el concepto análogo (activarlo); (3) identificar características relevantes del objetivo y del análogo; (4) establecer las correspondencias de similitudes (transferir y aplicar); (5) indicar las limitaciones de la analogía, y (6) sacar conclusiones. El orden de estos pasos puede variar pero lo importante es que se den todos los pasos. Raviolo y Garritz (2007) proponen un decálogo a tener en cuenta cuando se emplean analogías para enseñar. También Harrison y Coll (2008) presentan otra secuencia metodológica basada en la guía FAR: Foco, Acción y Reflexión y muestran, entre muchos ejemplos de aplicación de la secuencia, uno sobre estequiometría.
La efectividad de una analogía estará dada por el conocimiento de los atributos del análogo, el aprovechamiento que pueda hacerse de los atributos compartidos para comprender el objetivo, la profundidad de las conclusiones que se obtengan y las reflexiones metacognitivas realizadas.
En la bibliografía, especialmente en el Journal of Chemical Education, se encuentran varias propuestas de emleo de analogías para enseñar estequiometría, aunque se observan más sobre temas afines, en especial sobre el mol. Entre ellas: Fulkrod, 1981 y Alexander et al., 1984 (tamaño de los átomos y magnitud del número de Avogadro); Arce de Sanabia, 1993 (masas atómicas relativas y mol); Last y Webb, 1993 (masa atómica promedio) y Fortman, 1993 (masas atómicas relativas).
Entre las primeras propuestas de analogías para estequiometría se halla la de Last (1983) que utiliza a la pareja de baile, formada por un chico y una chica como análogo de la reacción NH3(g) + HCl(g) → NH4Cl(s). Con esta analogía aborda los conceptos de reactivo limitante, en exceso y de rendimiento porcentual. Incluso amplía la analogía para el caso de una danza en la que cada equipo está formado por un chico y dos chicas, para ilustrar la reacción C(s) + 2S(g) → CS2(g). La analogía de las parejas de baile es una de las más antiguas, y fue muy utilizada en equilibrio químico (Caldwell, 1932; Hildebrand, 1946; DeLorenzo, 1977; Baisley, 1978).
Bleam (1981) sugiere la analogía de la fruta-frutera para introducir el tema de estequiometría en el nivel medio. La frutera, compuesta por dos manzanas y tres bananas, para abordar las relaciones estequiométricas, reactivo limitante y rendimiento teórico. Felty (1985) emplea una receta simple de ensalada de frutas, formada por igual número de uvas y de cerezas. Supone que las cerezas pesan el doble que las uvas, y con ello aborda los temas de masas relativas y masas molares.
Varios autores emplean a la composición dada por una receta como analogía. Umland (1984) utiliza la analogía de la receta de cupcakes (en la que se utiliza dos tazas y un cuarto de harina y dos huevos, más otros ingredientes, para formar 30 cupcakes) como una forma de introducir el concepto de reactivo limitante y rendimiento teórico.
Silversmith (1985) se propone hacer frente a la concepción alternativa, que sostienen algunos estudiantes, de que el reactivo presente en menor número de moles es el reactivo limitante, a través de la presentación de la analogía del ensamble de una bicicleta, formada por un cuadro y dos ruedas, incluye la ecuación con palabras (cuadro + 2 ruedas → bicicleta) y el siguiente tipo de ecuación con símbolos (A + 2B → P). Fortman (1994a) propone el ensamble de un carrito de cuatro ruedas. Last (1998) sugiere para abordar el concepto de concentración de iones en una disolución la analogía de la bicicleta formada por un cuadro y dos ruedas como un análogo del soluto MgCl2.
Haim y otros (2003) proponen la analogía del sándwich de hamburguesa triple (P3H2Q), siendo P (rodaja de pan), H (hamburguesa de carne) y Q (feta de queso), formado a partir de otros sándwiches P2H2 y P2Q2, a través de cuatro actividades: (1) comprender las fórmulas y usar ecuaciones, (2) comprender la conservación de la masa, (3) comprender el concepto de reactivo limitante y (4) comprender el concepto de rendimiento.
Nos preguntamos si estos antecedentes son tenidos en cuenta en las propuestas que distintos autores vuelcan en Internet.
3. METODOLOGÍA
Esta investigación se propone analizar cómo distintas páginas de Internet abordan la enseñanza de la estequiometría, y especialmente el concepto de reactivo limitante, empleando analogías. Se trata de analizar la información que hallarían los docentes al realizar una búsqueda en páginas web.
Esta orientación metodológica se fundamenta, en parte, en los resultados del informe "Nuevas voces, nuevos escenarios: estudios evaluativos sobre el Programa Conectar Igualdad" del año 2011 (Magadán, 2012), que destaca que al proveer a los docentes de las netbooks se observó que, "si bien no es posible registrar aún cambios generalizados de carácter pedagógico-didáctico, ya se registra mayor frecuencia de uso [.] en un espectro amplio que abarca las diferentes áreas curriculares." Más del 40% de los docentes usuarios de las netbooks las emplean para buscar información y realizar tareas educativas, mientras que alrededor de un 25% produce recursos o utiliza software educativo.
Se utilizó el buscador Google para realizar una búsqueda sin restricciones, empleando como claves de búsqueda (Maglione y Varlotta, 2012) las palabras: analogías estequiometría. La indagación se llevó adelante durante el mes de mayo de 2013.
En concordancia con los objetivos planteados, en el análisis de las propuestas se respondieron las siguientes preguntas:
1. ¿Qué tipo de contribución es?
2. ¿A qué nivel educativo está destinada?
3. ¿Cuáles son los análogos utilizados?
4. ¿Plantea una ecuación para el análogo? ¿Cuáles son las características de dicha ecuación?
5. ¿Qué confusiones fomentan? ¿Promueven o refuerzan concepciones alternativas?
6. ¿Se acompaña la presentación de la analogía con el uso de imágenes?
7. ¿Cuál es el origen de estos análogos en la literatura específica? ¿Los autores citan la fuente original?
8. ¿Presentan una secuencia para presentar la analogía? ¿Es una secuencia apropiada?
4. RESULTADOS
El buscador señaló más de 41.000 resultados dado el criterio abierto de búsqueda. Se analizaron las primeras 50 páginas web que ofrece el buscador y se encontraron 21 páginas distintas que presentan por lo menos una analogía para enseñar el tema estequiometría.
Ante la abundancia de información se requieren estrategias específicas de búsqueda, como las que propone Brailovsky (2001) en el Google Académico. Desde este buscador el resultado obtenido fue de aproximadamente 700 páginas en español de las cuales la mayoría aportan ejemplos de analogías.
En el Anexo se encuentra la descripción de las 21 propuestas que incluye: la dirección URL, una breve descripción y la analogía empleada.
Cada una de estas páginas web fue analizada independientemente por cada uno de los dos investigadores y posteriormente se arribó a un consenso. A continuación se desarrolla el análisis de estas propuestas, de acuerdo al orden de las preguntas formuladas anteriormente:
4.1. Tipo de contribución
Con respecto al tipo de contribución se encontraron:
- Trabajos académicos: tesis, artículos de revistas, presentaciones a congresos: 5 (24%). En donde figuran citas bibliográficas.
. Tesis de maestría: 1
. Presentación a congresos: 2
. Artículo de revista: 2
- Propuestas de enseñanza del tema: 16 (76%)
. Páginas web: 11 (52%)
. Libros: 4 (19%)
. Presentación Power Point: 1 (5%)
Entre los trabajos académicos encontramos uno en el que la totalidad de las referencias bibliográficas provienen de Internet. Y entre las propuestas de enseñanza una página menciona: "La estequiometría es más fácil con sándwiches!! Buscando en la Red, se encuentran cosas interesantes como esta dinámica, que en vez de usar manzanas para que se entienda lo que nos quiere decir, utiliza los sándwiches como analogía, léela atentamente y comenta acerca de lo que puedas entender". Ambos casos demuestran la importancia del contenido disponible en la Web para la planificación de clases y la implementación de experiencias didácticas.
De los 5 trabajos que presentan referencias bibliográficas: 4 incluyen alguna cita sobre enseñanza y aprendizaje con analogías, 2 sobre aprendizaje de la estequiometría y 3 sobre enseñanza de estequiometría con analogías.
4.2. Nivel educativo
En relación con el nivel educativo al que están dirigidos los trabajos se aprecia que la mitad están orientados a nivel medio y la otra mitad a nivel universitario. En el nivel universitario, obviamente, a cursos introductorios o de primer año.
. Nivel medio: 43%
. Nivel universitario: 43%
. Ambos niveles: 14%
4.3. Tipo de análogo
Se encontraron 12 análogos diferentes en las 21 propuestas.
Los análogos empleados son: sándwich: 48%; ensamble tornillo, tuerca, arandela: 24%; fabricación camisas en serie: 10%; receta copa de helado: 10 %; ensamble auto: 10%; confección cuaderno de laboratorio: 5%; ensamble con Legos: 5%; frutas frutero: 5%; parejas de baile: 5%; receta de cocina: 5%; ensamble bicicletas: 5%; ramo de flores: 5%; ensamble lámparas: 5 %.
El 38% de los trabajos recurre a dos análogos. La analogía de sándwich, por ser muy versátil, es la más popular. De las 10 propuestas con sándwiches 6 se refieren mayoritariamente a un sándwich simple de jamón, o de jamón y queso, (P2J o P2QJ) y 4 a la analogía propuesta por Haim y otros (2003) de la formación de un sándwich triple a partir de otros dos: 2P 2H2 + P2Q2 → 2P3QH2.
Luego encontramos 5 propuestas con la analogía de formar ensambles con tornillos, tuerca y arandelas (o rondanas), por ejemplo: 1To + 3Tu + Ro → ToTu3Ro.
4.4. Ecuación química
Respecto al tratamiento de la ecuación química se aprecia:
. No presentan ecuaciones "químicas" del análogo: 39%
. Presentan ecuaciones "químicas" del análogo con símbolos: 19%, por ejemplo:
P2 + J → P2J (pan y jamón)
1To + 3Tu + 4Ro → ToTu3Ro4 (tornillos, tuercas y rondanas). Presentan ecuaciones "químicas" del análogo con palabras: 19%
1 jamón + 2 rebanadas de pan →1 "pan con jamón"
. 1 carrocería + 4 ruedas → 1 auto
. Presentan ecuaciones "químicas" del análogo con imágenes de objetos: 33% (muchas acompañadas con la ecuación con palabras o con símbolos): (Figuras 1 y 2)

Figura 1. Imagen presentada en resultado de búsqueda nº 16 (Anexo)

Figura 2. Imagen presentada en resultado de búsqueda nº 6 (Anexo)
4.5. Concepciones alternativas
En referencia a las concepciones alternativas que pueden fomentar o reforzar, se encuentran:
a. Trabajos que presentan ecuaciones químicas expresadas con las cantidades experimentales: 10% (ejemplos con símbolos y con imágenes de objetos) (Figura 3).
50P2J2 + 100P2Q2 → 100P3Q2J

Figura 3. Imagen presentada en resultado de búsqueda nº 6 (Anexo)
b. Trabajos que presentan ecuaciones químicas expresadas con las cantidades experimentales y con el exceso expresado como producto: 19%
Tu + 2To → 2ToTu2 + 2Tu
3P + 2Q +J → P2Q2J + P
c. Algunos trabajos fomentan la confusión entre coeficientes y subíndices. Por ejemplo, al generalizar la idea de que los coeficientes estequiométricos son los subíndices del producto; en otras palabras, que los coeficientes estequiométricos de los reactivos determinan la fórmula del producto: 19%
1To + 3Tu + 6Ro → ToTu3Ro6
3P + 2Q + J → P3Q2J
2R + C + M → R2CM
d.Utilización de una flecha con dos puntas, que en rigor se utiliza para híbridos de resonancia: 10%
P2 +Q2 ↔ 2PQ
P2J2 + 2P2Q2 ↔ 2P3Q2J
e. Algunas expresiones pueden reforzar la idea del cambio químico como la formación de una mezcla de los reactivos: 1 jamón + 2 rebanadas de pan →1 "pan con jamón". Sería más conveniente denominar como producto un "sándwich de jamón" resaltando la idea de que se formó una nueva especie, que es distinta a sus partes.
4.6. Uso de imágenes
Se refiere al hecho de si la presentación de la analogía o su secuencia didáctica se encuentra acompañada o reforzada con imágenes.
En 10 propuestas (48%) se presentan imágenes del análogo: 7 de la ecuación química (reactivos y productos), 2 de los productos solos y 1 de los
reactivos solos. Algunos ejemplos de imágenes son: (Figuras 4 - 6)

Figura 4. Imagen presentada en resultado de búsqueda nº 7 y 13 (Anexo)

Figura 5. Imagen presentada en resultado de búsqueda nº 10 (Anexo)

Figura 6. Imagen presentada en resultado de búsqueda nº 8 (Anexo)
4.7. Origen de la analogía
Recordemos que de los 21 resultados de la búsqueda, sólo los 5 académicos presentan referencias bibliográficas, de los cuales 3 incorporan citas sobre enseñanza de estequiometría con analogías.
El origen de la analogía del sándwich es difuso. Su uso está muy difundido en libros de texto (Brown y otros, 1998; Whitten y otros, 2008). La versión más elaborada de Haim y otros (2003) se encontró en 4 trabajos pero sólo en dos se cita esa fuente.
Las 5 propuestas que presentan la analogía del tornillo y tuerca no citan su origen. Esta analogía puede tener origen en la ofrecida por Fortman (1994b) para soluciones de electrolitos.
La analogía de las parejas de baile es una de las más antiguas, y fue utilizada tanto para el equilibrio químico como para estequiometría (Last, 1983), aparece por ejemplo en el texto universitario de Chang (1999). Ninguno de los trabajos hace referencia a estas fuentes. Lo mismo ocurre para la analogía de la fruta-frutera o ensalada de fruta y demás analogías.
La tesis de maestría, encontrada en esta búsqueda, menciona a la analogía de la fruta-frutera y cita a Felty (1985). También emplea la de los tornillos, tuercas y arandelas (tomando como referencia a Castelán y Hernández, 2009, que es otro resultado de la búsqueda el cual no menciona la fuente original) y la del sándwich (cita a Haim y otros, 2003).
4.8. Secuencia de enseñanza
Este criterio de análisis se refiere a si las propuestas siguen algún tipo de secuencia didáctica en la presentación de la analogía.
Se verificó que los 5 trabajos académicos siguen una secuencia de actividades elaborada, aunque sólo uno lleva adelante una de las secuencias discutidas en el ámbito de la enseñanza de las ciencias para enseñar con analogías.
De las 16 páginas web que ofrecen propuestas para enseñar estequiometría y, fundamentalmente el concepto de reactivo limitante, 9 (43% del total) la presentan como sólo un ejemplo para introducir el tema sin ecuaciones con símbolos.
Solamente tres trabajos del total muestran un cuadro con correspondencias entre el análogo y el objetivo, y éstos a su vez, no construyen las relaciones entre ambos, simplemente las enuncian. Las limitaciones de la analogía no son mencionadas en ningún trabajo.
5. DISCUSIÓN
A continuación se desarrollan algunos aspectos que se consideran esenciales sobre el empleo de analogías para enseñar estequiometría. En la elección de una analogía pueden resultar útiles los criterios de Curtis y Reigeluth (1984), para estos autores una buena analogía sería la que: (a) presenta muchas correspondencias (estructurales y funcionales), (b) se muestra con un formato mixto (verbal y pictórico), (c) utiliza un análogo concreto (bien familiar) para un objetivo abstracto, (d) puede enriquecerse fácilmente con correspondencias y limitaciones, (e) el objetivo admite varios análogos y (f) puede emplearse en distintos momentos de la presentación del tema (organizador previo, activador, sintetizador).
La presentación rápida de la analogía es frecuentemente para abordar la relación estequiométrica entre dos reactivos o la idea de reactivo limitante. Ésta surge de modo espontáneo en los docentes. Algunos ejemplos de este tipo de aplicación son:
"Antes de explicar el concepto de reactivo limitante haremos una comparación con una situación hipotética. Supongamos que en un taller de modistería una operaria corta 15 camisas al día, pero otra operaria únicamente cose 10 camisas al día, por lo tanto en el día sólo se producen 10 camisas. Eso implica que la operaria que cose limita la producción de camisas, ya que por muchas más que corte la primera la que cose no pasará de 10; en una analogía con la química ésta sería el relativo limitante." (Pretel, resultado 17 Anexo).
"Si en la fiesta hay más hombres que mujeres, habrá hombres sin pareja que no podrán bailar bajo este contexto. Es decir, quedará un remanente de hombres. Significa entonces que las mujeres limitan el número de parejas que se pueden formar, y que los hombres están en exceso. Lo mismo ocurre cuando quieres preparar hamburguesas con carne, queso y pan. Si no tienes la cantidad suficiente de queso, llegará un momento, cuando el queso se acabe, en el que no podrás hacer más hamburguesas. Te sobrarán panes y carne" (Garritz y otros, 2005).
Este tipo de presentación rápida llama la atención a los estudiantes y cumple la función de las analogías como un introductor previo. Al no utilizar, generalmente, ecuaciones y no entrar
en detalle, no promueve mayores confusiones y no requiere mayores reflexiones didácticas. A modo de información complementaria, se halló que este tipo de presentación se aprecia en cuatro libros de texto argentinos de nivel medio:
- Candás y otros (Ed. Estrada, 2000): analogía de la receta.
- Del Fávero y otros (Ed. Puerto de Palos, 2002): analogía del folleto con hojas de colores.
- Aldabe y otros (Ed. Colihue, 1999): analogía del ensamble de la bicicleta.
- Alegría y otros (Ed. Santillana, 1999): analogía del sándwich de jamón.
Distinto es el caso de la presentación elaborada de la analogía, con el objetivo de aprovechar su potencial para consolidar conceptos relacionados especialmente con la ecuación química.
La discusión de las fórmulas químicas es esencial. Cada especie tiene su composición definida, que constituye una identidad propia, que es distinta a la mezcla de sus partes, la pareja de baile, es distinto a un chico y una chica juntos. Por ello, es importante que la expresión del producto permita apreciar la composición y nombrar adecuadamente el compuesto, por ejemplo JP2 es un "sándwich de jamón", no "pan y jamón". Son recomendables las fórmulas químicas en las que se explicita su composición (AB2 por ejemplo) en lugar de fórmulas generales, cuyo producto es, por ejemplo, "P", como las ecuaciones presentadas por Silversmith (1985) (A + 2B → P), Cain (1986) (2Gc + 1M + 3Cp → 1 Sm) o Bleam (1981) (2A + 3B → 1Fb).
Como menciona la bibliografía (Yarroch, 1985), otro aspecto clave es diferenciar explícitamente coeficiente estequiométrico y subíndice: 2P es distinto P2, 2 rodajas de pan es distinto a una bolsa de dos rodajas de pan. Es decir, emplear las palabras bolsa, paquete, ensamble y relacionarlas con las expresiones de las fórmulas moleculares. En definitiva, comprender correctamente las relaciones estequiométricas, o relaciones cuantitativas en una reacción química, implica entender aspectos
del lenguaje químico y su simbolismo.
Las ecuaciones químicas con palabras son de utilidad inicial y se recomienda su uso. También tratar sólo con sustancias moleculares inicialmente.
Consideramos a la analogía del sándwich como una de las más apropiadas por su familiaridad y su versatilidad, dado que permite aumentar gradualmente su complejidad y un buen abordaje de la ecuación química. Admite obtener distintos productos finales, que otras analogías no lo permiten. Se sugiere seguir una secuencia con orden progresivo de dificultad, que en todo momento siga un paralelismo entre una situación análoga (preparación de sándwich de jamón) y otra química. Un ejemplo de posible secuencia con orden de complejidad creciente se presenta en la Figura 7. Esta tabla puede presentarse como una actividad de aplicación presentando una de las columnas a completar, ya sea del análogo o del objetivo.
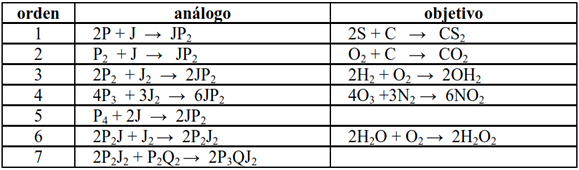
Figura 7. Secuenciación de reacciones sugerida
En la preparación del sándwich simple, cuya ecuación "química" es 2P + 1J → 1P2J, lo importante es discutir la diferencia entre reactivos y productos, entre coeficientes y subíndices, entre átomo y molécula, además de la proporción: dos rodajas de pan es a una de jamón. ¿Qué ocurrirá si los panes vienen en bolsitas de a dos? (P2 + 1J → 1P2J) o ¿y si vienen en paquetes de 4 panes? (P4 + 2J → 2P2J). En todos los casos el producto sándwich es el mismo. Esto permite plantear situaciones donde la relación estequiométrica entre los reactivos no es la misma, siguiendo el orden de los ejemplos sugeridos, la relación es: 2 a 1, 1 a 1, 2 a 1, 4 a 3, 1 a 2, 2 a 1 y 2 a 1.
La analogía del sándwich de jamón con rodajas de pan evita el inconveniente que presenta la analogía del sándwich de hamburguesa, ya que el pan de hamburguesa puede confundir dado que es una unidad formada por dos tapas. Es mejor usar dos rodajas de pan o un paquete (o bolsa) de dos rodajas de pan.
Harrison y Coll (2008) para la analogía 2P + 1J → 1P2J ponen como objetivo la reacción de síntesis del agua 2H2 + O2 → 2H2O, que no tiene una correspondencia plena con la elaboración del sándwich simple, lo mismo ocurre con el desarrollado por Whitten y otros (2008): CO + 2H2 → CH3OH. Para evitar este inconveniente la página Chemistry Understood.com emplea: 2H + O → H2O y Last (1983) propone la síntesis del disulfuro de carbono C(s) + 2S(g) → CS2(g).
Las cinco primeras reacciones de la secuencia de elaboración de sándwiches son reacciones de
síntesis de un compuesto a partir de las sustancias elementales. Las dos últimas, parten de uno o dos compuestos para formar otro compuesto. La última es la propuesta de Haim y otros (2003) en la que se forma un sándwich triple a partir de dos dobles.
Teniendo en cuenta que varias páginas analizadas promueven confusiones entre cantidades experimentales y coeficientes de la ecuación química, otra actividad pertinente es discutir situaciones en las que se pueda abordar la concepción alternativa de que el reactivo que está en menor cantidad absoluta es el limitante.
La presentación en diapositivas de Weiner (2001) ofrece una buena animación e imágenes para la discusión de la analogía de la preparación del sándwich. Aunque se debe tener cuidado dado que presenta ecuaciones con las cantidades experimentales, como la siguiente:
(Figura 8)
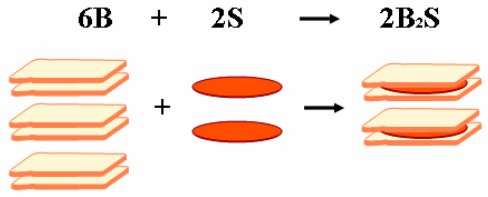
Figura 8. Ejemplo de imagen mostrada en la presentación de Weiner
Actividades con la hoja de cálculo, como las planteadas por Raviolo (2011), resultan útiles para diferenciar coeficientes estequiométricos de cantidades experimentales y cantidades que reaccionan.
Respecto a la metodología de empleo de una analogía para la enseñanza, es clave la utilización de una secuencia reconocida, como podría ser la secuencia TWA (Glynn, 1991), que, como ya se mencionó, consta de seis pasos: (1) introducir el concepto objetivo; (2) recordar el concepto análogo (activarlo); (3) identificar características relevantes del objetivo y del análogo; (4) establecer las correspondencias de similitudes (transferir y aplicar); (5) indicar las limitaciones de la analogía, y (6) sacar conclusiones.
En el establecimiento de correspondencias es apropiado presentar un cuadro comparativo como el siguiente: (Figura 9)

Figura 9. Correspondencias entre análogo y objetivo
En la síntesis del disulfuro de carbono se consideran condiciones tales de reacción que el azufre se presenta como monoatómico (Last, 1983; Chang, 1999).
En ocasiones se confunden los términos propios de cada dominio y esto puede resultar muy contraproducente, como en el caso de que se habla de "moles de pan": "¿cuántos moles de P2QJ se obtienen a partir de 150 moles de pan?"
Se pueden encontrar muchas limitaciones (o no correspondencias) en la analogía del sandwich, a nuestro criterio las más importantes son:
. El pan y el jamón no reaccionan. No hay fuerzas o "uniones químicas" que mantengan unidas a las rodajas de pan entre sí, ni al pan con el jamón.
. En el análogo, con dos rodajas de pan y una feta de jamón se prepara un sándwich de jamón y con una bolsa de dos rodajas de pan y una feta de jamón también se lo prepara. El ingrediente pan es la misma especie (solo cambia el envase) y se obtiene el mismo producto. En cambio en el objetivo, el cambio de la atomicidad significaría un cambio de especie, un cambio de sustancia. Por ejemplo, la sustancia oxígeno (O2) no es la misma sustancia que el ozono (O3).
. La principal limitación que tiene esta analogía es que la ecuación química puede leerse en términos microscópicos (sub micro) o macroscópico (macro), es decir en términos de átomos y moléculas (supongamos sustancias moleculares) y en términos de sustancias y moles (o su equivalente en gramos). Para pasar de un nivel a otro, del nivel sub micro al macro, se considera un número muy grande de partículas, el número de Avogadro (6,022 x 1023 partículas/ mol). En cambio, con el análogo no se cumple esta doble lectura de la ecuación química. La imagen de un sandwich, es el análogo a la molécula, sin embargo pesa (en esta analogía) como la masa molar. Esto puede inducir a pensar la idea errónea de que una partícula (átomo, molécula, ion) pesa la masa molar ("un átomo de carbono tiene una masa de 12 gramos", "una molécula de hidrógeno tiene una masa de 2 gramos").
Un tercio de los trabajos analizados presentan relaciones en gramos. En estos casos se parte del análogo del sándwich o del ensamble tornillo-tuerca-arandela. Con preguntas del tipo: "Si P = 10 g, J = 2 g ¿cuál es la masa de sándwiches que se produce con 60 g de pan?".
El uso de imágenes dinámicas puede complementar la presentación, como algunas interesantes simulaciones que existen. Por ejemplo sobre la analogía del sándwich, la simulación del entorno PhET (http://phet.colorado.edu/en/simulations/category/new). Esta simulación tiene el acierto de no presentar las cantidades experimentales con el formato de una ecuación química.
Sacar conclusiones de una analogía conlleva dos procesos, uno de ellos más simple e inmediato, relacionado con la proporción entre reactivos o la idea de un reactivo que se termina. Pero hay otro proceso que requiere mayor abstracción porque consiste en extraer el concepto superordinario (Duit, 1991), el modelo o estructura que subyace entre el análogo y el concreto. Poner en palabras "lo común" no es una actividad sencilla. Expresar el concepto abstracto, la esencia de la comparación analógica. En este caso va más allá de la relación proporcional estequiométrica y se vincula con la comprensión de la ecuación química: En común existe una expresión de una igualdad en la que cada tipo de unidad (J, P; O, H) se encuentra en igual número de cada lado de la ecuación. Estas unidades pueden encontrarse formando parte de entidades que tienen una composición definida (P2J; H2O). Establecida la igualdad (ajustada la ecuación química) se pueden plantear relaciones cuantitativas entre las entidades expresadas en la ecuación.
Como ya se mencionó, una posible actividad de transferencia y aplicación consiste en seguir la secuencia de las 7 reacciones formuladas anteriormente (Figura 7) en la que se solicite a los estudiantes completarlas con el análogo o con el objetivo a partir de la presentación de uno de ellos.
CONCLUSIONES
En una búsqueda de analogías para enseñar estequiometría, un profesor encontrará en Internet varios ejemplos de éstas, pero pocas secuencias adecuadas y escasas propuestas sistematizadas y fundamentadas a la luz del conocimiento de la Didáctica de las Ciencias, por ejemplo desde el conocimiento disponible de las concepciones alternativas y del abordaje adecuado de las analogías en la enseñanza. Las referencias bibliográficas en los trabjos, incluso los académicos, no son abundantes y, sobre todo, poco específicas. El tratamiento es el mismo independientemente del nivel educativo al que se dirija la propuesta.
La mayoría de las páginas muestran analogías sólo para introducir el tema de la relación estequiométrica, o de reactivo limitante, del estilo "esto es como.". No se detienen a profundizar las relaciones entre el análogo y el objetivo.
En las propuestas no se observa una secuencia progresiva adecuada de construcción de la ecuación química, con paralelismo entre análogos y objetivos. La analogía del sándwich es recomendable por su familiaridad y su versatilidad, dado que permite aumentar gradualmente su complejidad y un buen abordaje de la ecuación química. Aspectos conceptuales y didácticos para su transferencia a las aulas se abordaron en el apartado discusión.
En muchas otras páginas que desarrollan actividades se aprecia que pueden promover o reforzar confusiones o concepciones alternativas. Un solo autor previene sobre la concepción alternativa de sostener que el reactivo que está en menor cantidad absoluta es el reactivo limitante.
El trabajo con la analogía debería facilitar especialmente la comprensión completa del significado de reacción química y de la ecuación química. Ésta podría presentarse primero con palabras y después con símbolos, atendiendo las consideraciones que se han hecho en este trabajo. Luego profundizar progresivamente siguiendo un paralelismo permanente entre análogo y objetivo, donde se consoliden las diferencias entre coeficientes estequiométricos y subíndices, y entre sustancia elemental y compuesto.
Especial atención debe prestarse a las relaciones entre las cantidades experimentales, las representaciones a nivel submicroscópico y el simbolismo de la ecuación química y lo que ella representa.
El abordaje de los conceptos a través del uso de las analogías, el uso de las analogías sobre ecuación química y estequiometría, es un fructífero campo para investigar las relaciones entre modelo y realidad. Se aprecian las confusiones entre cantidades experimentales y las "cantidades" de la ecuación química (coeficientes y subíndices).
Una búsqueda y análisis como el realizado son necesarios, porque según Brailovsky (2011): "no siempre tenemos la preparación suficiente para interpretar, por nosotros mismos, la validez, relevancia y aplicabilidad de los resultados de una búsqueda". Al respecto señala que: "la red Internet, esta inmensa y desordenada biblioteca, representa mucho más una oportunidad que un riesgo para los formadores. Como todo lo nuevo que pisa fuerte (o quizás como todo lo que representa oportunidades y riesgos) nos asusta y nos preocupa porque saca a la luz las contradicciones y las paradojas de las prácticas a las que estamos acostumbrados. Nos dice cosas sobre lo que somos y sobre lo que creemos, sobre nuestras tradiciones pedagógicas, sobre cómo nos paramos a la hora de ser enseñantes, y a la hora de ser evaluantes."
Como proyecciones futuras, esta investigación continuará con el desarrollo de una propuesta de enseñanza basada en la secuencia de Glynn, con hincapié en la profundización de los factores que afectan el aprendizaje conceptual de la estequiometría.
Resultados búsqueda de páginas web sobre analogías para enseñar estequiometría.
1. Jairo Alonso Moreno González, Tesis de maestría, U. Nacional de Colombia. Documento pdf, 112 páginas. Analogías: tornillo - tuercas - arandelas; sándwich. Disponible en: http://www.bdigital.unal.edu.co/5976/1/8410004.2012.pdf
2. Margarita Castelán y Gisela Hernández, presentación a congreso. Congreso Nacional de Investigación Educativa, México, 2009. Documento pdf, 10 páginas. Analogías: tornillo-tuercas-arandelas. Disponible en: http://www.comie.org.mx/congreso/memoriaelectronica/v10/pdf/carteles/1398-F.pdf
3. Juan C. Cedrón, Victoria Landa y Robles Juana. Material enseñanza Química General,
Pontificia Universidad Católica del Perú, 2011. Archivo web (mht). Analogías: sándwich. Disponible en: http://corinto.pucp.edu.pe/quimicageneral/unidades/unidad-4-estequiometri
4. Universidad Nacional del Choco, Colombia. Capítulo 3 de libro. Documento pdf, 21 páginas. Analogías: producción de camisas en serie (pág. 9). Disponible en: http://200.26.134.109:8091/unichoco/hermesoft/portal/home_1/rec/arc_838.pdf
5. Instituto Moderno Americano, Colombia. Material de enseñanza del Instituto, Página web (htm). Analogías: sándwich. Disponible en: http://institutomodernoamericano.edu.co/moodle/grados/decimo/contenido/qui_10/qui_01_0055.htm
6. Universidad de Valladolid. Material de estudio adaptado de Chang, de Silberberg y de Petrucci et al. Documento pdf, 7 páginas. Analogías: copa de helado; cuaderno de laboratorio. Disponible en: https://www5.uva.es/guia_docente/uploads/2011/446/42089/1/Documento27.pdf
7. Adriana Orlandi y Rossana Bruera, Trabajo jornadas escuela-universidad, Universidad del Comahue, 2011, Documento pdf, 16 páginas. Analogías: sándwich; tornillo-tuercas-arandelas. Disponible en: http://escuelauniversidad.files.wordpress.com/2011/04/de_tuercas_y_arandelas__orlandi_bruera1.pdf
8. María del Mar Aragón, José M. Oliva y Antonio Navarrete. Artículo revista Investigación en la Escuela, Instituto de Educación Secundaria Drago, Departamento de Didáctica. Universidad de Cádiz, 2010. Documento pdf, 26 páginas. Analogías: legos; frutas-frutera. Disponible en: http://www.modelosymodelajecientifico.com/01HEMEROTECA/archivos/Usando_analogias_modelizacion_en%20prensa.pdf
9. Garritz, A. Gasque, L. y Martínez, A., Capítulo 6 estequiometría, libro Química universitaria, Pearson Educación, México, 2005. Documento pdf, 54 páginas. Analogías: parejas de baile, sándwich hamburguesas y receta de cocina. Disponible en: http://garritz.com/andoni_garritz_ruiz/documentos/Mi%20curriculum/06-Garritz.pdf
10. Maricarmen Grisolía. Material de enseñanza Química general. Ideas y tips para resolver problemas (estequiometría). Universidad de los Andes, Venezuela, Facultad de Humanidades y Educación. Documento pdf, 4 hojas. Analogías: sándwich. Disponible en: http://webdelprofesor.ula.ve/humanidades/marygri/documents/quimica/ITEstequiometria.pdf
11. Maricarmen Grisolía y Carmen Grisolía. Artículo Revista REEC, 8 (2), 2009. Universidad de los Andes, Venezuela, Facultad de Humanidades y Educación. Documento pdf, 26 páginas. Analogías: sándwich. Disponible en: http://www.academia.edu/635510/Integracion_de_elementos_didacticos_y_del_diseno_en_el_software_educativo_hipermedial_Estequiometria._Contando_masas_moles_y_particulas
12. Daniel Eduardo Delgado. Material sobre estequiometría y balanceo de ecuaciones. Universidad Nacional de Colombia. Blog Química Elemental, 2009. Página web. Analogías: sándwich. Disponible en: http://quimicaelementaldrd.blogspot.com.ar/2009/03/estequiometria-y-balanceo-de-ecuaciones.html
13. Normal Community High School, Illinois State University Chemistry. Material de enseñanza (en español mal traducido). Documento Word, 4 páginas. Analogías: tuercas y tornillos (pernos). Disponible en: http://www.teachnlearnchem.com/SPANISH/Stoichiometry%20Word/Stoichiometry%20Word%20Spanish/Nuts%20and%20Bolts%20Lab.doc
14. Juan Luis Morales, Hablemos de estequiometría (3º ESO). Recursos de Ciencias Naturales, 2010. Página web (htm). Analogías: sándwich. Disponible en: http://www.juanluismorales.es/?p=393
15. Maxi Sánchez. Material de enseñanza Química Estequiometría. Presentaciones Slideshare. Presentación de 40 diapositivas. Archivo web (mht). Analogías: auto: carrocería y 4 ruedas. Disponible en: http://www.slideshare.net/maxi17sanchez/quimica-diapositiva
16. Autores varios. Libro Química Cuantitativa I. Universidad Autónoma de Sinaloa. México, 2009. Documento pdf, 186 páginas. Analogías: ensamble bicicleta y copa de helados. Disponible en: http://dgep.uasnet.mx/Material_de_apoyo2009/Quimica_CuantitativaI.pdf
17. Roberto Gutiérrez Pretel, Material de enseñanza Estequiometría: reactivo limitante y reactivo en exceso. Universidad Tecnológica del Chocó. Colombia. Documento Word, 7 páginas. Analogías: fabricación de camisas. Disponible en: http://www.teachertube.com/download_doc.php?download=czoxNjoiOUIxNUQ0OEExNTE0RDgyMCI7
18. Bernarda Segurola, Graciela Saravia, Mariella Nassi, Mónica Franco, Libro Todo se transforma, Química 4º año. Capítulo 7 Estequiometría: la aritmética química. Editorial Contexto. Uruguay. 2006. Documento pdf, 15 páginas. Analogías: auto-carrocería-ruedas y flores-ramo flores. Disponible en: http://www.editorialcontexto.com.uy/index.php?option=com_content&view=article&id=73&Itemid=114
19. Curso de Introducción en Química General. Material de enseñanza. Reactivo limitante y rendimiento. Escuela de Ingenierías Industriales. Universidad de Valladolid. Página web. Analogías: cierre-arandela-tuerca (baratija) y bicicleta. Disponible en: http://quimy-abp-crist.blogspot.com.ar/2006/11/preguntas-de-estequiometra.html Preguntas estequiometría. Blog, 2006. Disponible en:
http://www.eis.uva.es/~qgintro/esteq/tutorial-04.html
20. Grupo Blas Cabrera.Material de enseñanza. Reactivo limitante / piezas de un cochito. Universidad de la Laguna. Archivo web (mht). Analogías: coches con mecano y lámpara. Disponible en: http://quimy-abp-crist.blogspot.com.ar/2006/11/preguntas-de-estequiometra.html Preguntas estequiometría. Blog, 2006. Disponible en:
http://www.grupoblascabrera.net/datos/didactica/analogias/reactivolimitante.htm
21. Roxana Ximena Burgos Barroso. La estequiometría es más fácil con sándwich. Blog alumnos. Universidad Autónoma del Beni, Bolivia. Archivo web (mht). Analogías: sándwich. Disponible en: http://uabcivil.blogia.com/2007/092302--comentario3-estequiometria-hasta-1er-parcial-.php
BIBLIOGRAFÍA
1. Alexander, M., Ewing, G. y Abbott, F. (1984). Analogies that indicate the size of atoms and molecules and the magnitude of Avogadro's number. Journal of Chemical Education, 61(7), 591. [ Links ]
2. Argón, M., Oliva, J. y Navarrete, A. (2010). Usando analogías para la enseñanza del cambio químico y los procesos de modelización. Investigación en la Escuela, 71, 93-114. [ Links ]
3. Arasasingham, R., Taagepera, M., Potter, F. y Longers, S. (2004). Using knowledge space theory to access student understanding of stoichiometry. Journal of Chemical Education, 81, 1517-1523. [ Links ]
4. Arce de Sanabia, J. (1993). Relative atomic mass and the mole: A concrete analogy to help students understand these abstract concepts Journal of Chemical Education, 70 (3), 233-234. [ Links ]
5. Baisley, D. (1978). Equilibrium and the dance floor problem. Chem 13 News, 92, 3. [ Links ]
6. Bleam, W. (1981). The fruit basket analogy. Journal of Chemical Education, 58(2), 184-185. [ Links ]
7. Brailovsky, D. (2011). El uso académico de Internet en la formación docente, Revista E-eccleston. Temas de Educación Infantil, 7(15), 1-16. [ Links ]
8. Brown, T. y otros. (1998). Química: La ciencia central (séptima edición) México: Ed Prentice Hall, pp.93-94. [ Links ]
9. Cain, L. (1986). S`mores: A demonstration of stoichiometric relationships. Journal of Chemical Education, 63(12), 1048-1049. [ Links ]
10. Caldwell, W. (1932). Usable analogies in teaching fundamentals of chemical equilibrium. Journal of Chemical Education, 9(12), 2079-2080. [ Links ]
11. Castelán, M. y Hernández, G. (2009). Estrategia didáctica para apoyar la comprensión de la estequiometría a partir del uso de analogías. X Congreso Nacional de Investigación Educativa. México. [ Links ]
12. Chang, R. (1999). Química. (sexta edición). Mc Graw Hill: México, pp. 92. [ Links ]
13. Curtis, R. y Reigeluth, C. (1984). The use of analogies in written text. Instructional Science, 13, 99-117. [ Links ]
14. DeLorenzo, R. (1977). Chemical equilibrium: analogies that separate the mathematics from the chemistry. Journal of Chemical Education, 5, 676, 1977. [ Links ]
15. Duit, R. (1991). On the role of analogies and metaphors in learning science, Science Education, 75(6), 649-672. [ Links ]
16. Felty, W. (1985). Gram formula weights and fruit salad . Journal of Chemical Education, 62(1), 61. [ Links ]
17. Fortman, J. (1993). Pictorical analogies IV: relative atomic weights. Journal of Chemical Education, 70(3), 235-236. [ Links ]
18. Fortman, J. (1994a). Pictorical analogies XII: stoichiometry calculations. Journal of Chemical Education, 71(7), 571-572. [ Links ]
19. Fortman, J. (1994b). Pictorical analogies X: solutions of electrolytes. Journal of Chemical Education, 71(1), 27-28. [ Links ]
20. Frazer, M. y Servant, D. (1987). Aspects of stoichiometry, where do students go wrong? Education in Chemistry, 24, 73-75. [ Links ]
21. Fulkrod, J. (1981). How big is Avogadro's number? Journal of Chemical Education, 58, 508. [ Links ]
22. Gabel, D. (1993). Use de particle nature of matter in developing conceptual understanding. Journal of Chemical Education, 70(3), 193-194. [ Links ]
23. Gauchon, L. y Méheut, M. (2007). Learning about stoichiometry: from students` preconception to the concept of limiting reactant. Chemistry Education Research and Practice, 8(4), 362-375. [ Links ]
24. Glynn, S. (1991). Explaining science concepts: a teaching with analogies model. En Glynn y otros (eds.). The psychology of learning science, Hillsdale, Erlbaum. [ Links ]
25. Haim, L., Cortón, E., Kocmur, S. y Galagovsky, L. (2003). Learning stoichiometry with hamburger sandwiches. Journal of Chemical Education, 80 (9), 1021-1022. [ Links ]
26. Harrison, A. y Coll, R. (eds.) (2008). Using analogies in middle and secondary science classrooms, California, Corwin Press. [ Links ]
27. Hildebrand, J. (1946). Catalyzing the approach to equilibrium. Journal of Chemical Education, 23(12), 589-592. [ Links ]
28. Huddle, P. y Pillay, A. (1996). An in-depth study of misconceptions in stoichiometry and chemical equilibrium at a South African University. Journal of Research in Science Teaching, 23(1), 65-77. [ Links ]
29. Last, A. M. (1983). A bloody nose, the hairdresser's salon, flies in an elevator, and dancing couples: the use of analogies in teaching introductory chemistry. Journal of Chemical Education, 60(9), 748-750. [ Links ]
30. Last, A. M. y Webb, M. (1993). Using monetary analogies to teach average atomic mass. Journal of Chemical Education, 70 (3), 234-235. [ Links ]
31. Last, A. M. (1998). A cyclist`s guide to ionic concentration. Journal of Chemical Education, 75(11), 1433. [ Links ]
32. Magadán, C. (2012). Los saberes y los aprendizajes con TIC: en práctica y en teoría. Enseñar y aprender con TIC. Especialización docente de nivel superior en educación y TIC. Buenos Aires. Ministerio de Educación. [ Links ]
33. Maglione, C. y Varlotta, N. (compiladores). (2012). Investigación, gestión y búsqueda de información en Internet. Plan Conectar Igualdad. Ministerio de Educación. [ Links ]
34. McMinn, D. (1984). Coffee, coins, and limiting reagents. Journal of Chemical Education, 61(7), 591. [ Links ]
35. Oliva, J. M., Aragón, M. M., Mateo, J. y Bonat, M. (2001). Una propuesta didáctica basada en la investigación para el uso de analogías en la enseñanza de las ciencias. Enseñanza de las Ciencias, 19(3), 453-470. [ Links ]
36. PhET Interactive Simulations. Simulación: Reactivos, productos y sobrantes. [https://phet.colorado.edu/es/simulation/reactants-products-and-leftovers]. University of Colorado, Boulder. [ Links ]
37. Raviolo, A. (2009). Modelos, analogías y metáforas en la enseñanza de la química. Educación Química, 20(1), 55-60. [ Links ]
38. Raviolo, A. (2011). TICs y enseñanza de la química: estequiometría con la barra de desplazamiento. Educación en la Química, 17(2), 101-110. [ Links ]
39. Raviolo, A. y Garritz, A. (2007). Uso de analogías en la enseñanza de la química: necesidad de elaborar decálogos e inventarios. Alambique, 51, 28-39. [ Links ]
40. Silversmith, E. (1985). Limiting and excess reagents, theoretical yield. Journal of Chemical Education, 62(1), 61. [ Links ]
41. Thiele, R. y Treagust, D. (1994a). The nature and extend of analogies in secondary chemistry textbooks. Instructional Science, 22, 61-74. [ Links ]
42. Thiele, R. y Treagust, D. (1994b). An interpretative examination of high school chemistry teachers` analogical explanations. Journal of Research in Science Teaching, 31(3), 227-242. [ Links ]
43. Toth, Z. (1999). Limiting reactant. An alternative analogy. Journal of Chemical Education, 76(7), 934. [ Links ]
44. Umland, J. (1984). A recipe for teaching stoichiometry. Journal of Chemical Education, 61(12), 1036-1037. [ Links ]
45. Weiner, J. (2001). Chemistry Website. https://sp.eths.k12.il.us/weinerj/default.aspx [ Links ]
46. Whitten, K. y otros. (2008). Química (octava edición) México: CENGAGE Learning Editores, pp. 94. [ Links ]
47. Yarroch, W. (1985). Student understanding of chemical equation balancing. Journal of Research in Science Teaching, 22(5), 449-459. [ Links ]














