Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Ciencia, docencia y tecnología
On-line version ISSN 1851-1716
Cienc. docencia tecnol. no.32 Concepción del Uruguay May 2006
CIENCIAS EXACTAS Y NATURALES, INGENIERIAS Y TECNOLOGÍAS: INVESTIGACIÓN
Modelos experimentales de anuros para estudiar los efectos de piretroides*
Anuran experimental models to study pyrethroid effects*
María F. Izaguirre**; Liliana Marín; María N. Vergara; Rafael C. Lajmanovich***; Paola Peltzer***; Víctor H. Casco
*) Artículo elaborado en el marco del PID 6053-1: «Desarrollo de Modelos Experimentales para el Estudio de los Efectos de los Piretroides sobre Vertebrados (Amphibia - Anura)», 2000-2002, radicado en la Facultad de Ingeniería, UNER, financiado por la Universidad Nacional de Entre Ríos. Director: Dr. V.H. Casco, vcasco@bioingenieria.edu.ar. Informe Final aprobado por Res.CS Nº 171/05. Recibido en agosto 2005 y aceptado en marzo 2006.
**) Jefe de Trabajos Prácticos de la Cátedra Biología I, Carrera de Bioingeniería, Investigadora del Laboratorio de Microscopía, Facultad de Ingeniería, UNER. E-mail: fizaguirre@yahoo.com.ar
***) Instituto Nacional de Limnología (INALI-CONICET),E-mail: lajmanovich@hotmail.com
Resumen
Los ecosistemas acuáticos están cada vez más expuestos a numerosos contaminantes ambientales, como los agroquímicos. En los últimos años se ha observado que los tests de toxicidad sólo evalúan los efectos a corto plazo (mortalidad) y no son suficientes para evaluar los riesgos de los ecosistemas. Por esta razón, son muy importantes las evaluaciones a largo plazo, ya que permiten estimar la incidencia de estos cambios sobre la biodiversidad y la salud humana. En el presente artículo evaluamos estadísticamente, bajo condiciones de laboratorio, el efecto agudo (mortalidad - supervivencia), las dosis subcrónicas (tasa de crecimiento y desarrollo) y las alteraciones a nivel subcelular e histológico, producidos por el pesticida cipermetrina. Los bioensayos de toxicidad fueron realizados con embriones y larvas de estadios críticos de dos especies regionales de anuros: Physalaemus biligonigerus y Bufo arenarum. Estas especies fueron elegidas debido a su sensibilidad a los biocidas y a su importancia ecológica. Adicionalmente, se realizó un análisis morfológico de los órganos target por microscopía óptica y electrónica, para evaluar el desarrollo de mecanismos adaptativos a las nuevas condiciones desfavorables. Se realizaron en forma complementaria estudios de in situ TUNEL y morfometría.
Palabras clave: Cipermetrina; Anuros; Apoptosis; Histología; Ultraestructura.
Abstract
Aquatic ecosystems are increasingly exposed to numerous environmental contaminants, as agrochemicals. In recent years it has been observed that toxicity tests only span short time effects (mortality) but are not sufficient to evaluate the ecosystems risk. For that reason, long time estimations are very important as reference to estimate the incidence of those changes over the biodiversity and also on human health. In the present report we statistically analyzed, under laboratory conditions, the acute effect (mortality - survival) and subchronic doses (growth rate and development), as well as the alterations at histological and subcellular level produced by the cypermethrin pesticide. Bioassays on toxicity were carried out with embryos and tadpoles of critical stages of two regional anuran species: Physalaemus biligonigerus and Bufo arenarum. These species were chosen due to their biocides sensibility and ecological importance. Additionally, a morphological analysis of the target organs by optic and electron microscopy was carried on, to determine the development of adaptative mechanisms to the new adverse condition. Complementary studies of in situ TUNEL and morphometry were made.
Key words: Cypermethrin; Anurans; Apoptosis; Histology; Ultrastructure.
I. Introducción
Desde el punto de vista económico, el empleo de agroquímicos ha significado un gran avance para el hombre, ya que con su utilización se han podido salvar un importante porcentaje de las cosechas que periódicamente se perdían por la acción de insectos, hongos, malezas, etc. Sin embargo, en las últimas décadas, el creciente empleo de los mismos en todo el mundo también significó la incorporación de sustancias xenobióticas a los ecosistemas (Sugavanam, 1996), es decir, productos no naturales sintetizados por el hombre, para los cuales, en general, la biota carece de mecanismos metabólicos para su degradación. Anualmente, la industria química mundial incorpora al mercado cientos de nuevos productos sintéticos, por lo que resulta indispensable predecir sus posibles efectos en los ecosistemas y en la salud humana.
Históricamente, las evaluaciones de riesgo para la biota acuática han sido realizadas con ensayos de toxicidad, utilizando organismos sensibles como algunas especies de plancton. En vertebrados, generalmente se han utilizado como modelos experimentales los peces (Boudou y Ribeyre, 1989), debido al mayor conocimiento sobre su biología general, fisiología bioquímica, ecología y etología, en relación con otros vertebrados acuáticos. En contraste, el estudio de la incidencia de la contaminación en los anfibios, principalmente por el uso de pesticidas en las proximidades de los cuerpos de agua en donde éstos se reproducen, es de reciente data y ha sido encarado fundamentalmente en otros países. Mientras que la declinación en las poblaciones de anfibios es un fenómeno global (Blaustein y Wake, 1990; Pechmann y col., 1991; Blaustein y col., 1994; Licht, 1996), sus causas son desconocidas, considerándose la degradación y la polución ambiental como factores importantes en la explicación del fenómeno. Esta tendencia decreciente en sus poblaciones se considera altamente perjudi-cial ya que afecta a los ecosistemas en su conjunto (Bury y col., 1980; Castanet y Guyetant, 1984; Devillers y Exbrayat, 1992), con el riesgo de acentuar los fenómenos de su extinción en gran escala (Carey y Bryant, 1995). En nuestro medio es un tema prácticamente no explorado, a excepción de las contribuciones realizadas por Salibián (1993), Lajmanovich y col. (1998) e Izaguirre y col. (2000, 2001).
Los anfibios son indicadores altamente sensibles del estrés ambiental, a causa de su piel permeable y de su ciclo de vida (Schuytema y col., 1993). Es por este motivo que constituyen excelentes modelos experimentales para evaluar los grados de contaminación ambien-tal y los efectos de los agroquímicos sobre la tasa de mortalidad, las tasas de desarrollo y crecimiento y los cambios morfo-estructurales que pueden ocasionarse. Asimismo, resulta de importancia emplear estos organismos como modelos de estudio, teniendo en cuenta que en la zona se encuentran especies que estarían expuestas al riesgo potencial de extinción, a pesar de no figurar en el Red Data Book International (Chebez, 1994).
En la evaluación de la carga tóxica que pueden soportar los ambientes acuáticos se han desarrollado protocolos estandarizados por las organizaciones internacionales de regulación y control como la U. S. Environment Protection Agency (USEPA), la American Public Health Association (APHA), la Comunidad Económica Europea (CEE) y la American Society for Testing and Materials (ASTM), entre otras. Estos protocolos consisten en la realización de bioensayos de toxicidad aguda y crónica. Adicionalmente,Herkovits y col. (1996) han propuesto a los estadios embrionarios y larvales de los anfibios para realizar pruebas de toxicidad para el diagnóstico, protección y monitoreo ambientales con fines de restauración.
El sistema del Valle Aluvial del Río Paraná posee una cuenca de gran extensión que representa la mayor reserva de agua dulce de nuestro país. Sus biomas poseen una alta riqueza faunística y florística, como la selva paranaense y los bosques chaqueños. Este sistema es eje de desarrollo de los principales centros industriales y agrícolas de Argentina y, en consecuencia, se halla expuesto constantemente al impacto de contaminantes del ambiente. Los datos proporcionados por la Dirección de Sanidad Vegetal del Ministerio de Agricultura y Ganadería de la provincia de Santa Fe (Argentina) resaltan el importante incremento en el empleo de piretroides, en virtud de su bajo costo (Bulacio y Panelo, 1999).
La cipermetrina [alfa - ciano - 3 - fenoxibencil - 3 - (2, 2 diclorovinil) 2, 2- dimetilciclopropano carboxilato] es una mezcla racémica de ocho isómeros. Hay dos grupos de isómeros, los que tienen el anillo ciclopropilo del diclorovinilo y los grupos éster con orientación cis y los que poseen una orientación trans. En particular, cipermetrina-α es una mezcla de dos de los cuatro isómeros cis presentes en aproximadamente 25% de la cipermetrina, es decir los isómeros (1R, cis)S y (1S, cis)R. Cipermetrina-α contiene más del 90% del par enantiomérico más activo como insecticida (WHO, 1992).
Se cree que la cipermetrina-a es degradada en el agua tanto por procesos fotoquímicos como biológicos. El agua superficial y sub-superficial en una charca rociada con 15 g/ha de ingrediente activo contiene de 5 a 19% de la dosis aplicada un día después del rociado, y 0,1% a 2% de la dosis aplicada siete días después. Aproximadamente el 5% de la dosis aplicada persiste como sedimento 16 días después de la aplicación (WHO, 1992). También se ha probado que cipermetrina-a se absorbe fuertemente en las partículas del suelo y que los residuos en él permanecen por debajo de 0,1 mg / Kg hasta un año después del tratamiento con 0,5 Kg de ingrediente activo por hectárea (WHO, 1992).
Se sabe que cipermetrina-a es altamente tóxica para invertebrados acuáticos. Los valores de la concentración efectiva 50 (CE50) (inmovilización) a las 24 y 48 hs. para Daphnia magna son de 1,0 y 0,3 μg / L, respectivamente, y a las 24 hs. para Gammarus pulex es de 0,05 μg / L. Así, cipermetrina-α es altamente tóxico para numerosos taxa de artrópodos acuáticos, pero posee una menor toxicidad en moluscos. Cipermetrina-a es altamente tóxica también para peces, con valores de concentración letal 50 (CL50) a las 96 horas postratamiento entre 0,7 - 350 μg/L dependiendo de la formulación. Las formulaciones emulsificables concentradas son más tóxicas que las suspensiones concentradas. El peligro de cipermetrina-a en peces e invertebrados acuáticos reside en su toxicidad aguda. No existen evidencias de ocurrencia de efectos acumulativos como resultado de exposiciones a largo término. En los ensayos de laboratorio, su toxicidad para lombrices de tierra es baja, mientras que para abejas es altamente tóxica. La elevada toxicidad de la cipermetrina-α para las abejas no se manifiesta en sí misma en ensayos de campo, probablemente como resultado del efecto repelente que ejerce este piretroide, causando una disminución en la actividad libadora de las abejas y, así, en la exposición de estos insectos (WHO, 1992).
En los últimos años se ha observado que las pruebas de toxicidad que sólo estudian los efectos inmediatos (mortalidad) no son adecuadas en las evaluaciones de riesgo de los ecosistemas en su conjunto. Por ello, también se consideran importantes las evaluaciones de las alteraciones a largo plazo, es decir subcrónicas y crónicas, que sirven de referencia para considerar la incidencia de estos cambios sobre la biodiversidad y la salud humana. Debido a estas razones se desarrollaron bioensayos de toxicidad agudos y crónicos sobre estadios críticos de embriones y larvas de dos especies de anuros, Physalaemus biligonigerus y Bufo arenarum; los cuales por su sensibilidad a los biocidas (Lajmanovich y col., 1998) tienen importancia ecológica. Además, se efectuó el análisis morfológico a nivel de microscopía fotónica y electrónica, de los órganos blanco, con el fin de evaluar y conocer el desarrollo de mecanismos de adaptación a las nuevas condiciones adversas. Para corroborar los resultados y complementar los estudios se aplicaron técnicas de in situ TUNEL y morfometría.
II. Materiales y Métodos
Luego de haber determinado que el piretroide cipermetrina-a provoca una apoptosis masiva, dependiente tanto de la dosis como del tiempo de exposición, de las células del sistema nervioso central embrionario y larval de Physalaemus biligonigerus (Izaguirre y col., 2000, 2001), se realizaron bioensayos de mortalidad en una segunda especie, Bufo arenarum, obtenida por la inducción a ovoposición en laboratorio, seguida de fertilización in vitro. Esta estrategia permitió contar con cohortes embrionarias y larvales homogéneas, de fácil desarrollo en condiciones de laboratorio, en todas las épocas del año, facilitando la realización de un estudio más completo, a la vez que permitió la profundización de las comprobaciones experimentales. En esta segunda fase de la investigación se realizó el cálculo morfométrico del número de células apoptóticas por cerebro y por dosis a las 96 hs. del bioensayo. Además de las pruebas morfológicas a nivel de microscopía óptica y electrónica, hemos realizado un test de apoptosis aplicando la técnica de TUNEL. La doble marcación inmunofluorescente de núcleos normales (DAPI) vs. apoptóticos (fluoresceína) permiten comparar tanto la especificidad como la magnitud del fenómeno apoptótico disparado por las diferentes dosis de cipermetrina.
Adicionalmente, el desarrollo de bioensayos subletales permitió tanto la investigación de efectos producidos a dosis menores a las que provocan la muerte de los individuos, así como el posible efecto de cipermetrina-a sobre el desarrollo embrionario.
II.1. Obtención de los especímenes
Los ensayos con Physalaemus biligonigerus se realizaron con nidos de espuma colectados en una charca temporaria del valle de inundación del Río Paraná (31° 43´ S; 60° 34´ O, Paraná, Argentina) y se mantuvieron en condiciones de laboratorio. La eclosión se produjo entre el 5to y 7mo día y los embriones y larvas obtenidos fueron aclimatados en tanques de vidrio de agua artificial de charca (APW: pH 8,1, conductividad 410 μohms/cm-1, concentración de oxígeno disuelto 5,5mg/L, dureza 83 mg/L CaCO3), a 22± 2o C por 7 días.
Los ensayos con Bufo arenarum se realizaron con ovocitos obtenidos de hembras adultas inducidas por inyección intraperitoneal de 2.500 UI de gonadotrofina coriónica humana (GCh) (Endocorion, Elea, Buenos Aires). Los embriones fueron obtenidos fertilizando los ovocitos con homogenatos de tejido testicular e incubándolos en solución Holtfreter (Holtfreter, 1931). Los embriones se mantuvieron en recipientes de 1.000 mL hasta que alcanzaron el estadio 20 (Gosner, 1960) y luego se transfirieron a las condiciones descriptas para el bioensayo. Las larvas fueron aclimatadas en las mismas condiciones que las de P. biligonigerus.
II.2. Bioensayos
Los ensayos de toxicidad aguda de 96 hs. y subletales en Physalaemus biligonigerus y Bufo arenarum fueron realizados de acuerdo a los métodos estandarizados de USEPA (1975, 1989), por triplicado y a una densidad de 10 larvas/L. El producto ensayado fue SHERPA® (Rhone Poulenc), una formulación comercial que contiene 25% de cipermetrina (CY) en xilol.
II.2.1. Bioensayos de toxicidad aguda durante 96 hs.
Las concentraciones de CY usadas para Physalaemus biligonigerus (estadios 26 hasta el 36, peso promedio de 0,06 + 0,01 gr) fueron: 375, 750, 1.500, 3.000 y 6.000 μg CY/L, y para Bufo arenarum (estadio 27, peso promedio de 0,008 + 0,002 gr.): 39, 156, 625, 2.500 y 10.000 μg de CY/L. Los controles fueron conducidos en APW con o sin vehículo (xilol) durante los mismos períodos de tiempo. Los tests fueron realizados a 22 ± 2° C y 12 hs luz - 12 hs oscuridad. Las soluciones fueron renovadas diariamente.
En ambos casos, la mortalidad fue registrada a las 24, 48, 72 y 96 hs y se estimó la concentración letal 50 (CL50) con límites de confianza (p<0,05) usando un programa de análisis Probit basado en Finney (1971). Los datos de los grupos experimentales y control fueron analizados mediante un ANOVA en conjunción con un test LSD (Sokal & Rohlf, 1979).
II.2.2. Bioensayos subletales con P. biligonigerus
Se realizaron respetando las condiciones precedentes, pero las concentraciones de CY usadas fueron: 12,9; 21,6; 36, 60 y 100 μg CY/ L.
II.3. Evaluación del desarrollo de Bufo arenarum
Previo a la inclusión del material para su estudio histológico y ultraestructural, los embriones de estadios 18-19 de B. arenarum provenientes del test subletal fueron fotografiados con un estereomicroscopio Nikon y evaluados en su desarrollo. Se estimaron algunos parámetros del desarrollo embrionario como longitud total (desde la boca hasta el final de la cola) y longitud de la cola (desde la cloaca hasta el final de la cola). Las mediciones fueron realizadas con un calibre digital micrométrico (precisión de 0,01 mm). Los resultados fueron analizados con el test de Kolmogorov-Smirnov y se obtuvieron los coeficientes de correlación de Bravais-Pearson a diferentes concentraciones. El análisis estadístico fue realizado con el programa Statgraphics (1994) con límites de confianza p ≤ 0,05.
II.3.1. Estudios histológicos y ultraestructurales
Larvas tratadas y control, sobrevivientes de los tests agudos y subletales de toxicidad para Physalaemus biligonigerus y Bufo arenarum a 24, 48, 72 y 96 hs fueron fijados en solución de glutaraldehído 3%, formaldehído 3%, solución saturada de ácido pícrico en buffer fosfato salino 0,1 M pH 7,4 por 4hs, a temperatura ambiente. A continuación de la fijación, se disecaron bajo lupa estereoscópica el cerebro, la piel y los ojos. Los tejidos fueron profusamente lavados en PBS, deshidratados en una serie acetónica de concentraciones crecientes y embebidas en araldita (Ladd®). Después de la polimerización los diferentes tejidos fueron seccionados a 0,5 μm de espesor con un ultramicrótomo Reichert Ultracut-S y teñidos con azul de toluidina. Las secciones fueron fotografiadas con un microscopio Olympus BX-50.
Las secciones de 80 nm de espesor para el análisis por microscopía electrónica de transmisión fueron realizadas en áreas preseleccionadas de cada tejido estudiado. Las secciones fueron doblemente teñidas con acetato de uranilo y citrato de plomo y examinadas con un TEM Phillips 201.
II.3.2. Estudios Morfométricos
Un grupo de larvas de B. arenarum sobrevivientes del test agudo de toxicidad fueron fijadas en Carnoy (60% etanol, 30% de cloroformo y 10% de ácido acético glacial) para IHQ, y en formaldehído 4% en tampón fosfato 0,1M pH 7,2 para morfometría; deshidratadas en una serie alcohólica de concentraciones crecientes, clareadas en xilol e incluidas en parafina (Cicarelli, San Lorenzo, Sta. Fe, Argentina). Los especímenes fueron seccionados a 5 μm de espesor en sentido sagital con un micrótomo de deslizamiento Reichert Hn 40 y montados en portaobjetos tratados con gelatina 1%, para los estudios de morfometría.
Para estos estudios se utilizaron larvas de Bufo arenarum sobrevivientes del test de 96 hs (n = 5), por cada concentración bioensayada. Las secciones fueron clareadas en xilol 100%, rehidratadas en una serie alcohólica de concentraciones decrecientes y teñidas con hematoxilina-eosina. Luego fueron deshidratadas y montadas con bálsamo de Canadá. Finalmente, para la identificación morfológica de las células apoptóticas versus las células normales, se utilizaron los criterios definidos por Izaguirre y colaboradores (2000) (Fig. 1). Brevemente, las células se consideraron apoptóticas cuando exhibían un núcleo condensado y muy picnótico, rodeadas por un halo claro característico.
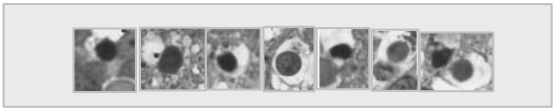
Figura 1: Tipos de células que se consideraron apoptóticas en el análisis morfométrico
El recuento de células apoptóticas fue realizado en la totalidad de los cortes de cerebro, por dos operadores distintos y en forma manual con un microscopio óptico Leitz a 400X.
Para cada uno de los cerebros se calculó el siguiente índice apoptótico:
Ia = Na / Dc
Donde: Ia: índice apoptótico
Na: Nº total de células apoptóticas
Dc: diámetro cerebral
Cada punto experimental comprende el promedio de 5 animales y fue expresado como media ± desviación estándar. Estos valores fueron sometidos al análisis de la varianza mediante el test de Kruskal-Wallis (ANOVA no-paramétrico), utilizando el test de comparaciones múltiples de Dunn como test a posteriori. Diferencias encontradas a niveles de significación menores o iguales a 0,05 fueron consideradas estadísticamente significativas.
Adicionalmente, los datos morfométricos fueron transformados (1/x) para calcular la concentración efectiva 50 (CE50) a las 96 horas de tratamiento. La concentración efectiva 50 (CE50) fue estimada con un límite de confianza (p<0,05) usando un programa de análisis probit basado en Finney (1971).
Todos estos análisis fueron procesados con el programa estadístico (GraphPad Instat Software® 1994 Versión 3.1. Número de Serie: 50533-353).
II.3.3. In situ TUNEL
Un grupo de larvas de Bufo arenarum bioensayadas durante 96 horas, fijadas en Carnoy, procesadas y seccionadas sagitalmente como se describió precedentemente fueron usadas para corroborar la presencia de células apoptóticas usando el In Situ Cell Death Detection Kit Fluorescein (Boehringer- Mannheim). Dicho test se basa en la adición a los extremos libres 3'-OH de los fragmentos de ADN generados durante el proceso de apoptosis, con nucleótidos modificados -con fluoresceína- catalizada por la enzima terminal desoxinucleotidil transferasa (TdT).
Las secciones fueron desparafinadas en xilol y rehidratadas usando una serie alcohólica de concentraciones decrecientes. Luego fueron incubadas con proteinasa K (20 mg/mL en 10 mM Tris / HCl, pH 7,4 - 8) por 15 - 30 min, a 37ºC. Las secciones fueron irradiadas con microondas (370 W durante 5 min en 200 mL de tampón citrato 0,1M pH 6), lavadas en PBS dos veces e incubadas a 37ºC durante 60 min y en oscuridad con la mezcla de reacción TUNEL -preparada de acuerdo a las indicaciones del fabricante. Posteriormente, las muestras fueron lavadas tres veces en PBS, montados con Vectashield® Mounting Medium with DAPI (Vector Laboratories, Burlingame CS, USA) y evaluados con un microscopio de fluorescencia Olympus. Como controles negativos las secciones fueron incubadas sólo con la solución de nucleótidos marcados con fluoresceína, sin la enzima terminal transferasa. Como controles positivos las secciones desparafinadas y rehidratadas fueron tratadas con DNasa I (100 μg / mL en Tris-HCl 50mM, pH 7,5, MgCl2 1 mM, 1 mg / mL BSA) por 10 min a temperatura ambiente, para inducir rupturas en las hebras de ADN.
IV. Resultados
IV.1. Bioensayos con Physalaemus biligonigerus
En el rango de 375 a 750 mg CY/L, la mortalidad de las larvas a las 96 hs fue alta y mostró diferencias significativas, comparada con las larvas control. Desde 1.500 a 3.000 mg CY/L la tasa de supervivencia fue de aproximadamente el 10%. A las 24 hs todas las larvas tratadas con 6.000 μg CY/L murieron (Fig. 2).
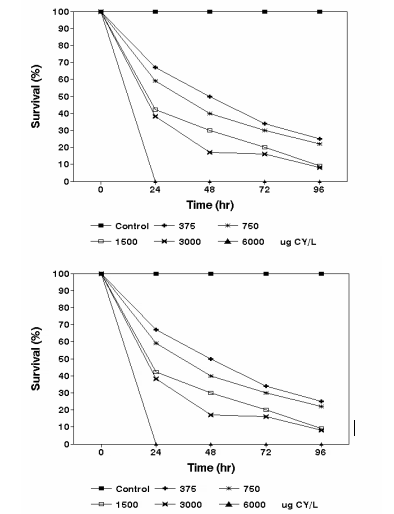
Figura 2: Curvas de supervivencia de larvas de Physalaemus biligonigerus (izquierda) y de Bufo arenarum (derecha) expuestas a distintas concentraciones de cipermetrina
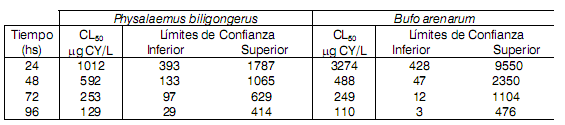
La CL50 a las 96 hs fue 7,9 veces menor que a las 24 hs (Tabla 1). Esto significa que se produce un incremento de la toxicidad de la CY conforme se incrementan los tiempos de exposición.
Tabla 1: Toxicidad aguda (CL50) de larvas de Physalaemus biligonigerus y de Bufo arenarum expuestas a distintas concentraciones de cipermetrina
Las pruebas de subletalidad permitieron verificar síntomas equivalentes a las fases I y II del comportamiento neurotóxico a cipermetrina. Las larvas incubadas en concentraciones tan bajas como 12,9 mg CY/L mostraron claros síntomas de intoxicación. En las pruebas agudas de 96 hs, las larvas En Bufo arenarum, dentro del rango de 39 a 156 μg CY/L se observó una alta tasa de mortalidad (30%) a las 96 hs. Estos porcentajes resultaron significativamente diferentes en comparación con las larvas control (p≤ 0,05). Entre 625 y 2.500μg CY/L, la tasa de supervivencia fue de aproximadamente 15%. A las 24 hs todas las larvas tratadas con 10.000 g CY/L murieron (Fig. 2). En relación con el tratamiento de 24 hs, la CL50 fue 6, 13 y 30 veces menor a: 48, 72 y 96 hs, respectivamente (Tabla 1). Por lo tanto, se produce un marcado incremento de la citotoxicidad conforme aumenta el tiempo de tratamiento. Dicho incremento tiene un comportamiento prácticamente lineal y es de mayor magnitud que para P. biligonigerus.
En forma proporcional al incremento de la concentración de cipermetrina, en ambas especies se pudo verificar síndrome de hiperactividad y comportamiento aberrante (larvas exhibiendo cola curvada lateralmente, deformidad en el eje céfalo-caudal y actividad natatoria giratoria).
IV.2. Estudios histológicos y ultraestructurales
En el presente estudio se examinaron a nivel microscópico, secciones transversales teñidas con azul de toluidina, del cerebro de larvas de Physalaemus biligonigerus (estadios 26-36) y de Bufo arenarum (estadio 27) a nivel del telencéfalo, tanto de animales control como tratados (100, 375, 1.500 y 3.000 mg CY/L para P . biligonigerus; 39, 156, 625 y 2.500 mg CY/L para B. arenarum) sobrevivientes del test de toxicidad aguda para todos los tiempos bajo estudio.
Las láminas celulares ventricular, marginal e intermedia del cerebro se visualizaron diferencialmente afectadas, mostrando arrugamiento volumétrico, pérdida de las uniones celulares, pérdida evidente del número y organización celular y aumento de los espacios intercelulares. Figuras apoptóticas típicas (masas redondeadas u ovales de núcleos y citoplasmas picnóticos) se verificaron en los cerebros en todas las dosis y tiempos analizados, aunque se verificó un gradiente dependiente de la dosis y tiempo de exposición al biocida (Figs. 3a-d). No se observaron cambios en otros tejidos aun a las dosis más altas (datos no mostrados).
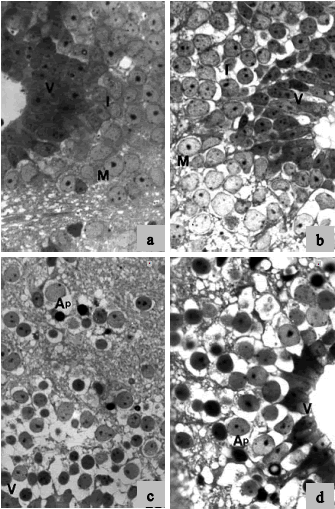
Figura 3: Secciones transversales del telencéfalo de larvas de Physalaemus biligonigerus teñidas con azul de toluidina (330X). a. Larva control, mostrando las capas celulares normales: ventricular, intermedia y marginal. b. 100 mg CY/L a las 48 hs. Se observa incipiente contracción celular y pérdida de uniones intercelulares. c. 100 mg CY/L a las 96 hs. Aumentan la contracción del volumen celular y los espacios intercelulatres con el mayor tiempo de exposición a CY. Se observan numerosas células apoptóticas y pérdida de organización de las capas celulares. d. 1.500 mg CY/L a las 48 hs. Observe que el aumento de la dosis a cortos tiempos de exposición causa neuroalteraciones similares a las mostradas en c. V: capa ventricular; I: capa intermedia; M: capa marginal; Ap: figura apoptótica.
A nivel ultraestructural, las células cerebrales inmaduras de los animales control poseen las características típicas de las células de los tejidos normales (Fig. 4 a), incluyendo esporádicas figuras apoptóticas. A su vez, en todas las larvas tratadas se pudo verificar un gradiente -dosis y tiempo dependiente- de células apoptóticas, caracterizadas por la formación de ampollas o burbujas en la membrana plasmática y la explosión celular en una serie de cuerpos rodeados de membrana, mientras que las organelas citoplasmáticas permanecen en gran parte intactas (Fig. 4b). El retículo endoplasmático está dilatado y posee una serie de cavidades similares a cráteres donde las cisternas se unen con la superficie celular. La estructura de las mitocondrias y ribosomas es normal a diferencia de lo que ocurre en los procesos necróticos. Como es usual en los procesos apoptóticos, los cambios más significativos ocurren en el núcleo (Figs. 4a-b). La cromatina forma agregados densos bordeando la membrana nuclear, resultando finalmente en núcleos segmentados. La célula se separa en grupos de vesículas limitados por membrana, denominados «cuerpos apoptóticos», los cuales a menudo contienen mitocondrias y otras organelas subcelulares morfológicamente normales (Fig. 4b). También se observaron cuerpos apoptóticos fagocitados por macrófagos u otras células neuronales viables adyacentes (no mostrado). Debido a la preservación de las organelas celulares no se produce liberación del material celular al espacio circundante o bien, ésta es escasa.
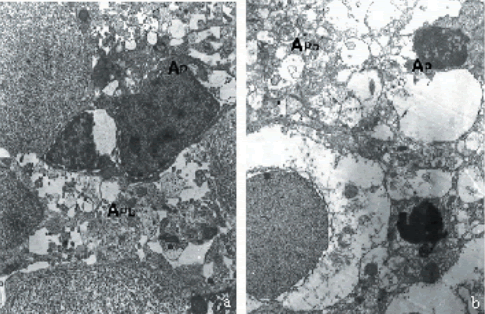
Figura 4: Ultraestructura de las células telencefálicas de larvas de Physalaemus biligonigerus. a. Detalle de células normales y de una célula apoptótica en una larva control (7.000X). b. Detalle del telencéfalo después de un tratamiento de 96 hs con 100
Tabla 2: Índices apoptóticos en cerebros de larvas de Bufo arenarum tratadas con distintas dosis de cipermetrina
![]()
IV. 3. Morfometría
Se encontraron diferencias significativas en el índice apopotótico de los -dosis y tiempo dependiente- de células apoptóticas, caracterizadas por la formación de ampollas o burbujas en la membrana plasmática y la explosión celular en una serie de cuerpos rodeados de membrana, mientras que las organelas citoplasmáticas permanecen en gran parte intactas (Fig. 4b). El retículo endoplasmático está dilatado y posee una serie de cavidades similares a cráteres donde las cisternas se unen con la superficie celular. La estructura de las mitocondrias y ribosomas es normal a diferencia de lo que ocurre en los procesos necróticos. Como es usual en los procesos apoptóticos, los cambios más significativos ocurren en el núcleo (Figs. 4a-b). La cromatina forma agregados densos bordeando la membrana nuclear, resultando finalmente en núcleos segmentados.
La célula se separa en grupos de vesículas limitados por membrana, denominados «cuerpos apoptóticos», los cuales a menudo contienen mitocondrias y otras organelas subcelulares morfológicamente normales (Fig. 4b). También se observaron cuerpos apoptóticos fagocitados por macrófagos u otras células neuronales viables adyacentes (no mostrado). Debido a la preservación de las organelas celulares no se produce liberación del material celular al espacio circundante o bien, ésta es escasa.
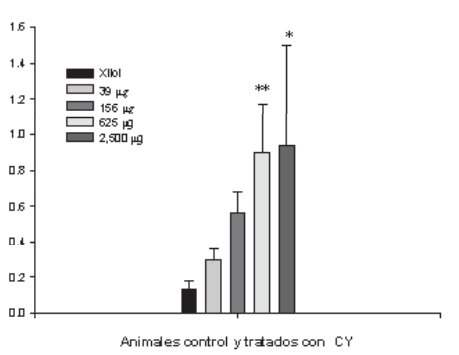
Figura 5: Histograma de los índices apoptóticos en larvas de B. arenarum (Media± DE) control (Xilol). * P<0,05 ** p<0,01.
IV.4. In situ TUNEL
Se observó un incremento significativo del número de núcleos apoptóticos conforme se incrementaba la dosis de cipermetrina (Figs. 6a-d), corroborando el efecto proapoptótico de CY . La escasez de núcleos fluorescentes con bajas dosis del piretriode (39 µg CY/L) muestra que los estadios tempranos de la apoptosis no están acompañados por una importante fragmentación internucleosomal de ADN. La detección de eventos apoptóticos sufre un incremento muy importante en los cerebros de los animales tratados con 2.500 µg CY/L.
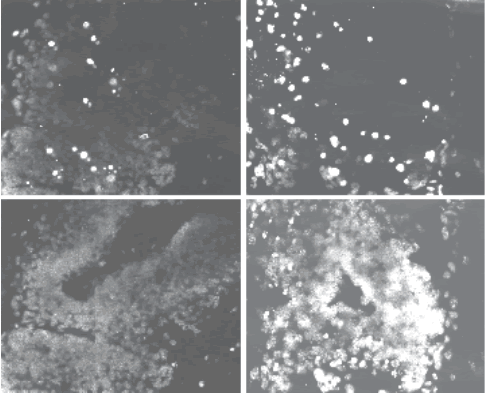
Figura 6: In situ TUNEL (a-b) vs. DAPI (c-d) de secciones sagitales de cerebro de larvas de B. arenarum. a y c. 39 µg CY/L; b y d. 2.500 µg CY/L.
IV.4.1. Influencia de cipermetrina en el desarrollo embrionario
Si bien se detectaron alteraciones morfológicas macroscópicas de los embriones a partir de 625 mg CY/L - 48 hs (Figs. 7a-h), el efecto parece ser dosis-dependiente a las 96 hs (Tabla 3). Se observó arqueamiento del eje corporal, reducción del tamaño del cuerpo y de la cabeza (Figs. 6a-h).
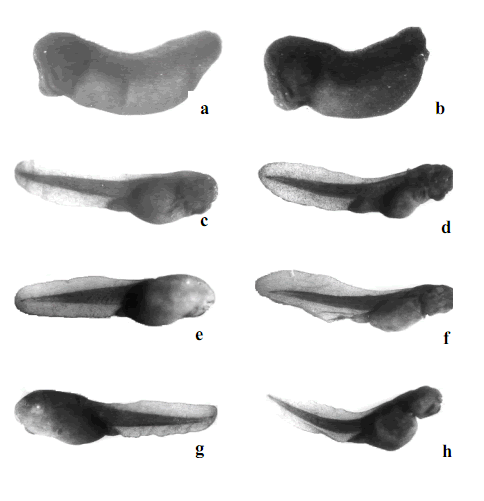
Figura 7: Efectos de la CY en el desarrollo de Bufo arenarum. a. Control de estadio 18 a las 24 hs del bioensayo. b. 156 µg CY/L-24 hs. c. Control de estadio 21 a las 48 hs del bioensayo. d. 625 µg CY/L-48 hs. e. Control de estadio 25 a las 72 hs del bioensayo. f. 156 µg CY/L-72 hs. g. Control de estadio 25 a las 96 hs. del bioensayo. h. 625 µg CY/ L-96 hs.
Los embriones mostraron inhibición del desarrollo a las 72 hs de exposición a CY (Tabla 4). Se encontraron correlaciones significativamente negativas en los parámetros morfométricos entre los animales control y los tratados con CY, fundamentalmente a partir de 156 µg CY/L y 72 hs de exposición.
Los estudios histológicos demostraron la inducción masiva de apoptosis cerebral y de las vesículas oculares (origen neural) a partir de concentraciones de 625 µg de CY/L y 96 hs de tratamiento con CY (Figs. 8a-b).
Tabla 3: Desarrollo de embriones de Bufo arenarum control y expuestos a CY. St: estadio de desarrollo (Gosner, 1960). LT: longitud total; LCo: longitud de la cola (media ± DE). Kolmogorov Smirnov (p KS) > 0,05 para valores normales. rs: coeficiente de correlación de Bravais-Pearson, (ns) = no significativo, * = p < 0,05, ** p < 0,01.

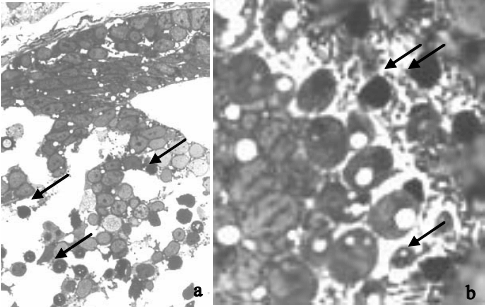
Figura 8: Sección transversal teñida con azul de toluidina, de un embrión de Bufo arenarum después de 96 hs de tratamiento con 625 µµ µµ µg CY/L (333X). a. Tubo neural notablemente desorganizado y con numerosas figuras apoptóticas (flechas). b. Detalle del ojo, mostrando la coexistencia de células viables con células apoptóticas (flechas).
V. Discusión
Los piretroides han incrementado su popularidad para el control de los insectos en sistemas acuáticos y agrícolas (Smith y Straton, 1986). Entre ellos, la cipermetrina es un piretroide sintético tipo II altamente activo y efectivo contra un amplio rango de pestes que afectan la agricultura, la salud pública y a los animales domésticos (WHO, 1989). Los derivados a-ciano (tipo II) con el grupo CN en la configuración S del 3-fenoxibencil alcohol (Ej.: cipermetrina, deltametrina, cihalotrina, fenvalerato, fenpropatrina) tienen el doble de potencia sobre los insectos que los piretros del tipo I (Ej.: permetrina, alfametrina, bioalletrina).
Aunque se cree que los piretroides son relativamente no tóxicos para aves y mamíferos, se ha probado que son extremadamente tóxicos para los organismos acuáticos (Jolly y col. 1978; Smith y Stratton, 1986). En particular, los peces son altamente sensibles (Holcombe et al., 1982; Eshleman y Murria, 1991; Little y col., 1993). En pruebas de laboratorio con peces, la CL50 a 96 hs está en el rango de 0,4-2,8 µg CY/L (WHO, 1989). Sin embargo, la atención alrededor del mundo se ha enfocado en los anfibios debido a que sus poblaciones se encuentran en franca declinación (Hedges y col., 1993; Wake, 1991; Donnelly y Crump, 1998). Las posibles razones de tal proceso incluyen la destrucción del hábitat, los cambios del uso de la tierra, la radiación ultravioleta, la introducción de competidores no nativos, la lluvia ácida, la sobrecolección, el cambio climático y los contaminantes ambientales (Vos y Phillips, 1990; Pounds y Crump, 1994; Berill y col., 1994). Algunos estudios han demostrado que los anfibios son altamente sensibles a casi todos los piretroides examinados (Cole y col., 1983;Salibián, 1992; Salibián y Marazzo, 1995; Izaguirre y col., 2000, 2001).
Los piretroides se caracterizan por una actividad insecticida de amplio espectro basada en su neurotoxicidad (Salibián, 1992; Salibián y Marazzo, 1995). Se cree que actúan interfiriendo la permeabilidad iónica de las membranas celulares y en la generación y conducción de los impulsos nerviosos del sistema nervioso central y periférico. En los mamíferos, se ha probado que actúan sobre el mecanismo de entrada de los iones sodio, produciendo ralentización del cierre de los canales de sodio (Kaloyanova y col., 1991). Salibián y Marazzo (1995) notaron que la acción biocida de la mayoría de los piretroides se basa en la alteración de la conductancia iónica de la membrana nerviosa. Adicionalmente, Berlin y col. (1984) demostraron que los tejidos nerviosos incrementan el influjo de sodio transmembrana e inhiben la ATPasa dependiente de iones en insectos, calamares y sapos.
Los resultados del presente trabajo demuestran que las larvas dePhysalaemus biligonigerus, especie que vive tanto en aguas corrientes como pantanos temporarios asociados con regiones agrícolas sujetas a aplicación de pesticidas, resulta un modelo experimental sensible para testear contaminación ambiental. Sin embargo, a la hora de cuantificar morfométricamente el grado de afectación, no resultó un buen modelo experimental por lo que en una segunda fase del estudio se recurrió al uso de otra especie de anfibios, el sapo Bufo arenarum. Este anuro permite la obtención de especímenes en el laboratorio, a través de la inducción a ovoposición seguida de fertilización in vitro, lo que genera cohortes homogéneas en todas las épocas del año, permitiendo así la realización de un estudio más completo y la profundización de las comprobaciones
experimentales.
El trabajo realizado demuestra que tanto las poblaciones naturales de larvas de Physalaemus biligonigerus como las de Bufo arenarum obtenidas por fertilización in vitro serían afectadas por la aplicación de CY, aun en valores de concentración menores que la correspondiente a la CL50 obtenida en el laboratorio. Se verificó que las células nerviosas indiferenciadas de las larvas en desarrollo, son vulnerables a los disturbios ambientales y sufren muerte celular programada - dosis y tiempo-dependientes. Se probó, además, que el efecto de cipermetrina es específico para las células nerviosas. Adicionalmente, se distinguieron las fases de neurotoxicidad típicas de la intoxicación con CY descriptas por Salibián (1992).
A las 96 hs, la CL50 para larvas de Physalaemus biligonigerus fue de 129 mg CY/L y para Bufo arenarum de 110 μg CY/L, valores mucho mayores que los hallados para peces. Sin embargo, comparando los límites de confianza de nuestra prueba aguda y el análisis morfológico de la prueba subletal, puede inferirse que aún menores concentraciones que las de la CL50 a 96 hs, pueden causar neuroalteraciones. Nuestro rango de valor estimado fue similar al de α-cipermetrina (0,7 y 350 μg CY/L, WHO, 1992), dependiendo de las formulaciones.
Los experimentos de fumigación con CY (Crossland, 1982) a concentraciones iniciales de 24.000 μg CY/L, demuestran que después de la primer semana la concentración cae a 50 μg CY/L. Suponiendo una degradación progresiva, después de 96 hs la concentración en el agua debería ser de aproximadamente 10.000 μg CY/L. Estos valores son extremadamente superiores a los usados en el presente bioensayo y a los obtenidos para las CL50 96 hs en las dos especies bajo estudio. De acuerdo con Ruzo y col. (1977) la CY es uno de los piretroides tipo II más estables a la luz. Roberts y Standen (1981) mostraron que las tasas de degradación de CY observadas tanto en condiciones de laboratorio como de campo no difieren significativamente.
Los cambios morfológicos observados en el telencéfalo, tanto por microscopía óptica como electrónica, aparecen como una respuesta aguda a las agresivas dosis de CY. Esta reacción disminuye con la disminución de cipermetrina y el tiempo de exposición. Principalmente, un fenómeno apoptótico a nivel neural se observó a concentraciones superiores a 100 µg CY/L para las dos especies estudiadas. Se ha demostrado en este estudio que la CY dispara una muerte celular programada masiva, de manera dependiente de la dosis y el tiempo. Está bien establecido que la muerte celular programada juega un rol muy importante durante la maduración del sistema nervioso central (Xiao y Nikodem, 1998). Usualmente el proceso de apoptosis es contrastado con el de muerte por necrosis, porque este último a menudo está asociado con muerte celular inducida por toxinas (Wyllie y col., 1980; Kerr y col., 1987). Basados en nuestros resultados de laboratorio, concluimos que una simple exposición de las larvas a CY entre 12,9 y 100µg CY/L puede causar efectos subletales en el comportamiento, mientras que las concentraciones por encima de 100 µg CY/L pueden provocar mortalidad y una onda apoptótica masiva.
En el presente modelo no se detectaron alteraciones en otros órganos, concluyendo que el efecto es específico del sistema nervioso.
Si bien este artículo no expone el mecanismo molecular ni el patofisiológico de la toxicidad de la cipermetrina, sus resultados están en concordancia con reportes previos. Está bien establecido que la mayoría de las células realizan y mantienen el balance osmótico a través de la continua actividad de la bomba de Na+/K+ ~ ATPasa, la cual crea y mantiene un ambiente intracelular alto en potasio y bajo en sodio. En contraste, el ambiente extracelular típicamente contiene bajos niveles de potasio y altos niveles de sodio. A pesar del potencial transmembrana negativo, se establece un gradiente electroquímico neto que favorece el movimiento pasivo de potasio fuera de la célula. Probablemente el movimiento de iones de potasio sea el responsable de la pérdida de volumen celular durante el proceso apoptótico (Hoffmann, 1986; al-Habori, 1994; Hoffmann y Dunham, 1995). Debido a que la evidencia disponible indica que la acción de los piretroides altera principalmente el proceso de transporte de Na+ a través de la membrana, sugerimos que el efecto de la CY sobre el mecanismo de transporte iónico puede ser el responsable de la onda apoptótica masiva. Sin embargo, estudios recientes han postulado la inducción de apoptosis por los piretroides vía el óxido nítrico, así como por otras especies de oxígeno reactivo (El-Gohary y col., 1999).
Desde un punto de vista ecológico, aun cuando la sensibilidad de los peces a los piretroides es más alta que en anfibios, el hecho de que las larvas habiten charcas temporarias podría hacerlas más vulnerables a la cipermetrina que los habitats lóticos. Por ello, se propone a las larvas de Physalaemus biligonigerus y de Bufo arenarum como organismos indicadores sensibles para bioensayos acuáticos de piretroides. A su vez, los estudios realizados con las larvas de Bufo arenarum permitieron corroborar los resultados obtenidos con P. biligonigerus (Izaguirre y col., 2000; 2001). Los resultados de la presente investigación serían los primeros en demostrar un mecanismo de respuesta apoptótica al efecto tóxico de cipermetrina en larvas de anfibios anuros. A su vez, permiten establecer que la exposición de embriones de estadios tempranos (estadio 18) a CY, por arriba de 72 hs, provoca la inhibición de su desarrollo, un efecto independiente de su neurotoxicidad.
Referencias bibliográficas
1. AL-HABORI, M. (1994). Cell volume and ion transport regulation, en: Int. J. Biochem., 26 (3): 319-334. [ Links ]
2. BERILL MS, BERTRAM S, MC.IVRAY L, KOLOHON M, PAUL B (1994). Effects of low concentration of forest-use pesticides on frog embryos and tadpoles, en: Environ. Toxicol. Chem., 13: 657-664. [ Links ]
3. BERLIN JR, AKERA T, BRODY TM, MATSUMURA F. (1984). The ionotropic effects of a synthetic pyrethroid decamethrin on isolated guinea pig atrial muscle, en: European J Pharmacol., 98: 313-322. [ Links ]
4. BLAUSTEIN A.; WAKE D. B. (1990). Declining amphibian populations: A global phenomenon, Trends Ecol. Evol, 5: 203-204. [ Links ]
5. BLAUSTEIN A., WAKE D., AND SOUSA, W. P. (1994). Amphibian declines: Judging stability, persistence, and susceptibility of populations to local and global extinction, en: Conserv. Biol., 8: 60-71. [ Links ]
6. BOUDOU, A.; RIBEYRE, F. (1989). Aquatic ecotoxicology: fundamental concepts and methodoly. Vol. 1. CRC Press., Boca Ratón, USA. [ Links ]
7. BULACIO, A. ; PANELO, M. S. (1999). Evaluación y medidas de seguridad en el manejo de fitosanitarios para cultivos extensivos en dos localidades de la República Argentina, en: Acta Toxicológica Argentina. 7: 32-35. [ Links ]
8. BURY, R. B., DODD, C. K.; FELLERS, G. M. (1980). Conservation of the Amphibian of the United States: a Review U.S. Fish Willd Serv., Resour. publ. 134, Washington DC, USA. [ Links ]
9. CAREY, C.; BRYAN, C. J. (1995). Possible interrelations among environmental toxicans, amphibian development, and decline of amphibian populations, en: Environmental Health Perspective, 103: suppl. 4: 13-17. [ Links ]
10. CASTANET, J.; GUYETANT, R. (1984). Atlas de répartition des Amphibias et Reptiles de France. Société Herpetologique de France, Paris, France. [ Links ]
11. CHEBEZ, J. C. (1994). Los que se van. Especies Argentinas en peligro. Albatros, Buenos Aires, Argentina. [ Links ]
12. COLE, L. M. ; CASIDA, J. E. (1983). Pyrethroid Toxicology in the Frog, en: Pesticide Biochemistry and Physiology, 20, 217-224. [ Links ]
13. CROSSLAND, N. O. (1982). Aquatic toxicology of cypermethrin: II. Fate and biological effects in pond experiments, en: Aquat. Toxicol., 2: 205-222. [ Links ]
14. DEVILLERS, J.; EXBRAYAT, J. M. (1992). Ecotoxicity of chemicals to Amphibia. Gordon & Breach Science Publishers, New York, London, Paris. [ Links ]
15. DONNELLY , M. A., CRUMP , M. L. (1998). Potential efects of climate change on two Neotropical amphibian assemblages, en: Climate Change, 39: 541-561. [ Links ]
16. EL-GOHARY M, AWARA WM, NASSAR S, HAWAS S (1999). Deltamethrin-induced testicular apoptosis in rats: the protective effect of nitric oxide synthase inhibitor, en: Toxicology 132: 1-8. [ Links ]
17. ESHLEMAN, A. J.; MURRAY , T. F . (1991). Pyrethroid insecticides indirectly inhibit GABA-dependent 36 CL- influx in synaptoneurosomes from the trout brain, en: Neuropharmacology, 12 A: 1333-1341. [ Links ]
18. FINNEY, D. J. (1971). Probit analysis. 3rd ed. Cambridge University Press, New York. [ Links ]
19. GOSNER, K. L. (1960). A simplified table for staging anuran embryos and larvae, with notes on identification, en: Herpetológica, 16: 183-190. [ Links ]
20. HEDGES SB, HASS CA, MAXSON LR. (1993). Relations of fish and tetrapods, en: Nature, 363(6429):501-502. [ Links ]
21. HERKOVITS, C., PEREZCOLL, C.; HERKOVITS, F . (1996). Ecotoxicity in the Reconquista river , Province of Buenos Aires, Argentina: Preliminary study, en: Environmental Health Perspectives, 104 (2): 186-189. [ Links ]
22. HOFFMANN, E. K. (1986). Anion transport systems in the plasma membrane of vertebrate cells, en: Biochim. Biophys. Acta, 864(1):1-3. [ Links ]
23. HOFFMANN, E. K.; DUNHAM, P . B. (1995). Membrane mechanisms and intracellular signalling in cell volume regulation, en: Int. Rev. Cytol., 161:173-262. [ Links ]
24. HOLCOMBE, G. W., PHIPPS, G. L.; TANNER, D. K. (1982). The acute toxicity of ketthane, dursban, disulfoton, pydrin, and permethrin to fathead minnous Pimephales promelas and rainbow trout Salmo gairdneri, en: Env. Poll. A29: 167-178. [ Links ]
25. HOLTFRETER J. (1931). Über die Aufzucht isolierter Teile des Amphibienkeimes. II Züchtung von Keimen und Keimteilen in Salzlösung, en: Roux Arch. 124, 405-464. [ Links ]
26. IZAGUIRRE, M. F., LAJMANOVICH, R. C., PELTZER, P . M., PERALTA SOLER, A.; CASCO, V. H. (2000). Cypermethrin- Induced Apoptosis in the Telencephalon of Physalaemus biligonigerus Tadpoles (Anura: Leptodactylidae), en: Bull. Environ. Contam. Toxicol. 65: 501-507. [ Links ]
27. IZAGUIRRE, M. F., LAJMANOVICH, R. C., PELTZER, P . M., PERALTA SOLER, A.; CASCO, V. H. (2001). Induction of cell Death by the Synthetic Pyrethroid Insecticide Cypermethrin in the Developing Brain of Physalaemus biligonigerus Tadpoles from Argentina, en: Froglog, 43-3. [ Links ]
28. JOLLY , A. L. JR., AVAULT , J. W., KOONEE, K. L.; GRAVES, J. B. (1978). Acute toxicity of permethrin to several aquatic animals, en: Trans. Am. Fish. Soc., 107: 825-827. [ Links ]
29. KALOYANOVA, F., BATAWI, E.; MOSTAFA, A. (1991). Human toxicology of pesticides. CRC, Press, Inc. Boca Ratón. [ Links ]
30. KERR, J. F . R., SEARLE, J., HARMON, B. V. AND BISHOP , C. J. (1987). Apoptosis. In Perspectives on Mammalian Cell Death, edited by C. S. Potten, pp. 93-128. Oxford: Oxford University Press. [ Links ]
31. LAJMANOVICH, R. C.; IZAGUIRRE M. F.; CASCO, V. H. (1998). Paraquat tolerance and Alteration of internal gills structures of Scinax nasica tadpoles (Anura:Hylidae), en: Arch. Environ. Contam Toxicol. 34 (4): 364-369. [ Links ]
32. LICHT, L. (1996). Amphibian Decline Still a Puzzle, en: BiosScience, 4 (3):173. [ Links ]
33. LITTLE, E. E.; DWYER, E. J.; FAIRCHILD, J. F.; DELONAY, A. J.;D ZAJICEK, J. L. (1993). Survival of bluegill and their behavioral responses during continuous and pulsed exposures to esfenvalerate, a pyrethroid insecticide, en: Environ. Toxicol. Chem., 12: 871-878. [ Links ]
34. PECHMANN J. H.; SCOTT, D., SEMLITSCH, R. D. ; CALDWELL J. P.; VITT, L.; GIBBONS W. (1991). Declining amphibian populations: The problem with separating human impacts natural populations, en: Science, 255: 892-895. [ Links ]
35. POUNDS, J. A.; CRUMP, M. L. (1994). Amphibian declines and climate disturbance: The case of the golden toad and the harlequin frog, en: Conserv. Biol., 8: 72-85. [ Links ]
36. ROBERTS TR ; STANDEN ME (1981). Further studies of the degradation of the pyrethroid insecticide cypermethrin in soils, en: Pestic. Sci., 12: 285-296. [ Links ]
37. RUZO,L.O.; HOLMSTEAD, R. L.; CASIDA, J. E. (1977). Pyrethroid photochemistry: Decamethrin, en: J. Agr. Food Chem., 25: 1385-1394. [ Links ]
38. SALIBIÁN, A. (1992). Effects of deltametrhin on the south american toad (Bufo arenarum), en: Bull. Eviron. Contam. Toxicol., 48 (4) 616-621. [ Links ]
39. SALIBIÁN, A. (1993). Interpretación fisiológica de las declinaciones de las poblaciones de anfibios, en: Res. 1ras . Jornadas de Medio Ambiente, La Plata:123. [ Links ]
40. SALIBIÁN, A.; MARAZZO, J. (1995). Studies on the Effects of Deltamethrin on Sodium Net Transport Through the in vivo Amphibian Skin, en: Biomedical and Environmental Sciencies, 8,164-168. [ Links ]
41. SCHUYTEMA, G.; NEBEKER, A.; PETERSEON, J. A.; GRIFFIS, W. (1993). Effects of Pentacholophenol-Contaminated Food Organisms on Toxicity and Bioaccumulation in the Frog Xenopus laevis, en: Arch. Environ. Contam Toxicol. 24: 359-364. [ Links ]
42. SMITH, T. M.; STRATTON, G. W. (1986). Effects of synthetic pyrethroid insecticides on non-target organisms, en: Residue Rev., 97: 93-120. [ Links ]
43. SOKAL, R. R., ROHLF, F. J. (1979). Biometría. Ediciones Blume, Madrid. [ Links ]
44. SUGAVANAM, B. (1996). Risk reduction in pesticide development in developing countries. Challenges and opportunities, en: J. Environ. Sci. Health, Part B, 31: 307-323. [ Links ]
45. UNITED STATES ENVIRONMENTAL PROTECTION AGENCY (USEPA). (1975). Methods for acute toxicity test with fish, macroinvertebrate, and amphibians. Ecol. Res. Ser. EPA- 660/3-75-009. [ Links ]
46. UNITED STATES ENVIRONMENTAL PROTECTION AGENCY (USEPA). (1989). Short- term methods for estimating the chronic toxicity of effluents and receiving waters to fishwater organism. 2nd edition. [ Links ]
47. WAKE, D.B. (1991). Declining amphibian populations, en: Science, 253:860. [ Links ]
48. WORLD HEALTH ORGANIZATION (WHO). (1989). Environmental Health Criteria 82: Cypermethrin. WHO/UN, Geneva:154. [ Links ]
49. WORLD HEALTH ORGANIZATION (WHO). (1992). Alpha-cypermethrin. Environmental Health Criteria 142. WHO/UN, Geneva: 20-44 . [ Links ]
50. WYLLIE, A. H.; KERR, J. F. R.; CURRIE, A. R. (1980). Cell death: the significance of apoptosis, en: International Review of Cytology, 68: 251-306. [ Links ]
51. XIAO, Q.; NIKODEM, V. M. (1998). Apoptosis cerebellum of the thyroid hormone deficient rat, en: Frontiers in Bioscience, 3: 1122-1145. [ Links ]














