Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Ciencia, docencia y tecnología
On-line version ISSN 1851-1716
Cienc. docencia tecnol. no.32 Concepción del Uruguay May 2006
CIENCIAS EXACTAS Y NATURALES - INGENIERÍAS Y TECNOLOGÍAS: INVESTIGACIÓN
Detección de Escherichia coli O157:H7 en aguas abiertas, heces y rumen de bovinos en las proximidades de casco urbano*
Detection of Escherichia coli O157:H7 in environ- mental waters, lees and rumen of bovines in urban proximities
José D. Tanaro**, Liliana H. Lound, M. M. Domínguez
*) Artículo producido en el marco del Proyecto de Investigación Cód. 9023, desarrollado en la Facultad de Bromatología y financiado por la SICTFRH, UNER, Informe Final aprobado por Resolución "C.S." N°276/05; recibido en octubre 2005 y aceptado en abril 2006.
**) Director del proyecto; Profesor Titular de Microbiología y Parasitología, Facultad de Bromatología, UNER, Gualeguaychú. E-mail: jdtanaro@fb.uner.edu.ar
Resumen
Se investigó la presencia de Escherichia coli O157:H7 en 35 muestras de agua provenientes del Río Gualeguaychú y de pequeños afluentes, 25 muestras de heces bovinas y 40 muestras de rumen. El esquema adoptado consistió en un enriquecimiento selectivo en caldo EC modificado adicionado de novobiocina, incubando a 42ºC durante 18 - 24 h, seguido de una inmunoconcentración magnética y posterior aislamiento en Agar MacConkey sorbitol adicionado de Telurito de potasio y en medio ID® incubando a 37ºC durante 18 - 24 h. Las colonias presuntivas fueron sometidas a etapas sucesivas de tamizaje bioquímico y serológico para después realizar pruebas complementarias de confirmación. Los aislamientos fueron caracterizados fenotípica y genotípicamente. Se obtuvieron 7 aislamientos a partir de agua y uno de contenido ruminal. Cinco cepas resultaron O157:H7 biotipo C toxigénicas, ß- Glucuronidasa (-), EHEC-hly (+), cuatro de ellas productoras de Stx ½ y la restante sólo productora de Stx2. Otras tres cepas resultaron no toxigénicas ni portadoras de los factores de virulencia eae y EHEC-hly, pero pertenecientes al serotipo O157.
Palabras clave: Escherichia coli O157:H7; Agua; Rumen; Estiércol; Separación inmunomagnética.
Abstract
Escherichia coli O157:H7 was searched in 35 water samples of the Gualeguaychú River and other small affluent streams, 25 samples of bovine faeces, and 40 samples of rumen. The adopted scheme consisted of a selective enrichment in modified broth EC added of novobiocina (42ºC, 18-24hs), followed by a magnetic inmunoconcentration and later isolation in Agar MacConkey sorbitol with addition of Telurito of Potassium and ID® medium (37ºC 18 - 24 h). Biochemical and serological screening was performed for the typical colonies, and then tests of confirmation were made. The strains isolated were fenotipic and genotipically characterized. Seven strains were obtained from water and one from ruminal content. Five strains were toxin-producing O157:H7 serotype and C biotype, ß-Glucuronidasa (-), EHEC-hly (+). Four of them were Stx ½-producing and the last strain was only Stx2-producing. Another three strains that were O157 serotype lacked of virulence factors.
Key words: Escherichia coli O157:H7; Water; Rumen; Manure; Immunomagnetic separation.
I. Introducción
Escherichia coli O157:H7 y los E. coli productores de Toxina de Shiga (STEC) son patógenos emergentes mundialmente difundidos, causantes de un síndrome diarreico seguido de graves consecuencias extraintestinales agudas que comprometen la vida, tales como el Síndrome Urémico Hemolítico (SUH) y la Púrpura Trombótica Tromobocitopénica (PPT), o dejan secuelas igualmente importantes como una insuficiencia renal a largo plazo. La enfermedad es primariamente una zoonosis transmitida por alimentos y, si bien es importante en estas bacterias caracterizadas por su baja dosis infectiva la transmisión persona a persona, particularmente en ambientes cerrados (como guarderías, geriátricos, etc.) o por contacto bebé-progenitores, se considera que éstas son constantemente reintroducidas desde su reservorio principal, el ganado bovino.
La relevancia de estos patógenos en Argentina radica tanto en el aspecto sanitario, -tiene una muy alta tasa de incidencia de SUH-, como en el económico, ya que, como país exportador de carne bovina puede resultar perjudicado si no se toman medidas eficaces para el control de la contaminación de las carnes en lo inmediato, y para intentar disminuir la prevalencia de los mencionados patógenos en el reservorio a largo plazo.
El modelo que interpreta la cadena infectiva (Ver Fig. 1) ha ido sufriendo una evolución desde las primeras hipótesis en 1987, pero aun hoy sigue habiendo aspectos relevantes de su epidemiología que se desconocen. Para investigar las posibles fuentes medioambientales del reservorio debe tenerse en cuenta que las limitaciones del concepto tradicional que considera el hábitat "normal" de E. coli al colon de animales de sangre caliente (aves y mamíferos) (Souza, 1999), utilizado como un indicador de contaminación fecal "reciente" del agua por su limitada supervivencia extraintestinal; ya que, es posible encontrar poblaciones de E. coli en vertebrados de sangre fría, y también se han encontrado cepas particulares residentes en ambientes acuáticos, especialmente los que son ricos en compuestos orgánicos como en las aguas de desagüe (Parveen, 1999). Surge la pregunta de si estas cepas de E. coli representan verdaderamente un riesgo para la salud humana, ya que algunos estudios que utilizan marcadores genéticos, como alozimas y ribotipos, muestran que la diversidad genética de las cepas es mayor en estos cuerpos de agua, y que las encontradas en el ambiente exterior no siempre son las mismas que existen en el colon de los hospederos (Pupo, 1995).
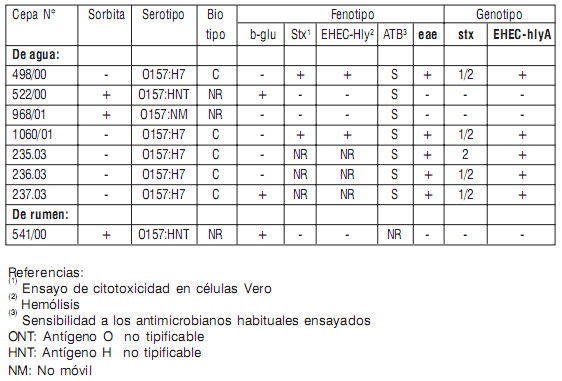
Figura 1: Evolución del modelo de la cadena infectiva de E. coli O157:H7 Tomado de Kaper JB, O'Brien A (Ed), Escherichia coli O157:H7 and other Shiga toxin-producing E. coli strains. American Society for Microbiology Press, Washington, DC
En la Figura 1 se pone de manifiesto que el agua juega un papel relevante en la cadena infectiva. Este es un vehículo que ha sido repetidamente vinculado a brotes o casos aislados de enfermedad producida por E. coli O157:H7 (Swerdlow, 1992; Bopp, 2003: Samadpour, 2002) y a otros serotipos (McCarthy, 1999). Esta transmisión se ha documentado con relación al uso del agua en forma recreacional, dónde se atribuiría a la ingestión de pequeños volúmenes de agua al nadar en piscinas (Samadpour, 2002; Feldman, 2002; Bruce, 1999; Friedman,
1999; Ackman, 1997; Brewster, 1994) y en lagos (Paunio, 1999).
El agua también se considera un vehículo potencial en la contaminación de las hortalizas, donde especialmente la lechuga ha resultado incriminada (Wachtel, 2002; Hilborn, 1999; Ackers, 1998).
Entre las conclusiones del 4° Simposio y Taller Internacional sobre Infecciones por Escherichia coli productor de Verotoxina (VTEC 2000) se afirma que el agua potable en áreas de cría intensiva de ganado se considera un factor de riesgo en aumento para la difusión de las infecciones humanas por VTEC.
Pero, además del rol del agua como vector de transmisión de estos patógenos en forma directa o indirecta al ser humano, ésta se ha considerado de importancia crítica en la colonización del ganado (Hancock, 2001; LeJeune, 2001; LeJeune, 1997). Actuar sobre esta ruta de transmisión horizontal controlando la contaminación de los abrevaderos tiene un significativo potencial para disminuir la contaminación cruzada entre los animales (LeJeune, 1997). Con este objetivo se han sugerido diversas estrategias (Callaway, 2004) relativas al manejo del agua en los establecimientos productivos, tales como, clorinación, ozonización, limpieza frecuente de los abrevaderos y la colocación de barreras para disminuir la presencia de sólidos orgánicos (Hancock, 2001) en los abrevaderos. El objetivo general de este artículo es aportar al conocimiento del rol del agua en la diseminación de cepas de STEC desde el reservorio animal al hombre, y su papel en el mantenimiento de la colonización de éste.
I. Materiales y Métodos
Se analizaron 35 muestras de agua provenientes del Río Gualeguaychú (Provincia de Entre Ríos, República Argentina) y de pequeños cursos afluentes que drenan campos contiguos donde se crían bovinos destinados al consumo interno, 25 muestras de heces bovinas y 40 muestras de rumen. El enriquecimiento se realizó en en 225 ml de caldo EC modificado adicionado de novobiocina durante 24 h a 42°C.
• Para la toma de muestras de agua se utilizó una metodología (Tanaro y col., 2001) consistente en ubicar hisopos de Moore durante 48 hs expuestos a la corriente fluvial. Los lugares escogidos fueron preferentemente zonas recreacionales (Ver Figura 2). Previo a incubarlos se agitaron los hisopos en el caldo 2 minutos en estomacher a velocidad media.

Figura 2: Lugares de toma de muestra
• Las heces se recogieron con cucharas plásticas descartables en bolsas estériles y luego se sembraron 25 g de cada una.
• Las muestras de rumen se obtuvieron en el momento del sacrificio, a partir de animales jóvenes (terneros de menos de 70 kg y aproximadamente 1 año de edad), que habían sido alimentados con alimento balanceado elaborado por el mismo productor y compuesto por una mezcla de: afrechillo de trigo, afrechillo de arroz, maíz molido, sorgo, Núcleo vitamínico (fabricado por veterinarios locales), espeler de girasol, espeler de soja, fibra (paja de lino). Los animales pastan libremente durante el día y recibían el alimento suplementado cuando eran encerrados.
Luego del enriquecimiento se realizó la técnica de separación inmunomagnética(1) y se estrió el concentrado en Agar MacConkey sorbitol adicionado de Telurito de potasio y cefixima y en un medio cromogénico(2).
A las colonias presuntivas se las caracterizó bioquímica y serológicamente comenzando por pruebas de tamizaje consistentes en: agar hierro tres azúcares, medio sulfuro-indol-movilidad y serología(3) somática O157 en portaobjetos. Pruebas complementarias: Lisina decarboxilasa, utilización de citrato, b-glucuronidasa, fermentación de celobiosa, dulcitol y rammosa, prueba de hemólisis en agar sangre ovina suplementada con cloruro de calcio, y serología(4) flagelar H7 en tubo con previa estimulación de la movilidad.
Para el establecimiento de la acción citotóxica sobre células VERO y la detección de genes por técnicas moleculares se remitieron las cepas al Servicio Fisiopatogenia del INEI-ANLIS.
III. Resultados
Se obtuvieron 7 aislamientos a partir de agua. Cinco de las cepas resultaron toxigénicas, cuatro resultaron E. coli O157:H7 del biotipo C productoras de Stx1 y Stx2, y una sola productora de Stx2. Dos de las E. coli O157 no eran productoras de toxinas, una no móvil y la otra con antígeno flagelar no tipificable.
En las muestras de heces no se logró ningún aislamiento y en las de rumen, se obtuvo un E. coli O157: HNT avirulento. (Ver Cuadros 1 y 2).
Cuadro 1: Aislamientos de Escherichia coli O157

Cuadro 2: Caracterización fenotípica y genotípica de Escherichia coli O157

IV. Discusión
La caracterización de los aislamientos evidencia la mayor frecuencia de cepas E. coli O157:H7 del biotipo C (fermentación de ramnosa y dulcitol) y predominio de las cepas toxigénicas productoras de Stx1 y Stx2, con los demás factores de virulencia necesarios para causar la enfermedad humana.
Se comprueba una importante presencia de E. coli O157:H7 en agua. Si se considera que la mayoría de los hallazgos ocurrieron en momentos en que los cauces muestreados estaban con fuerte corriente debido al drenaje del agua acumulada en los campos luego de lluvias copiosas, se advierte la relación con el arrastre de heces bovinas desde los campos de cría de ganado.
Por el momento, parece imposible producir alimentos cárnicos crudos con seguridad de estar exentos de STEC. Un estudio realizado en las carnicerías de Gualeguaychú (Tanaro y col., 2000) demostró que el 3,9% de 297 muestras cárnicas estaban contaminadas. Pero a medida que se conozca más sobre la persistencia de éstos en el reservorio animal, será posible reducir al mínimo la contaminación de los alimentos.
V. Conclusión
Escherichia coli O157:H7, dotada de factores de virulencia, está presente en las aguas de uso recreacional muestreadas en el entorno de la ciudad de Gualeguaychú y merece continuarse investigando el papel del agua en la diseminación de cepas de STEC desde el reservorio animal al hombre, la permanencia en éste, y su potencial relación con los casos de SUH registrados localmente.
Agradecimientos
Al Dr. Pedro Antonio García del Servicio de Inspección Veterinaria, Frigorífico Rural Gualeguaychú.
A la Secretaría de Ciencia y Técnica de la UNER (Proyecto N°9023)
(1) Dynabeads® anti-E. coli O157 DYNAL, Dynal MPC®-M (Magnetic Particle Concentrator), Dynal® Sample Mixer
(2) O157:H7 ID - mediumÒ, bioMérieux
(3) E. coli O157 latex test, Oxoid
(4) División Antígenos y Sueros - ANLIS
Referencias bibliográficas
1. ACKERS M.L.; MAHON B.E.; LEAHY E.; GOODE B.; DAMROW T.; HAYES P.S. y col. (1998). An outbreak of Escherichia coli O157:H7 infections associated with leaf lettuce consumption, en: J. Infect Dis; 177, pág.1588-1593. [ Links ]
2. ACKMAN D.; MARKS S.; MACK P.; CALDWELL M.; ROOT T.; BIRKHEAD G. (1997). Swimming-associated haemorrhagic colitis due to Escherichia coli O157:H7 infection: evidence of prolonged contamination of a fresh water lake, en: Epidemiol Infect. Aug;119(1), pág.1-8. [ Links ]
3. BOPP D.J.; SAUDERS B.D.; WARING A.L.; ACKELSBERG J.; DUMAS N.; BRAUN- HOWLAND E.; DZIEWULSKI D.; WALLACE B.J.(IV.), HALSE T, MUSSER K.A.; SMITH P.F.; MORSE D.L.; LIMBERGER R.J. (2003). Detection, isolation, and molecular subtyping of Escherichia coli O157:H7 and Campylobacter jejuni associated with a large waterborne outbreak, en: J. Clin Microbiol. Jan;41(1), pág.174-180. [ Links ]
4. BREWSTER D.H.; BROWN M.I.; ROBERTSON D.; HOUGHTON G.L.; BIMSON J; SHARP J.C.M. (1994). An outbreak of Escherichia coli O157 associated with a children's paddling pool, en: Epidemio. Infect.;112, pág.441-447. [ Links ]
5. BRUCE M.G.; CURTIS M.B.; PAYNE M.M.; GAUTOM R.K.; THOMPSON E.C.; BENNETT A.L; KOBAYASHI J.M. (1999). Lake-associated outbreak of Escherichia coli O157:H7. En: Clark County, Washington, August 1999. Epidemiology Program Office, Centers for Disease Control and Prevention, Atlanta. [ Links ]
6. CALLAWAY T.R.; ANDERSON, R.C.; EDRINGTON, T.S.; GENOVESE, K.J.; . BISCHOFF, K.M.; POOLE, T.L.; JUNG, Y.S.; HARVEY, R. B.; D.J. NISBET, D.J. (2004). What are we doing about Escherichia coli O157:H7 in cattle?, en: J. Anim. Sci., 82(13_suppl),pág. E93 - 99. [ Links ]
7. FELDMAN K.A.; MOHLE-BOETANI J.C.; WARD J.; FURST K.; ABBOTT S.L.; FERRERO D.V.; OLSEN A.; WERNER S.B. (2002). A cluster of Escherichia coli O157: nonmotile infections associated with recreational exposure to lake water, en: Public Health Rep. Jul-Aug;117(4), pág.380-385. [ Links ]
8. FRIEDMAN M.S.; ROELS T.; KOEHLER J.E.; FELDMAN L.; BIBB W.F.; BLAKE P. (1999). Escherichia coli O157:H7 outbreak associated with an improperly chlorinated swimming pool,en: Clin. Infect. Dis. Aug;29(2), pág.298-303. [ Links ]
9. HANCOCK D.; BESSER T. ; LEJEUNE J. y col. (2001) The control of VTEC in the animal reservoir, en: Internatl J Food Microbiol, 66, pág.71-8. [ Links ]
10. HILBORN E.D.; MERMIN J.H.; MSHAR P.A.; HADLER J.L.; VOETSCH A.; WOJTKUNSKI C.; SWARTZ M.; MSHAR R.; LAMBERT-FAIR M.A.; FARRAR J.A.; GLYNN M.K.; SLUTSKER L. (1999). A multistate outbreak of Escherichia coli O157:H7 infections associated with consumption of mesclun lettuce, en:Arch. Intern.Med., 159, pág.1758-64. [ Links ]
11. KEENE W.E.; MCANULTY J.M.; FREDERICK C.; HOESLY, L.; WILLIAMS P.; HEDBERG K.; OXMAN G.L.; BARRETT T.J.; PFALLER M.A.; FLEMING D.W. (1994). A Swimming-Associated Outbreak of Hemorrhagic Colitis Caused by Escherichia coli O157:H7 and Shigella sonnei, en: The New England Journal of Medicine. Volume 331:579-584. Sept.1, Nº 9. [ Links ]
12. LEJEUNE J.; HANCOCK D.D.; BESSER T.E. (1997). "Escherichia coli O157 in cattle water troughs: A possible on-farm reservoir", en: Abstracts of the Fifth Annual Food Safety, Farm to Table Conference, Northwest Food Safety Consortium, Moscow, ID. [ Links ]
13. LEJEUNE J. ; BESSER T.E. ; HANCOCK D.D. (2001). Cattle Water Troughs as Reservoirs of Escherichia coli O157, en: Appl.Environ.Microbiol, 67, pág.3053-3057. [ Links ]
14. LEJEUNE J.; BESSER T.E.; MERRILL N.L.; RICE D.H., HANCOCK D.D. (2001) Livestock drinking water microbiology and the factors influencing the quality of drinking water offered to cattle, en: J. Dairy Sci., 84, pág.1856-1862. [ Links ]
15. MCCARTHY TA, IV. TO NL, HADLER JL, SALSBURY B, HOWARD RT, DINGMAN DW, BRINKMAN CD, IV. WF, CARTTER ML. "Hemolytic-Uremic Syndrome and Escherichia coli O121 at a Lake in Connecticut". 1999. [ Links ]
16. PARVEEN S., PORTIER K.M.; ROBINSON K.; EDMISTON L.; TAMPLIN M.L. (1999). Discriminant analysis of ribotype profiles of Escherichia coli for differentiating human and nonhuman sources of fecal pollution, en: App. Environ. Microbiol, 65, pág.3142-3147. [ Links ]
17. PAUNIO M, PEBODY R, KESKIMAKI M, KOKKI M, RUUTU P, OINONEN S, VUOTARI V, SIITONEN A, IV. E, LEINIKKI P. (1999). Swimming-associated outbreak of Escherichia coli O157:H7, en: Epidemiol. Infect. Feb.122(1), pág.1-5. [ Links ]
18. PUPO G.M.; RICHARDSON B.J. (1999). Biochemical genetics of a natural population of Escherichia coli: seasonal changes in alleles and haplotypes, en: Microbiology, 141, pág.1037-1044. [ Links ]
19. SAMADPOUR M.; STEWART J.; STEINGART K.; ADDY C.; LOUDERBACK J.; MCGINN M.; ELLINGTON J.; NEWMAN T. (2002). Laboratory investigation of an E. coli O157:H7 outbreak associated with swimming in Battle Ground Lake, Vancouver, Washington, en: J. Environ. Health. Jun; 64 (10), pág. 16-20, 26, 25. [ Links ]
20. SWERDLOW D.L.; WOODRUFF B.A.; BRADY R.C. y col. (1992) "A waterborne outbreak in Missouri of Escherichia coli O157:H7 associated with bloody diarrhea and death, en: Ann. Intern. Med.,117, pág.812-8. [ Links ]
21. SOUZA, V.; ROCHA M.; VALERA A.; EGUIARTE L.E. (1999). Genetic structure of natural populations of Escherichia coli in wild hosts on different continents, en: App. and Environm. Microbiol, 65, pág.3373-3385 [ Links ]
22. TANARO, J.D., LOUND, L.H., MILIWEBSKY, E., CHINEN, I., BASCHKIER, A., LEDRI, S.E., DOMÍNGUEZ, M., ROMERO, B., CHILLEMI, G., RIVAS, M. (2001). Detección de Escherichia coli O157: H7 en aguas abiertas en las proximidades de casco urbano. En: Resúmenes de las Primeras Jornadas de Microbiología del Noroeste, dic., San Miguel de Tucumán [ Links ]
23. TANARO, J. D., MILIWEBSKY, E., LOUND, L. H., BASCHKIER, A., LEDRI, S.E., LEARDINI, N., SCARPIN, M., AGUERRE, L., SCHIMPF, M., CASSE J. S., LARRIVEY, M., PÉREZ, W., RIVAS, M. (2000). Detección de Escherichia coli O157:H7 en carne bovina y derivados en carnicerías del Municipio de Gualeguaychú. En: Resúmenes, VI Congreso Latinoamericano de Microbiología de Alimentos, nov. 20-24, Buenos Aires, Poster C21. [ Links ]
24. VTEC 2000. (2000). Proceedings. 4th International Symposium and Workshop on "Shiga Toxin (Verocytotoxin)-Producing Escherichia coli Infections", Oct.29 - Nov.
2, Kyoto, [ Links ]
25. WACHTEL M.R.; WHITEHAND L.C.; MANDRELL R.E. (2002). Association of Escherichia coli O157:H7 with Preharvest Leaf Lettuce upon Exposure to Contaminated Irrigation Water, en: J. Food Prot., 65(1), pág.18-25. [ Links ]














