Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Ciencia, docencia y tecnología
versión On-line ISSN 1851-1716
Cienc. docencia tecnol. n.39 Concepción del Uruguay nov. 2009
CIENCIAS EXACTAS Y NATURALES - INVESTIGACIÓN
Fermentación alcohólica de jugo de naranja con S. cerevisiae
Alcoholic Fermentation of Orange Juice with S. Cerevisiae *
Ferreyra, María M.**; Schvab, María del C.**; Gerard, Liliana M.**; Zapata, Luz M.**; Davies, Cristina V.**; Hours Roque A.***
*) Articulo que expone resultados parciales del PID UNER Nº 8029, 2004-2006, Dirigido por R. A. Hours, Facultad de Ciencias de la Alimentación, Universidad Nacional de Entre Ríos (UNER), financiado por la SYCTFRH, UNER; recibido en junio 2009, admitido en octubre 2009.
**) Facultad de Ciencias de la Alimentación, UNER, Concordia (Argentina).
***) Fac.Cs.Alimentación, UNER, Concordia (Argentina); CINDEFI, Fac.Ciencias Exactas, Universidad Nacional de La Plata, La Plata (Argentina). hours@biotec.org.ar
Resumen: Se fermentaron jugos de naranja (natural, JN, o pasteurizado, JP) con S. cerevisiae a pHs (3,5 ó 4,0), temperaturas de fermentación (10 ó 20°C) y de maduración (10 ó 20°C). Se determinaron azúcares reductores directos (ARD) y totales (ART), N-amínico y recuento microscópico durante 4 etapas: inicial, fermentación, envasado y maduración (4 meses). Al final también se determinaron azúcares y etanol. Los ARD y ART decrecieron durante la fermentación en ambos mostos; el N-amínico también disminuyó, permaneciendo luego casi constante. El recuento de levaduras fue 2×106/mL (JN) y 7×106/mL (JP). En los envasados se detectó fructosa (80-100%) y glucosa (<20%) pero no sacarosa. El etanol alcanzó 60-80 g/L (JN) y 80-85 g/L (JP). Durante la maduración, los azúcares y el N-amínico aumentaron levemente, el etanol disminuyó en JN pero incrementó levemente en J P. El recuento de levaduras disminuyó. Durante la fermentación, las levaduras asimilaron casi la totalidad de azúcares y del N-amínico para crecer; luego durante la producción de etanol no hubo casi cambios hasta el envasado, produciéndose su lisis.
Palabras clave: Fermentación alcohólica; Jugo de naranja; Levaduras
Abstract: Orange juice was fermented with S. cerevisiae using natural (NJ) or pasteurized (PJ) juice, at 2 pHs (3.5 or 4.0) and at 2 temperatures of fermentation (10 or 20°C) and 2 of aging (10 or 20°C). Reducing sugars (RS) and total sugars (TS), amino-N and yeast counts were determined during 4 stages: initial, fermentation, bottling and aging (4 months). Sugars and ethanol were determined as well at the end. RS and TS decreased during the fermentation for both musts as well as amino-N, later remaining almost constant. Yeast counts were 2×106/mL (NJ) and 7×106/mL (PJ). Fructose (80-90%) and glucose (<20%) were detected after bottling but not sucrose. Ethanol reached 60-80 g/L (NJ) and 80-85 g/L (PJ). Sugars and amino-N increased slightly during aging, but ethanol decreased in NJ and increased slightly in PJ. Yeast counts decreased. Yeasts metabolized almost all sugars and amino-N during the fermentation for growing; later, during ethanol production there were almost no changes up to bottling, occurring their lysis.
Keywords: Alcoholic fermentation; Orange juice; Yeasts
I. Introducción
La citricultura de Entre Ríos se localiza sobre la margen occidental del río Uruguay, en los Departamentos Concordia, Federación y norte de Colón. Esta zona se continúa por el norte en el Departamento Monte Caseros, Provincia de Corrientes. Las principales variedades de naranja cultivadas en la zona de Concordia son: Navelina, Salustiana, Washington Navel, Valencia y New Hall (en pequeña escala para determinar su performance en el mercado). En promedio, alrededor de un veinte por ciento de la producción se destina a la industria, particularmente para la producción de jugo (Larocca, 2000).
Es conocida la importancia de la producción de cítricos en nuestra región. Sin embargo, razones económicas y de mercado indican la necesidad de estudiar nuevas alternativas para su industrialización, que permitan la oferta de productos novedosos e impliquen la creación de nuevos mercados. Una posibilidad es la transformación de jugo de naranja en una bebida alcohólica fermentada, el así llamado "vino de naranja".
La mayor parte del vino se elabora a partir de uvas y, a menos que se especifique otra fuente, la palabra vino se refiere al producto que resulta de la fermentación del jugo de uva (Brown et al., 1989). La manufactura de vinos de otras frutas distintas de la uva es muy popular en muchos países del norte europeo, donde las condiciones climáticas impiden el desarrollo de la vitivinicultura, especialmente en Polonia, Rusia y Alemania. En Gran Bretaña sólo una pequeña cantidad de vinos de otras frutas es producida a escala comercial, pero es muy común la elaboración casera artesanal.
La CEE define los vinos de frutas de la siguiente manera: "Vino de fruta: bebida alcohólica obtenida por la fermentación parcial o completa de jugos de frutas frescos, jugo concentrado o reconstituido; o macerado de pulpa con la adición de agua, azúcar o miel. Finalizada la fermentación se puede adicionar jugo fresco, concentrado o reconstituido". "Los vinos de frutas tendrán una concentración alcohólica comprendida entre 8 y 14 % (gramos/100 ml). Pueden ser sin carbonatar o carbonatados por la inyección de CO2 o por fermentación secundaria." (Jarvis, 1996).
Hay antecedentes bibliográficos que datan de muchos años, tales como los de Hendrickson y Kesterson (1965) citando un trabajo de von Loesecke de 1936, que describen diversos productos derivados de la manufactura de los cítricos, entre ellos vinos de pomelo y naranja. En este último caso, se expresa que, si bien el jugo de estos cítricos puede ser convertido en vino de sabor y aroma agradables, se requiere la adición de azúcar y condiciones de elaboración cuidadosamente controladas. Braverman (1952) menciona y describe los pasos para obtener los "vinos de agrios", a los cuales define como productos obtenidos por fermentación con levaduras vínicas, de zumos procedentes de frutas maduras de las variedades menos ácidas, adicionadas de azúcar, con el fin de obtener vinos de más cuerpo y menos ácidos. Braddock (1999) también nombra los vinos cítricos, pero no especifica el proceso para su elaboración. Los conocimientos científicos más actualizados que se tienen sobre la elaboración de vinos cítricos provienen de Turquía y otros países asiáticos (China, Japón, Corea). Entre ellos se pueden citar los estudios sobre la producción de vino de naranja realizados por Arici-Oe ef al. (1994) en China, el aislamiento e identificación de levaduras para la producción de vino de naranja de Young-Hwan ef al. (1997) en Corea, estudios básicos de las técnicas de producción de vino de naranja de You-Young y Guo-Qing (2000) en China, estudios de los componentes del flavor en vinos de naranjas variedad Kozan y el efecto del color de las botellas y las condiciones de almacenamiento sobre el amarronado de vino de naranja, ambos de Selli ef al. (2002-2003) en Turquía.
En la bibliografía específica de procesos biotecnológicos y elaboración de vinos (Vogt, 1971; Brown efa/., 1989; Ward, 1991; Varnam y Sutherland, 1997), si bien en general hay un apartado sobre vinos de distintas frutas, no hay información sobre variables de los procesos tecnológicos, cepas de levaduras usadas y características fisicoquímicas y sensoriales de los productos. Más recientemente, autores como Kolb (2002) han recopilado prácticas artesanales así como también algunos aspectos industriales sobre la producción de "bebidas similares al vino" a partir de frutas, pero concretamente sobre vino de naranja es poco lo que explica, haciendo hincapié sólo en el hecho de la diferencia en la obtención del jugo de esta fruta para su posterior fermentación. Destaca además que, al igual que el jugo de piña, el de naranja ofrece la gran dificultad de su contenido en ácido cítrico que puede ser metabolizado por diversas bacterias, las cuales obstaculizan la fermentación alcohólica. En Argentina no hay estudios previos reportados en cuanto a la elaboración de vinos cítricos ni de "vino de naranja".
La calidad de los vinos de frutas en general y de los elaborados a partir de frutas cítricas en particular dependerá de las características del jugo utilizado, de las levaduras usadas para su fermentación y del proceso de elaboración. Sin embargo, la escasa disponibilidad de datos sobre la tecnología de elaboración y las características fisicoquímicas y sensoriales particulares del vino de naranja imposibilitan cotejar los resultados obtenidos con productos similares. Por lo tanto, se hace necesario adaptar las prácticas enológicas y comparar los resultados del producto elaborado, principalmente con los vinos de uva, de los cuales existe profusa bibliografía, y con vinos de otras frutas tales como el kiwi y mango (Obisanya efa/. 1987).
El objetivo del presente trabajo fue caracterizar la fermentación alcohólica de jugo de naranja usando una S. cerevisiae aislada de la fruta, aplicando el siguiente diseño experimental:
a) Dos sustratos (jugo de naranja natural y jugo de naranja pasteurizado).
b) Dos pHs del mosto (3,5 y 4,0).
c) Dos temperaturas de fermentación (10 y 20ºC).
d) Dos temperaturas de maduración (10y 20ºC).
II. Materiales y métodos
11.1. Microorganismo usado para la vinificación de mostos de naranja
Saccharomyces cerevisiae, levadura autóctona aislada y seleccionada a partir de jugo fermentado de naranjas (Hours ef al. 2005).
11.2. Preparación de mostos de diferentes jugos de naranja
II.2.1. Mosto de jugo natural de naranja
La variedad de naranja seleccionada para la obtención del jugo fue la W. Navel, con un índice de madurez (ºBrix/% acidez) de 12. Se procesaron en planta piloto aproximadamente 600 kg de fruta (lavada pero no encerada) procedente de un empaque de la zona. Luego de la recepción, la fruta se volvió a lavar en mesa lavadora con circulación de agua a los efectos de disminuir la población microbiana de la superficie. El jugo se obtuvo con extractora FMC, modelo FS BR 1. Se filtró con malla metálica (tamiz ASTM # 18), se recolectó en un tanque pulmón y se ajustó a 20 ºBrix con sacarosa (azúcar comercial) para incrementar la graduación alcohólica del vino a obtener. Luego se añadieron 150 ppm de KHSO3 (INV, 1994, Resolución Nº 281/85) a los efectos de mantener la dosis de SO2 libre entre 30 y 40 ppm, valores necesarios para una buena conservación de los vinos blancos (Menegazzo Gómez, 1978). Esta dosis se recomienda para mostos con un pH @ 3,5.
El mosto así preparado se dividió en dos partes. A una mitad se le ajustó el pH a 4 con CaCO3. Se usó este compuesto a fin de facilitar la sedimentación de la borra una vez finalizada la fermentación (INV, 1994, Resolución Nº 281/85) y la otra mitad se mantuvo al pH del jugo natural (" 3,5). El mosto estandarizado fue distribuido en 8 damajuanas de vidrio color verde, de 30 l de capacidad: 4 damajuanas con mosto a pH: 4,0 y 4 damajuanas con mosto a pH: 3,5 (sin ajuste de pH).
II.2.2. Mosto de jugo de naranja pasteurizado
El jugo pasteurizado se preparó mediante tratamiento térmico (90ºC, 3,5 min) del jugo natural recién exprimido, en un intercambiador de calor en planta piloto. Posteriormente se añadió 100 ppm de KHSO3. Se eligió esta dosis por considerar que el tratamiento térmico minimiza los riesgos de alteración microbiana y, por lo tanto, la función principal que debería cumplir el SO2 sería la de antioxidante.
El mosto de jugo de naranja pasteurizado, una vez hechos los ajustes correspondientes según el protocolo seguido para el mosto de jugo natural, se distribuyó también en 8 damajuanas de vidrio color verde, de 30 l de capacidad: 4 damajuanas con mosto a pH: 4,0 y 4 damajuanas con mosto a pH: 3,5.
II.3. Fermentación alcohólica
En la Fig. 1 se muestra el diagrama de flujo de las distintas operaciones efectuadas para la preparación de los mostos empleados a partir de jugo de naranja natural y pasteurizado.
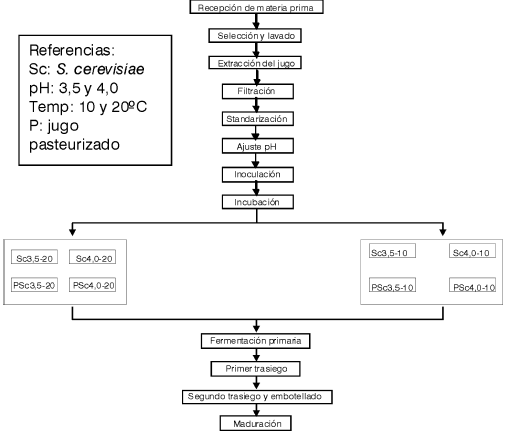
Figura 1: Diagrama de flujo para la obtención de "vino de naranja" a partir de jugo de naranja natural y pasteurizado (P)
II.3.1. Precultivo
Para la fermentación se utilizó el método de precultivo o "pie de cuba". El precultivo se preparó de acuerdo al siguiente procedimiento: se distribuyeron 2 l de cada jugo con un contenido de hasta 70 g/l de azúcares reductores directos, adicionados de 10 g/l de (NH4)2HPO4, a razón de 500 ml en 4 Erlenmeyers de 1l. Se trataron a vapor fluente durante 30 min. Se enfriaron hasta temperatura ambiente y se inocularon en condiciones asépticas: con 200 mg de S. cerevisiae (biomasa con 48% de humedad). Se incubaron a 25 ± 2ºC durante 24 h. Finalizada la incubación, se realizó un análisis microbiológico siguiendo la técnica de coloración vital con azul de metileno, recuento microscópico en cámara de Neubaüer y vitalidad del cultivo.
II.3.2. Fermentación primaria de los mostos
Las damajuanas de 30 l fueron inoculadas con el precultivo, a razón de 2 l por cada 100 l de mosto a fermentar. Durante las primeras 24 h se cubrieron con una gasa fina, a fin de facilitar un crecimiento aeróbico de las levaduras, que ocurre hasta el agotamiento del O2 disuelto en el mosto. Finalmente, se sellaron con cierre hidráulico y se incubaron a 10 y 20ºC, respectivamente.
11.3.3. Primer trasiego
A los 10 días de iniciado el proceso de fermentación, cuando ya no se observó desprendimiento de CO2, se efectuó el primer trasiego para separar las borras del sobrenadante. El trasiego se realizó por caída natural del vino a damajuanas limpias y previamente enjuagadas con una solución de KHSO3 al 1%. Estos recipientes se sellaron con cierre hidráulico y se continuó con la incubación a 10 y a 20ºC, respectivamente.
Las muestras para analizar se tomaron en condiciones asépticas, impidiendo la entrada de aire por aumento de la presión en el interior de las damajuanas para homogeneizar el contenido y lograr la representatividad de las mismas. Los ensayos realizados por triplicado que se detallan a continuación., también fueron realizados sobre los mostos de jugo natural y jugo pasteurizado:
- Azúcares reductores directos y totales. Método de Lane y Eynon (Ting y Rouseff, 1986).
- Nitrógeno amínico: Expresado en mg/100 mL jugo (Ting y Rouseff, 1986).
Además, se realizaron los siguientes análisis microbiológicos:
- Recuento directo de levaduras y diferenciación de otros microorganismos por observación microscópica en fresco.
- Prueba de viabilidad de células de levaduras con azul de metileno.
II.3.4. Segundo trasiego y envasado
Luego del primer trasiego, a los 45 días del inicio de la fermentación, se realizó un segundo trasiego, fraccionándose inmediatamente los productos de los 16 ensayos en botellas de vidrio color verde de 750 ml, que se cubrieron con tapones de corcho semimicroparticulado aglomerado. El producto así obtenido se llamó "vino joven". En esta etapa se realizó un nuevo muestreo para los ensayos anteriormente citados (por triplicado) incorporando además, los siguientes:
- Graduación alcohólica (Enzymatische BioAnalytik, Roche).
- Sacarosa, glucosa, fructosa (Enzymatische BioAnalytik, Roche).
II.3.5. Maduración
Después del envasado, se procedió al almacenamiento a dos temperaturas 10ºC y 20ºC. A esta etapa se la denominó "maduración o envejecimiento de los vinos de naranja", realizándose un nuevo muestreo para los ensayos previamente citados.
III. Resultados y discusión
III.1. Evolución de los azúcares, nitrógeno amínico y recuento de levaduras
Se analizó la evolución de los parámetros químicos desde la inoculación de ambas cepas de levaduras en los mostos de jugo natural y jugo pasteurizado de naranja hasta la obtención del vino joven para las condiciones en estudio.
III.1.1. Perfil de azúcares reductores y totales
En la Tabla 1 se muestran los correspondientes perfiles de azúcares reductores y totales. Al final del primer trasiego se alcanzó a consumir entre 89 y 98% de los azúcares totales, mientras que el consumo en la etapa siguiente varió entre 25 y 84% de los azúcares remanentes de la etapa anterior. Estos resultados son comparables con los reportados por Obisanya ef al. (1987).
Tabla 1: Evolución de azúcares totales en la fermentación alcohólica de jugo de naranja natural y pasteurizado (P), a pHs 3,5 y 4,0 y a 10 y 20°C

Se evidenciaron diferencias en el consumo de azúcares principalmente con respecto al tipo de mosto utilizado. Con mosto de jugo de naranja natural se consumieron entre 93 y 98 % de los azúcares totales, mientras que con mosto de jugo pasteurizado el remanente de azúcar en los vinos jóvenes fue de entre 7 y 11%.
Nurgel ef al. (2002) han demostrado que trabajando con jugo de uva pasteurizado e inoculando con una cepa autóctona de S. cerevisiae, el consumo inicial de azúcares totales fue alto, pero a los 10 días la concentración de azúcares finales no alcanzó los niveles del producto de la fermentación de mosto no pasteurizado, presentando un remanente de 1,4 g/ l contra 1 g/l del pasteurizado.
La evolución de los azúcares reductores en los vinos de naranja en iguales etapas de fermentación que las consideradas para los azúcares totales se muestra en las Fig. 2. La cinética de la utilización de los azúcares reductores es análoga a la de los azúcares totales. Los resultados evidencian el mayor consumo de azúcares reductores (78 a 94%) en el mosto preparado con jugo natural de naranja, que en el preparado con jugo pasteurizado (58 a 78%).
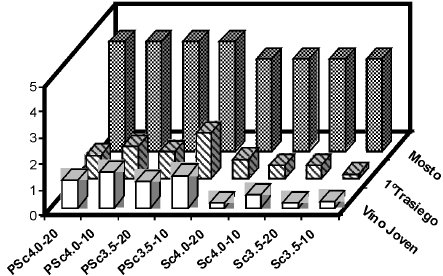
Figura 2: Variación de los azúcares reductores en los vinos de naranja elaborados a partir de jugo natural y jugo pasteurizado (P)
III.1.2. Contenido de glucosa, sacarosa y fructosa en los vinos jóvenes
En el vino joven el porcentaje de glucosa sin fermentar como se puede observar en la Fig. 3 es menor al 10 % o nulo, salvo en Sc3,5-20 y Sc4,0-20 que superó el 10% del total de glúcidos. Reynolds et al. (2001) en un estudio sobre vinificación en blanco con distintas cepas de S. cerevisiae, reportaron valores de fructosa comprendidos entre 3,3 y 5,8 g/l, al cabo de 48 días de fermentación según la cepa usada, mientras que en el mismo período la concentración de glucosa fue tan baja que en algunos casos no fue detectada.
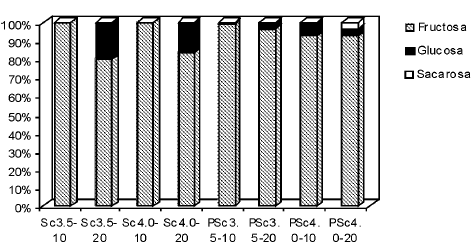
Figura 3: Contenido de azúcares en vinos jóvenes de naranja elaborados a partir de jugo natural y jugo pasteurizado (P)
La fructosa representa entre el 80 y 100 % del contenido en glúcidos en los productos recién envasados, mientras que la sacarosa prácticamente no pudo ser detectada en esta etapa.
Durante la maduración, los azúcares reductores directos y totales experimentaron un aumento independientemente del mosto utilizado, igual situación se verificó en la concentración de glucosa, mientras el contenido de fructosa prácticamente no sufrió variaciones relevantes durante esta etapa.
III.1.3. Nitrógeno
La evolución del nitrógeno amínico partiendo de los mostos de jugo natural y pasteurizado se puede observar en la Fig. 4. Las concentraciones de partida fueron de 118,2 mg/l y 144,2 mg/l, respectivamente, valores considerados por varios autores como la cantidad mínima necesaria de N asimilable para completar la fermentación de un mosto (Agenbach, 1977; Bely et al., 1990). La cantidad de nitrógeno residual en los vinos está determinada por el consumo de componentes nitrogenados durante la primera etapa de fermentación. En los vinos elaborados con S. cerevisiae se verificó un consumo de nitrógeno amínico comprendido entre el 57 y 71 para el mosto de jugo natural y de 68 a 74% en el mosto de jugo pasteurizado hasta el primer trasiego, y a partir de allí la tendencia fue a permanecer casi constante, probablemente debido a la presencia de etanol en el medio (D´Amore y Steward, 1987, Ferreras et al., 1989).
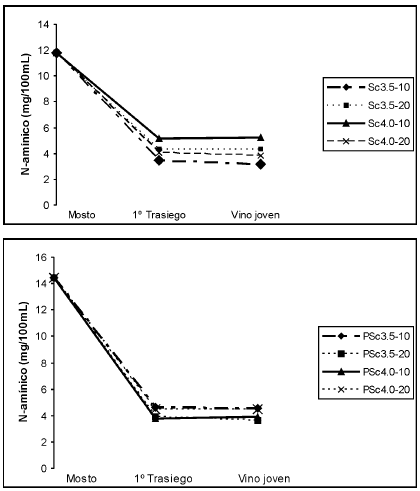
Figura 4: Evolución del N-amínico en vino de naranja elaborado a partir de: A, jugo natural y B, jugo pasteurizado
Esto se podría explicar teniendo en cuenta que durante la primera fase, donde aún hay O2, los microorganismos usan la única fuente de nitrógeno disponible para crecer aeróbicamente. Estudios realizados sobre cinética de fermentación y consumo de nitrógeno han demostrado que la fermentación se completa en un tiempo menor cuando la disponibilidad de N asimilable es de aproximadamente 300 mg/l (contenido normal del jugo de uva). Cantidades mayores de N asimilable retrasan la fermentación. Asimismo la producción de biomasa fue significativamente menor cuando se realizaron fermentaciones con niveles de N de alrededor de 60 mg/l. Esto reafirma que se produce represión por catabolito (Beltran et al., 2004).
El nitrógeno amínico alcanzó valores superiores a los registrados en los vinos jóvenes, hecho que también puede atribuirse al proceso de autólisis, que se da cuando la célula de levadura pierde viabilidad y por lo tanto los sistemas selectivos que controlan la proteólisis endógena dejan de actuar, de manera que todas la proteínas son susceptibles de degradación, iniciándose una proteólisis generalizada.
III.1.4. Graduación alcohólica
Partiendo de la concentración de azúcares totales, que incluye entre otros la glucosa y fructosa propia del jugo más la sacarosa agregada para obtener el mosto, se puede calcular el grado alcohólico probable del vino aplicando la fórmula:
Grado alcohólico probable = Azúcares – 1/17 (Aleixandre Benavent, 1999).
En la Fig. 5, el etanol teórico corresponde a la aplicación de esta fórmula para los mostos de jugo natural y pasteurizado. El etanol medido fue siempre menor que el valor teórico, lo cual demuestra que la transformación de azúcares en etanol no es total, pudiendo formarse además otras sustancias del metabolismo de las levaduras. Probablemente debido al agregado de sacarosa al inicio de la fermentación, las levaduras hayan desarrollado diferentes mecanismos para resistir esta situación adversa. Cuando modifican su metabolismo tienen fermentaciones anormales con bajo rendimiento en etanol y alta producción de ácido acético (Caridi et al., 1999).

Figura 5: Etanol teórico y experimental en vinos jóvenes de naranja elaborados a partir de jugo natural y jugo pasteurizado (P)
La producción de alcohol etílico fue mayor en los vinos elaborados con mosto de jugo de naranja pasteurizado (80-85 g/l) que en los elaborados con mosto de jugo natural (60-80 g/l), situación que también encontraron otros autores, pero para mostos de uva (Nagel et al., 2002).
Se pudo apreciar que los vinos elaborados a partir de mosto de jugo de naranja natural experimentaron una disminución de alcohol etílico durante el almacenamiento a ambas temperaturas (10ºC y 20ºC), mientras que los elaborados con mosto de jugo pasteurizado muestran un incremento en la concentración de este compuesto en iguales condiciones.
III.1.5 Control microbiológico
Con el fin de seguir la fermentación alcohólica y detectar otros microorganismos que podrían ser causantes de alteraciones microbianas (enfermedades), se efectuaron análisis microbiológicos para revelar la presencia de ellos antes de que se produjeran el deterioro del producto final.
Se observó, en el caso de los mostos tanto de jugo natural como de jugo pasteurizado, la presencia de levaduras vínicas en un franco estadio de reproducción, con un conteo en muestras de vinos de naranja de mosto natural (obtenidos por fermentación a pHs 3,5 como 4,0 y a 10 y 20ºC) con valores entre 5×105 y 2×106 células/ml, en tanto para los productos del mosto de jugo pasteurizado el número de células/ml no superó entre 4,5×105 y 7×106. Durante el período de fermentación de los vinos de mosto de jugo natural de naranja no se observó la presencia de bacterias, y las especies de levaduras non-Saccharomyces fueron muy escasas, lo que demuestra que la concentración de SO2 utilizada fue eficiente para el control de microorganismos indígenas.
IV. Conclusiones
Se concluyó que durante la fermentación tumultuosa las levaduras usaron casi la totalidad de los azúcares y del N-amínico para crecer; luego, coincidiendo con la producción de etanol, permanecieron en estado estacionario hasta el embotellado, produciéndose una lisis que pudo haber sido la causa del ligero incremento de los azúcares y del N-amínico. El apreciable consumo de los mismos y la producción de etanol durante la fermentación a 10ºC y pH 4,0 hacen suponer que éstos son el pH y temperatura óptimos de proceso para la levadura autóctona.
Referencias bibliográficas
1. AGENBACH, W.A. (1977). A study of must nitrogen content in relation to incomplete fermentations, yeast production and fermentation activity, en: Proceedings of South African Society of Enology and Viticulture. Stellenbosch: South African Society of Enology and Viticulture: 66-68. [ Links ]
2. ALEIXANDRE BENAVENT J.L. (1999). Vinos y Bebidas Alcohólicas. Valencia: Servicio de publicaciones, Universidad Politécnica de Valencia. [ Links ]
3. ASSOCIATION OF OFFICIAL ANALYTICAL CHEMISTS (AOAC) (1990). Official Methods of Analysis. 15th ed. Washington D.C.: AOAC. [ Links ]
4. ARICI-OE; YUECEL, U. (1994). A study on the production of orange wine, en: Gida 19, 2: 113-117. [ Links ]
5. BELTRAN, G.; NOVO, M.; ROZES, N.; MAS, A.; GUILLAMON, J.M. (2004). Nitrogen catabolite repression in Saccharomyces cerevisiae during wine fermentations, en: FEMS Yeast Res. 4: 625-632. [ Links ]
6. BELY, M.; SABLAYROLLES, J.M.; BARRE, P. (1990). Description of alcoholic fermentation kinetics: Its variability and significance, en: Am. J. Enol. Vitic. 41: 319-324. [ Links ]
7. BRADDOCK, R. (1999). Handbook of citrus by-products and processing technology. New York: John Wiley & Sons. [ Links ]
8. BRAVERMAN, J.B.S. (1952). Los Agrios y sus derivados. Composición y tecnología química. Madrid: Aguilar. [ Links ]
9. BROWN, C.M.; CAMPBELL, I.; PRIEST, F.G. (1989). Introducción a la Biotecnología. Zaragoza: Acribia. [ Links ]
10. CARIDI, A.; CRUCITTI, R; RAMONDINO, D. (1999). Winemaking of must at high osmotic strength by thermotolerant yeasts, en: Biotech. Lett. 21: 617-620. [ Links ]
11. D'AMORE, T.; STEWARD, G.G. (1987). Ethanol tolerance of yeast, en: Enzyme Microb. Technol. 9: 322-330. [ Links ]
12. FERRERAS, J.M.; IGLESIAS, R.; GIRBEES, T. (1989). Effect of the chronic ethanol action on the activity of general aminoacids permease from Saccharomyces cerevisiae var. ellipsoideus, en: Biochim. Biophys. Acta, 979: 357-377. [ Links ]
13. HENDRICKSON, R.; KESTERTON, J.W. (1965). By-products of Florida citrus. Composition, technology and utilization, en: Agrie. Exp. Sta. Bull. 698: 64-66. [ Links ]
14. HOURS, R.A.; FERREYRA, M.M.; SCHVAB, M.C.; GERARD, L.M.; ZAPATA, L.M.; DAVIES, C.V. (2005). Caracterización fisicoquímica y microbiológica de jugos de naranja destinados a vinificación, en: Ciencia, Docencia y Tecnología 31: 219-239. [ Links ]
15. INV. Instituto Nacional de Vitivinicultura. República Argentina (1994). Prácticas Enológicas Lícitas y Resoluciones Reglamentarias. En:http://www.inv.gov.ar/normativas.php?ind=1 [ Links ]
16. JARVIS, B. (1996). Cider, perry, fruit wine and other alcoholic fruit beverages. (pp. 97-103). En: D. Arthey and R Ashurt,. Fruit Processing. London: Academic Press. [ Links ]
17. KOLB, E. (2002). Vinos de frutas. Elaboración artesanal e industrial. Zaragoza: Acribia. [ Links ]
18. LAROCCA, L. (2000). Informe de la Provincia de Entre Ríos. Concordia: EEA INTA. [ Links ]
19. MENEGAZZO GÓMEZ, J.M. (1978). Acción estimulante del anhídrido sulfuroso. (pp. 49-66). En: Carrau J.L.; Callegari Basso, R.M. Novos Enfoques en Microbiología Enológica. Caxias do Sul: Universidade de Caixas do Sul. [ Links ]
20. NAGEL, C.W.; ANDERSON, J.D.; WELLER, K.M. (2002). A comparison of the fermentation patterns of six commercial wine yeasts, en: Vitis 27: 173-182. [ Links ]
21. NURGEL, C; ERTEN, H., CANBAS, A.; CABAROGLU, T; SELLI, S. (2002). Influence of Saccharomyces cerevisiae strain on fermentation flavor compounds of white wine made from c.v. Emir grown in central Anatolia, Turkey, en: J. Ind. Microb. Biotech. 29: 28-33. [ Links ]
22. OBISANYA, M.O.; AÍNA, J.O.; OGUNTIMEIN, G.B. (1987). Production of wine from mango (Magnifera indica L.) using Saccharomyces and Schizosaccharomyces species isolated from palm wine, en: J. Appl. Bact. 63: 191-196. [ Links ]
23. REYNOLDS, A.G.; EDWARDS, C.G.; CLIFF, M.A.; THORNGATE, III; MARR, J.C. (2001). Evaluation of Yeast strains during fermentation of Riesling and Chenin blanc musts, en: Am. J. Enol. Vitic. 52, 4: 336-344. [ Links ]
24. SELLI, S.; CANBAS, A.; ÜNAL, Ü. (2002). Effect of bottle color and storage conditions on browning of orange wine, en: Nahrung/Food 46, 2: 64-67. [ Links ]
25. SELLI, S.; CABAROGLU, T; CANBAS, A. (2003). Flavour components of orange wine made from a Tukish cv. Kozan, en: Int. J. Food Sci. Tech. 38, 5: 587-593. [ Links ]
26. TING, S.V.; ROUSEFF, R.L (1986). Citrus fruits and their produets: Analysis and Technology. New York: Dekker. [ Links ]
27. VARNAM, A.H.; SUTHERLAND, J.R (1997). Bebidas. Tecnología, Química y Microbiología. Zaragoza: Acribia. [ Links ]
28. VOGT, E. (1971). La Fabricación de Vinos. Zaragoza: Acribia. [ Links ]
29. WARD, O. (1991). Biotecnología de la fermentación. Principios, procesos y productos. Zaragoza: Acribia. [ Links ]
30. YOUNG-HWAN, K.; JAE-HA, K.; JEANG-SA, K.; CHANG-JIN, K. (1997). Screening and identification of the yeast for orange wine and their citric acid decomposition, en: Korean J. Food Sci. Technol. 29, 3: 588-594. [ Links ]
31. YUO-YOUNG, W.; GUO-QING, H. (2000). A primary study on the brewing technique of orange wine, en: J. Zhejiang Univ. (Agrie. Ufe Sci.) 26, 5: 513-515. [ Links ]














