Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Ciencia, docencia y tecnología
On-line version ISSN 1851-1716
Cienc. docencia tecnol. no.40 Concepción del Uruguay May 2010
CIENCIAS EXACTAS Y NATURALES - INVESTIGACIÓN
Manejo de mohos poscosecha de cítricos mediante antagonistas microbianos*
Management of Postharvest Citrus Fungi by Microbial Antagonists*
Visintin, Griselda**; Fálico, Ladys**; García, Blanca**
*) Artículo derivado del PID UNER Cód. 2090, Facultad de Ciencias Agropecuarias, Universidad Nacional de Entre Ríos -UNER-, 2004-2008, financiado por la SICTyFRH, UNER, con un Acuerdo de Cooperación Técnica con INTA Concordia;
Informe Final aprobado por Res. CS Nº 081/09; recibido en junio 2009, admitido en diciembre 2009.
**) Cátedra de Fitopatología, Facultad de Ciencias Agropecuarias, UNER (Oro Verde, Entre Ríos, Argentina).
E-mail: gvisintin@fca.uner.edu.ar
Resumen: La aparición de cepas resistentes a fungicidas y las actuales exigencias de alimentos inocuos impulsan el uso de medidas de control alternativas con sustancias no contaminantes y de rápida biodegradación, como el uso de antagonistas microbianos. Este trabajo muestra la obtención, selección y eficacia antagónica de microorganismos procedentes de la microflora cítrica frente a Penicillium sp. Técnicas in vitro permitieron seleccionarlos como antagonistas y aportaron conocimientos sobre la interacción bioquímica-fisiológica con el patógeno. En las heridas sobre las frutas, la interacción estuvo condicionada por el establecimiento y persistencia de la población del microorganismo, el efecto de las ceras utilizadas y las temperaturas de almacenamiento. Además, distintas técnicas experimentales de aplicación demostraron que la eficacia del tratamiento biológico depende de la forma de aplicación utilizada, la cual debería incorporarse a la tecnología de plantas de empaque sin modificaciones sustanciales y de las condiciones de almacenamiento según los destinos de comercialización.
Palabras clave: Agronomía; Biocontrol; Poscosecha; Citrus; Penicillium spp.
Abstract: The emergence of resistant strains to existing fungicides and safe food requirements drive the use of alternative control measures with non-polluting substances and rapid biodegradation, as the use of microbial antagonists. In this paper we show the collection, selection and determination of the effectiveness of microorganisms antagonistic microflora from citrus against Penicillium sp. In vitro techniques allow select as antagonists and provided knowledge about the biochemicalphysiological interaction with the pathogen. In wounds in fruits, the interaction was conditioned by the establishment and persistence of the microorganism population, the effect of the waxes used and temperature storage. In addition to the specific interaction between antagonist and pathogen, applying different experimental techniques show that the effectiveness of biological treatment depends on the application's form, which must be incorporated into packaging technology without major changes, notably with the storage conditions according to marketing destinations.
Key words: Agronomy; Biocontrol; Postharvest; Citrus, Penicillium spp.
I. Introducción
En general, las causas de las pérdidas poscosecha son de orden fisiológico
y patológico. Considerando estas últimas, y en frutos cítricos en
particular, son provocadas por Penicillium spp., Alternaria sp., Botrytis sp., Geotrichum sp. y Rhizopus sp. Dentro de ellos, las podredumbres
más comunes y destructivas son causadas por Penicillium spp., responsables
de más del 90% de las pérdidas [1, 6, 11, 12, 13].
Para prevenir las infecciones primarias de P. digitatum se requiere
un cuidadoso manipuleo de las frutas durante la cosecha y almacenamiento
y la aplicación de medidas de higiene en los galpones de empaque.
A pesar de la eficacia de las medidas preventivas de limpieza y
desinfección de equipos e instalaciones en la reducción de la población
patógena, es la propia fruta la que generalmente llega contaminada del
campo, por lo que se hace necesario realizar tratamientos dirigidos a
controlar de forma activa las podredumbres mediante productos químicos.
Estos suelen ser fungicidas a base de imidazoles o benzimidazoles,
cuya eficacia general depende del modo de aplicación. Pero la aparición
de cepas resistentes a ambos fungicidas se ha constituido en un
gran problema en zonas productoras de cítricos como Israel, California,
Florida, Sudáfrica, España, Argentina, etc., y los ha limitado enormemente
como medida de control [4,10].
Por otro lado, la preocupación pública sobre inocuidad de los alimentos
ha aumentado el interés por encontrar alternativas frente a los
fungicidas de síntesis en el control de enfermedades poscosecha. Consecuentemente,
han avanzado distintas y prometedoras vías que incluyen:
uso de compuestos antifúngicos naturales, tratamientos de calor
(baños con agua caliente y curado), modificaciones forzadas de temperatura
(altas o bajas), luz UV, la utilización de productos químicos de
baja toxicidad como el carbonato y bicarbonato sódico, el ozono, aceites
esenciales, fitoalexinas, péptidos antimicrobianos, inducción de
resistencia y la utilización de antagonistas microbianos, así como la
combinación de varios de ellos entre sí [2, 3, 5].
A nivel mundial, numerosos laboratorios aíslan permanentemente
microorganismos a partir del filoplano y frutoplano de manzanas, peras, citrus, etc. como potenciales biocontroladores de hongos que causan
podredumbres en poscosecha. Posteriormente, se evalúan por su
antagonismo potencial en distintos patosistemas. Así se han descubierto
y se formulan comercialmente numerosas bacterias y levaduras antagonistas
que son efectivas en poscosecha de una gran variedad de frutas.
Debido a que los patógenos necrotróficos invasores de heridas son
vulnerables al biocontrol, los antagonistas pueden ser aplicados directamente
en las frutas heridas, y una simple aplicación usando los sistemas
existentes (drencher, aspersión en línea de empaque, etc.) puede
reducir significativamente las podredumbres de frutos. Los productos
pioneros de biocontrol BioSave y Aspire, registrados por la Agencia de
Protección ambiental de Estados Unidos (EPA) en 1995 para el control
de podredumbres poscosecha de manzanas y citrus, respectivamente,
continúan disponibles comercialmente y, aunque posean limitaciones,éstas pueden ser solucionadas a través de la manipulación del ambiente,
el uso de mezclas de microorganismos benéficos o mejorando genética
y fisiológicamente el mecanismo de control, estudiando formulaciones e
integrando el biocontrol con otros métodos alternativos que, solos, no
proveen protección adecuada pero en combinación proveen efectos
aditivos o sinérgicos [8].
Investigar y experimentar nuevas técnicas que mejoren la calidad de
las frutas frescas para mercado interno o para industria, y especialmente
la destinada a exportaciones, es una prioridad fundamental para el
desarrollo citrícola de Entre Ríos y del NE Argentino, sobre todo si contribuyen
a mantener muy bajo el grado de contaminación ambiental.
Como hipótesis de trabajo, planteamos que el uso de la población
microbiana epífita sobre tejidos vegetales, y que tiene actividad antagónica
sobre Penicillium spp., es una herramienta que puede transformarse
en el principal componente para el manejo del patosistema.
Los objetivos del trabajo cuyos resultados se exponen en este artículo
fueron extraer y seleccionar la microflora presente sobre tejidos vegetales
por su bioactividad in vitro frente a Penicillium digitatum (Ensayo 1) y determinar
su eficacia antagónica in vivo frente a Penicillium sp. (Ensayo 2).
II. Ensayo 1: Extracción y selección de la microflora bioactiva
II.1. Materiales y métodos
II.1.1. Extracción de la microflora
La obtención de los microorganismos se realizó principalmente desde
la microflora epífita de plantas cítricas sin controles químicos, o lotes
con un manejo integral de enfermedades y buenas condiciones sanitarias.
Las muestras, compuestas principalmente por frutas, provinieron
de distintas regiones geográficas (Oro Verde, Paraná y Diamante en la
Provincia de Entre Ríos, y de la Provincia de Santiago del Estero) y
específicamente de la región citrícola entrerriana. La extracción se realizó mediante el lavado por agitación del material vegetal en solución tampon fosfato peptona pH 7, a 1200 rpm durante 45 min.
Mediante diluciones decimales, alícuotas de las suspensiones obtenidas
se sembraron en Agar papa glucosado (APG 2%) durante 7 días
a 24ºC. Las colonias bacterianas y levaduriformes obtenidas se repicaron
en tubos pico de flauta, prestando especial atención a aquellas que
mostraban efectos inhibitorios del crecimiento de colonias fúngicas.
Con igual metodología y a partir de trozos de tallos de girasol o muestras
de semillas de soja y trigo de muy buena sanidad se obtuvieron
colonias de levaduras y bacterias antagónicas de distintos patógenos.
II.1.2. Preselección in vitro de los microorganismos
Con el objetivo de preseleccionar los 10 mejores microorganismos por
su actividad bioctiva frente a Penicillium sp., se realizó un bioensayo
con la técnica de cultivos múltiples, enfrentándolos a dos cepas de Penicillium, una de ellas resistente a fungicidas [7, 9]. En cajas de Petri
conteniendo APG 2%, Penicillium spp. se enfrentó simultáneamente a
4 microorganismos diferentes. Realizando 3 repeticiones de cada microorganismo
frente a cada cepa de Penicillium, las cajas se incubaron
en estufa de cultivo a 25ºC durante 7 días.
Microorganismos: Participaron 37 aislamientos bacterianos y 7 levaduras.
Dentro de las bacterias se incluyó un formulado comercial de Pseudomonas syringae como testigo de actividad antagónica eficaz.
Los parámetros para preseleccionarlos fueron: la capacidad de inhibición del crecimiento de Penicillium spp. (distancia en cm. entre el borde
de la colonia de Penicillium en crecimiento y la línea de siembra del
biocontrolador) y la estabilidad en el comportamiento bioactivo. Con
las distancias obtenidas se realizó un análisis de variancia con Programa
InfoStat y comparación de medias con Tukey a= 0,05.
II.1.3. Selección "in vitro" de los microorganismos
La técnica de convivencia en medio nutritivo fue utilizada con el objetivo
de seleccionar 2 microorganismos (1 bacteria y 1 levadura) por su
bioactividad frente a Penicillium sp. resistente y sensible a fungicidas.
Con los microorganismos bioactivos se prepararon suspensiones al
50% de transmitancia. Alícuotas de 0,15 ml de suspensión se agregaron
a tubos de ensayo conteniendo 15 ml de APG 2% en estado líquido,
a 40ºC. Esta mezcla fue dispensada en cajas de Petri para que solidifique.
Con los cultivos de Penicillium (PD 55 (resistente) y J10 (sensible
a fungicidas)) se prepararon suspensiones a una concentración de
2x106 con./ml. Alícuotas de 0,05 ml de esta suspensión se estriaron
sobre las cajas de petri conteniendo el sustrato APG 2%+ biocontrolador.
Al ensayo se incorporó Pseudomonas syringae, como biocontrolador comercial
de referencia, y en el tratamiento testigo, Penicillium creció solo
sobre APG 2%. Se realizaron dos repeticiones por cada combinación microorganismo- Penicillium sp. Las cajas se incubaron en estufa de cultivo
a 25ºC durante 7 días, con un diseño completamente aleatorizado. Para
evaluar se utilizaron dos parámetros [9, 16].
a- La capacidad de germinación de Penicillium spp.:
A las 24 horas de incubación se determinó el Porcentaje de conidios
germinados y el Grado de alteración morfológica del micelio de Penicillium sp. recién germinado.
El porcentaje de conidios germinados se definió tomando porciones
de sustrato sembrado y, previa coloración con azul de anilina, se
hicieron observaciones bajo microscopio con un aumento de 20x.
Se obtuvo el promedio de dos campos ópticos para cada combinación
microorganismo-Penicillium. En los mismos campos, la estimación
del grado de alteración miceliar se realizó según una escala de 5 grados (0= sin alteración, X = alteración leve, XX = alteración moderada,
XXX = alteración grave y XXXX = alteración muy grave)
b- Mantenimiento de esta capacidad a 7 días de incubación:
A los siete días se evaluó el Grado de cobertura miceliar/caja lograda
por Penicillium sp. en comparación con las cajas testigo. Los resultados
se expresaron en grados según la siguiente escala:
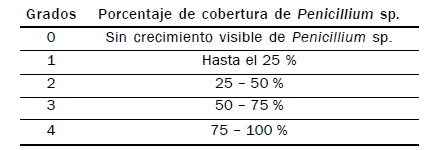
II.2. Resultados y discusión
II.2.1. Extracción de la microflora
La microflora cítrica obtenida estuvo compuesta por 20 aislamientos
bacterianos y 18 levaduras.
Desde el frutoplano de toronja (Citrus grandis (L.) Osbeck) se obtuvieron
mayormente levaduras (71%). Considerando la fruta procedente de Concordia,
de pomelo (Citrus paradisi Macfadyen) se obtuvo 50% de bacterias
y 50% de levaduras, mientras que en naranjas (Citrus sinensis (L.) Osbeck)
y mandarinas (Citrus reticulata Blanco) predominaron las bacterias. Desde
frutos y hojas de limón (Citrus limon (L.) Burm.) se aislaron bacterias.
A partir de los hospederos trigo, soja y girasol se obtuvieron en total
11 aislamientos, todos bacterianos (Tabla 1).
Tabla 1. Número y tipo de microorganismos obtenidos según la especie, órgano y
procedencia:

II.2.2. Preselección in vitro de los microorganismos
La técnica de cultivos múltiples permitió preseleccionar microorganismos bioactivos frente al patógeno. Los resultados obtenidos se presentan en la Tablas 2 y 3, diferenciando bacterias de levaduras.
Tabla 2. Siete aislamientos bacterianos preseleccionados según cultivos múltiples in vitro. Comparación con efectos del formulado comercial.

Tabla 3. Evaluación de la bioactividad de 3 levaduras locales frente a Penicillium spp.
en cultivos múltiples in vitro.

Preselección de bacterias:
Se registraron las distancias promedio entre el borde de la colonia de Penicillium y la línea de siembra de cada microorganismo. Según las mayores
distancias logradas, se preseleccionaron 7 aislamientos (Tabla 2) que no marcaron entre ellos diferencias estadísticas significativas en su
bioactividad frente a ambas cepas patógenas. Las siete bacterias
preseleccionadas registraron distancias superiores a la comercial - Pseudomonas syringae (Tabla 2). En promedio, se registraron distancias
levemente mayores frente a la cepa local de Penicillium PDFCA,
que frente a la cepa resistente a fungicidas.
Preselección de Levaduras
Para completar los 10 aislamientos previstos de la preselección, se escogieron
tres levaduras que registraron las mayores distancias entre patógeno
y microorganismo: dos procedentes de citrus (CNCo 8 y CNCo 20) y una
de semilla de trigo TSPa 4 (Tabla 3). La levadura aislada de naranja (CNCo8)
y la aislada de trigo (TSPa4), marcaron distancias de crecimiento superiores
a 1 cm entre los cultivos enfrentados, interactuando con ambos aislamientos
de Penicillium. Para completar los tres aislamientos, se preseleccionó CNCo20 con efectos levemente mayores sobre la cepa resistente
a fungicidas. La capacidad antagónica in vitro de las bacterias fue mayor
que las provocadas por las levaduras, y en comparación con biocontroladores comerciales como Pseudomonas syringae, las bacterias locales
mostraron mayores efectos de antibiosis. El hecho ser nativas aseguraría
la adaptación a nuestra región productiva.
II.2.3. Selección "in vitro" de los microorganismos
II.2.3.1. Selección de Bacterias bioactivas por convivencia con Penicillium spp.
Efectos sobre la germinación de Penicillium spp.
Los aislamientos bacterianos afectaron la germinación de los conidios
de Penicillium spp. provocando graves alteraciones a las 24 horas de convivencia. Estos efectos fueron mayores sobre la cepa sensible a
fungicidas que sobre la resistente, lo que podría considerarse beneficioso
porque su empleo provocaría menor presión de selección y por lo
tanto menor posibilidad de aparición de cepas resistentes (Tabla 4).
Tabla 4. Comportamiento in vitro de Penicillium spp. en convivencia con 7 aislamientos
bacterianos locales y un formulado comercial.

GTPa3 y CNCo32 afectaron más la germinación de la cepa resistente,
mientras que CNCo 9 y TSPa 9 inhibieron totalmente la germinación de
conidios de la cepa sensible. Se apreció a estos cuatro aislamientos
como los de mayor bioactividad in vitro frente a Penicillium spp.
Frente a la cepa resistente, Pseudomonas syringae afectó más el PG
(35%) que cualquiera de los aislamientos locales, y solo permitió la
germinación del 56% de los conidios de la cepa sensible.
Efectos sobre la cobertura miceliar por caja
En los tratamientos en que se registró 100% de germinación, si bien los
conidios estaban germinados, presentaron tubos germinativos muy cortos
y con paredes muy engrosadas en comparación con el testigo. Estas
alteraciones tan severas (XXXX de la escala propuesta) permanecieron
como efecto estable, hasta los 7 días, impidiendo visualizar crecimiento
de micelio en las cajas (Grado cero de la escala de cobertura propuesta).
De este modo según la evaluación a 7 días, no existieron diferencias entre los aislamientos bacterianos, mientras que la cobertura
miceliar en las cajas del testigo alcanzó a 75-100% (Grado 4).
II.2.3.2. Selección de Levaduras por convivencia en medio nutritivo con Penicillium spp.
Efectos sobre la germinación de Penicillium spp. y la cobertura miceliar/caja.
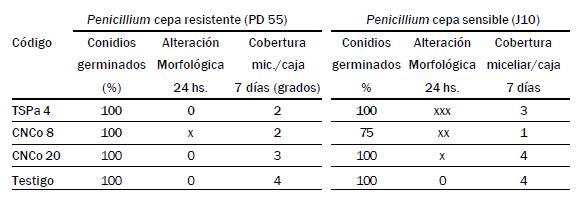
La cepa CNCo8 logró reducir un 25% la germinación de conidios de la
cepa sensible a funguicidas y afectó moderadamente la morfología del
micelio de Penicillium spp., alcanzando J10 solo el 25% de cobertura
miceliar después de 7 días de incubación (Tabla 5). TSPa4 permitió solo
el 50% de cobertura miceliar de PD55, y el 75% de J10, pero produciéndole
alteraciones graves sobre el micelio. Estas dos cepas resultan promisorias
por su bioactividad in vitro frente a Penicillium spp. teniendo
CNCo8 la ventaja de provenir de la microflora cítrica. Considerando los
aislamientos bacterianos, los cuatro de mayor bioactividad in vitro frente
a Penicillium spp. fueron GTPa3, CNCo32, CNCo 9 y TSPa 9.
Tabla 5. Comportamiento de Penicillium spp en convivencia con 3 aislamientos de
levaduras locales
Para el inicio de las experiencias de eficacia antagónica en frutas, se
consideraron en primer lugar los aislamientos provenientes de frutas
cítricas. De los dos microorganismos bacterianos correspondientes a
este origen (CNCo9 y CNCo32), el primero presentó la ventaja de poseer
una mayor capacidad de crecimiento in vitro, con gran producción de
inóculo respecto a CNCo32 y facilidad de manipuleo para la preparación
de suspensiones adecuadas en calidad y cantidad, destinadas al tratamiento
de frutas en laboratorio y en línea de empaque experimental.
Según las pruebas de selección de microorganismos in vitro, se dispuso
entonces continuar los ensayos sobre frutas, con el aislamiento
bacteriano CNCo9 y la levadura CNCo8, sin descartar el resto de los
microorganismos.
III. Ensayo 2: Eficacia antagónica de los microorganismos
III.1. Materiales y Métodos
La determinación de la eficacia antagónica de los microorganismos seleccionados se realizó sobre frutas cítricas a través de distintos bioensayos que permitieron evaluar: la eficacia en la reducción de la incidencia de podredumbres en condiciones de laboratorio y con agregado de aditivos, el establecimiento y persistencia de CNCo9 en frutas inoculadas y enceradas, la aplicación de CNCo9 por aspersión en línea experimental y la aplicación por inmersión e inoculación forzada bajo condiciones de comercialización interna y de exportación. Expondremos cada uno de ellos.
III.1.1. La eficacia en la reducción de la incidencia de podredumbres
En los ensayos se utilizaron dos microorganismos (CNCo9 y CNCo8)
procedentes de la microflora de Citrus sp., dos aditivos carbonados (uno
importado y uno nacional) y Penicillium resistente y sensible a fungicidas.
Distintas especies cítricas fueron inoculadas por herida, bajo condiciones
de incubación favorables a la actividad del patógeno [14, 15].
Fundamentos del uso de aditivos: En general, los microorganismos antagónicos
no controlan infecciones ya establecidas y son más efectivos
cuando son aplicados antes del inicio de las infecciones por Penicillium (efecto protector).
La falta de una actividad curativa ha sido identificada como la mayor
limitante de los biocontroladores para enfermedades poscosecha. Para lograr un nivel de control satisfactorio es necesario lograr la erradicación
(actividad curativa) de infecciones incipientes ocurridas a partir de
la cosecha y disminuir la variabilidad de las eficacias de los antagonistas.
La actividad biocontroladora de los antagonistas puede ser mejorada
con el agregado de aditivos orgánicos e inorgánicos. Entre ellos se han
reportado hidratos de carbono como la 2 deoxi-d-glucosa en el control
de podredumbres de manzanas y peras. Este azúcar análogo interfiere
con el crecimiento de la mayoría de los patógenos poscosecha y controla
podredumbres aportando el efecto curativo.
Aditivos: Se utilizaron dos aditivos, que fueron agregados a las suspensiones
de microorganismos, a una concentración de 0,2% p/v.:
a- 2 deoxi-d-glucosa.
b- Formulado comercial: Aditivo Biagro S2, a base de carbohidratos
como fuente de nutrientes.
Inóculo patógeno: Conidios de Penicillium digitatum proveniente de
frutas esporuladas del mercado local, se usaron para preparar una suspensión
de 1 x 106 con./ml.
Especie Cítrica: Se realizaron ensayos sobre tres especies cítricas
(Naranjas, limones y mandarinas) bajo condiciones ambientales de
incubación no controladas (18-25ºC y cámara húmeda).
Tratamientos: Los 7 tratamientos realizados distribuidos según un
DCA, comprendieron 10 frutas con tres repeticiones. Las frutas testigo
fueron inoculadas con 1 x 106 conidios/ml del patógeno (Tabla 6).
Tabla 6. Incorporación de aditivos. Tratamientos y concentraciones de microorganismos
aplicados sobre frutas cítricas

Protocolo:
- Lavar y desinfectar las frutas con alcohol 70º, y sobre la zona ecuatorial
identificar el área a tratar y producir una herida de 1 mm de ancho
por 2 mm de profundidad. Distribuir 10 frutas por bandeja plástica.
- Aplicar 20 μl de suspensión del microorganismo bioactivo a evaluar.
- Una vez reabsorbida la gota (2 hs), inocular 10 μl de suspensión de Penicillium.
- Una vez reabsorbida la suspensión patógena embolsar las bandejas
manteniéndolas como cámaras húmedas con algodones humedecidos.
- Incubar en ambiente de laboratorio durante 8 días.
- Realizar el recuento de frutas con síntomas de podredumbre húmeda
a los 2, 4, 6 y 8 días desde el tratamiento.
Las evaluaciones se realizaron obteniendo la incidencia de frutas
sintomáticas. Los porcentajes finales fueron transformados a arcosen%
para un posterior análisis de Variancia con el Programa Infostat.
La comparación de medias se realizó con LSD a= 0.05. Con las
incidencias acumuladas se realizaron curvas de progreso de la enfermedad,
las que se exploraron gráficamente. Con el ajuste a modelos
matemáticos se obtuvieron las tasas de infección para cada
patosistema.
III.1.2. El establecimiento y persistencia de CNCo9 en frutas inoculadas y enceradas
El estudio de la capacidad de establecimiento y persistencia de CNCo9
en las heridas de frutos encerados se realizó rescatando su población
después de la aplicación por inmersión en una suspensión de la mezcla
CNCo9- P. digitatum [18, 19].
Materiales:
Frutas: Naranjas Valencia Late, cosechadas un día antes del procesado
y provistas por la EEA INTA Concordia.
Microorganismo bioactivo: Suspensión de CNCo9 en solución tampón
fosfato peptona pH7, a una concentración de 1,3 x 108 ufc/ml.
Patógeno: Cepa de Penicillium digitatum resistente a Tiabendazol
(TBZ) en suspensión de 3 x 106 prop/ml, obtenida en INTA Concordia.
Tratamiento: Suspensión de CNCo9 (1,3 x 108 ufc/ml.) + P. digitatum
(3x106 prop/ml) + 0,2% Biagro S2 y posterior encerado con LC15. Se
trataron en total 20 naranjas conteniendo 10 heridas cada una.
Protocolo:
- Lavar y desinfectar las frutas con alcohol 70º.
- En cada fruta identificar 10 círculos en la zona ecuatorial y 4 círculos
en frutas del tratamiento 3. En el centro de cada círculo producir
una herida de 1 x 2 mm.
- Aplicar el tratamiento por inmersión de las frutas en la suspensión,
durante 1min. Realizar tres repeticiones.
- Dejar secar y encerar a través de guantes de latex encerados con
cera LC 15. Dejar secar.
- Colocar las frutas en bolsas individuales de cierre hermético y en
cámara húmeda.
- Almacenar durante 7 días en condiciones de laboratorio. Temp.
Ambiente: 21-23 ºC
- A partir de las frutas tratadas, rescatar 3 heridas al azar por repetición
con un sacabocado de 5 mm de diámetro, para formar una
muestra compuesta, en 4 tiempos diferentes: día cero, uno, dos,
tres y siete.
- Lavar los 3 trozos obtenidos en 10 ml de solución tampón fosfato
peptona ph 7 durante 1 hora a 1400 rpm.
- Sembrar 0,1 ml de la suspensión original y de una dilución decimal
en cajas con APG 2% Realizar 2 repeticiones.
- Incubar a 25ºC y contar a los 3-4 días el número de colonias
bacterianas y del patógeno.
Evaluación de Resultados: recuento de colonias de CNCo9 y P. digitatum en los 4 tiempos, expresados como ufc/herida o propágulos/herida.
III.1.3. La aplicación de CNCo9 por aspersión en línea experimental:
Considerando la aplicación experimental de CNCo9 en línea de empaque,
se realizó en primer término la aspersión de la suspensión bacteriana
(108 ufc/ml), incorporándola al depósito de funguicidas de la línea. De
esta forma se respetó el proceso normal de empaque de frutas, reemplazando
el control químico por el biológico. Se trató un total de 2400 naranjas Valencia Late en madurez comercial aportadas por INTA Concordia,
que solo poseían la infección natural del campo y el encerado se realizó con una cera comercial de concordia y otra utilizada en el NO argentino.
Tratamientos: Se realizaron 4 tratamientos que comprendieron 10
repeticiones de 60 frutas cada uno:
T1: Testigo con infección natural de Penicillium (600 frutas lavadas y
enceradas con Cera comercial de Concordia.)
T2: Testigo con infección natural de Penicillium (600 frutas lavadas y
enceradas con cera LC 15)
T3: Tratamiento por aspersión con CNCo9 y encerado con LC15 (600
frutas)
T4: Tratamiento por aspersión con CNCo9 y encerado con cera comercial
de Concordia (600 frutas)
Las condiciones de incubación de las frutas en cámara simularon la
comercialización en mercado interno (20ºC y 80% de humedad forzada).
En las frutas tratadas se evaluaron las dinámicas poblacionales de
la biocontroladora y del patógeno y las incidencias de podredumbres.
Las dinámicas poblacionales de los microorganismos sobrevivientes
(antagonista y patógeno) se obtuvieron lavando los frutos en solución
tampón fosfato, y sembrando diluciones decimales de la suspensión en
APG2%. El número de colonias obtenidas se expresó en función de la
superficie de cada fruta [20].
III.1.4. La aplicación por inmersión e inoculación forzada bajo condiciones de comercialización interna y de exportación
Considerando una modificación factible en el proceso de empaque,
similar al volcado de frutas en piletas conteniendo 200 ppm de ClNa
para desinfección de Xanthomonas axonopodis pv. citri, se realizaron
aplicaciones experimentales por inmersión en la suspensión bacteriana.
La bacteria CNCo9 se aplicó mediante inmersión de frutas en una
suspensión mezcla de biocontroladora y Penicillium digitatum bajo inoculación
forzada. Después de la inmersión, las frutas siguieron el proceso
normal de encerado y secado en línea de empaque experimental. La cera
utilizada se comercializa en la zona citrícola de Concordia. Las condiciones
de incubación simularon la inmediata comercialización en mercado interno (20ºC y 80% de humedad forzada) y la comercialización de frutas
para exportación (26 días a 5ºC y 8 días a 20ºC), lo que incluye simular
las bajas temperaturas de transporte en barco y posteriormente temperaturas
ambiente de comercialización en mercado interno [21].
Frutas: En cada uno de los ensayos, 200 naranjas Valencia Late provistas
por INTA Concordia fueron lavadas y secadas en línea experimental.
En la zona ecuatorial de cada una se identificaron cuatro círculos
donde se realizaron heridas de 1x2mm.
Tratamientos:
1- Inoculación por inmersión en una suspensión mezcla de CNCo9
(107 ufc/ml) más Penicillium digitatum (2x105 prop./ml) y posterior
encerado. (Total: 400 heridas).
2- Testigo: Inoculación por inmersión en suspensión de Penicillium
digitatum (3x105 prop./ml) y encerado posterior. (Total 400 heridas).
Evaluaciones: En uno solo de los ensayos (Incubación a 20ºC y 80% de
HR) se cuantificó la población de CNCo9 en las heridas, al momento de la
aplicación del biocontrolador y a los 7 días. Para esto, muestras compuestas
de 4 heridas al azar se agitaron en 10 ml de solución tampón fosfato peptona.
Alícuotas de la suspensión fueron sembradas en cajas conteniendo APG
2%. El recuento de colonias se realizó a los 4 días de incubación a 25ºC.
Considerando cada herida como una repetición se evaluó la intensidad
de la enfermedad obteniendo la Incidencia (%) de heridas sintomáticas,
con la que se graficaron las curvas de progreso de la enfermedad.
Bajo las condiciones de comercialización interna, el recuento de heridas
sintomáticas (hidrosis y podredumbre húmeda con esporulación) se
realizó a los 2, 3, 4 y 7 días, con el recuento final a los 11 días sobre frutas
deshidratadas (no comercializables) por las condiciones de incubación a
20ºC. Bajo las condiciones de comercialización de frutas para exportación,
este recuento fue a los 7, 13, 21, 26 y 34 días.
Se graficaron las curvas de progreso temporal de la enfermedad (CPE)
y con el Programa Epimoden se seleccionó el modelo matemático de
mejor ajuste y se obtuvo la tasa de infección (r). Las áreas bajo la curva de
progreso de la enfermedad (ABCPE) se calcularon con el Programa AUDPC
(GWBASIC) y la eficacia del tratamiento biológico en la reducción de intensidad
respecto al testigo se obtuvo mediante la fórmula: Eficacia= nº heridas sintomáticas en testigo - nº heridas sintomáticas en trat. biológico/nº heridas sintomáticas en trat. testigo* 100 [17].
III.2 Resultados y Discusión
III.2.1 Eficacia de control por inoculación de heridas, incorporando aditivos a las suspensiones de microorganismos bioactivos
En las tres especies cítricas inoculadas por herida (Naranjas, limones y mandarinas) y bajo condiciones de incubación favorables a la actividad del patógeno, la bacteria CNCo9 redujo significativamente las podredumbres respecto al testigo, sola o con el agregado de aditivos (Tablas 7,8 y 9). El aditivo importado optimizó el control de las podredumbres y la reducción de las tasas de incremento, pero su costo actual hace inviable su uso.
Tabla 7. Efecto de aditivos sobre la capacidad bioactiva de microorganismos
frente a Penicillium digitatum en mandarina Ellendale. Incidencias acumuladas
(%), modelos matemáticos y tasas de infección.

Tabla 8. Efecto de aditivos sobre la capacidad bioactiva de microorganismos en
Citrus limón. Incidencias acumuladas (%), modelos matemáticos de ajuste y tasas
de infección (r)
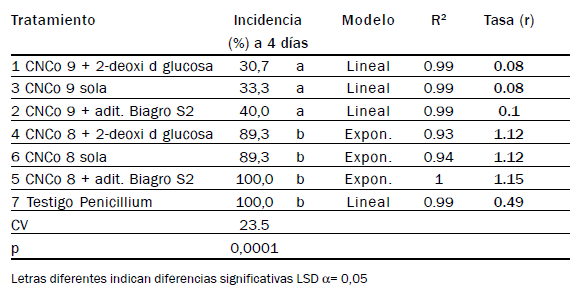
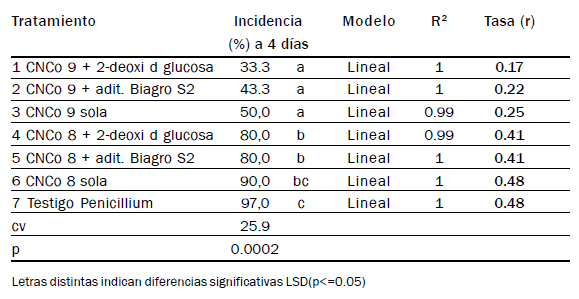
Tabla 9. Incidencia (%) de naranjas sintomáticas a los 4 días desde la inoculación.
Patosistema Citrus sinensis-microorganismo bioactivo- Penicillium sp. Modelos
de ajuste y tasas de infección r.
Sola o con aditivos, la levadura CNCo8 fue incapaz de reducir las incidencias y tasas de infección a niveles comercialmente aceptables. Los aditivos orgánicos pueden estimular la colonización de esta levadura en heridas pero en la interacción patógeno-antagonista también parecen favorecer la patogenicidad de Penicillium sp. La capacidad bioctiva in vitro de la levadura no se correlacionó con la ejercida en frutas heridas.
III.2.1.1. Efecto de aditivos sobre Patosistema Mandarina Ellendale -microorganismo bioactivo- Penicillium sp.
Bajo las condiciones en las que progresó el ensayo, favorables al proceso
infeccioso de Penicillium sp., y aplicando una agresiva técnica de
inoculación, a los cuatro días se registró el 97% de frutas podridas en el
tratamiento testigo. En este momento se consideró definido el progreso
de la enfermedad para todos los tratamientos en referencia al testigo.
Las incidencias acumuladas, modelos de las curvas de progreso de
la enfermedad y tasas de infección se observan en Tabla 7.
Sobre mandarinas, la bacteria CNCo9 redujo significativamente las
podredumbres, sola o con el agregado de aditivos. La menor incidencia
(23%) se registró con el agregado de 2 deoxi-d-glucosa 0,2%, aunque
sin diferencia estadística con el valor registrado cuando se aplicó sola.
Aplicando la levadura CNCo8, sola o con aditivos, se observaron diferencias
estadísticas en las incidencias finales con el testigo, pero la reducción
de las podredumbres fue prácticamente insuficiente (Tabla 7).
Las tasas de infección registradas con la bacteria CNCo9, sola o con
aditivos fueron tres veces menores que las registradas con la levadura CNCo8.
En tanto 2 deoxi-d glucosa mejoró levemente el efecto bioactivo de
la bacteria y de la levadura, disminuyendo las velocidades de las infecciones,
el aditivo Biagro S2 permitió mayor incidencia y mayor tasa de
infección al actuar con la bacteria y resultó indiferente agregado a la
levadura CNCo8 (Tabla 7).
III.2.1.2. Efecto de aditivos sobre Patosistema Citrus limón -microorganismo bioactivo- Penicillium sp.
Bajo las condiciones del ensayo, favorables a las infecciones de Penicillium sp., a los 4 días de la aplicación se registró en el testigo 100% de frutas
sintomáticas. Los valores de incidencia de los distintos tratamientos, modelos
a los que ajustan las curvas de progreso y tasas de infección se
observan en Tabla 8.
En limones, CNCo9 sola o con aditivos redujo significativamente las
podredumbres respecto al testigo y a la levadura (Tabla 8). Aunque sin
diferencias estadísticas, la mayor reducción de incidencia resultó agregando
2-deoxi-d-glucosa (30,7%).
CNCo 8 fue incapaz de reducir las podredumbres en las condiciones
del ensayo, sin diferencias estadísticas con el testigo.
El aditivo Biagro S2 permitió mayores incidencias de Penicillium sp.
con cualquiera de los microorganismos.
III.2.1.3. Efecto de aditivos sobre Patosistema Citrus sinensis -microorganismo bioactivo- Penicillium sp.
Cuando los tratamientos se aplicaron sobre naranjas Midknight, a los 4
días se registró en el testigo el 97% de frutas sintomáticas. Los valores
de incidencia de los distintos tratamientos, modelos de ajuste de las
curvas de progreso de la enfermedad y tasas de infección se observan
en Tabla 9.
En naranjas, la bacteria CNCo 9 con cualquiera de los aditivos o sola
redujo significativamente las podredumbres causadas por Penicillium.
La menor incidencia se registró con el aditivo 2-deoxi-d-glucosa (33.3%)
(Tabla 9).
CNCo 8 sola o con aditivos fue incapaz de reducir las incidencias a
niveles comercialmente aceptables bajo las condiciones del ensayo.
Tanto el testigo como los tratamientos biológicos progresaron linealmente
en función del tiempo.
Ambos aditivos redujeron las tasas de incremento al actuar junto a la
bacteria CNCo9. De ellos 2 deoxi-d glucosa fue el más efectivo (r=0,17)
y provocó las menores intensidades de la enfermedad. Sola o con aditivos,
la bacteria CNCo9 redujo la velocidad de la infección a la mitad.
Los dos aditivos tuvieron el mismo efecto sobre la levadura CNCo8,
reduciendo muy levemente la tasa de infección.
III.2.2. Establecimiento y persistencia de CNCo9 en frutas inoculadas y enceradas
Aplicando por inmersión la mezcla conteniendo CNCo9 y Penicillium, antagonista y patógeno compitieron colonizando las heridas (Figura 1).

Figura 1. Ufc de CNCo9 y de P. digitatum en heridas de naranjas. Tratamiento por
inmersión en CNCo9, más P. digitatum, más aditivo y cera LC15.
Después de la inmersión, quedó depositada una población de CNCo9
de 1,3x105 ufc/herida, que fue disminuyendo en el tiempo, con un pequeño
pico de incremento a los 2 días desde la aplicación.
En las mismas heridas, quedaron adheridos 4,4x103 propágulos de Penicillium/herida. Esta población se mantuvo más o menos estable
durante 48 hs, momento desde el cual produjo un incremento, manteniéndose
en 3x104 prop/herida.
De este modo el incremento de la población del patógeno en las
heridas, entre las 48 y 72 hs del tratamiento, coincidió con una marcada disminución de la población del antagonista. Esto se correspondió con la manifestación de síntomas de hidrosis y podredumbres en las
heridas tratadas. La observación de heridas sintomáticas permitió corroborar
la actividad antagónica de CNCo9 retrasando el incremento
poblacional del patógeno y provocando 2 días libres de podredumbre.
Bajo estas condiciones, de inoculación forzada con un muy elevado
nivel de inóculo patógeno, la aplicación por inmersión permitió la adherencia
de una población importante en las heridas soportando el posible
efecto nocivo de la cera.
III.2.3. Aplicación de CNCo9 por aspersión en línea experimental
Durante el proceso de aplicación, en las frutas tratadas se evaluaron las dinámicas poblacionales de la biocontroladora y del patógeno y las incidencias de podredumbres:
a- Dinámicas poblacionales de antagonista y patógeno
Después de cosechadas, la población de Penicillium sobre naranjas Valencia
Late fue de 414,6 prop/cm2 en promedio (Figura 2). Después de ser
lavadas con detergente neutro y enjuagadas, la población disminuyó a
75,3 prop./cm2. Este bajo nivel de inóculo patógeno se vio disminuido aún
más después del encerado, quedando en promedio 6 prop/cm2 de fruta.

Figura 2. Monitoreo de Penicillium y CNCo9 por cm2 de frutas cítricas durante 14
días a partir de la aspersión en línea de empaque.
Al utilizar la cera comercial usada en el NO argentino (LC15), se produjo
un incremento inusual en la presión de la línea, lo que provocó el cambio
del manómetro y la alteración física del túnel de secado después del encerado.
Esto hizo desestimar la posibilidad de uso futuro de esta cera.
El efecto combinado de la biocontroladora y cualquiera de las ceras
comerciales usadas no provocó diferencias en la población del patógeno
sobre las frutas. La población de Penicillium pasó de 7 prop/cm2 de
fruta a los 7 días, a 24 prop/cm2 a los 14 días, coincidentemente con la
aparición de frutas sintomáticas (Fig.2).
En cuanto a la dinámica poblacional de la biocontroladora, la aplicación
por aspersión indujo en promedio una adherencia de CNCo9 de
solo 79,5 ufc/cm2 de fruta. A pesar de que por el pico pulverizador se
aplique una suspensión conteniendo 108 ufc/ml, la llegada a un blanco
de superficie esférica y en movimiento de rotación sobre cepillos no
asegura el depósito de un nivel similar sobre la fruta.
Después del encerado con la cera comercial de Concordia, solo se
rescataron 11,6 ufc/cm2, mientras que con la cera comercial del NO
argentino no se logró rescatar ninguna colonia de CNCo9. La bacteria
no pudo ser rescatada desde la superficie de las frutas tratadas durante
las dos semanas posteriores a la aplicación (Fig.2).
La aplicación de la bacteria por aspersión en línea de empaque no
aseguró una población efectiva y estable de la biocontroladora sobre
las frutas.
b- Evaluación de incidencia de frutas sintomáticas
Los bajos valores de incidencia de frutas sintomáticas registrados en
este ensayo (1,5-2,5%) no permitieron evaluar la eficacia de la biocontroladora
aplicada. Si bien, en principio, el lavado y encerado redujeron
el inóculo de Penicillium, los bajos valores de incidencia se correlacionarían,
además, con un bajo nivel de inóculo sobre las frutas que
provenían de lotes de la Estación Experimental y cosechadas por personal
capacitado que minimiza la producción de heridas. Esto hace
necesario considerar la inoculación forzada del patógeno para asegurar
diferencias entre los tratamientos.
III.2.4. Aplicación experimental por inmersión e inoculación forzada bajo condiciones de comercialización interna y de exportación
III.2.4.1. Bajo condiciones de comercialización interna
Después de la inmersión, la población que quedó establecida en las
heridas fue inferior a lo esperado (3,1x103ufc), según los ensayos de
establecimiento previos realizados en laboratorio (3x105 ufc/herida), y
descendió a los 7 días a 4,6x102.
A los 7 días desde la aplicación en cada herida había 102 unidades
tanto de la bacteria como del patógeno.
A pesar del descenso poblacional de la biocontroladora, bajo estas
condiciones de incubación, favorables tanto al patógeno como a
la bacteria, el tratamiento con CNCo9 disminuyó la intensidad final
de la enfermedad, logrando respecto al testigo una eficacia de 76%,
la reducción de la tasa de infección a la mitad y la disminución de
83,7% del área bajo la curva de progreso de la enfermedad (Tablas
10-11) .
Tabla 10. Incidencia (%) de heridas con podredumbre según tratamiento biológico por
inmersión de frutas heridas. Su eficacia bajo condiciones de comercialización interna

Tabla 11. Ajuste de las CPE al modelo Logístico. Variables epifitiológicas del
tratamiento biológico vs. Penicillium sp.

III.2.4.2 Bajo condiciones de comercialización externa
A partir de los siete días de incubación en estas condiciones, aumentó progresivamente la intensidad de la enfermedad, sin establecerse diferencias
ni al finalizar la incubación en frío ni luego del período que simuló
la comercialización interna de frutas en destino de exportación. Bajo
estas condiciones, no existieron diferencias ni en las tasas de infección
ni en el área bajo la curva de progreso de la enfermedad.
Es probable que la falta de eficacia se deba a las bajas temperaturas
de los primeros 25 días. La condición ambiental adversa para CNCo9
habría estimulado su resistencia en las heridas como esporas, sin poder
colonizarlas como células vegetativas, y de este modo, disminuyó la
actividad antagónica frente a Penicillium.
Es necesario continuar con la evaluación de éste y otros microorganismos,
tratando de combinar métodos que limiten el inóculo primario
de Penicillium y/o las infecciones incipientes, para que, al aplicar el
biocontrolador, éste ejerza una acción protectora de heridas, aún bajo
distintas condiciones de almacenamiento [3, 5, 22, 23].
IV. Conclusiones
Se obtuvo una valiosa colección de microorganismos bioactivos, mayormente
integrantes de la microflora epífita de cítricos. Las técnicas in
vitro permitieron seleccionarlos rápidamente como antagonistas de Penicillium sp. y aportaron conocimientos de la acción bioquímica-fisiológica
ejercida en la interacción antagonista-patógeno.
En estas interacciones, los aislamientos bacterianos fueron más eficaces
que las levaduras en afectar el desarrollo del patógeno y a su vez,
mayores sobre la cepa sensible a fungicidas que sobre la resistente. En
el ambiente de las heridas sobre las frutas, la interacción estuvo condicionada
principalmente por la población del microorganismo establecida
en las mismas, el efecto de las ceras utilizadas y las temperaturas
de almacenamiento en cámaras.
Todos estos factores están involucrados en el método de aplicación
del microorganismo, que debe incorporarse a la tecnología de plantas
de empaque sin grandes modificaciones. Según nuestros ensayos, la
aplicación de un aislamiento bacteriano por aspersión en línea experimental
no aseguró una población efectiva y estable de la biocontroladora,
mientras que la inmersión de frutas en la suspensión bacteriana
permitió el establecimiento de una población mayor a nivel de heridas.
Aplicando la bacteria por este método y bajo condiciones de comercialización
en mercado interno, se logró una eficacia de 76% en el control
de Penicillium. Sin embargo, la biocontroladora no fue eficaz al variar
las condiciones de almacenamiento, considerando la comercialización
de frutas para exportación.
Agradecimientos
A la Universidad Nacional de Entre Ríos que, por medio de la Secretaría de Investigaciones Científicas, Tecnológicas y de Formación de Recursos Humanos, instrumenta y fomenta la investigación, contribuye a la formación de recursos humanos, permite el logro de nuevos conocimientos, su transferencia al medio y la integración con profesionales e investigadores.
1. AGRIOS, G. Fitopatología. México: Noriega Editores; 1999. [ Links ]
2. CHALUTZ, E., WILSON, CL. Postharvest biocontrol of green and blue mold and sour roto f citrus fruit by Debaryomyces hansenii. Plant Disease. 1990; 74 (22): 134-137. [ Links ]
3. D'HALLEWIN, G., ARRAS, G., VENDITTI, T., RODOV, V., BEN-YEHOSHUA, S. Combination Of Ultraviolet-C Irradiation And Biocontrol Treatments To Control Decay Caused By Penicillium Digitatum in Washington Navel' Orange Fruit. Acta Hort. (ISHS). 2005; 682: 2007-2012. [ Links ]
4. EL GHAOUTH, A., WILSON, C. Candida saitoana compositions for biocontrol of plant postharvest decay. US Patent. 2002, nº 6.419.922. [ Links ]
5. EL GHAOUTH, A.; WILSON, C., WISNIEWSKI, M. Biologically-Based Alternatives to Synthetic Fungicides for the Control of Postharvest diseases of Fruit and Vegetables. En: S.A.M.H. Naqvid (ed.). Diseases of Fruits and Vegetables. Vol.II: Diagnosis and Management. Neatherland: Kluwer Academic Pub.; 2004; pp. 511-535. [ Links ]
6. GARRAN, S.; RAGONE, M., VASQUEZ, D. Calidad de frutas cítricas exportadas de Concordia, Argentina. Horticultura Argentina. 1995;. 14 (37):36-43. [ Links ]
7. GIECO, I. Biocontrol de cepas de Penicillium digitatum resistentes y susceptibles a fungicidas. [Trabajo Final de Graduación]. Biblioteca Fac.Cs. Agrop., UNER; 2004 (inédito). [ Links ]
8. JANISIEWICZ, W., KORSTEN, L. Biological control of postharvest diseases of fruits. Annual Review of Phytopathology. 2002; 40: 411-441, <http://arjournals.annualreviews. org/doi/abs/10.1146/annurev.phyto. 40.120401.130158> [ Links ]
9. RONCONI, A. Actividad biológica in vitro de distintos microorganismos frente a Penicillium digitatum. XII Jornada de Jóvenes Investigadores AUGM. Universidad Estadual de Campinas, Campinas, Brasil, 2006. <http:/ /www.cori.unicamp.br/jornadas/completos/ UNER/RONCONI, %20ANA%20PAULA.doc> [ Links ]
10. SMILANICK,J.L., DENNIS ARRUE, R. Control of green mold of lemons with Pseudomonas species. Plant disease. May 1992:481-485. [ Links ]
11. VISINTIN, G., FÁLICO, L., GARCÍA, B. Evaluación de antagonistas capaces de inhibir in vitro el crecimiento de Penicillium digitatum. Anais do VI SICONBIOL (Simposio de controle biológico), Río de Janeiro, Brasil, 1998, p. 13 [ Links ]
12. VISINTIN, G., FÁLICO, L., GARCÍA B., GARRÁN, S. Agentes biocontroladores de Penicillium digitatum sobre frutos cítricos. Actas del Primer congreso Argentino de control biológico de las enfermedades de las plantas. Buenos Aires, Argentina, 1998, p. 31. [ Links ]
13. VISINTIN, G.; FÁLICO, L.; GARCÍA B., GARRÁN, S. Agentes biocontroladores de Penicillium spp. en la cera de cobertura para frutos cítricos. Fitopatología, 2000; 35 (3): 163-168. [ Links ]
14. VISINTIN, G.; GIECO, I.; GARCÍA, B., FÁLICO, L. 2005. Control Biológico de Penicillium digitatum sobre Naranja Valencia. Actas del V Congreso Argentino de Citricultura, Concordia, Argentina, 30 nov.- 2 dic. 2005; Nº 56. [ Links ]
15. VISINTIN, G.; GARCÍA, B.; FÁLICO, L., RONCONI, A. Efecto de aditivos sobre la bioactividad de microorganismos frente a Penicillium digitatum en frutas cítricas. Resúmenes XII Jornadas Fitosanitarias Argentinas. San Fernando del Valle de Catamarca, Argentina, 28-30 junio 2006; pp. 298-299. [ Links ]
16. VISINTIN, G.; GARCÍA, B.; FÁLICO, L., RONCONI, A. 2006. Antibiosis de microorganismos bioactivos frente a Penicillium digitatum resistente y sensible a funguicidas de síntesis. Resúmenes XII Jornadas Fitosanitarias Argentinas. San Fernando del Valle de Catamarca, Argentina, 28-30 junio 2006; pp. 181-182. [ Links ]
17. VISINTIN, G., GIECO, I., GARCÍA, B.,FÁLICO, L. Bioactividad de microorganismos nativos sobre infecciones en naranjas de Penicillium digitatum resistente y sensible a fungicidas. Ciencia, Docencia y Tecnología. 2007; XVIII (34): 229-242. [ Links ]
18. VISINTIN, G., GARCÍA, B., FÁLICO, L., GARRÁN, S. Compatibilidad de una bacteria bioactiva con ceras de uso comercial en frutas cítricas. Actas del 11º Congreso Nacional SUHF. 3er. Congreso Panamericano Promoción del Consumo de Frutas y Hortalizas. Montevideo, Uruguay, 21- 23 mayo 2007; p. 80. [ Links ]
19. VISINTIN, G., GARCÍA, B., FÁLICO, L., RONCONI, A. Establecimiento y persistencia de una bacteria antagonista de Penicillium digitatum en frutas cítricas tratadas con ceras. Resúmenes IV Jornadas de Biología y Tecnología de Poscosecha y I Jornadas de Poscosecha del Cono Sur. Buenos Aires, Argentina, 5-6 julio 2007, p. 88. [ Links ]
20.VISINTIN, G. GARCÍA, B. FÁLICO, L.. ALCARAZ FÁLICO, M.E; G. BARREDO. 2008. Eficacia de aspersión de un microorganismo bioactivo en una línea de empaque experimental. Actas del 1er Congreso Argentino de Fitopatología. Córdoba, Argentina, 28-30 mayo 2008; p. 221. [ Links ]
21. VISINTIN, G. GARCÍA, B.; FÁLICO L., ALCARAZ FÁLICO, M.E., BARREDO G. Aplicación experimental de una bacteria antagónica de Penicillium por inmersión de cítricos. Actas del 1er Congreso Argentino de Fitopatología. Córdoba, Argentina, 28- 30 mayo 2008, p. 222. [ Links ]
22. VISINTIN, G.; GARCÍA, B; CÁCERES, C.; BARREDO, G. Potencial antagónico de la microflora cítrica adaptada a heridas y a bajas temperaturas frente a Penicillium digitatum. Actas de XIII Jornadas Fitosanitarias Argentinas. Santiago del Estero, Argentina,30 set.-2 oct. 2009; PV 96. [ Links ]
23. VISINTIN, G.; GARCÍA, B.; CÁCERES, C.; BARREDO, G. 2009. El frutoplano de los cítricos como fuente de microflora potencialmente antagónica de patógenos poscosecha. Actas de V Jornadas Argentinas de Biología y Tecnología de Poscosecha. INTA San Pedro, Argentina, 27-28 oct. 2009, D 124. [ Links ]














