Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Ciencia, docencia y tecnología
versión On-line ISSN 1851-1716
Cienc. docencia tecnol. no.40 Concepción del Uruguay mayo 2010
CIENCIAS EXACTAS Y NATURALES - INVESTIGACIÓN
Cultivo in vitro de anteras de lino (Linum usitatissimum L.)*
In Vitro Flax (Linum usitatissimum L.) Anthers Culture*
Lassaga, Sergio**; Bretón, Adriana***; Gieco, Lucrecia***; Milisich, Héctor****; Dittrich, Alberto****
*) Artículo derivado del PID UNER Cód. 2079, Director. Dr. S. L. Lassaga, Codirector: H., Facultad de Ciencias
Agropecuarias -FCA-, Universidad Nacional de Entre Ríos. -UNER-; Financiado por la SICTFRH, UNER, y la EEA
Paraná del Instituto Nacional de Tecnología Agrícola -INTA-; recibido en diciembre 2009; admitido en abril 2010.
**) FCA, UNER, y EEA Paraná INTA (Oro Verde, Entre Ríos, Argentina);
***) FCA, UNER;
****) EEA Paraná INTA.
E-mail: slassaga@parana.inta.gov.ar.
Resumen: El cultivo de lino (Linum usitatissimum L.) es una alternativa productiva de interés para Entre Ríos y sus cualidades nutricionales hacen prever un incremento de la demanda en el mercado nacional e internacional. El mejoramiento genético es un instrumento que permite obtener nuevos genotipos adaptados a las condiciones constantemente cambiantes. El cultivo de anteras es considerado el método más eficiente de producción de plantas doble haploides de lino, y puede utilizarse como una biotecnología que asista a los programas de mejoramiento a fin de incrementar su eficiencia al permitir la obtención de líneas puras en un corto tiempo. Si bien el lino se ha mostrado recalcitrante para esta técnica, a través de la investigación que se presenta se lograron ajustes en el protocolo de cultivo de anteras in vitro, se llegó al correcto desarrollo de la etapa de callogénesis y se redujo sustancialmente la oxidación de los callos durante la etapa de regeneración.
Palabras clave: Agricultura; Biotecnologia; Linum usitatissimum; Cultivo in vitro
Abstract: Flax (Linum usitatissimum L.) is an important oil crop and an interesting agriculture production activity in Entre Ríos. Its nutritional qualities provide a high expectation for an increased national and international commercial demand. Crop genetic improvement is a tool that allows obtaining new genotypes adapted to constantly changing conditions. Consumers look for better nutrition qualities and farmers needs new genotypes adapted to the ecological and climatic requirements. Anther culture is considered the most successful method of producing doubled haploid plants in flax and it can be used in flax breeding programs to increase the efficiency and obtain lines in a short time. Although flax appeared to be recalcitrant to this technology through the study here presented some adjustments in the protocols that allowed obtaining a suitable growth at callus stage and reduced in a significant manner the calluses oxidation during the regeneration stage were made.
Key words: Agriculture; Biotechnology; Linum usitatissimum; In vitro culture
I. Introducción
El lino (Linum usitatissimun L.) es una planta herbácea anual perteneciente
a la familia Linaceae. Dentro de esta especie existen dos tipos
de lino: el oleaginoso y el textil; el primero se emplea para la extracción
de aceite destinado a la elaboración de pinturas, barnices, tintas, aditivos,
productos farmacéuticos, etc., y es el que se produce en nuestro
país. El lino textil se destaca por la longitud y calidad de las fibras presentes
en los tallos y, como su nombre lo indica, es utilizado en la
industria textil.
A pesar de que la producción de este cultivo en nuestro país ha mostrado
una tendencia ha disminuir, se observa un renovado interés en fomentar
y realentar su producción [15]. Esto tiene fundamentos agronómicos,
económicos y relacionados con la salud humana y animal [15, 3].
La Provincia de Entre Ríos es la principal productora de lino de Argentina,
con una superficie sembrada en la campaña 2006/2007 de
25.300 hectáreas; representa una alternativa productiva de interés
para nuestra provincia ya que se adapta a sus diferentes características
agroecológicas. Por otra parte, sus cualidades nutricionales lo están
posicionando como un alimento beneficioso para la salud humana
por el contenido de ácidos grasos omega 3 y omega 6 presentes en el
aceite de las semillas, lo que hace prever un incremento de la demanda
en el mercado a nivel nacional e internacional.
La obtención de genotipos mejorados de lino se ha desarrollado a
través de métodos tradicionales y se requieren más de 7 años para
obtener variedades mejoradas. Diferentes herramientas pertenecientes
al campo de la biotecnología son capaces de brindar asistencia al
mejoramiento genético permitiendo la obtención de resultados en un
tiempo menor y con una mayor eficiencia. La utilización de la técnica
del cultivo in vitro de anteras puede permitir la obtención de líneas
dobles haploides en un corto tiempo, llegando así a contar con homocigotas
en forma rápida, evitando las cinco a siete generaciones de
autofecundación necesarias en caso de emplear el método natural de
endogamia. El cultivo de anteras es considerado el método más eficiente
de producción de plantas doble haploides de lino [5].
En los programas de mejoramiento de especies autógamas, como lo
es el lino, se debe contar con líneas puras estabilizadas que se someten
a selección, luego de ser obtenidas a partir de poblaciones segregantes.
En condiciones naturales de autofecundación, la obtención de
líneas puras implica alrededor de 5 a 7 ciclos de cultivo (es decir, de 5
a 7 años), para luego comenzar la evaluación de los genotipos estabilizados.
El cultivo in vitro de anteras es una biotecnología mediante la
cual es posible reducir el tiempo necesario para la obtención de líneas
homocigóticas estabilizadas; mediante su aplicación sería posible la
generación de plantas haploides a partir de microsporas, y posteriormente,
por duplicación cromosómica, obtener plantas doble haploides.
De esta forma se lograrían líneas puras en un corto tiempo (un año
aproximadamente), con lo cual se reducirían costos y se lograrían, con
mayor rapidez, nuevos genotipos mejorados.
El cultivo in vitro de anteras se utiliza a gran escala para el mejoramiento
de algunas especies como el trigo, arroz, cebada y colza entre
otros, sin embargo, el lino se presenta hasta el momento como una
especie recalcitrante, ya que se obtiene una baja eficiencia en la obtención
de plantas doble haploides, y la técnica no ha sido ajustada aún,
como para lograr su aplicación a gran escala. Algunos de los factores
que influyen sobre el desarrollo de ésta técnica son: el genotipo, la
temperatura, la intensidad de luz, la composición de los medios de
cultivo, la aplicación de pretratamientos a los explantos y las condiciones
de crecimiento de las plantas donantes de las anteras, entre otros.
Los medios de cultivo contienen componentes esenciales como micro y
macronutrientes, vitaminas, aminoácidos, azúcares, etc. que deben estar
en las dosis adecuadas, de manera tal que permitan optimizar la formación
y el desarrollo de los callos u órganos. Además, el tipo y concentración
de fitorreguladores presentes es determinante de cada etapa de desarrollo.
Otros factores de importancia a tener en cuenta para optimizar la técnica
son las condiciones de crecimiento de las plantas donantes de anteras.
El lino, por ser un cultivo invernal, requiere de una cierta cantidad de horas
de frío para su normal desarrollo e inducción a la floración.
Para utilizar el cultivo de anteras en lino como una herramienta que
asista y optimice los programas de mejoramiento, es necesario conocer y evaluar diferentes aspectos que influyen en el cultivo in vitro, a fin
de ajustar la técnica y hacer factible su aplicación como práctica común
para la rápida la obtención de variabilidad genética estabilizada y de
nuevos cultivares comerciales. Con ese propósito se realizó un estudio,
orientado a objetivos específicos, cuyos resultados se expondrán
en este artículo.
II. Objetivos
Los objetivos del estudio desarrollado fueron:
-Evaluar la respuesta de anteras de lino cultivadas in vitro en diferentes
etapas del cultivo y para distintos genotipos.
-Determinar el efecto de las concentraciones de cobre, furfuryl-6-amino
purina (FAP), ácido indolacético (AIA) y zeatina en los medios de cultivo.
-Analizar el efecto sobre el cultivo in vitro del pretratamiento con frío
de las semillas de las plantas donantes de anteras.
-Generar variantes somaclonales de interés agronómico.
III. Materiales y métodos
Los genotipos evaluados por su comportamiento al cultivo de las anteras in vitro fueron siempre sembrados a campo. Se probaron líneas estabilizadas, cultivares comerciales, líneas introducidas que presentaban diferentes genes de resistencia a roya y se realizaron cruzamientos entre líneas de interés (Cuadro 1), a fin de obtener poblaciones segregantes y, a partir de allí, genotipos que presenten nuevas combinaciones entre genes de resistencia a roya y buen comportamiento agronómico.
Cuadro 1. Callogénesis media para el genotipo 03E7 con dos concentraciones de
SO4Cu (1μm y 10μm) en el medio de inducción Sun I.

Se evaluaron a través de diferentes ensayos más de 40 genotipos
correspondientes a líneas comerciales (Ceibal, Tape, Atalante, Buenos
Aires 106; Omega, Paisano, Curundú, Carapé), líneas introducidas donantes
de genes de resistencia (Dakota, Birio, Linore, CI2008; Steward,
Cass, Bison), líneas avanzadas del programa de mejoramiento de la
EEA Paraná INTA (94E1; 94E2; 96E1; 96E2; etc.), F1 provenientes de
las cruzas entre las líneas antes mencionadas, y poblaciones F2 a F6 derivadas de estos cruzamientos.
Para el cultivo in vitro de las anteras, se procedió a obtener botones
florales durante el estadio de plena floración, tomando en cuenta los
parámetros florales que indican una mayor respuesta en la formación
de callos [11] y que corresponden al momento de desarrollo en el cual
las microsporas se encuentran en estado uninucleado.
Los botones florales se desinfectaron en cámara de flujo laminar
con alcohol al 70% durante 1 minuto, luego con hipoclorito de sodio al
10% durante 10 minutos y finalmente se enjuagaron tres veces con
agua bidestilada estéril. Una vez esterilizados los pimpollos, se procedió a la extracción de las anteras que se colocaban en tubos de ensayo
con 10ml del medio de cultivo correspondiente.
Durante la etapa de callogénesis, se empleó como medio base el
medio SunI (17) constituido por micro y macronutrientes B5 (8) + 2 mg/
l de cinetina + 8 mg/l AIA+ 1000mg/l de lactoalbúmina hidrolizada+
300mg/l de extracto de levadura, modificado con el agregado de 3% de
maltosa [10].
Para la extracción de las anteras, se trabajó bajo cámara de flujo
laminar. Las 5 anteras de un mismo pimpollo se cultivaron en el mismo
tubo de ensayo. Las anteras recién cultivadas se incubaron a 27±2°C;
en oscuridad continua durante 10 días, luego se mantuvieron en cámara
de cría a 25 ± 3°C y con un fotoperíodo de 16 horas. Entre los 25 y
30 días posteriores al cultivo in vitro, se realizó la evaluación de la
callogénesis, la cual consistió en la determinación del número de anteras
que habían producido callo y el estado de los mismos.
Los callos cuyo diámetro era igual o superior a 2mm fueron repicados
al medio de regeneración de vástagos denominado P20 (14), compuesto
por macro, micronutrientes y vitaminas de N6 + 100mg/l
mioinositol + 375mg/l glutamina + 250mg/l asparagina + 125mg/l
serina + 1mg/l zeatina + 30g/l maltosa + 6g/l de agarosa, que se
empleó como medio base para esta etapa. Dicho medio se reponía
mediante repiques de los callos y/o vástagos cada 20-30 días. Para
esta etapa, el cultivo se realizó en frascos de boca ancha, de 5cm de
diámetro, tapados con papel aluminio y film plástico.
Durante la etapa de regeneración, las condiciones de crecimiento
fueron en cámara de cría a 25 ± 3°C y un fotoperíodo de 16 horas.
Los vástagos generados que alcanzaron aproximadamente 2cm fueron
transferidos a tubos de ensayo con 10ml del medio de enraizamiento
WL18 [14] que fue empleado como medio base, y se mantuvieron las
condiciones de incubación de la etapa anterior. Cuando se obtuvo más
de un vástago por callo, se separaron y ubicaron en tubos diferentes.
Se practicaron distintos ensayos a fin de ajustar y optimizar las respuestas
al cultivo in vitro en sus diferentes etapas. Por un lado, se
probó la respuesta de los genotipos, ya que se conoce que existen
respuestas diferenciales [14]. También se evaluó un pretratamiento
realizado a las semillas de las plantas donantes, que consistió en la
exposición de las semillas a una temperatura de 6 ± 1ºC durante 20
días previos a la siembra a campo.
En cuanto a los medios de cultivo, se probaron variantes en la concentración
de sulfato de cobre (SO4Cu) para el medio de inducción y el
de regeneración, evaluando en ambos el efecto del incremento de la
concentración de 1 a 10 μM. También se efectuaron modificaciones en
las concentraciones y tipos de fitorreguladores presentes, utilizando
diferentes dosis de FAP, zeatina y AIA.
En la etapa de enraizamiento, se probó el medio base WL 18 y a la
mitad de su concentración normal (½WL18). También se realizó un
tratamiento que consistió en sumergir el extremo inferior de los vástagos
en una solución con 2% de AIA, durante 1 hora, antes de llevarlos al
medio de enraizamiento.
Algunos de los vástagos formados en los medios P20, WL18 y ½ WL
18, que no generaron raíces, fueron utilizados para extraer segmentos
internodales de aproximadamente 1,5cm, que se cultivaron en el medio
MS [13]. Se utilizaron tubos de ensayo con 10ml de MS y se colocó un segmento por tubo.
Para los ensayos se emplearon diseños completos al azar, con cuatro
repeticiones y un número de 25 anteras, callos o vástagos por
repetición.
Los datos obtenidos fueron analizados empleando los paquetes estadísticos
SAS (1989) e InfoStat (2004).
IV. Resultados y discusión
Durante la primera etapa de callogénesis, se conoce que las respuestas
a la formación de callos a partir de anteras son altamente dependientes
del genotipo [4, 2,14], lo cual se observó en todas las pruebas
realizadas.
La callogénesis osciló entre 96% para la población F2 Buenos Aires
106 X Linore y 37% para la F5 CI2008 x 94E1 (Cuadro 3). Por otra
parte, se pudo observar el efecto de oxidación que sufrieron los callos,
lo cual también fue variable de acuerdo al genotipo. Cabe destacar que
los callos oxidados normalmente no regeneran, ya que pierden su capacidad
de fotosíntesis.
Cuadro 3. Resultados callogénesis (%) por genotipo para callos totales (verdes +
oxidados), verdes y oxidados.

Los callos verdes, con posibilidad de regenerar vástagos, se formaron
en proporciones que variaron entre el 78 y el 17 % (Cuadro 3).
Las mayores frecuencias de producción de callos se observaron comúnmente
en poblaciones provenientes de combinaciones híbridas, lo
cual podría ser atribuible a la presencia de efectos heteróticos en los loci que gobiernan la capacidad de callogénesis.
Como valor medio de callogénesis se obtuvo un 67%, con un 47,27%
de callos verdes (Cuadro 3). Estos valores, correspondientes a la primera
etapa de callogénesis, permitirían la utilización de esta técnica a
gran escala.
De todas maneras, se continuaron probando diferentes alternativas
que permitieran mejorar los resultados obtenidos; así se ensayó una
mayor concentración de SO4Cu para el medio base SunI. Normalmente
el medio posee 1 μM, y esta concentración se contrastó con otra de 10 μM. Para realizar esta prueba se empleó un solo genotipo, la línea
avanzada 03E7 obtenida en la EEA Paraná de INTA.
Los resultados obtenidos para callogénesis no mostraron diferencias
estadísticamente significativas, al 5% de significancia, entre los
medios SunI y SunI + Cu para el genotipo evaluado en este ensayo. A
pesar de esto, se observó un mayor porcentaje de callos totales y de
callos verdes en el medio con agregado de cobre. Los callos producidos
se incrementaron en un 5,6 %, lo que implica un 9% más de eficiencia
(Cuadro 1), y los callos oxidados se redujeron en un 27% (Cuadro 2).
Cuadro 2. Porcentaje de callos oxidados para el genotipo 03E7 con dos concentraciones
de SO4Cu (1μm y 10μm) en el medio de inducción Sun I.

IV.1. Evaluación del efecto de tratamiento con cobre
El cobre se agrega a los medios en forma de sulfato de cobre. En las
plantas cumple funciones relacionadas con la síntesis de clorofila y la
fotosíntesis [12]; en algunas especies cumple un rol clave durante el
desarrollo del polen en las etapas de división celular y su deficiencia
afecta el metabolismo normal provocando inhibición de la síntesis de
ADN [1,6]. Trabajos realizados en cebada (Hordeum vulgare L.) [19] han reportado un incremento en la callogénesis a partir del aumento de
la dosis de cobre en el medio de cultivo de anteras, logrando también
un marcado incremento en la regeneración de plantas viables. Si bien
se conocen varias de las funciones que cumple el cobre en las plantas
superiores, no se cuenta aún con datos específicos sobre la influencia
de este micronutriente en el cultivo de anteras de lino. Los datos obtenidos
en el ensayo llevado a cabo no mostraron un comportamiento
estadísticamente diferencial a las dosis probadas, pero se logró generar
un incremento significativo en el porcentaje de callos verdes
fotosintéticamente activos.
A partir de los resultados obtenidos, se comenzó a trabajar con el
medio Sun I modificado, con 10 μm de SO4Cu.
IV. 2. Evaluación del efecto del pretratamiento con frío
El lino es un cultivo invernal que requiere de horas de frío para inducir la
floración. Las condiciones ambientales de los últimos años muestran
una tendencia hacia el acortamiento del período invernal y el incremento
de las temperaturas, lo cual puede influir sobre el desarrollo de la
especie. La exposición de las semillas a bajas temperaturas antes del
momento de la siembra puede ser un mecanismo que permita suplir la
posible carencia de horas de frío, otorgando mejores condiciones fisiológicas
para la floración, con lo cual se verían favorecidas las condiciones
para el cultivo in vitro de anteras, especialmente en años cálidos.
Para evaluar el efecto del pretratamiento con frío, se trabajó con dos
variedades comerciales adaptadas a la región, Omega y Ceibal. Parte
de las semillas a sembrar se mantuvieron durante 20 días en frío, a una
temperatura de 6 ± 1ºC. En callogénesis, no se observó diferencia significativa
entre los tratamientos con y sin frío. En regeneración, se evaluó a los 25 y a los 50 días, el porcentaje de callos que permanecían verdes
y los que se habían oxidado. El modelo planteado fue significativo tanto
para la primera como para la segunda evaluación.
Del análisis de los datos surge que el tratamiento con frío de las
semillas permitió obtener y mantener una mayor frecuencia de callos
verdes. Para el genotipo Ceibal, la reducción de callos verdes entre los
25 y los 50 días fue de 34,11% en el tratamiento sin frío y de 3,67% en
el tratamiento con frío. El genotipo Omega presentó un comportamiento
similar: para el tratamiento sin frío, la reducción de callos verdes fue
del 33,7% y para los tratados con frío fue de 11,76% (Cuadros 4 y 5).
Cuadro 4. Frecuencias de callos obtenidos para callos verdes y oxidados a los 25
días de permanencia en el medio de regeneración.
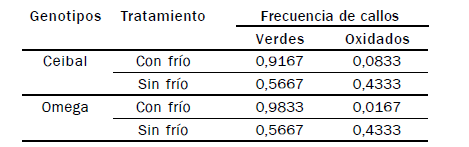
Cuadro 5. Frecuencias de callos obtenidos para callos verdes y oxidados a los 50
días de permanencia en el medio de regeneración.

IV. 3. Evaluación de tratamiento con FAP
Por otra parte, se probaron diferentes dosis de FAP en el medio de
inducción a fin de generar un estrés hormonal que permitiera mejorar la
respuesta en la etapa siguiente de regeneración. Se emplearon 2 dosis
de FAP correspondientes a 4 y 8mg/l de medio. Este cambio generó una
gran reducción en la producción de callos verdes y la respuesta en
regeneración no fue mejorada.
En el medio de regeneración P20, también se probaron cambios en la
composición de hormonas y la adición de SO4Cu en dosis de 10μM. Para
esta prueba se trabajó con un solo genotipo, el cultivar comercial Omega.
Los callos obtenidos, que poseían 2mm de diámetro, se transfirieron al
medio de regeneración P20 normal (1μm de SO4Cu + 1mg/l de zeatina) y
a tres modificaciones, a saber: P20 + 10μm de SO4Cu; P20 + 1,5mg/l de
zeatina y P20 + 10μm de SO4Cu + 1,5mg/l de zeatina.
A los 25 días del repique se realizó la primera evaluación de la regeneración.
Del análisis de los datos resultó que el modelo fue significativo
y que existían diferencias significativas entre medios; el medio P20
sin modificar fue el que presentó mayor proporción de callos oxidados.
El aumento de la dosis de cobre o zeatina en el medio incrementó la
permanencia de los callos en estado fotosintéticamente activo, siendo
máximo en el medio con aumento de dosis para ambos compuestos.
Cuando se incrementó la dosis de zeatina y de cobre en el medio, se
obtuvo un 13% de callos oxidados, significativamente menor a lo observado
en el medio sin modificar, que presentó un 97%. La proporción de
callos verdes fue mayor en el medio con incremento de zeatina respecto
del medio en el cual se incrementó solo el cobre (Cuadro 6).
Cuadro 6. Porcentaje de callos oxidados y callos verdes en el medio de cultivo
P20 y tres modificaciones.

(*) Letras diferentes indican diferencias estadísticamente significativas (a=0,01)
Se evaluó también el tamaño de los callos y se observó un incremento al
aumentar la dosis de cobre y de zeatina. El número mayor de callos con
más de 6mm se obtuvo en el medio en el cual se aumentó solo la dosis
de hormona. En el medio P20 normal no se desarrollaron callos con un
tamaño mayor a 3mm luego de 25 días de permanencia en el medio.
El incremento de la dosis de SO4Cu de 1mm a 10mm y de zeatina de
1 a 1,5 mg/l en el medio de regeneración P20 disminuyó la oxidación
de los callos y permitió lograr callos de mayor tamaño a partir del cultivo
de anteras de lino.
Otra de las pruebas realizadas tuvo por objeto evaluar el efecto de
las fitohormonas zeatina y AIA, en distintas concentraciones, durante la
etapa de regeneración de vástagos. Se probó como medio base testigo
el medio P20 [14], que contiene sólo la fitohormona zeatina en una
concentración de 1 mg/l, y cuatro modificaciones en las hormonas de
dicho medio (Cuadro 7).
Cuadro 7. Hormonas presentes en el medio de regeneración P20 y sus modificaciones.

Para evaluar los cambios introducidos en los medios se emplearon
cuatro genotipos, todos líneas puras mejoradas, a saber: Atalante,
Carapé, Omega y Ceibal.
Los callos de 2mm obtenidos en el medio de inducción SunI [17] modificado por Lassaga y Bretón (1997) con el agregado de 3% de
maltosa y sulfato de cobre a razón de 10mM/l [18], se pasaron a los
cinco medios de regeneración (Cuadro 7). A los 40 días de comenzada
la etapa de regeneración, se evaluó el estado de los callos en cada quiriendo en función de una escala que consideraba callos grandes a
aquellos con más de 6mm de diámetro, callos medianos con entre 3 y
6mm, y callos pequeños con menos de 3mm.
En la etapa de callogénesis, el comportamiento de los genotipos evaluados
fue el que se muestra en el Cuadro 8.
Cuadro 8. Callogénesis. Frecuencias de callos totales, verdes y oxidados.

Del análisis de los datos obtenidos en regeneración surge que el
modelo propuesto es estadísticamente significativo y se observan diferencias
entre genotipos, entre medios y también es significativa la
interacción genotipo x medio.
El genotipo que mayor porcentaje de callos verdes mantuvo a través del
tiempo fue Ceibal con 77,30% y no difirió significativamente de Atalante,
que presentó 75,33% de callos verdes (Cuadro 9).
Cuadro 9. Porcentaje de callos verdes y oxidados por genotipo en el medio de
regeneración.

*Letras diferentes indican diferencias significativas (Duncan 0,05).
Los medios modificados 5 (Zeatina 1,50mg/l + AIA 1mg/l) y 4 (Zeatina 1,25mg/l + AIA 0,750mg/l) no difirieron estadísticamente, presentando 89,17% y 88,75% de callos verdes respectivamente. El medio P20 sin modificar se ubicó último en el orden de mérito, conjuntamente con el medio 2 (Zeatina 1 mg/l + AIA 0,250mg/l) produciendo 52,5% y 49,17% de callos verdes respectivamente (Cuadro 10).
Cuadro 10. Porcentaje de callos verdes y oxidados por medio en regeneración.

*Letras diferentes indican diferencias significativas (Duncan 0,05).
En cuanto al tamaño de los callos, se pudo observar que del total de
los callos verdes, el 35,74% presentó un diámetro mayor a 6mm, mientras
que de los callos oxidados solo el 18,65% alcanzó un diámetro
igual o superior a los 6 mm, en tanto que el 66,35% tuvieron menos de
3 mm de diámetro.
Los callos verdes mantuvieron su capacidad fotosintética, con lo que su
tamaño continuó en aumento generando más células no diferenciadas. La
producción de vástagos fue muy baja. Los genotipos y medios en los cuales se formaron vástagos regenerantes de 2cm de altura, que fueron pasados
al medio de enraizamiento, se exponen en el Cuadro 11.
Cuadro 11. Cantidad de callos regenerantes en los distintos medios y cantidad de
plantas de longitud mayor a 2cm pasadas a medio de enraizamiento para
cada genotipo evaluado.

Los resultados permitieron concluir que el incremento en el medio
de regeneración de la concentración de la zeatina, fitoregulador del
grupo de las citocininas, y la presencia de la fitohormona del grupo de
las auxinas, AIA, produjeron en general una mayor permanencia de los
callos en estado fotosintéticamente activo.
El número de callos que formaron vástagos fue muy bajo pero se
destacó el efecto observado en el genotipo ceibal, para el cual el agregado
de AIA en el medio permitió que pocos callos regenerantes formaran
un gran número de vástagos que alcanzaron más de 2cm de altura
(Cuadro 11).
De las 107 plántulas regenerantes pasadas al medio de enraizamiento½ WL18, 8 (ocho), correspondientes al genotipo ceibal en el medio 2,
presentaron raicillas incipientes que no alcanzaron desarrollo suficiente
como para poder ser transferidas a la etapa de rustificación.
En la etapa de enraizamiento, se realizaron diversas pruebas. Los vástagos
obtenidos se transfirieron al medio WL18 (14) y WL18 con la
mitad de concentración de sus componentes (½WL18), directamente desde el medio P20. Por otra parte, se trató a los vástagos con una
solución al 2% de AIA, sumergiendo el extremo de los vástagos durante
una hora, previo a la colocación en el medio de enraizamiento. Para
ninguno de los tratamientos se logró un correcto enraizamiento.
Si bien no se lograron plantas haploides y dobles haploides, objetivoúltimo de este proyecto, los resultados obtenidos permitieron detectar
concentraciones hormonales que reducen la oxidación de los callos y
permiten su mayor desarrollo, lo cual es importante tanto para la obtención
de plantas, como cuando se piensa en el empleo del cultivo in vitro con el fin de lograr variantes somaclonales.
El proceso denominado variación somaclonal involucra cambios en
el ADN de las células de los callos y, por lo tanto, en las plantas regeneradas
a partir de ellos. Dichos cambios son heredables, es decir, transmitidos
a la progenie. A diferencia de otros procesos de variación
genética, se ha encontrado variación somaclonal en las progenies de
las plantas regeneradas in vitro, con una elevada frecuencia ubicada
en el orden del 15%, mientras que la tasa de ocurrencia de mutaciones
espontáneas es sólo de una en un millón (0,0001%) [7]. Uno de los
mayores beneficios de la variación somaclonal es la obtención de variabilidad
genética en cultivares agroeconómicamente útiles, la cual se ha
obtenido tradicionalmente recurriendo a la hibridación. Los somaclones
mutantes pueden enriquecerse y seleccionarse durante el cultivo in
vitro para algunas de las siguientes características: resistencia a enfermedades
y a herbicidas y tolerancia a estrés químico o ambiental. En
general, esta técnica de cultivo in vitro y obtención de variantes
somaclonales es relativamente sencilla, comparada con otras técnicas
como la del ADN recombinante, y es también una buena fuente de
variabilidad genética [7].
Se considera que la variación somaclonal podría ser muy útil para incorporar
nuevas características a una variedad, o para modificar las que ésta
tiene; de tal forma, la variabilidad genética inherente al somacultivo sería
una práctica que permitiría mejorar significativamente el valor agronómico
del lino, como así también de otras especies cultivadas.
V. Conclusiones
El agregado de Cu al medio de cultivo Sun I, empleado en la etapa de
callogénesis, resultó en la disminución de la oxidación de los callos.
El pretratamiento con frío de las semillas permitió obtener y mantener
una mayor frecuencia de callos verdes.
Al someter a los explantos a un estrés hormonal, mediante el incremento
de la dosis de FAP, se generó una gran reducción en la producción
de callos verdes y la respuesta en regeneración no fue mejorada.
Durante la etapa de regeneración de vástagos, el medio P20 modificado
con el agregado de 1,50 mg/l de Zeatina y 1 mg/l de AIA, mostró el mayor porcentaje de callos verdes, fotosintéticamente activos.
1. AZOUAOU, Z.; SOUVRÉ, A. Effects of copper deficiency on pollen fertility and nucleic acids in the durum wheat antier. Sex Plant Reproduction. 1993; 6: 199-204. [ Links ]
2. BRETÓN, A.M.; DITTRICH, A.A.; LASSAGA, S.L. Efecto del aumento de la dosis de sulfato de cobre en el medio de inducción sobre la callogénesis en cultivo de anteras de Linum usitatissimum L. En: Actas XXXIII Congreso Argentino de Genética, Malargüe, Argentina; 26-29 set, 2004. S.A.G. pp: 101-102. [ Links ]
3. CARTER, J.F. Potential of flaxseed and flaxseed oil in baked goods and other products in human nutrition. Cereal Foods World. 1993; 38: 753-759. [ Links ]
4. CHEN, Y.; DRIBNENKI, P. Effect of genotype and medium composition on flax Linum usitatissimum L. anther culture. Plant Cell Rep. 2003; 21: 204-207. [ Links ]
5. CHEN, Y., LIN, l., DUGUID, S., DRIBNENKI, P.; KENASCHUCK, E. Effect of sucrose concentration on elongation of shoots from flax anther culture. Plant Cell, Tissue and Organ Culture. 2003. 72: 181-183. [ Links ]
6. DAHLEEN, L. Improved plant regeneration from barley callus cultures by increased copper levels. Plant Cell Tissue and Organ Culture. 1995; 43: 267-269. [ Links ]
7. EVANS, D. A., SHARP W. R. Somaclonal and gametoclonal variation. En: EVANS, D.A.; SHARP, W.R.; AMMIRATO, P.V. (eds.). Handbook of plant cell culture. New York: Mac Millan Publ.; 1986; pp.97-132. [ Links ]
8. GAMBORG, O. L., MILLER, R. A.; OJIMA, K. Nutrient requirement of suspension cultures of soybean roots cells. Exp. Cell Res. 1968; 50:151-158. [ Links ]
9. INFOSTAT, versión 2004. Manual del Usuario. Córdoba: Ed. Brujas Argentina; 2004. [ Links ]
10. LASSAGA, S. L., BRETÓN, A. M. (1997). Respuesta al cultivo in vitro de anteras de lino (Linum usitatissimum L.) con dos fuentes carbonadas a distintas concentraciones. XXVIII Congreso Argentino de Genética. En: Actas del Encuentro Latinoamericano de Bioética y Genoma Humano. San Miguel de Tucumán, Argentina, Set.14-18 1997. p. 185. [ Links ]
11. LASSAGA, S.L., MILISICH, H.J. y A.A. SANCHEZ. Linseed (Linum usitatissimum L.) anther culture. Response at different pollen development stages. Correlations with morphological bud characteristics. Bast fibrous plants today and tomorrow. En: Proc. Breeding, molecular biology and biotechnology beyond 21st century. Saint Petersburg, Rusia, Set. 28-30 1998. pp: 115-118. [ Links ]
12. MAKSYMIEC, W. Effect of copper on cellular processes in higher plants. Photosynthesis. 1997; 34: 321-342. [ Links ]
13. MURASHIGE, T.; SKOOG F. A revised médium for rapad growth and bioassay with tobacco tissue cultures. Physiol. Plant. 1962; 15: 473-497. [ Links ]
14. NICHTERLEIN, K.; UMBACH, H.; FRIEDT, W. Genotypic and Exogenous Factors Affecting Shoot Regeneration from Anther Callus of Linssed (Linum usitatissimum L.). Euphytica. 1991; 58:157-164. [ Links ]
15. PICCA C., DEVOTO, R. Participación del germoplasma INTA en el mercado de semilla de lino. INTA, Informe Técnico No 00. 2003:8. [ Links ]
16. SAS INSTITUTE. SAS/STAT TM. User's Guide. Release 6.03. Cary, NC, USA:SAS Institute; 1989. pp. 1028. [ Links ]
17. SUN, H.; FU, W. Induction of pollen plants in flax (Linum usitatissimum L.) and preliminary observations on performance of their progenies. Acta Genet. Sin. 1981; 8: 369-374. [ Links ]
18. VILLAMONTE, S., BRETÓN A. M. Evaluación de la callogénesis en el cultivo de anteras de lino utilizando dos dosis de sulfato de cobre en el medio de inducción. En: Actas XII Jornadas de Jovens Pesquisadores da AUGM. Curitiba, Brasil; 2004. pp: 87-89. [ Links ]
19. WOJNAROWIEZ, G.; JACQUARD, P.; DEVAUX, P.; SANGWAN, R. S.; CLÉMENT, C. Influence of copper sulfate on anther culture in barley (Hordeum vulgare L.). Plant Science. 2002; 162: 843-847. [ Links ]














