Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Ciencia, docencia y tecnología
versión On-line ISSN 1851-1716
Cienc. docencia tecnol. no.49 Concepción del Uruguay dic. 2014
CIENCIAS EXACTAS Y NATURALES: INVESTIGACIÓN
Optimización de la extracción de antocianinas de arándanos
Zapata, Luz M.; Heredia, Ana M.; Quinteros, Carlos F.; Malleret, Antonio D.; Clemente, Gabriela; Cárcel, Juan A.
Autores: Universidad Nacional de Entre Ríos, Facultad Ciencias de la Alimentación, carrera Ingeniería de Alimentos (Concordia, Argentina).
Contacto: zapatam@fcal.uner.edu.ar
Artículo que expone resultados de un proyecto desarrollado en la Facultad de Ciencias de la Alimentación (FCAL), Universidad Nacional de Entre Ríos (UNER); una versión previa fue presentada en XII Congreso CYTAL-AATA, Concordia, octubre 2011;
recibido en 09/05/2014,
admitido el 15/10/2014.
Resumen
Actualmente existe interés en las antocianinas debido a sus beneficios potenciales para la salud por su actividad antioxidante y su utilización como colorante natural en la industria alimentaria. Se pueden extraer de vegetales y frutas, como por ejemplo los arándanos. En este trabajo se investigó la influencia de variables del proceso de extracción sólido-líquido de antocianinas de arándanos. Así, se obtuvo una combinación de variables que maximizó su recuperación: etanol acidificado con ácido cítrico al 1% como solvente de extracción, proporción materia prima/solvente 1:3 kg/kg, temperatura 36±1 ºC y tiempo de extracción 2 h. A partir de la caracterización del extracto obtenido se obtuvo que la concentración de antocianinas totales fue de 879.0±12.9 mg cianidina-3-glucósido/100 mL, el contenido de fenoles totales de 1424±67 mg GAE/100 mL y la actividad antioxidante de 5730±103 y 4872±124 mg EAA/100 mL, medidos por los métodos ABTS y DPPH, respectivamente.
Palabras clave: Tecnología de alimentos; Industria de colorantes alimentarios; Extracto de antocianina; Arándano; Antioxidantes.
Optimizing the extraction of anthocyanins from blueberry
Abstract
There is a current interest in anthocyanins owing to the potential benefits both in the health area as an antioxidant and as a natural food colorant in the food industry. Anthocyanins may be extracted from vegetables and fruits, blueberries being a case in point. The influence of the variables of anthocyanin solid-liquid extraction process from blueberries was studied. The best extraction conditions identified were: ethanol acidified with 1% citric acid as extraction solvent, 1:3 kg/kg raw material/ solvent proportion, 36±1 ºC temperature and 2h time extraction time. From characterization of extracts, it was obtained that the total anthocyanin concentration was 879.0±12.9 mg cyanidin-3-glucoside/100 mL, the total phenol content was 1424 ± 67 mg GAE/100 mL and the antioxidant activity was 5730 ± 103 y 4872 ± 124 mg EAA/100 mL, measured by ABTS y DPPH respectively.
Keys Words: Food technology; Food coloring industry; Anthocyanin extract; Blueberry; Antioxidant
Otimização da extração de antocianinas de mirtilos
Resumo
Atualmente existe interesse nas antocianinas devido a seus potenciais benefícios para a saúde por sua atividade antioxidante e sua utilização como corante natural na indústria alimentar. Podem ser extraídas de vegetais e frutas tais como os mirtilos, por exemplo. Neste trabalho foi investigada a influência de variáveis do processo de extração sólido-líquido de antocianinas de mirtilos. Assim, foi obtida uma combinação de variáveis que maximizam sua recuperação: etanol acidificado com 1% de ácido cítrico como solvente de extração, proporção matéria-prima/solvente 1:3 kg/kg, temperatura 36±1º C e tempo de extração 2 h. A partir da caracterização do extrato obtido encontrou-se que a concentração de antocianinas totais fue de 879.0±12.9 mg cianidina-3-glicosídeo/100 mL, o conteúdo fenólico total de 1424±67 mg GAE/100 mL e a atividade antioxidante de 5730±103 e 4872±124 mg EAA/100 mL, medidos pelos métodos ABTS e DPPH, respectivamente.
Palavras chave: Tecnologia de alimentos; Indústria de corantes alimentares; Extrato de antocianina; Mirtilo; Antioxidantes.
I. Introducción
Los compuestos fenólicos están presentes en frutas, vegetales y granos. Estudios epidemiológicos han sugerido que estos compuestos, entre los que se encuentran las antocianinas, podrían tener un efecto protector contra muchas enfermedades degenerativas (Cacace y Mazza, 2003) al proporcionar al cuerpo una protección antioxidante. Dietas ricas en antioxidantes están asociadas con un menor riesgo de padecer patologías cardiovasculares, neurodegenerativas, cáncer e incluso el envejecimiento, todas ellas vinculadas al estrés oxidativo (López-Alarcón y Denicola, 2013).
Se denomina antioxidante a "cualquier sustancia que retarda, previene o elimina el daño oxidativo hacia una molécula" o bien, "a la capacidad que tienen determinados compuestos para neutralizar los radicales libres" (López-Alarcón y Denicola, 2013). En este sentido, se ha observado que los arándanos, comparados con otras frutas y vegetales, tienen una alta capacidad antioxidante (Kalt et al., 2000) debido particularmente a sus altas concentraciones de antocianinas y compuestos fenólicos (Jin et al., 2011). Las antocianinas son glucósidos de antocianidinas conformadas por dos anillos aromáticos, A y B, unidos por una cadena de tres átomos de carbono. Variaciones estructurales del anillo B producen las seis antocianidinas conocidas (Figura 1) (Garzón, 2008).
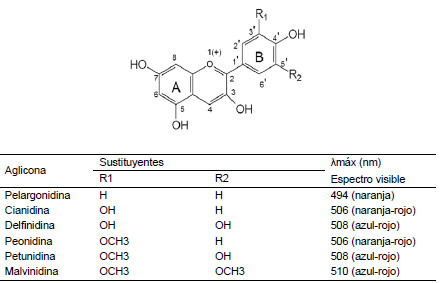
Figura 1. Estructura básica y sustituyentes de las antocianinas.
Las antocianinas se caracterizan por tener una deficiencia de electrones debido a su particular estructura química, que las hace muy reactivas frente a los radicales libres presentes en el cuerpo. Por consiguiente, pueden ser potentes antioxidantes naturales (Bridgers et al., 2010). Las propiedades atribuidas a las antocianinas para mejorar la salud están asociadas a esta capacidad de actuar como antioxidantes y secuestrar radicales libres en sistemas biológicos (Trappey et al., 2005; Garzón, 2008). Pueden donar hidrógenos (Miller y Rice-Evans, 1997; Wang, 1997) o electrones a los radicales libres o bien atraparlos y desplazarlos en su estructura aromática (Ramirez-Tortosa, 2001). Se ha demostrado que frutos ricos en antocianinas evidencian una alta actividad antioxidante contra el peróxido de hidrógeno (H2O2) y contra radicales peróxido, (ROO•), superóxido (O2•), hidroxilo (-OH) y oxígeno singulete (1O2) (Garzón, 2008).
Pero el interés en los pigmentos de antocianina también se ha incrementado por su color, ya que se podrían utilizar como colorantes naturales (Bridgers et al., 2010). Las antocianinas son responsables del color atractivo de muchas frutas y verduras (Zozio et al., 2011). Su intenso color rojo-púrpura es una fuente atractiva de colorante de alimentos naturales para la industria alimentaria y textil, constituyendo una alternativa a los colorantes alimentarios sintéticos (Bridgers et al., 2010). El estudio y el uso de colorantes naturales ha adquirido relevancia en los últimos años debido a que organizaciones internacionales, como la Organización Mundial de la Salud (OMS), han cuestionado el uso de colorantes sintéticos por estar vinculados con el desarrollo de enfermedades degenerativas como algunos tipos de cáncer (Gamarra et al., 2009).
Las antocianinas se pueden extraer de diferentes tejidos vegetales (Pereira-Kechinski et al., 2010; Garzón, 2008). A nivel comercial, las antocianinas se obtienen principalmente de los subproductos industriales de la uva. En la actualidad existe la tendencia de utilizar los extractos antociánicos sin necesidad de realizar la separación de los distintos componentes, debido a que todos ellos, presentan propiedades antioxidantes (von Elbe y Steven, 2000).
En relación a la extracción, el método usual de extracción es la extracción sólido-líquido. El carácter polar de la molécula de antocianina permite su solubilidad en variados solventes, tales como alcoholes, acetona y agua. Su estabilidad es afectada fácilmente por modificaciones estructurales con grupos hidroxilo, metoxilo, glucósidos y grupos acilos, además de factores como la temperatura y la luz (Pereira-Kechinski et al., 2010; Garzón, 2008).
El método de extracción debe ser el más adecuado para cada aplicación concreta. Las condiciones de extracción, tales como relación sólido-líquido, temperatura, tiempo, tipo de disolvente y concentración de disolvente influyen en la estabilidad de las antocianinas, así como también en la concentración de antocianinas extraídas (Bridgers et al., 2010). Así, se debe maximizar la recuperación de pigmentos, minimizar los compuestos adjuntos extraídos y limitar la degradación o alteración del estado natural del extracto. El conocimiento de los factores involucrados en su estabilidad y de los mecanismos de degradación es sumamente vital para una eficiente extracción, purificación y uso de las antocianinas como colorantes de alimentos.
En este sentido, Gorriti-Gutierrez et al. (2009a) estudiaron las mejores condiciones de extracción de antocianinas a partir de corontas de maíz morado. Ensayaron extracciones con soluciones etanólicas al 20 % y pH 2 acondicionadas según un diseño factorial con los factores temperatura y tiempo de extracción. Los resultados obtenidos indicaron que las mejores condiciones de extracción correspondieron a una temperatura de 75 °C y un tiempo de extracción de entre 120 y 240 minutos, mientras que las condiciones más desfavorables fueron 25 °C y 30 minutos. También se ha estudiado la influencia de otras variables de proceso como el tipo de solvente de extracción y el pH. Así, Gorriti-Gutierrez et al. (2009b) concluyeron que la extracción se ve favorecida por la utilización de un medio etanólico al 20% como agente de extracción y un pH entre 2 y 4.
Cacace y Mazza (2003) publicaron un trabajo que consistió en la optimización de la extracción de antocianinas y compuestos fenólicos de grosellas negras usando etanol acuoso como solvente de extracción. Las variables independientes seleccionadas por estos investigadores fueron: concentración de etanol, temperatura y relación solvente-sólido. Dos de las respuestas evaluadas fueron la concentración de polifenoles totales y la concentración de antocianinas. Los resultados obtenidos mostraron que la mejor extracción fue para una concentración de etanol de 60%, relación solvente-sólido 19L:1kg de frutos y temperatura de 30 °C. La elevación de la temperatura de extracción no afectó la extracción de fenoles pero provocó una disminución en el rendimiento de extracción de antocianinas, debido a la degradación de las mismas. Estos autores identificaron la existencia de una temperatura crítica a partir de la cual la degradación fue mayor. Esta temperatura aumentó con la concentración de etanol. Así, para una concentración de etanol de 20%, la temperatura crítica fue 25 °C, mientras que para una concentración de etanol de 95%, la temperatura crítica fue 35 °C. En general, obtuvieron una fuerte disminución en la concentración de las antocianinas extraídas a temperaturas superiores a 45 °C.
También Fan et al. (2008) investigaron sobre las condiciones de extracción de antocianinas presentes en batata morada. Trabajaron con las variables: temperatura de extracción (40-80 °C), tiempo (60-120 min) y relación sólido-líquido (1:15-1:30) y como respuesta evaluaron el rendimiento de extracción de antocianinas. La temperatura de extracción y la relación sólido-líquido influyeron en el rendimiento de extracción, mientras que el tiempo no tuvo efecto significativo. Estos autores obtuvieron que la mejor combinación de las variables fue: temperatura de 80 °C, relación sólido-líquido 1:32 y tiempo de extracción 60 minutos.
El objetivo de nuestro estudio fue determinar la influencia de variables del proceso de extracción sólido-líquido de antocianinas a partir de arándanos, establecer valores de esas variables que maximicen su recuperación y caracterizar el extracto de antocianinas obtenido.
II. Materiales y Métodos
II.1. Materia prima
Este estudio se realizó con arándanos de la variedad O´Neal procedentes de la Provincia de Entre Ríos (Argentina). Esta variedad es la de de mayor producción en la zona y es una de las que tiene mayores problemas de comercialización en fresco debido la rápida pérdida de firmeza y la elevada proliferación de microorganismos patógenos después de la recolección. Por otra parte, es una de las que presenta una mayor concentración de antocianinas totales (Zapata et al., 2010) con lo que posee un gran potencial para la obtención de extractos ricos en este componente.
Los arándanos utilizados en el presente estudio, que fueron proporcionados por productores de la Provincia de Entre Ríos, no cumplieron con el estándar de tamaño para su comercialización en fresco (Resolución SAGPyA Nº 201/2007), por lo que estarían dentro de lo que se considera descarte.
Para reducir el deterioro postcosecha, los frutos, inmediatamente después de ser recolectados, se colocaron en bandejas de polietilentereftalato del tipo clamshells. Después se almacenaron a 3±0.5 °C hasta ser transportados al laboratorio donde se introdujeron en una cámara de refrigeración (0±0.5 °C) hasta el momento de utilizarlos en las diferentes experiencias planificadas. El tiempo transcurrido entre el momento de la recolección y la realización de las experiencias no superó una semana, por lo que los frutos utilizados conservaron adecuadamente sus características.
II.2. Obtención de los extractos de antocianina
La Figura 2 esquematiza la metodología de trabajo. Durante el proceso de obtención de extracto de antocianinas se tomaron muestras (TM) para realizar las determinaciones analíticas señaladas en la figura. Inicialmente, en los arándanos utilizados como materia prima se cuantificaron antocianinas totales, perfil de antocianinas, composición mineral, sólidos solubles y pH (apartado II.4).
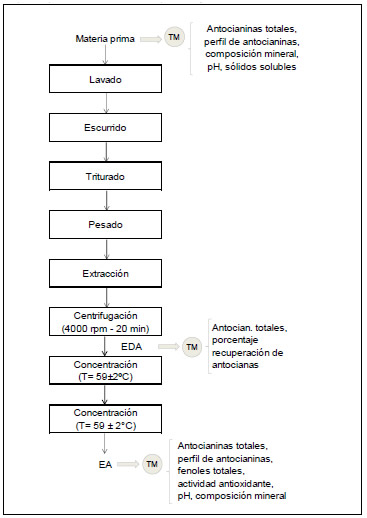
Figura 2. Esquema del proceso de obtención de extracto de antocianinas de arándanos
A continuación los frutos se lavaron en bandejas bajo un chorro de agua potable, se escurrieron realizando suaves movimientos del recipiente y se trituraron con una miniprocesadora de mano (modelo MR 400 Plus, Braun, España). Posteriormente, los arándanos triturados se pesaron en una balanza (Moretti, Serie NJW, Argentina) de 1500 g + 0.05 g de capacidad y se realizó la extracción sólido-líquido de antocianinas (ESLA) según dos diseños experimentales (apartado II.3). La mezcla se centrifugó (centrífuga ALRESA, modelo Digicen, Álvarez Redondo S.A., España) a 4000 rpm durante 20 minutos, con lo que se obtuvieron dos fases, el sobrenadante y el residuo. El residuo se desechó y en el sobrenadante, denominado extracto diluido de antocianinas (EDA), se cuantificaron las antocianinas totales y el rendimiento de extracción de antocianinas totales (RAT) (apartado II.4).
A partir de los datos experimentales obtenidos en los diferentes ensayos, se determinaron los valores de las variables de proceso que permitieron obtener un mayor RAT (apartado II.5).
Posteriormente, el EDA obtenido en las mejores condiciones de extracción (mayor RAT), fue concentrado en rotavapor (Yamato, modelo RE-46, Japón) a 59±2 ºC hasta reducir 6 veces su volumen. A continuación, para intentar conseguir un extracto de calidad comercial, se realizó una segunda concentración también en rotavapor y a la misma temperatura. El producto obtenido se denominó extracto de antocianinas (EA). Esta concentración adicional podría tener un efecto de estabilización, dado que cuando la concentración de antocianinas alcanza valores altos, se presentan fenómenos de autoasociación entre dos cationes flavilio, dos formas hemicetal, dos bases quinoidales, e inclusive, entre una base quinoidal y un catión flavilio, protegiendo la molécula de antocianina (Garzón, 2008).
El EA se caracterizó mediante las determinaciones analíticas de antocianinas totales, perfil de antocianinas, fenoles totales, capacidad antioxidante, composición mineral y pH (apartado II.4).
II.3. Extracción sólido-líquido de antocianinas
La ESLA se realizó en dos series de experiencias (apartados II.3.1 y II.3.2). La primera, en la que se estudiaron las variables temperatura, tiempo y pH, y una segunda en la que, a partir de los resultados obtenidos en la primera, se estudió la proporción materia prima/solvente y el tiempo de extracción. Para cada una de ellas, se empleó un diseño de superficie de respuesta compuesto central: 23+principal, rotable y aleatorio. Como respuesta del diseño experimental, se tomó el rendimiento de extracción de antocianinas totales
de arándanos (RAT). La metodología superficie de respuesta (MRS) permitió obtener los valores de los factores que maximizaron el RAT.
La formulación de los diseños experimentales se realizó con la ayuda del software STATGRAPHICS Centurión XV.
II.3.1. Primera serie de experiencias de extracción sólido-líquido de antocianinas
En la primera serie de experiencias de ESLA, se utilizó como solvente una solución de etanol-agua (50:50 v/v). La relación materia prima / solvente de extracción fue de 1:3. Las variables de proceso estudiadas y los niveles de trabajo de las mismas fueron: temperatura (3, 20, 45, 70 y 87 °C), pH (1.8, 2.5, 3.5, 4.5 y 5.2) y tiempo de extracción (1.0, 2.0, 3.5, 5.0 y 6.0 h). El diseño experimental arrojó un total de 34 experiencias en las que se combinaron las variables estudiadas.
II.3.2. Segunda serie de experiencias de extracción sólido-líquido de antocianinas
En la segunda tanda de experiencias de ESLA, se usó como solvente de extracción etanol acidificado con ácido cítrico al 1 % ya que el gran contenido de agua que de manera natural tienen los arándanos (85-90 %) produce un efecto de dilución en el extracto obtenido que dificulta su posterior concentración. Además, el agua puede reaccionar como nucleófilo con el catión flavilio en el C-2 formando la base carbinol incolora, lo que constituye una degradación de las antocianinas (Garzón, 2008) y, en consecuencia, un deterioro de su atributo como colorante y antioxidante. Si bien el etanol por tener, al igual que el agua, dos pares de electrones de no enlace podría actuar como nucleófilo, este presenta mayor impedimento estérico para atacar al C-2 del catión flavilio, lo que estaría disminuyendo la efectividad de los ataques.
La temperatura de trabajo fue de 36±1 ºC y el pH de 3.5, valores que en la primera serie de experiencias de ESLA posibilitaron la obtención de RAT más elevados.
El diseño experimental consistió en un total de 22 experiencias de extracción en las que se combinaron las variables siguientes a los niveles especificados: tiempo de extracción (0.5, 2.0 y 3.5 h) y proporción de materia prima / solvente (MP/S) (1:0.4, 1:2.5 y 1:4.6).
II.4. Determinaciones analíticas
II.4.1. Sólidos solubles
El contenido de sólidos solubles se determinó mediante el método refractométrico (AOAC, 1990), utilizando un refractómetro termo-compensable (Atago, modelo DTM-1, Japón). Los resultados se expresaron en ºBrix.
II.4.2. pH
La determinación del pH se realizó mediante un pHmetro (Crison, modelo GLP 22, España).
II.4.3. Antocianinas totales
La concentración de antocianina monomérica se determinó por el método de pH-diferencial (Giusti y Wrolstad, 2001). Para ello, una alícuota de extracto de antocianina se mezcló con tampón a pH 1.0 de cloruro de potasio 0.025 M (ajustado con ácido clorhídrico) y otra con tampón a pH 4.5 de acetato de sodio 0.4 M (ajustado con ácido acético). La diferencia en la absorbancia a la longitud de onda de máxima absorción (510 nm) es proporcional al contenido de antocianinas (Wrolstad, 1993). Posteriormente y con el propósito de efectuar la corrección de la medida debida a la presencia de compuestos degradados o sustancias interferentes, se midió la absorbancia a 700 nm. Las mediciones se realizaron con un espectrofotómetro (Shimadzu UV-VISIBLE, modelo UV-1603, Japón), contra un blanco de agua ultra pura. La concentración de las antocianinas se expresó como mg cianidina-3-glucósido/100mL de extracto de acuerdo a la expresión siguiente (Wrolstad et al., 2005) (Ecuaciones 1 y 2):
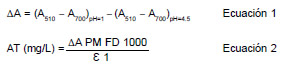
Dónde:
AT: Antocianinas totales
ΔA: Cambio en la absorbancia
PM: Masa molecular para cianidina-3-glucósido, 449.2 g/mol
FD: Factor de dilución
Ɛ: Coeficiente de extinción molar para cianidina-3-glucósido, 26900
l: Longitud de paso de celda, 1cm
1000: factor de conversión de gramos a miligramos
Para la determinación del contenido de antocianinas en los extractos, EDA y EA, se empleó el mismo procedimiento pero variando la dilución. Se tomó una alícuota de extracto y se mezcló con 10 mL de tampón, de forma que la absorbancia de la mezcla a pH 1 y a 510 nm fuera inferior a 1.0.
La determinación de antocianinas en los frutos frescos de arándanos se realizó a partir de 50 g de bayas trituradas con una miniprocesadora de mano (Braun, modelo MR 400 Plus, España). Posteriormente, en 1 g del triturado (balanza analítica Sartorius, modelo BP221S, Alemania) se efectuó una extracción con metanol acidificado con ácido clorhídrico al 1% en tres etapas, manteniendo una relación en peso de muestra-solvente 1:10. Los sobrenadantes metanólicos obtenidos en cada una de las tres etapas se mezclaron y se realizó una centrifugación a 4000 rpm durante 20 minutos (ALRESA, modelo Digicen, Álvarez Redondo S.A., España). A continuación, se mezcló una alícuota del sobrenadante con tampón a pH 1.0 y otra alícuota con tampón a pH 4.5 y se midió la absorbancia a 510 y 700 nm. La concentración se expresó como mg de cianidina-3-glucósido/100 g de arándano.
II.4.4. Perfil de antocianinas
En los arándanos utilizados como materia prima y en el EA también se realizó una determinación del perfil de antocianinas. Para ello, se realizó una extracción de antocianinas de arándanos con metanol acidificado con ácido clorhídrico. Realizada una centrifugación, el sobrenadante se purificó haciéndolo pasar por un cartucho C18, limpiado previamente con 1.5 mL de agua ultra pura. Las antocianinas retenidas en el cartucho fueron eluidas con metanol conteniendo 0.01% de ácido clorhídrico. De igual forma, se purificó el EA. La determinación de antocianinas presentes en las muestras se realizó en cromatógrafo Hewlett-Packard 1100 detector con matriz de diodos a 518 nm. La separación de las antocianinas se llevó a cabo usando una columna C18 (150 x 4.6 mm diámetro interno, tamaño de partícula 5 μm). Las condiciones cromatográficas fueron: flujo 0.5 mL/min, volumen de inyección 50 μL, temperatura 35 °C, y disolventes 0.1% de ácido trifluoroacético (A) y acetonitrilo (B), grado HPLC.
II.4.5. Fenoles totales
El método utilizado consiste en la reducción del reactivo de Folin-Ciocalteu (Min-Sheng y Silva, 2006). Para cuantificar los fenoles totales en el EA se mezclaron 50 μL de éste con 50 μL de reactivo de Folin-Ciocalteu. A continuación se añadieron 100 μL de una solución de carbonato de sodio al 20% y 800 μL de agua ultra pura. La mezcla se agitó durante 30 segundos a 1600 rpm y se incubó a temperatura ambiente (25±1 °C) durante 30 minutos en la oscuridad. Después, se midió la absorbancia a 760 nm en espectrofotómetro (Shimadzu, UV-VISIBLE, modelo UV-1603, Japón). La medición se realizó contra un blanco de 850 μL de agua ultra pura, 100 μL de solución de carbonato de sodio al 20% y 50 μL de Reactivo de Folin-Ciocalteu. Los resultados se expresaron como mg equivalente de ácido gálico (GAE)/100 mL de extracto.
Para la cuantificación de fenoles totales en los arándanos frescos se procedió de la misma forma que la descrita pero partiendo del extracto metanólico obtenido según se describió apartado II.4.3. Los resultados se expresaron como mg equivalente de ácido gálico (GAE)/100 g de arándano.
II.4.6. Actividad antioxidante
La actividad antioxidante del EA se determinó por dos métodos: ABTS y DPPH. En ambos casos, se utilizó ácido L-ascórbico como antioxidante de referencia y los resultados se expresaron como mg de equivalente de ácido ascórbico (EAA)/100 mL de extracto.
II.4.6.1. Método ABTS
El radical ABTS•+ fue generado mezclando una solución de ABTS de 3.5 mM con solución de persulfato de potasio de concentración 125 mM e incubando en la oscuridad durante 12 h. Una vez formado el radical ABTS•+ se diluyó con tampón fosfato a pH 7.4 hasta obtener un valor de absorbancia de 0.70 a 734 nm (Re et al., 1999). Para medir la capacidad antioxidante del EA se mezcló 40 μL de éstos con 960 μL de solución diluida de radical ABTS•+, se agitó durante 30 segundos a 1600 rpm e incubó a temperatura ambiente (25±1 °C) y en oscuridad durante 20 minutos. Luego se midió la absorbancia a 734 nm en espectrofotómetro (Shimadzu, UV-VISIBLE, modelo UV-1603, Japón). Además, se preparó un control mezclando 40 μL de agua ultra pura con 960 μL de solución diluida de radical ABTS•+ y se procedió como los extractos.
II.4.6.2. Método DPPH
Inicialmente, se preparó una solución madre del radical DPPH• de concentración 200 mg/L. Para las determinaciones analíticas se realizó una dilución 1/10 de esa solución madre con metanol (Brand-Williams et al., 1995). Para medir la capacidad antioxidante del EA se mezcló 10 μL de éste con 990 μL de solución diluida de radical DPPH•, se agitó durante 30 segundos a 1600 rpm e incubó a temperatura ambiente (25±1 °C) y en oscuridad durante 30 minutos. Luego se midió la absorbancia a 517 nm en espectrofotómetro (Shimadzu, UV-VISIBLE, modelo UV-1603, Japón). Además se preparó un control mezclando 10 μL de agua ultra pura con 990 μL de solución diluida de radical DPPH• y se procedió como los extractos. Con estos datos se calculó el cambio de absorbancia (absorbancia del control menos absorbancia del EA) a los 30 minutos de iniciada la reacción entre el radical y los antioxidantes presentes en el extracto.
La cuantificación de actividad antioxidante en los arándanos frescos se realizó con el extracto metanólico obtenido según se describió apartado II.4.3. Los resultados se expresaron como mg de equivalente de ácido ascórbico (EAA)/100 g de arándano.
II.4.7. Rendimiento de extracción de antocianinas
El rendimiento de extracción de antocianinas se calculó mediante la Ecuación 3:
![]()
Donde:
RAT: Rendimiento de extracción de antocianinas totales (%)
MEDA: Masa del extracto (g)
ATEDA: Concentración de antocianinas totales en el EDA (mg cianidina-3-glucósido/100g EDA)
Ma: Masa de arándanos (g)
ATa: Concentración de antocianinas totales en los arándanos (mg cianidina-3-glucósido/100g de arándano)
II.4.8. Composición mineral
En las bayas frescas de arándanos y en el EA se cuantificaron los siguientes minerales a las longitudes de onda señaladas: calcio (422.7 nm), hierro (248.3 nm), magnesio (285.2 nm), potasio (766.5 nm), sodio (589.0 nm) y zinc (213.9 nm). La cuantificación se realizó por espectroscopía de absorción atómica (Shimadzu Corporation, 2000), utilizando un espectrofotómetro de absorción atómica (Shimadzu, modelo 6500, Japón) con horno de grafito y automuestreador. Dado que las muestras pueden contener partículas o material orgánico que interfieren en el análisis espectroscópico, tanto en las bayas como el EA, se realizó un pretratamiento que consistió en la degradación de la materia orgánica que pudiera estar presente. Para ello se pesaron 0.5 g de muestra en una balanza analítica (Sartorius, Italia), se agregaron 10 mL de ácido nítrico 70% y se llevó a cabo una digestión en un equipo de reacción acelerado por microondas (MARS 5 de CEM, Japón). La muestra se inyectó en el espectrofotómetro para la cuantificación de los minerales. Los resultados se expresaron en mg/100g.
II.5. Análisis estadístico
La obtención de la mejor combinación de niveles de los factores que dieron por resultado el nivel más elevado de RAT se realizó utilizando un método gráfico de superficie de respuesta (Cacace y Mazza, 2003; Fan et al., 2008), aplicado a diseño central compuesto con software STATGRAPHICS Centurión XV.
III. Resultados y discusión
III.1. Primera serie de experiencias de extracción sólido-líquido
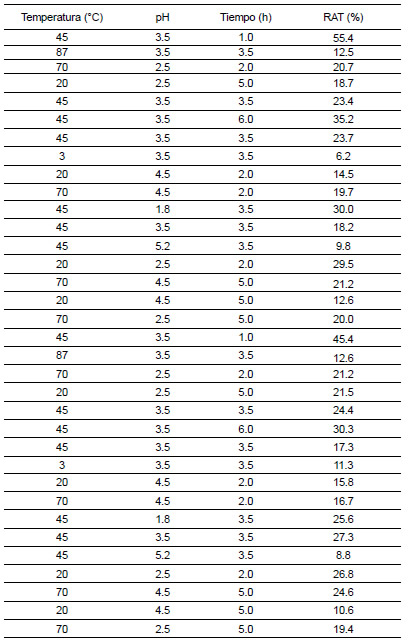
En la primera serie de experiencias de ESLA se estudió la influencia de las variables temperatura de extracción, pH y tiempo de extracción en el RAT. Los datos experimentales obtenidos para las distintas combinaciones de condiciones ensayadas se muestran en la Tabla 1. A partir de los mismos, se calculó una superficie de respuesta que se muestra en la Ecuación 4.
Tabla 1. RAT obtenido de la combinación de las distintas condiciones ensayadas en la primera serie de experiencias de ESLA
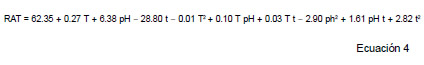
Donde:
T: temperatura (ºC)
t: tiempo de extracción (h)
El estadístico R2 ajustado (coeficiente de determinación) indicó que el modelo explicó el 97% de la variabilidad del RAT. Con la metodología superficie de respuesta (MSR) se obtuvieron los niveles de los factores experimentales estudiados (T, t y pH) que maximizaron el RAT. La combinación de los factores ensayados que se identificó como más adecuada fue una temperatura de 36.6 °C, un pH de 2.12 y un tiempo de extracción de 1.0 h y, en estas condiciones, se logró extraer el 51% de las antocianinas presentes en los arándanos.
A partir de la ecuación 4, se analizó la influencia de las variables de proceso estudiadas en el RAT. Para ello, se elaboraron diferentes gráficos de superficie de respuesta. Dado que se trabajó con tres factores (temperatura, pH y tiempo de extracción) y una variable de respuesta (RAT), los gráficos se obtuvieron manteniendo uno de los factores constantes en el nivel correspondiente al máximo RAT identificado en la optimización y variando los otros dos. Así, la Figura 3 muestra las estimaciones de RAT para un tiempo de extracción constante de 1h y variando temperatura y pH. Como se puede observar, a temperatura constante, el aumento del pH provocó una disminución en el RAT, mientras que a pH constante, el incremento de la temperatura provocó un aumento del RAT hasta alcanzar un máximo para luego disminuir. Las mejores condiciones de extracción estuvieron comprendidas en el rango de temperatura de 26 a 50 °C y de pH entre 1.8 y 2.6.
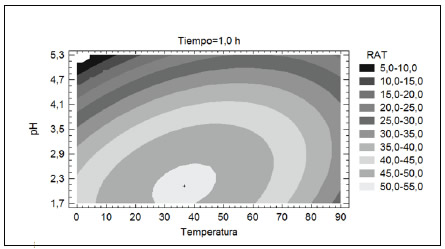
Figura 3. Contornos de la superficie del RAT estimado en función de la temperatura y el pH (tiempo de extracción=1.0h) en la primera serie de experiencias de ESLA
La Figura 4 muestra las estimaciones de RAT para una temperatura constante de 36.6 °C y pH y tiempo de extracción variables. Se puede observar que, en los rangos de temperatura y pH estudiados, el RAT fue mayor cuanto menor fue el tiempo de extracción. Esto puede deberse a que, para el mínimo tiempo de extracción contemplado (1 h) se alcanzó el equilibrio entre la fase sólida y la fase líquida (Ibarz y Barbosa-Cánovas, 2005). Por otra parte, para un determinado tiempo de extracción, el RAT se mantuvo prácticamente constante con el aumento del pH hasta valores de 3.5 para luego disminuir. Probablemente, la disminución del RAT con el incremento del pH se deba a la degradación del catión flavilio al elevar el pH, ya que éste es deficiente en electrones y por lo tanto muy reactivo. Esta reacción daría lugar a la formación de hemiacetal y chalcona, también inestables (Badui-Dergal, 2006; Garzón, 2008).
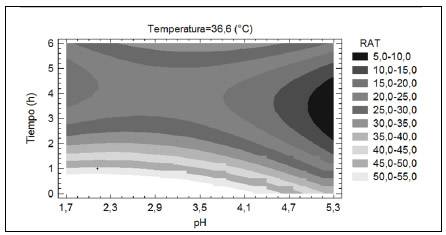
Figura 4. Contornos de la superficie del RAT estimado en función del pH y el tiempo de extracción (temperatura=36.6°C) en la primera serie de experiencias de ESLA
Por último, la Figura 5 muestra las estimaciones de RAT para un pH constante de 2.12 en función de la temperatura y tiempo de extracción. Nuevamente se observa que el mejor rendimiento se logró cuanto menor fue el tiempo de extracción (1.0 h) lo que indicaría, como se ha comentado anteriormente, que en este tiempo se alcanzaría el equilibrio entre las fases sólida y líquida. También se advierte que para un tiempo constante, el RAT fue mayor al aumentar la temperatura hasta valores de aproximadamente 50 °C. Por encima de esta temperatura, se observó una disminución del RAT. Este comportamiento puede deberse a que, hasta 50 °C, la extracción se favorecería por la elevación de la temperatura al aumentar la solubilidad de los antocianos y el coeficiente de difusión (Cacace y Mazza, 2003). Sin embargo, por encima de esa temperatura, las antocianinas extraídas se podrían degradar por efecto del calor probablemente debido a la pérdida del azúcar glicosilante en la posición 3 de la molécula y apertura de anillo, con la consecuente producción de chalconas incoloras (von Elbe y Steven, 2000).
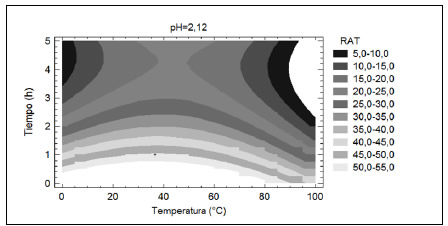
Figura 5. Contornos de la superficie del RAT estimado en función de la temperatura y el tiempo de extracción (pH=2.12) en la primera serie de experiencias de ESLA
En la optimización de la extracción de antocianinas de grosellas negras y utilizando como solvente de extracción etanol al 85%, Cacace y Mazza (2003) obtuvieron la máxima recuperación entre los 30 y 35 °C, valores estos muy similares a los obtenidos en el presente estudio. Por su parte, en la optimización de las condiciones de extracción de antocianinas de batata morada, Fan et al. (2008) lograron la mejor extracción a 80 °C; mientras que Gorriti-Gutierrez et al. (2009a y 2009b) al estudiar la extracción de antocianinas a partir de maíz morado obtuvieron que la mejor temperatura de extracción fue 75 °C. Estos valores fueron muy superiores al obtenido en la presente investigación. Sin embargo, este último autor, obtuvo la mejor extracción de antocianinas de maíz morado a pH comprendido entre 2 y 4, resultado similar al obtenido en el presente trabajo.
En cuanto al factor tiempo de extracción, Fan et al. (2008) encontraron que la extracción de antocianinas de batata morada tuvo lugar con 60 min de extracción. Por su parte, Gorriti-Gutierrez et al. (2009a y 2009b) consiguieron mayores rendimientos de extracción de antocianinas de maíz morado a tiempos de 120 y 240 min.
III.2. Segunda serie de experiencias de ESLA
La segunda serie de ESLA se realizó utilizando etanol acidificado con ácido cítrico al 1% como solvente de extracción. La temperatura de extracción utilizada fue de 36±1 °C por ser ésta la temperatura que posibilitó obtener el mejor RAT en la primera serie de ESLA. En cuanto al pH, en estas experiencias fue de 3.5 y no 2.12 que sería el valor óptimo identificado en la serie ESLA anterior. Como se puede observar en la Figura 4, el RAT se mantuvo prácticamente constante hasta pH 3.5. La diferencia de trabajar a pH de 3.5, en lugar de 2.12, implica un consumo de aproximadamente 70 g de ácido cítrico más por cada 100 g de materia prima. Esto, a nivel industrial aumentaría sensiblemente el costo de producción. Además, la concentración posterior del EDA hace que el pH disminuya aproximadamente en una unidad. Un pH excesivamente bajo dificultaría su incorporación a ciertos alimentos.
En cuanto a las variables estudiadas, éstas fueron el tiempo de extracción y la MP/S y su influencia en el RAT. En la Tabla 2 figuran los datos experimentales obtenidos para las distintas combinaciones de condiciones ensayadas.
Tabla 2. RAT obtenido de la combinación de las distintas condiciones ensayadas en la segunda serie de experiencias de ESLA
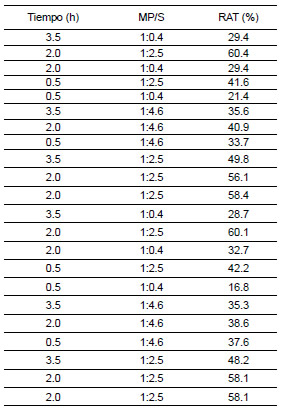
De igual forma que en la primera serie de ESLA, se calculó una superficie de respuesta (ecuación 5) y se obtuvieron los niveles de los factores experimentales que maximizaron el RAT. En este caso, el resultado fue un tiempo de extracción de 2 h 12 min y una relación MP/S de 1:2.8 kg/kg. En estas condiciones se extrajo el 57% de las antocianinas presentes en los arándanos.
![]()
Donde:
PS: proporción de solvente utilizado para 1 parte de MP
El coeficiente de determinación ajustado, R2, fue de 99%, por lo que la calidad del ajuste fue muy satisfactoria. En la Figura 6, se muestra la estimación del RAT en función del tiempo de extracción y de la MP/S. Se puede observar que, en los rangos estudiados, las mejores condiciones de extracción correspondieron a un tiempo de extracción comprendido entre 1.6 - 2.9 h y una proporción MP/S dentro del rango 1:2.2 - 1:3.4 kg/kg. También se puede observar que para un tiempo de extracción constante, el RAT se incrementó al aumentar la MP/S hasta valores de 1:3.4 kg/kg para disminuir después. De la misma forma, para una determinada relación MP/S, el RAT se elevó a medida que aumentó el tiempo de extracción hasta valores de 2.9 h (2 h 54 min), mientras que para tiempos mayores de extracción el RAT fue menor.
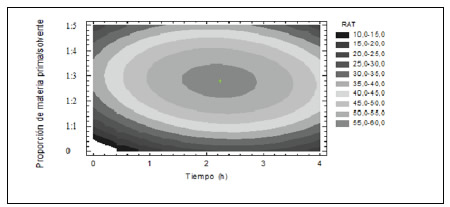
Figura 6. Contornos de la superficie del RAT estimado en función del tiempo de extracción y la proporción de materia prima / solvente en la segunda serie de experiencias de ESLA
Los tiempos de extracción que proporcionaron el RAT más elevado en las dos series de ESLA fueron diferentes, 1.0 h en la primera y 2 h 12 min en la segunda. Estos resultados muestran la importancia de prestar atención a los factores que pudieren influir en el proceso de extracción, puesto que la modificación de alguno de ellos podría afectar el rendimiento de extracción.
Por lo tanto, a partir de estos resultados, se consideró que la metodología de trabajo más adecuada para la extracción de antocianinas de arándanos se podría realizar utilizando etanol acidificado con ácido cítrico al 1% como solvente de extracción, una proporción materia prima / solvente de extracción: 1:3 kg/kg, una temperatura de extracción: 36±1 °C y un tiempo de extracción: 2 h.
III.3. Caracterización del EA
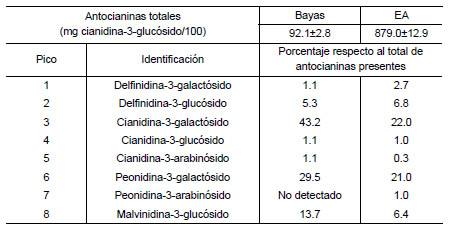
A continuación, y aplicando las condiciones anteriores, se obtuvo un extracto (EDA) que fue concentrado (EA) según se describió en la metodología. Para su caracterización, se determinaron parámetros como el contenido de antocianinas totales, el perfil de antocianinas, contenido de polifenoles totales, actividad antioxidante y composición mineral. Así, la concentración de antocianinas totales en el EA fue de 879.0±12.9 mg cianidina-3-glucósido/100 mL, mientras que en los arándanos frescos fue de 92.1±2.8 mg cianidina-3-glucósido/100 g (Tabla 3). Del total de antocianinas extraídas, las antocianinas predominantes fueron cianidina-3-galactósido, peonidina-3-galactósido y malvinidina-3-glucósido.
Tabla 3. Concentración de antocianinas totales y de antocianinas individuales identificadas en el EA y en bayas de arándanos
En las Figuras 7 y 8, se muestran los cromatogramas obtenidos en la fruta fresca y en el EA. Estos perfiles fueron bastante similares a los encontrados por You et al. (2011) para especies nativas del sudeste de EE.UU de arándanos Rabbiteye (Vaccinium virgitatum) de las variedades Powderblue y Climax. En este caso, las antocianinas predominantes fueron cianidina-3-galactósido, malvinidina-3-galactósido, petunidina-3-glucósido, malvinidina-3-glucósido y peonidina-3-galactósido dependiendo la proporción de cada una de ellas de la variedad y del tipo de cultivo, orgánico o convencional.
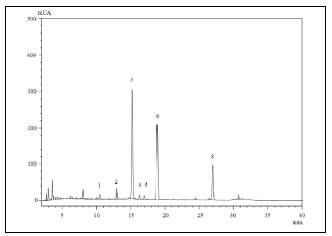
Figura 7. Perfil de antocianinas en arándanos frescos (La identificación de los picos se muestra en la Tabla 3)
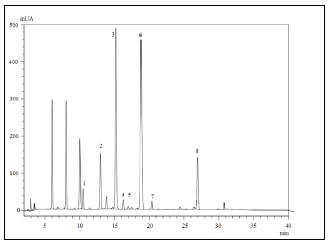
Figura 8. Perfil de antocianinas en el EA (La identificación de los picos se muestra en la TABLA 3)
Por otro lado, el contenido de polifenoles totales en el EA fue muy superior al contenido de antocianinas (Tabla 4), lo que estaría indicando la presencia de compuestos fenólicos distintos a los pigmentos antociánicos. Como era de esperar, la actividad antioxidante en el EA fue superior a la de los arándanos frescos, lo que constituye una ventaja, dado que los efectos terapéuticos de las antocianinas están relacionados con su actividad antioxidante (Aguilera-Ortíz et al., 2011). En la tabla se muestran los resultados de actividad antioxidante usando las metodologías de ABTS y DPPH. Con la primera se puede medir la actividad de compuestos de naturaleza hidrofílica y lipofílica, mientras que con el DPPH, solo los componentes que pueden disolverse en medio acuoso (Kuskoski, et al., 2005).
Tabla 4. Contenido de fenoles totales y actividad antioxidante en el EA y en bayas frescas de arándanos

(*1) Los fenoles totales en los arándanos se expresaron como mg GAE/100 g de fruto y en el EA como, mg GAE/100 mL de extracto.
(*2) La actividad antioxidante en los arándanos se expresó como mg EAA/100 g de fruto y en el EA como, mg EAA/100 mL de extracto.
Kuskoski et al (2005) evaluaron la capacidad antioxidante de pulpas de diversas frutas congeladas comercializados en el sur de Brasil y obtuvieron valores de 125.8±3.2 mg EAA/100 g para mora, 161.5±3.3 mg EAA/100 g para uva y 1198.9±8.1 mg EAA/100 g para acerola con el método ABTS y de 82.6±2.6, 105.9±0.4 y 959.1±19.0 mg EAA/100 g, respectivamente con la metodología DPPH. Estos autores también midieron contenido de fenoles totales en la pulpa de esas frutas, alcanzando concentraciones de 118.9±2.1 mg GAE/100 mg para pulpa de mora, 117.1±0.6 mg GAE/100 mg para pulpa de uva y 580.1±4.6 mg GAE/100 mg para pulpa de acerola. Los resultados publicados revelan que el EA no solo posee alta concentración de antocianinas totales, sino también de fenoles totales y elevada actividad antioxidante.
La complejación de las antocianinas con metales constituye una alternativa viable de estabilización del color, particularmente si los metales involucrados no implican un riesgo para la salud e incluso pueden representar una fuente de minerales esenciales en la dieta (Castañeda-Ovando et al., 2009). Por ello, se analizó el contenido de algunos minerales en las bayas de arándanos y en el EA. Concretamente se estudiaron: calcio, hierro, magnesio, potasio, sodio y zinc. Los resultados obtenidos (Tabla 5) mostraron que la concentración de calcio en el EA disminuyó un 35% respecto el contenido en las bayas, la del hierro, un 57% y la de magnesio, un 48%; mientras que la concentración de potasio aumentó en un 73%, la de sodio en un 96% y la de zinc en un 150%.
Tabla 5. Composición mineral del EA y de las bayas de arándanos
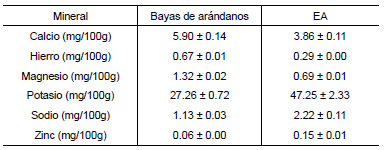
Aparentemente, algunas antocianinas y ciertos cationes metálicos, como aluminio, hierro, estaño y cobre, a concentraciones de 10 mg/L, formarían estos complejos (Boulton, 2001). En el caso del hierro, la concentración en el EA fue menor, por lo que posiblemente éste no contribuya en la estabilización del extracto. Castañeda-Ovando et al. (2009) observaron, para maíz criollo azul, la formación de los complejos metal-antocianina y estudiaron la estabilidad de estas últimas en presencia de dichos metales. Estos autores señalaron que la cianidina es capaz de complejarse con los metales que predominan en el pericarpio de maíz criollo azul, especialmente el calcio, debido a que es el que se encuentra en mayor concentración (1112.2 mg/kg peso seco). Teniendo en cuenta estos resultados, es probable que el calcio tampoco contribuya a la estabilización de las antocianinas presentes en el extracto debido que su contenido fue mucho menor.
Dado que la capacidad de complejación del potasio es mínima, el aumento de su concentración en el EA se desestima como posible agente estabilizador del color de las antocianinas (Castañeda-Ovando et al., 2009), aunque sí puede contribuir como fuente de mineral para la dieta.
Por lo tanto, la baja concentración de los minerales investigados en el EA haría suponer que estos no participan de forma significativa en la estabilidad de las antocianinas. Sin embargo, a partir de los resultados obtenidos, podría ser útil investigar en un futuro, la incorporación de algún metal al EA que contribuya a la estabilización.
IV. Conclusiones
En la extracción sólido-líquido de antocianinas de arándanos se observó que el rendimiento de extracción de antocianinas totales (RAT) fue mayor a valores más bajos de pH, mientras que las variables relación materia prima/solvente de extracción, temperatura y tiempo de extracción, presentaron un valor óptimo que proporcionó el máximo RAT: proporción materia prima/solvente 1:3 kg/kg, temperatura 36±1 °C y tiempo de extracción 2 h. En estas condiciones, el extracto obtenido fue concentrado en rotavapor, alcanzando una concentración de antocianinas totales de mucho mayor que la presente en las bayas frescas.
Entre las antocianidinas identificadas en el EA se destacaron cianidina-3-galactósido, malvinidina-3-galactósido, petunidina-3-glucósido, malvinidina-3-glucósido y peonidina-3-galactósido.
Referencias bibliográficas
1. AGUILERA-ORTÍZ, M., REZA-VARGAS, M.C., CHEW-MADINAVEITIA, R.G., MEZA-VELÁZQUEZ, J.A. (2011). Propiedades funcionales de las antocianinas, en: Revista de Ciencias Biológicas y de la Salud, XIII(2): 16-22. [ Links ]
2. AOAC. (1990). Official methods of analysis of the Association of Official Analytical Chemists. 15th ed. Washington, DC: Association of Official Analytical Chemists. [ Links ]
3. BADUI-DERGAL, S. (2006). Química de los alimentos. 4a ed. México: Pearson Educación. [ Links ]
4. BOULTON, R. (2001). The Copigmentation of Anthocyanins and Its Role in the Color of Red Wine: A Critical Review, en: Am. J. Enol. Vitic. 52(2): 67-87. [ Links ]
5. BRAND-WILLIAMS, W.; CUVELIER, M.E.; BERSET, C. (1995). Use of a free radical method to evaluate antioxidant activity, en: LWT- Food Science and Technology, 22(1): 25-30. [ Links ]
6. BRIDGERS, E.N.; CHINN, M.S.; TRUONG, V.D. (2010). Extraction of anthocyanins from industrial purple-fleshed sweetpotatoes and enzymatic hydrolysis of residues for fermentable sugars. Industrial, en: Crops and Products, 32 (3): 613-620. [ Links ]
7. CACACE, J.E.; MAZZA G. (2003). Optimization of extraction of anthocyanins from black currants with aqueous ethanol, en: Journal of Food Science 68(1): 240-248. [ Links ]
8. CASTAÑEDA-OVANDO, A.; GALÁN-VIDAL, C.A.; PACHECO-HERNÁNDEZ, M. DE L.; RODRÍGUEZ, J.A.; PÁEZ-HERNÁNDEZ, M.E. (2009). Evaluación del contenido de metales y su efecto en la estabilidad de antocianinas, en: Journal of Food, 7(3): 225-232. [ Links ]
9. FAN, G.; HAN, Y.; GU, Z.; CHE D. (2008). Optimizing conditions for anthocyanins extraction from purple sweet potato using response surface methodology (RSM), en: LWT-Food Science and Technology, 41(1):155-160. [ Links ]
10. FUENTES-MIRANDA, W.V. (2005). Extracción, cuantificación y estabilidad de colorantes naturales presentes en los frutos de Prunus capuli Cav. (Cereza), Rubus urticaefolius Poir. (Mora) y Sambucus canadensis L. (Saúco) como alternativas naturales de consumo de los colorantes artificiales rojo No.40, rojo No.3 y rojo No.2, en bebidas en el rango de pH: 3, 4 y 5. Tesis, Universidad de San Carlos de Guatemala. (Inédita ). [ Links ]
11. GAMARRA, F.M.; LEME, G.C.; TAMBOURGI, E.B.; BITTENCOURT, E. (2009). Extração de corantes de milho (Zea mays L.), en: Ciênc. Tecnol. Aliment. 29(1): 62-69. [ Links ]
12. GARZÓN, G.A. (2008). Las antocianinas como colorantes naturales y compuestos bioactivos: revisión, en: Acta biol. Colomb. 13(3): 27-36. [ Links ]
13. GIUSTI, M.M.; WROLSTAD, R.E. (2001). Anthocyanins: characterization and measurement with uv-visible spectroscopy. (F1.2:1-13). En: WROLSTAD, R.E. (ed). Current protocols in food analytical chemistry. New York [ Links ]
14. GORRITI-GUTIERREZ, A.; ARROYO-ACEVEDO, J.; NEGRON-BALLARTE, L.; JURADO-TEIXEIRA, B.; PURIZACA-LLAJARUNA, H.; SANTIAGO-AQUISE, I. et al. (2009a). Antocianinas, fenoles totales y actividad antioxidante de las corontas del maíz morado (Zea mays L.): Método de extracción, en: Boletín Latinoamericano y del Caribe de Plantas Medicinales y Aromáticas, 8(6): 509-518. [ Links ]
15. GORRITI-GUTIERREZ, A., FREDY-QUISPE, J., JORGE, L., ARROYO, A., AUGUSTA-CÓRDOVA, R., BERTHA-JURADO, T. et al. (2009b). Extracción de antocianinas de las corontas de Zea mays L. "Maíz morado", en: Ciencia e Investigación, 12(2): 64-74. [ Links ]
16. GUTIÉRREZ-PÚLIDO, H.; VARA-SALAZAR, H. (2008). Análisis y diseño de experimentos. 2a ed. México: McGraw-Hill. [ Links ]
17. IBARZ, A.; BARBOSA-CÁNOVAS, G.V. (2005). Operaciones unitarias en la ingeniería de alimentos. España: Mundi-Prensa. [ Links ]
18. JIN, P.; WANG, S.Y.; WANG, C.Y.; ZHENG, Y. (2011). Effect of cultural system and storage temperature on antioxidant capacity and phenolic compounds in strawberries, en: Food Chemistry, 124: 262-270. [ Links ]
19. KALT, W.; MCDONALD, J.E.; DONNER, H. (2000). Anthocyanins, phenolics, and antioxidant capacity of processed lowbush blueberry products, en: Food Chemistry and Toxicology, 65(3): 390-393. [ Links ]
20. KUSKOSKI, E.M.; ASUERO, A.G.; TRONCOSO, A.M.; MANCINI-FILHO, J.; FETT, R. (2005). Aplicación de diversos métodos químicos para determinar actividad antioxidante en pulpa de frutos, en: Ciên. Tecnol. Aliment., 25(4): 726-732. [ Links ]
21. LÓPEZ-ALARCÓN, C.; DENICOLA, A. (2013). Evaluating the antioxidant capacity of natural products: A review on chemical and cellular-based assays, en: Analytica Chimica Acta, 763(6): 1-10. [ Links ]
22. MILLER, N.J.; RICE-EVANS, C.A. (1997). The relative contributions of ascorbic acid and phenolic antioxidants to the total antioxidant activity of orange and apple jueces and blackcurrant drink, en: Food Chemistry, 60(3): 331-337. [ Links ]
23. MIN-SHENG, S., SILVA J.L. (2006). Antioxidant activity, anthocyanins, and phenolics of rabbiteye blueberry (Vaccinium ashei) by-products as affected by fermentation, en: Food Chemistry, 97(3): 447-451. [ Links ]
24. PEREIRA-KECHINSKI, C.; RAMOS-GUIMARAES, P.V.; ZAPATA-NOREÑA, C.P.; TESSARO, I.C.; FERREIRA-MARCZAK, L.D. (2010). Degradation kinetics of anthocyanin in blueberry juice during thermal treatment, en: Food Science, 75(2): 173-176. [ Links ]
25. RAMIREZ-TORTOSA, C.; ANDERSEN, O.M.; GARDNER, P.T.; MORRICE, P.C.; WOOD, S.G.; DUTHIE, S.J.; COLLINS, A.R.; DUTHIE, G.G. (2001). Anthocyanin-rich extract decreases indices of lipid peroxidation and DNA damage in vitamin E depleted rats, en: Free Radical Biology & Medicine, 31(9): 1033-1037. [ Links ]
26. RE, R.; PELLEGRINI, N.; PROTEGGENTE, A.; PANNALA, A.; YANG, M.; RICE-EVANS C. (1999). Antioxidant activity applying an improved ABTS radical cation decolorization assay, en: Free Radical Biology and Medicine, 26(9):1231-1237. [ Links ]
27. SAGPyA (Secretaría de Agricultura, Ganadería, Pesca y Alimentos). (2007). Protocolo de calidad para arándanos frescos (Resolución Nº 201. 23-08-2007). [ Links ]
28. SC (Shimadzu Corporation). (2000). Atomic Absorption Spectrometry Cookbook: Water Analysis. 430. Analytical Instruments Division, Kyoto Japan: G10: 1-32). [ Links ]
29. TRAPPEY, A.; BAWADI, H.A.; BANSODE, R.R.; LOSSO, J.N. (2005). Anthocyanin profile of mayhaw (Cretaegus opaca), en: Food Chemistry, 91(4): 665-671. [ Links ]
30. VON ELBE J.H.; STEVEN J. (2000). Colorantes. (pp.773-854). En: FENNEMA, O.R. Química de los Alimentos. Zaragoza: Acribia SA. [ Links ]
31. WANG, H.; CAO, G.; PRIOR, R.L. (1997). Oxygen radical absorbing capacity of anthocyanins, en: J. Agric.Food Chem. 45(2): 304-309. [ Links ]
32. WROLSTAD, R.E. (1993). Color and pigment analyses in fruit products. agricultural experiment station. Oregon State University, Agricultural Experiment Station, Station Bulletin 624. [ Links ]
33. WROLSTAD, R.E.; DURST, R.W.; LEE, J. (2005). Tracking colour and pigment changes in anthocyanins products,en: Food Science & Technology, 16(9):423-428. [ Links ]
34. YOU, Q.; WANG, B.; CHEN, F.; HUANG, Z.; WANG, X.; LUO, P.G. (2011). Comparison of anthocyanins and phenolics in organically and conventionally grown blueberries in selected cultivars, en: Food Chemistry, 125(1): 201-108. [ Links ]
35. ZAPATA, L.M.; QUINTEROS, C.F.; MALLERET, A.D.; VUARANT, C.O.; RIVADENEIRA, J.A.; GERARD, J.A. (2010). Estudio de la capacidad antioxidante de especies de arándanos cultivadas en la región de Salto Grande. En: VUARANT, C.O. (ed.) Arándanos, Avances Científicos-Tecnológicos en la región de Salto Grande. Concordia: Fac. Cs.Alimentación - Univ. Nac. Entre Ríos. [ Links ]
36. ZOZIO, S. ; PALLET, D. ; DORNIER, M. (2011). Evaluation of anthocyanin stability during storage of a coloured drink made from extracts of the Andean blackberry (Rubus glaucus Benth.), açai (Euterpe oleracea Mart.) and black carrot (Daucus carota L.), en: Fruits, 66(3) : 1-12. [ Links ]














