Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Boletín de la Sociedad Argentina de Botánica
versión On-line ISSN 1851-2372
Bol. Soc. Argent. Bot. v.40 n.1-2 Córdoba ene./jul. 2005
Estudio comparativo de la comunidad liquénica en cuatro ecosistemas de la provincia de Córdoba
Cecilia Estrabou1 , Laura Stiefkens2, Miriam Hadid2 , Juan M. Rodríguez1 y Adriana Pérez3
1Centro de Ecología y Recursos Naturales, Fac. Ciencias Exactas, Físicas y Naturales, UNC
2Cátedra de Morfología Vegetal. Fac. Ciencias Exactas, Físicas y Naturales, UNC
3Técnico de CONICET, IMBIV (UNC-CONICET)
Summary: Comparative study of the lichen community of four ecosystems in the province of Córdoba. Distributions of twenty five species of epiphytic lichens were registered at 140 sites in four ecosystems in Córdoba province. Multivariate analyses (DCA) were applied. The lichen communities were analyzed over native phorophytes in the Chaco forest, mountain woodland and nearby area, and over introduced phorophytes in Córdoba city. The DCA ordination of the sample plots and species of Salinas Grandes and Córdoba city showed a single group. This similarity made as to find morphological, anatomical and reproductive characters between both communities. The same dominant species were found with some variations in cover, reproduction, anatomy and morphology. Thickness of upper cortex was the most variable pattern in each species.
Key words: Epiphytic lichens; Species richness; Chaco; Introduced phorophytes
Resumen: Se analiza la distribución de 25 especies de líquenes epífitos registrados en 140 sitios en cuatro áreas de la provincia de Córdoba. Se aplicó análisis multivariado (DCA). En el bosque chaqueño oriental, el bosque serrano y el área perisalina, se analizó la comunidad liquénica sobre forófitos nativos; para la ciudad de Córdoba, sobre forófitos introducidos dada la ausencia de nativos. El análisis de DCA de sitios y especies agrupa los sitios y especies de Salinas Grandes y ciudad de Córdoba. Esta similitud llevó a profundizar en la búsqueda de patrones morfológicos, anatómicos y reproductivos que la expliquen. Las especies dominantes en ambas comunidades resultaron las mismas, con variaciones en su cobertura, reproducción, anatomía y morfología. El parámetro que más alteraciones presentó es el espesor de la corteza superior en cada especie.
Palabras clave: Líquenes epífitos; Riqueza de especies; Chaco; Forófitos introducidos
INTRODUCCIÓN
La conservación de los bosques nativos es un componente esencial para el mantenimiento de la riqueza de las especies en general. En particular, los líquenes epífitos dependen de manera estricta de la permanencia de sustratos arbóreos disponibles. En la provincia de Córdoba extensas áreas boscosas se ven afectadas por diferentes motivos que amenazan la subsistencia de los bosques nativos. No hay estudios que registren sistemáticamente la abundancia de líquenes a largo plazo en Córdoba, estos estudios son escasos aún en Europa (van Dobben, 1991; Kuusinen et al., 1990). Es necesario conocer la distribución de las especies liquénicas en Córdoba, por un lado, porque si avanza la desaparición de sustratos disponibles, es posible que a corto plazo sólo queden comunidades aisladas con problemas para su reproducción; por otro lado, debe registrarse la distribución actual con miras a planificar un seguimiento a largo plazo en los cambios de abundancia (Bruteig, 1993). En el norte de la provincia, el bosque chaqueño es arrasado para soportar cultivos como la soja. La quema reiterada, la urbanización y el creciente fenómeno turístico ponen en riesgo la continuidad del bosque serrano. Por otra parte, en la ciudad de Córdoba las especies liquénicas corticícolas se desarrollan sobre sustratos que en general no son nativos; en el área periférica a las Salinas Grandes escasos grupos de árboles permiten el desarrollo de una comunidad liquénica que soporta las condiciones de salinidad del aire.
En este trabajo se comparan los patrones estructurales y de riqueza de especies de las comunidades liquénicas en cuatro ecosistemas de la provincia de Córdoba: el bosque chaqueño oriental, el bosque serrano, área perisalina de las Salinas Grandes y la ciudad de Córdoba.
La similitud en la composición y cobertura de las comunidades liquénicas de la ciudad de Córdoba y la de Salinas Grandes llevó a profundizar estudios en la morfología, anatomía y reproducción de las especies comunes encontradas. Se excluyó el estudio de los líquenes saxícolas ya que su ocurrencia en bosques es esporádica.
MATERIALES Y MÉTODOS
La región de las Salinas Grandes ocupa el fondo de un bolsón cuyos niveles altitudinales varían entre 150 msm en las playas salinas y 300 msm en las márgenes. Pertenece al Dominio climático Semidesértico, con precipitaciones inferiores a 400 mm anuales, siendo la región más seca de la provincia de Córdoba (Capitanelli, 1979), la temperatura máxima media anual es de 27 ºC y la mínima es de 11 ºC y se registran grandes amplitudes térmicas diarias. Durante el verano extensas superficies desiertas aparecen cubiertas por una delgada capa de eflorescencia de cloruro de sodio y otras sales.
La cuenca cerrada de las Salinas Grandes presenta una vegetación típicamente adaptada a condiciones de xero y halofitismo, donde se desarrollan un matorral halófilo y subhalófilo, pajonales y diferentes comunidades de herbáceas (Luti et al., 1979).
El gradiente de salinidad varía desde la planicie hacia el interior de las playas del fondo de la depresión. En la planicie occidental hay un bosque de Aspidosperma quebracho-blanco Schltdl. ("quebracho blanco"), en los bordes de la depresión sólo queda un matorral halófilo de Allenrolfea patagonica (Moq.) Kuntze y Heterostachys ritteriana (Moq.) Moq. y en el fondo del bolsón no hay vegetación alguna (Cabido & Zak, 1999). En la localidad de San José de las Salinas se encontraron, además, ejemplares aislados de Prosopis alba Griseb.
La ciudad de Córdoba se encuentra a 440 msm con una topografía irregular, ubicada en el faldeo oriental de las Sierras Chicas en un valle de erosión. Tiene un clima de tipo monzónico con inviernos fríos y secos y veranos cálidos y lluviosos. La precipitación media anual es de 790 mm concentrada en el verano. Presenta un microcentro de edificios altos y un área que circunda al centro donde alternan edificios con construcciones mas bajas, finalmente extendidas áreas barriales de construcciones bajas. Por estar construida en una depresión, hay una marcada diferencia de temperatura entre el centro de la ciudad, de hasta 5°C más que en los alrededores elevados (Estrabou, 1999). La ciudad tiene pocos espacios verdes y en las veredas hay escasos árboles o, a veces, cuadras enteras carecen por completo de árboles.
El Chaco semiárido ocupa la porción nor-oriental de la provincia de Córdoba. Las precipitaciones oscilan entre 500 y 750 mm al año (Karlin et al., 1994). El paisaje original del Chaco consistía en manchones de bosque alternando con abras de pastizales originadas artificialmente. Los principales componentes arbóreos del bosque son: Aspidosperma quebracho-blanco Schltdl., Acacia praecox (Griseb.), Ziziphus mistol (Griseb.) y Prosopis pugionata (Burkart) (Cabido & Zak, 1999).
Como piso altitudinal de vegetación el "bosque serrano" se extiende entre los 500 y 1.350 msm (Luti et al., 1979). Es un bosque abierto donde domina el "molle" Lithraea ternifolia (Gill.) Barkley & Rom., acompañado por el "coco" (Fagara coco (Gill.) Engl.) y el "tala" (Celtis tala Gillies ex Planch.) y con amplios manchones de arbustos o pastizal y muchas especies introducidas.
Tiene un clima mesotermal, perteneciendo al Dominio climático Semi-húmedo con tendencia al Semiseco, con un régimen monzónico de lluvias y precipitación media anual de 750-970 mm principalmente primavero-estivales. Se estima una media anual de entre 8 y 14º C (Capitanelli, 1979).
Para cada ecosistema se determinó una localidad representativa donde se trazó una transecta de 1,5 km, y a lo largo de ella se registró la cobertura total (en porcentaje) de líquenes por forófito y la de cada especie liquénica presente. El registro de la composición y cobertura por especie se realizó mediante una grilla de 30 x 30 cm sobre la cara sudoeste del tronco y a 1,5 m del suelo sobre 10 ejemplares de cada forófito. En el bosque chaqueño (localidad de La Candelaria) se censaron líquenes sobre "mistol", "quebracho blanco" y "algarrobo". En el bosque serrano (localidad de Atos Pampa), sobre "molle" y "tala" y en ambos casos la transecta se trazó dentro de una unidad homogénea evitando unos 10 metros de los bordes. Dentro del bolsón de las Salinas no se encontraron especies liquénicas ni aún en sus márgenes, recién en la localidad de San José de las Salinas y sobre troncos de "quebracho blanco" y "algarrobo" se desarrolla una comunidad liquénica característica. Para la ciudad de Córdoba se utilizó el mismo método pero sobre Melia azedarach L. ("paraíso") como forófito, ya que es un árbol de amplia distribución en la ciudad y buen sustrato para líquenes. Se tomaron 10 ejemplares de vereda siguiendo una transecta de 1,5 Km desde el microcentro hacia el Noroeste.
Para la identificación de las especies y la comparación del estado general de los ejemplares entre las comunidades se usaron técnicas de rutina de análisis morfoanatómicos y químicos (Scutari, 1992, 1995a, 1995b; Scutari & Theinhardt, 2001). Para identificar las sustancias liquénicas presentes se utilizaron las técnicas de recristalización y cromatografía en capa delgada (White & James, 1985).
Para comparar las muestras de Salinas Grandes y Córdoba capital, se coleccionaron muestras de 5 ejemplares de cada especie liquénica y se analizaron en el laboratorio con un estereomicroscopio Olympus VM. Se analizaron características morfológicas (tamaño del talo, color, etc.), y reproductivas (cobertura de soredios en una sección de 25 mm2 de la superficie del talo, número total de apotecios presentes en 25 mm2 de la superficie del talo y cobertura de cada apotecio sobre una grilla de igual tamaño). Para determinar el número de esporas se seleccionó de cada muestra un apotecio de alrededor de 1.15 mm de diámetro, se cortó sobre un portaobjetos y se maceró con agua destilada. Se tomó 50 µl de esta suspensión con una pipeta automática y se depositó en una cámara de conteo de Neubauer para obtener el número de esporas en cada división.
Se calculó una tasa de fertilidad para las especies apoteciadas a través de la siguiente fórmula elaborada a tal fin:
![]()
Donde n = número total de esporas, N = número de apotecios, y C = cobertura de apotecios.
Para las especies comunes de Córdoba y Salinas Grandes se comparó estadísticamente el número de algas por mm2, espesor de la corteza superior y de la médula (medidos en µm) mediante el uso del programa "SPSS" (release 6.0 for Windows, SPSS Inc., 1993). Se efectuó la prueba de ANOVA, con el objeto de determinar si existían diferencias significativas en estas variables y entre los dos ambientes y la comparación entre las medias se realizó utilizando el test de Bonferroni (Scheffé, 1959; Sokal & Rohlf, 1981).
Las características anatómicas tales como el tipo de tejidos, su estado, grosor y disposición se observaron con un microscopio Bausch & Lomb RD. Para ello se fijaron muestras en FAA, luego se deshidrataron con una serie ascendente de alcohol etílico, se dejaron en butanol una noche, se clarificaron con xileno y se incluyeron en "paramat" BDH. Los cortes (entre 10 a 15 µm de espesor) se realizaron en micrótomo de rotación tipo Minot y se tiñeron con hematoxilina durante 5 minutos. El montaje se realizó con Bálsamo de Canadá artificial. En los cortes se analizaron las siguientes variables: número de algas y espesor de tres de las cuatro capas del talo: corteza superior, capa gonidial y médula.
Con los datos obtenidos se generó una matriz de sitios por especies (valores de cobertura) a la que se aplicó un análisis de Correspondencia Detendenciado (DCA, Hill & Gauch 1980), para identificar patrones entre las especies liquénicas y los cuatro ecosistemas seleccionados.
RESULTADOS
Se encontró un total de 25 especies (Tabla 1); es probable que las especies crustosas fueran submuestradas debido al escaso conocimiento sistemático sobre ellas en nuestra provincia. Diez especies son comunes al bosque chaqueño y serrano; 11 especies sólo están presentes en el bosque chaqueño, 1 es exclusiva del bosque serrano, 3 son comunes a Córdoba y Salinas Grandes y 1 es exclusiva en Salinas Grandes. La Fig. 1 muestra la media de la cobertura de las especies mas representativas en los cuatro ambientes.
Tabla 1. Lista de especies presentes en los cuatro ecosistemas.

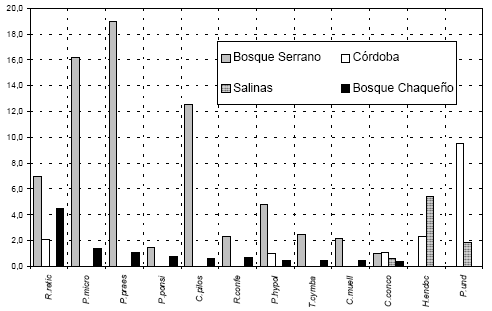
Fig. 1. Coberturas medias (valor medio de cobertura de 10 árboles) de las especies más representativas de cuatro
ambientes de la provincia de Córdoba.
La ordenación de la matriz especies por sitios con DCA muestra una inercia a lo largo del eje 1 (autovalor 0,886) que permite explicar las diferencias entre las especies de ambientes de bosque, tanto serrano como chaqueño (Fig. 2,grupo 1 y 2) y las de Ciudad de Córdoba y Salinas Grandes (Fig.2, grupo 3).
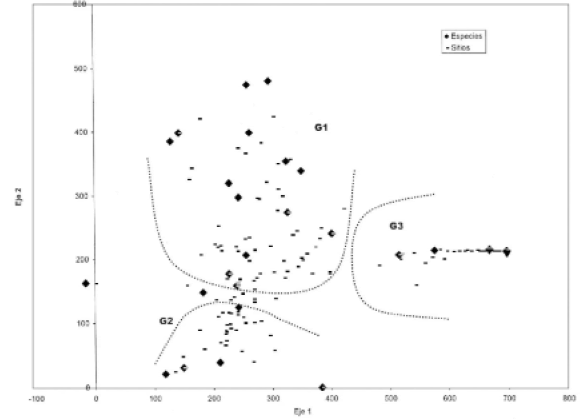
Fig. 2. Disposición en el plano definido por los dos primeros ejes de DCA de los sitios y las especies en cuatro
ecosistemas de la provincia de Córdoba.. G1= especies del bosque chaqueño . G2= especies del bosque serrano. G3=
especies de Córdoba ciudad y de Salinas Grandes.
El segundo eje (autovalor 0,522) explica la diferencia entre especies y sitios exclusivos del bosque chaqueño (Fig. 2, grupo 1) y especies y sitios compartidos entre ambos ambientes de bosque (Fig. 2, grupo 2). Las especies de ciudad de Córdoba y de Salinas Grandes formó un sólo grupo, con especies compartidas.
A lo largo del eje 1 del DCA se identifican 2 grandes grupos, el primero corresponde a las especies del ambiente de bosque y el segundo agrupa fuertemente a las especies de Córdoba ciudad y Salinas Grandes con especies compartidas y valores de cobertura similares. A lo largo del segundo eje se separan las especies y los sitios compartidos entre ambos ambientes de bosque, el bosque chaqueño y el bosque serrano. En el grupo 1 se encuentran las especies y los sitios exclusivos del bosque chaqueño. Hay también una tendencia sobre el eje 1 a agrupar especies de menor cobertura a la izquierda del diagrama y las de mayor cobertura a la derecha.
Estudio comparativo entre las especies comunes de Córdoba ciudad y Salinas Grandes
En el texto que sigue sólo se destacan los caracteres diferenciales de las especies en ambos sitios.
Familia Candelariaceae
Candelaria concolor (Dickson) Arnold
Corteza superior delgada paraplectenquimática. (Tabla 2). Corteza inferior delgada. Apotecios lecanorinos amarillos con margen talino y sorediados. Química: ácidos calcínico y pulvínico. No se observan diferencias importantes en el espesor de médula entre los ejemplares de ambos sitios. El espesor de la corteza superior, en cambio, resultó el doble para los ejemplares de Córdoba que para Salinas y el número de algas es algo mayor (Tabla 2). La cobertura de soredios resultó más del doble para Córdoba que para Salinas Grandes (Tabla 3). Material estudiado: Argentina. Prov. de Córdoba: Dto. Cruz del Eje, San José de las Salinas, 10-V-2001, leg. Estrabou, sobre Prosopis alba (BAFC 39.143). Ciudad de Córdoba, Barrio Villa Páez, 1997, leg. Estrabou, sobre Melia azedarach (BAFC 39.158).
Tabla 2. Media del número de algas medido en mm2, espesor de corteza superior y médula (medidos en µm, para cada especie dominante) en ambiente urbano y ambiente halófito

Tabla 3. Valores medios de cobertura de soredios (%) y desviación estándar en dos especies entre Córdoba y Salinas Grandes.

Familia Physciaceae
Hyperphyscia syncolla (Tuck.) Kalb spec. coll. Iconografía en Scutari 1995a; 166.
Corteza superior paraplectenquimática, sin tejido epinecral. La corteza superior resultó el doble de gruesa en Córdoba que en Salinas, mientras que los valores de espesor de médula se mantienen similares; el número de algas es algo superior en Córdoba (Tabla 2). Médula preponderantemente blanca con algún sector ocráceo, compacta. La capa gonidial no presenta espacios lacunares en Salinas Grandes, pero son notables en ciudad de Córdoba. Corteza inferior bien definida de grosor irregular. Apotecios muy numerosos. El índice de Fertilidad muestra un valor muy bajo para Córdoba (0,044) y significativamente alto para Salinas Grandes (0,58). Química: zeorina + skirina.
Material estudiado: Argentina. Prov. de Córdoba: Dto. Cruz del Eje, San José de las Salinas, 10-V- 2001, leg. Estrabou sobre Prosopis alba (BAFC 39.146), sobre Aspidosperma quebracho-blanco (BAFC 39.147). Ciudad de Córdoba, Barrio Villa Páez, 1997, leg. Estrabou, sobre Melia azedarach (BAFC 39.156).
Physcia undulata Moberg Iconografía en Scutari, 1995b; 225.
No se ven diferencias importantes entre, espesor de médula ni tampoco en la cobertura media de soredios; mientras que el espesor de corteza resultó casi el doble para Córdoba que para Salinas y el número de algas resultó algo mayor en Salinas Grandes que en Córdoba (Tablas 2 y 3). Química: atranorina + zeorina.
Material estudiado: Argentina. Prov. de Córdoba: Dto. Cruz del Eje, San José de las Salinas, 10-V- 2001, leg. Estrabou y Hadid sobre Prosopis alba (BAFC 39.144), sobre Aspidosperma quebrachoblanco, (BAFC 39.145). Ciudad de Córdoba, Barrio Villa Páez, 1997, leg. Estrabou, sobre Melia azedarach, (BAFC 39.155).
Análisis estadísticos
Los valores de cobertura total de cada especie y para ambos ambientes se muestran en la Tabla 4. Según este valor de importancia la especie dominante en ambiente urbano es P. undulata con alto valor de cobertura seguida por H. syncolla; en ambiente halófito, los valores importantes de cobertura los presenta H. syncolla seguida de P. undulata. La otra especie común, C. concolor presenta valores similares en ambos sitios.
Tabla 4. Valores de cobertura total por especie (en %) en ambiente urbano (sobre Melia azedarach) y en ambiente halófito sobre dos forófitos.

En cuanto a los caracteres anatómicos de las especies dominantes estudiadas para ambos ambientes, se observó que la capa gonidial presentó un buen desarrollo. La corteza superior resultó de mayor espesor que el descrito en bibliografía para cada especie. Es el parámetro de mayor variación entre ambos ambientes, ya que los valores para la ciudad de Córdoba son superiores en las tres especies consideradas. La médula presentó valores normales sin variaciones entre ambos ambientes (Tabla 2).
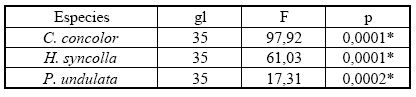
Cuando se comparan estad ísticamente el número de algas por mm2 y el espesor de la corteza superior en las tres especies dominantes, se observa que hay diferencias significativas entre los dos ambientes. Con respecto al espesor medular la única especie que muestra diferencias es Candelaria concolor, aunque al realizar el test de Bonferroni, este no arroja diferencias estadísticamente significativas (Tablas 5, 6, 7).
Tabla 5. Comparación de número de algas medido en mm2 para las tres especies dominantes entre ambiente urbano y halófito. ANOVA de p< 0.05; gl = grados de libertad; *= diferencias estadísticamente significativas.
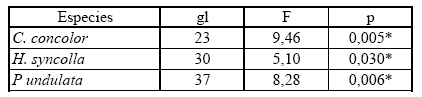
Tabla 6. Comparación de espesor de capa medular para las tres especies dominantes entre ambiente urbano y halófito. ANOVA de p< 0.05; gl = grados de libertad; * = diferencias estadísticamente significativas.

Tabla 7. Comparación de espesor de corteza superior para las tres especies dominantes entre ambiente urbano y halófito. ANOVA de p< 0.05; gl= grados de libertad; *= diferencias estadísticamente significativas.
DISCUSIÓN Y CONCLUSIONES
Las especies estudiadas están citadas para Argentina (Calvelo & Liberatore, 2002). Del total de 25 especies encontradas, 20 se desarrollan en el bosque chaqueño, que es el ambiente con más diversidad, 15 en el bosque serrano, en Córdoba ciudad hay 5 al igual que en Salinas Grandes que presenta 1 exclusiva de este ambiente.
El área que presenta las coberturas más altas es el bosque serrano donde Parmotrema praesorediosum es la especie de mayor cobertura, seguida por Punctelia microsticta, que es también la especie subdominante en el bosque chaqueño. En este último Rimelia reticulata es la especie dominante y las coberturas medias de las especies liquénicas son más bajas que en el bosque serrano.
Candelaria concolor es la única especie común a los cuatro ambientes con una cobertura similar en todos, ligeramente superior en ciudad de Córdoba.
Dado que los cuatro ecosistemas estudiados presentan diferentes forófitos, necesariamente se ha analizado la comunidad liquénica sobre diferentes especies arbóreas. La influencia del forófito en la vegetación epifítica ha atraído la atención en numerosos estudios (Barkman, 1958; Nimis, 1985; Palmer, 1986) y en general hay acuerdo acerca de su relevancia como factor determinante para la comunidad liquénica que se desarrolla sobre ellos. No obstante, también es discutida su influencia por otros autores, por ejemplo, Bates & Brown (1981) señalan que la vegetación epífita sobre dos forófitos contrastantes muestra escasa diferencia, en cambio, atribuyen a los factores ecológicos las variaciones encontradas en la vegetación. También Nimis (1985) y Palmer (1986) han encontrado especies epífitas similares cuando ellos comparan casos en los que los forófitos son diferentes. Oksanen (1988) concluye que el forófito en si mismo no es decisivo, aunque influyen las condiciones que prevalecen.
Salinas Grandes es una depresión pobre en vegetación en general (Luti et al., 1979) y también pobre en líquenes. El ambiente salino, las altas temperaturas y la falta de sustratos adecuados son determinantes, por ello sólo aparecen especies liquénicas en árboles ubicados por fuera de los bordes de la depresión. Algo similar ocurre en la ciudad de Córdoba, la que se encuentra en una depresión con escasa presencia de árboles y valores importantes de contaminación, siendo una de las ciudades más contaminadas de Argentina (Cañas et al., 1997).
Las comunidades presentes en ambos ambientes son similares en su composición específica y con particularidades en sus dominantes. La especie dominante en ambiente urbano, P. undulata, es subdominante en Salinas y la dominante en Salinas, H. syncolla es subdominante en ambiente urbano. En ambos ambientes hay valores similares de cobertura de C. concolor. Las tres especies han sido mencionadas también para la ciudad de Buenos Aires y para Córdoba (Scutari & Theinhardt, 2001; Estrabou, 1998).
Las especies que se desarrollan en ambientes contaminados como la ciudad de Córdoba, muestran modificaciones en la morfología y en la anatomía como lo mencionan numerosos trabajos (Nimis et al., 2002; Richardson, 1988).
Hyperphyscia syncolla, en Salinas Grandes no presenta espacios lacunares ni tejido epinecral, a diferencia de los ejemplares analizados en ambiente urbano (Estrabou et al., 2004), esto permite suponer que no requiere de estructuras especiales para mejorar el intercambio gaseoso por lo que estará mejor adaptada al ambiente halófito. Physcia undulata y Candelaria concolor; se encuentran en mejor estado en Salinas Grandes que en urbano donde el depósito de material particulado y hollín oscurece el talo.
En las tres especies consideradas, el número de algas presentó diferencias estadísticamente significativas entre ambos ambientes. C. concolor y H. syncolla tienen mayor número de algas en Salinas, mientras P. undulata tiene mayor valor en urbano. Este carácter se relaciona con la capacidad fotosintética del talo, por lo que es de esperar que aumente el número de algas en un ambiente adverso. C. concolor y H. syncolla, se desarrollan mejor en el ambiente halófito, mientras que P. undulata lo hace mejor en urbano.
Los valores de la médula, para cada especie, se mantienen similares en ambos ambientes; esta capa se encuentra mejor protegida y no ha respondido a factores externos.
La corteza superior mostró diferencias estadísticamente significativas en las tres especies para ambos sitios; los valores, prácticamente se duplican en la ciudad de Córdoba. Esta capa es la más expuesta a la superficie y debe resistir el efecto del particulado y hollín que se deposita sobre ella por lo que es probable que aumente su espesor como una respuesta a tal efecto.
En la región de Salinas Grandes, no se aprecian diferencias remarcables entre los valores del número de algas, espesor de corteza superior y médula de las especies, entre un forófito y otro, los valores medios resultaron prácticamente iguales. Esto indica que el sustrato no influye en la morfoanatomía de las tres especies que se desarrollan en ambos. No obstante, P. undulata presenta menor cobertura sobre quebracho blanco que en algarrobo, hecho que indica una preferencia por este último sustrato.
La reproducción asexual está representada por la presencia de soredios. En P. undulata no hay variaciones en la cobertura entre ambos sitios; en cambio en C. concolor los valores de cobertura superan el doble en Córdoba. Este resultado se contrapone a lo referido por Mykhaylova (2000) que encuentra que la respuesta de los líquenes a factores de estrés se da en términos de una disminución en la tasa de crecimiento del talo y una disminución o ausencia de producción de soredios.
El índice de fertilidad, que representa la reproducción sexual de una especie, resultó muy bajo para la ciudad de Córdoba en H. syncolla, lo que significa que la especie está produciendo un menor número de esporas en este ambiente poniendo en riesgo su supervivencia en el mismo. Gorbushina et al. (2000), encuentra para especies que se desarrollan en el desierto de Gobi, un aumento en el número de apotecios pero una significativa reducción en el número de esporas. Este resultado coincide con el comportamiento observado en este estudio.
Dadas las similitudes entre la comunidad de ambiente halófito y la urbana y el buen estado de las especies en la primera, se podría pensar que Salinas Grandes es la comunidad de origen de la segunda donde las especies se adaptaron a la situación de contaminación del aire.
AGRADECIMIENTOS
A la Secretaría de Ciencia y Técnica de la Universidad Nacional de Córdoba por financiar el proyecto, al Ing. Agr. Daniel Reynoso por su apoyo técnico.
BIBLIOGRAFIA
BARKMAN, J. J. 1958. Phytosociology and ecology of cryptogamic epiphytes. Van Gorcum, Assen. [ Links ]
BATES, J. W. & D. H. BROWN. 1981. Epiphyte differentiation between Quercus petraea and Fraxinus excelsior trees in a maritime area of South West England. Vegetatio 48: 61-70. [ Links ]
BRUTEIG, I. E. 1993. Large-scale survey of the distribution and ecology of common apiphytic lichens on Pinus sylvestris in Norway. Ann. Bot. Fenn. 30: 161-179. [ Links ]
CABIDO, M. R. & M. R. ZAK. 1999. Vegetación del Norte de Córdoba. Secretaría de Agricultura, Ganadería y Recursos Renovables de la provincia de Córdoba y Agencia Córdoba Ambiente, Córdoba. [ Links ]
CALVELO, S. & S. LIBERATORE. 2002. Catálogo de los líquenes de la Argentina. Kurtziana 29: 1-173. [ Links ]
CAÑAS, M., L. ORELLANA & M. L. PIGNATA. 1997. Chemical response of the lichens Parmotrema austrosinense and P. conferendum transplanted to urban and non-polluted environments. Ann. Bot. Fenn. 34: 27-34. [ Links ]
CAPITANELLI, R. G. 1979. Clima. En: J. VÁZQUEZ, R. MIATELLO & M. ROQUÉ (eds.), Geografía Física de la provincia de Córdoba, pp. 45-138. Ed. Boldt, Buenos Aires. [ Links ]
DOBBEN, H. F. van. 1991. Recent changes in the epiphytic lichen flora of the Netherlands. Acta Bot. Neerl. 40: 380-387. [ Links ]
ESTRABOU, C. 1998. Lichen species identification and distribution according tolerance to airborne contamination in the city of Córdoba, Argentina. In: Lichenology in Latin America: history, current knowledge and applications. Marcelli, M.P. and Seaward, M. R. D.(eds.) CETESB, Sao Paulo. [ Links ]
ESTRABOU, C. 1999. Respuesta de plantas y líquenes como bioindicadores. Revista Educ. Biología 2: 31-39. [ Links ]
ESTRABOU, C., L. STIEFKENS, M. HADID, J. M. RODRÍGUEZ & A. PÉREZ. 2004. Effects of air pollutions on morphology and reproduction in four lichen species. Ecol. Bolivia 39: 33-45. [ Links ]
GORBUSHINA, A. A, M. GALUN & N. S. GOLUBKAVE. 2000. Symbiotic (lichenised) and free living fungi on desert rocks: propagation strategies and similarity of vegetative life forms. 4th IAL Symposium. Progress and problems in lichenology at the turn of the millenium. Barcelona. [ Links ]
HILL, M. O. & H. G. GAUCH. 1980. Detrended correspondence analyses: an improved ordination technique. Vegetatio 42:47-53. [ Links ]
KARLIN, U. O. T., L. A. CATALÁN &. R. O. COIRINI. 1994. El Chaco seco, un ambiente con vocación forestal. Facultad de Ciencias Agropecuarias, Universidad Nacional de Córdoba. [ Links ]
KUUSINEN, M., K. MIKKOLA & E. L JUKOLASULONEN. 1990. Epiphytic lichens on conifers in the 1960's to 1980's in Finland. In: Kauppi, P. Antiila, P. & K. Kenttämies (eds.) Acidificaction in Finland. Springer Verlag, Berlin, Heidelberg. [ Links ]
LUTI, R., M. SOLÍS, F. M. GALERA, N. MÜLLER DE FERREIRA, M. BERZAL, M. NORES, M. HERRERA & J. C. BARRERA. 1979. Vegetación. En: J. Vázquez, R. Miatello y M. Roqué (Dir), Geografía Física de la provincia de Córdoba, pp. 297-368. Ed. Boldt, Buenos Aires. [ Links ]
MYKHAYLOVA, I. 2000. Populations of Hypogymnia physodes (L.) Nyl. under the stress conditions their structure and functioning. 4th IAL Symposium. Progress and problems in lichenology at the turn of the millennium, Barcelona. [ Links ]
NIMIS, P. L. 1985. Phytogeography and ecology of epiphytic lichens at the southern rim of the Clay Belt (N-Ontario, Canada). Bryologist 88: 315-324. [ Links ]
NIMIS, P. L; C. SCHEIDEGGER; & P. A. WOLSELEY. 2002. Monitoring with Lichens - Monitoring Lichens. (Nato Science Series. IV. Earth and Environmental Sciences - Vol. 7). Kluwer Academic Publishers, Dordrecht, Boston, London. [ Links ]
OKSANEN, J. 1988. Impact of habitat, substrate and microsite classes on the epiphyte vegetation: Interpretation using exploratory and canonical correspondence analysis. Ann. Bot. Fenn. 25: 59-71. [ Links ]
PALMER, M. W. 1986. Pattern in corticolous bryophyte communities of the North Carolina Piedmont: do mosses see the forest or the trees? Bryologist 89: 59-65. [ Links ]
RICHARDSON, D. H. S. 1988. Understanding the pollution sensitivity of lichens. Bot. J. Linn. Soc. 96:31-43. [ Links ]
SCHEFFÉ, H. 1959. The analysis of variance. John Wiley, New York. [ Links ]
SCUTARI, N. 1992. Estudios sobre Pyxinaceae foliosas (Lecanorales, Ascomycotina) de la Argentina, IV: claves de los géneros y las especies de la provincia de Buenos Aires. Bol. Soc. Argent. Bot. 28: 169-173. [ Links ]
SCUTARI, N. C. 1995a. Los macrolíquenes de Buenos Aires, I: Dirinaria, Heterodermia e Hyperphyscia (Physciaceae, Ascomycotina). Darwiniana 33: 149- 176. [ Links ]
SCUTARI, N. 1995b. Los macrolíquenes de Buenos Aires, II: Phaeophyscia, Physcia y Pyxine (Physciaceae, Ascomycotina). Darwiniana 33: 211-231. [ Links ]
SCUTARI, N. C. & N. I. THEINHARDT. 2001. Identification of urban lichens in the field: a case study for Buenos Aires City (Argentina). Mycotaxon 80: 427-445. [ Links ]
SOKAL, R.R. & F. J. ROHLF. 1981. The principles and practice of statistics in biological research. Freeman, San Francisco. [ Links ]
WHITE, J. & P. JAMES. 1985. A new guide to microchemical techniques for the identification of lichen substances. British Lichen Soc. Bull. 57: 1-41. [ Links ]
Recibido el 15 de Octubre de 2003
Aceptado el 07 de Julio de 2004.














