Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Boletín de la Sociedad Argentina de Botánica
versión On-line ISSN 1851-2372
Bol. Soc. Argent. Bot. v.42 n.1-2 Córdoba ene./jul. 2007
El Género Nowakowskiella (Cladochytriaceae, Chytridiomycota) en ambientes de la Pcia. de Buenos Aires (Argentina): Taxonomía, frecuencia y abundancia de las especies encontradas*
Agostina V. Marano1, Mónica M. Steciow1, María L. Arellano1, Angélica M. Arambarri1 y María V. Sierra2
*Trabajo publicado en homenaje a la Dra Irma J. Gamundi en conmemoración de su 80º aniversario.
1Instituto de Botánica Spegazzini, calle 53 N° 477, B1900AVJ La Plata, Buenos Aires, Argentina.
E-mail: agosvm@hotmail.com
2Instituto de Limnologìa «Dr. R. A. Ringuelet», Av. Calchaqui Km. 23.5, Fcio. Varela, Buenos Aires.
Resumen: El género Nowakowskiella comprende organismos acuáticos y terrestres, que se encuentran como saprótrofos principalmente sobre restos vegetales en descomposición. El género es citado por primera vez para Argentina y en esta contribución, se describen cuatro especies, analizándose su frecuencia y abundancia en los ambientes estudiados, brindándose una clave basada en caracteres morfológicos para diferenciarlas.
Palabras clave: Nowakowskiella; Chytridiomycota; Buenos Aires.
Summary: The genus Nowakowskiella (Cladochytriaceae, Chytridiomycota) in environments of Buenos Aires Province (Argentina): Taxonomy, frequency and abundance of the found species. The genus Nowakowskiella comprises aquatic and terrestrial organisms, which occur as saprotrophs on decomposed vegetable debris mainly. This genus is recorded for the first time in Argentina and in this contribution four species are described, analyzing their frequency and abundance in the studied environments and providing an identification key based on morphological characters to differentiate them.
Key words: Nowakowskiella; Chytridiomycota; Buenos Aires.
INTRODUCCIÓN
El Phylum Chytridiomycota (Fungi) comprende actualmente seis órdenes: Monoblepharidales, Blastocladiales, Neocallimastigales, Spizellomy cetales, Chytridiales (Müeller et al ., 2004) y Rhizophydiales (Letcher et al ., 2006). El orden Chytridiales ha alcanzado la mayor diversificación con 80 géneros y 600 especies descriptos, ubicados en cuatro familias: Synchytriaceae, Endochytriaceae, Chytridiaceae y Cladochytriaceae. Sparrow (1960) contempla la existencia de las familias Megachytriaceae donde se ubican los géneros operculados (Megachytrium Sparrow, Nowakowskiella Schroeter y Septochytrium Berdan), y Cladochytriaceae (formada por Amoebochytrium Zopf, Cladochytrium Nowakowski, Coenomyces Deckenbach, Physocladia Sparrow y Polychytrium Ajello). Whiffen (1943) considera que los géneros anteriormente mencionados son muy semejantes en desarrollo, organización, estructura y reproducción, por lo que propone como válida únicamente a la familia Cladochytriaceae. A esta familia pertenecen 10 de los 80 géneros, entre los cuales se encuentra Nowakowskiella (Kirk et al. , 2001). Este género comprende 17 especies (Index fungorum, 2006) de organismos cosmopolitas, saprótrofos, comúnmente encontrados sobre restos vegetales en descomposición, tanto en ambientes acuáticos como terrestres (Sparrow, 1960).
Nowakowskiella y Rhizophlyctis rosea (de Bary & Woronin) Fischer, son organismos que se hallan estrechamente asociados creciendo juntos sobre materiales celulósicos y cumpliendo un importante papel en el suelo como degradadores (Willoughby, 1964), por lo que muchos de sus representantes han sido aislados a partir de celofán, catáfilas de Allium cepa y hojas de Zea mays (Sparrow, 1960; Marano & Steciow, 2006).
Para la región Neotropical, los Chytridiales corresponden al 26,68 % de la diversidad de hongos zoospóricos conocidos (Milanez, 1992) y particular mente en Brasil, se han registrado hasta la actualidad ocho especies de Nowakowskiella : N. elegans (Nowak.) Schroeter, N. elongata Karling, N. hemisphaerospora Shanor, N. macrospora Karling, N. multispora Karling, N. profusa Karling y N. ramosa E. J. Butler. En el caso de N. elegans , ha sido considerado en ese país, un hongo muy común debido al número de hallazgos registrados en hojas sumergidas de diversas especies vegetales (Schoenlein-Crusius & Milanez, 1998a).
El objetivo del presente trabajo es citar por primera vez para la Argentina al género Nowakowskiella, describiendo e ilustrando cuatro especies: N. elegans , N. hemisphaerospora , N. profusa y N. ramosa . Se analiza su frecuencia y abundancia en los ambientes estudiados y se brinda una clave dicotómica para laidentificación de estos organismos.
MATERIAL y MÉTODO
Área de muestreo: Para este estudio se seleccionaron ambientes acuáticos pertenecientes a la cuenca del Río de La Plata y ambientes terrestres, ambos ubicados en la provincia de Buenos Aires (Argentina). Entre los ambientes acuáticos analizados encontramos el arroyo Las Cañas (Reserva Natural Selva Marginal Punta Lara, Pdo. de Ensenada) y el arroyo Martín (Pdo. de La Plata ), y dos charcas semipermanentes ubicadas en la zona de inundación del arroyo El Pescado (Pdo. de La Plata ), mientras que los ambientes terrestres corresponden a dos lotes cultivados con frutilla en el partido de Luján (Pcia. de Bs. As.).
Análisis de las muestras :
a) Ambientes acuáticos : - Arroyo Las Cañas: se definieron dos sitios, uno cercano a las nacientes (sitio1: ubicado entre los 34° 47´ 58.5" S- 57° 57´ 19.3" O y 34° 47´ 54.5" S- 58° 00´ 33.8" O) y otro cercano a su desembocadura (sitio 2: ubicado entre los 34° 47´ 54.1" S- 58° 00´ 37" O y 34° 47´ 29.3" S- 57° 59´ 49.2" O), y en cada uno de ellos se delimitó una transecta con seis puntos de muestreo en donde se recolectaron muestras de agua superficial de las márgenes, materia orgánica flotante (restos vegetales) y se colocaron en el lugar dos réplicas de bolsas de malla plástica, conteniendo 50 unidades de sustratos celulósicos (hojas de Zea mays ), que permanecieron sujetas a un flotador de telgopor durante 10 días. Se realizó un muestreo de otoño (22-03-06) y otro de invierno (28-06-06). En cada fecha de muestreo, se analizaron un total de 60 cápsulas de Petri y 300 hojas de Zea may s.
-Arroyo Martín: se definieron tres sitios de muestreo, uno cerca de sus nacientes (S1: 34º 51' 22" S- 58º 03' 38" O), otro en su parte media (S2: 34º 03' 38" S-58º 04' 11" O) y otro cerca de su desembocadura en el Río de la Plata (S3: 34º 54' 56" S-58º 04' 42" O). Se emplearon recipientes de plástico como unidades muestrales (108 cm 2 ), que se dispusieron en los sitios seleccionados durante un mes en dos estaciones: verano (febrero-marzo) y otoño (abril-mayo) de 2006. Se extrajeron, mediante un aspirador, cinco alícuotas (5ml cada una) de la película de organismos desarrollada en los recipientes. En el laboratorio se analizaron 18 cápsulas de Petri, tres réplicas por cada sitio de muestreo (S1, S2 y S3) en cada muestreo estacional (verano y otoño), y 90 unidades de sustrato celulósico. Las muestras fueron homogeneizadas, realizándose diluciones 1.10 -1 y se fraccionaron en submuestras de 30 ml que se dispusieron en cápsulas de Petri estériles con sustratos celulósicos (hojas de Zea mays ).
-Charcas semipermanentes: se recolectaron duplicados de muestras de agua superficial de las márgenes y materia orgánica sumergida y flotante, de dos charcas (charca A: 35° 01´ 3.49"S- 57° 51´ 34.07" O y charca B: 35° 01´ 16.18" S- 57° 51´ 25.14" O) pertenecientes a la zona de inundación del arroyo El Pescado. En el laboratorio, se analizaron 12 cápsulas de Petri, seis pertenecientes a la charca A y seis a la charca B.
b) Ambientes terrestres : -Campos cultivados: se recolectaron muestras de suelo superficial de dos lotes (R y M), las cuales fueron secadas a temperatura ambiente y homogeneizadas en dos submuestras (R1, R2 y M1, M2, respectivamente). En el laboratorio, se analizaron 12 cápsulas y 60 unidades de sustrato celulósico. Todas las muestras recolectadas fueron procesadas en laboratorio según la «técnica de cebado», colocándolas en cápsulas de Petri con cebos celulósicos (Sparrow, 1960; Stevens, 1974). En este caso, se empleó la metodología modificada por Marano & Steciow (2006), para permitir un análisis de la frecuencia (frecuencia de colonización y/o frecuencia relativa) y la abundancia de este género (abundancia y/o abundancia relativa) con resultados comparables en los ambientes estudiados. Al cabo de 10 días de incubación, se identificaron las especies encontradas y se registró su presencia o ausencia y el número de aislamientos de cada especie por unidad muestral (cápsula de Petri), calculándose de esta forma, su frecuencia de colonización (%) y abundancia (%) en cada ambiente. Para describir la frecuencia de colonización de las especies encontradas, se empleó la escala de Braun-Blanquet (Kershaw, 1973).
Las identificaciones taxonómicas fueron realizadas según los trabajos de Sparrow (1960), Karling (1977) y Johnson (1973).
RESULTADOS
Descripción de las especies :
1. Nowakowskiella elegans (Nowak.) Schroeter, Engler & Prantl, Natürlinchen Pflanzenfam. 1: 82. 1892. (1893). (Figs. 1-2).
Cladochytrium elegans Nowakowski, pro parte, in Cohn, Beitr. Biol. Pflanzen 2: 95. 1876.
Nowakowskiella endogena Constantineanu, Revue Gen. Bot. 13: 387. 1901.
Nowakowskiella delica Whiffen, J. Elisha Mitchell Sci. Soc. 59: 37. 1943.
Nowakowskiella crassa Karling, Bull. Torrey Bot. Club 76: 294. 1949.

Fig. 1. Detalle de la descarga de las zoosporas en N. elegans . A: Estadíos en la diferenciación de las esporas en el interior del zoosporangio (previos al desarrollo del flagelo). B: Apertura del opérculo (flecha). C: Liberación de un tapón mucoso (flecha). D: Migración de algunas de las esporas hacia el exterior envueltas en material mucilaginoso, donde completan su formación. E: Esporas remanentes en el interior del zoosporangio (zoosporas). F: Zoospora remanente liberándose (flecha).

Fig. 2 . N. elegans . A: Aspecto general del talo policéntrico creciendo sobre hojas de Zea mays. B: Detalle de la ramificación del talo, con zoosporangios de crecimiento extramatrical. C: Esporangios en distinto estado de desarrollo, algunos con un tubo de descarga. D: Detalle del zoosporangio vacío, con apófisis basal (flecha) y opérculo. D: Zoospora en el orificio de descarga (flecha). E: Espora de reposo.
Talo policéntrico, eucárpico, de extenso desarrollo extra e intramatrical (endobiótico). Zoosporangios de pared lisa, terminales, ocasionalmente intercalares, cuando extramatricales ovoides, obpiriformes u oblongos, cuando endobióticos, toman la forma de la célula que los contiene, (20-) 25-41 (-46) μm diám., con 1-2 tubos de descarga presentes o no. Apófisis basal generalmente presente, 9-17 μm diám. Opérculo liso o umbonado, de posición apical o subapical, 7-10μm diám, que permanece o no adherido al esporangio luego de la descarga. Sistema rizoidal variable en extensión, muy ramificado, de 3 μm diám.promedio.
La descarga de los zoosporangios se inicia con la apertura del opérculo, la liberación de un tapón de material mucoso y la posterior migración de las esporas hacia el exterior envueltas en material mucilaginoso, donde completan su diferenciación y escapan rápidamente (Fig. 1). Z oosporas esféricas, 4-10 μm diám., con un gran glóbulo lipídico. Esporas de reposo esféricas o elípticas, de pared lisa, gruesa, 16-22 (-25) μm diám., sin espacio entre la pared y el contenido citoplasmático; a la madurez presentan un único glóbulo lipídico refringente.
2. Nowakowskiella hemisphaerospora Shanor, Am. J. Bot . 29: 174. 1942. (Fig. 3).

Fig. 3. N. hemisphaerospora . A: Zoosporangio no descargado con opérculo y desprovisto de apófisis. B: Zoosporangios creciendo en el margen de hojas de Zea mays , mostrando la descarga incipiente de su contenido. C: Agrupación de zoosporas completamente diferenciadas. D: Cuerpo de reposo conteniendo en su interior la espora de reposo en formación (flecha) y la célula acompañante aún con contenido citoplasmático. E-G: Cuerpo de reposo con una, tres y cuatro esporas de reposo en su interior, respectivamente. H: Cuerpo de reposo cuya única espora ha germinado (vacía) dando origen a un zoosporangio (flecha).
Talo policéntrico, eucárpico, de desarrollo variable, mayormente intramatrical. Zoosporangios de pared lisa, usualmente terminales, en ramas cortas u ocasionalmente intercalares, hialinos, 15-26 µm diám., ovoides, elipsoidales o piriformes, operculados, con o sin tubo de descarga. Apófisis basal generalmente ausente. Opérculo cuando presente, liso, que permanece o no adherido al esporangio luego de la descarga. Sistema rizoidal muy ramificado, hialino, con filamentos de diámetro variable. Descarga de las zoosporas semejante a N. elegans. Zoosporas esféricas, 2,5- 3,8 µm diám., con un glóbulo lipídico refringente. Cuerpos de reposo terminales o intercalares, a veces elípticos, (13-) 15-20 (-26) µm diám., conteniendo 1-4 esporas de reposo de pared gruesa, acompañadas por células sin contenido (células acompañantes); esporas de reposo elípticas, 12-14 X 8-11 µm, a la madurez presentan un gran glóbulo refringente, rodeado por varios glóbulos de menor tamaño.
Hábitat : especie saprótrofa sobre restos vegetales en descomposición, muy comúnmente obtenida a partir de muestras de agua incubadas con hojas de Zea mays , y en hojas de Zea mays colocadas in situ .
Distribución geográfica : Brasil, Cuba, Estados Unidos de América, México, Reino Unido y Argentina (material estudiado).
Material examinado : ARGENTINA. Buenos Aires . Partido de La Plata : arroyo Martín, sitios 1 y 3, III- 06, a partir de muestras de sedimento sumergido, leg. Sierra; Partido de Ensenada : arroyo Las Cañas (Reserva Natural Selva Marginal Punta Lara), sitio 2 22-III- 06, a partir de sustratos celulósicos colocados in situ (hojas de Zea mays ), leg. Marano & Saparrat. Marano (LPS 47765 y LPSC 922).
Obs. : Se ha observado la diferenciación dentro del cuerpo de reposo de la espora y su célula acompañante y la geminación de la espora dando origen a un esporangio. La especie ha sido cultivada sobre fragmentos de papel de filtro dispuestos sobre la superficie de medio agarizado YpSs/10 (Marano et al ., 2006), y en medio agarizado YpSs/10 (Fuller & Jaworski, 1987).
3. Nowakowskiella profusa Karling, Bull. Torrey Bot. Club 68: 386. 1941. (Fig. 4, A-C).

Fig. 4. A-C: N. profusa . A-B: Aspecto general del rizomicelio, con zoosporangios descargados, obpiriformes, ovales e irregulares. C: Aspecto del talo con espora de reposo intercalar (flecha). D-H: N. ramosa . D-F: Zoosporangios con tubos de descarga de variada longitud y apófisis esféricas o subesféricas (flecha). G: Zoosporangio descargando. H: Espora de reposo de pared gruesa (flecha), con detalle del seudoparénquima característico (flecha). er: espora de reposo, sp: seudoparénquima.
Talo policéntrico, eucárpico, mayormente intramatrical. Zoosporangios de pared lisa, terminales, laterales o mayormente intercalares, obpiriformes (17-) 20-35 (-37) X 12-20 (-25) µm, globosos o subglobosos, hialinos, esféricos, ovales, obpiriformes o irregulares, con un tubo de descarga prominente usualmente presente. Apófisis generalmente ausente. Opérculo presente, liso, que permanece o no adherido al esporangio luego de la descarga. Sistema rizoidal ramificado, septado, 2,5-7,5 µm de diám., con presencia de engrosamientos miceliares. Zoosporas con un único glóbulo lipídico de menor tamaño que en N. elegans. Esporas de reposo intercalares, alargadas, con bordes truncados, de pared lisa, con contenido granular y color amarillo-dorado, dispuestas ocasionalmente en cadena.
Hábitat : saprótrofa, raramente encontrada creciendo sobre hojas de Zea mays ; obtenida a partir de muestras de agua.
Distribución geográfica : Alemania, Brasil, Estados Unidos de América y Argentina (material estudiado).
Material examinado : ARGENTINA. Buenos Aires . Partido de La Plata : charca semipermanente cercana al arroyo El Pescado (charca A), 14-VIII- 06, a partir de muestras de agua superficial. leg. Arellano. Arellano (LPS 47766).
Obs. : la especie no ha podido ser cultivada en medio agarizado. Se conserva material herborizado. Es característica la forma alargada y la disposición de las esporas de reposo (en su mayoría intercalares), como así también el menor tamaño del glóbulo lipídico en la zoospora, a diferencia del resto de las especies encontradas en el presente estudio.
Johnson (1973) describe para N. profusa , esporangios obpiriformes de mayor tamaño (40-65 X 18-32 µm) que los encontrados en nuestros aislamientos, mientras que el diámetro de los esporangios descriptos por Roberts (1948) coincide con los registrados para nuestros aislamientos.
4. Nowakowskiella ramosa E. J. Butler, Mem. Dep. Agr. India , Bot. Ser. 1: 141. 1907. (Fig. 4, D-H).
Talo policéntrico, eucárpico, mayormente intramatrical. Zoosporangios de pared lisa , terminales o intercalares, esféricos 20-41 (-45) µm diám., piriformes 35-62 (-72) X 20-40 µm, o irregulares, algunos con un largo tubo de descarga. Apófisis basal presente, esférica o subesférica. Opérculo oval o circular, que permanece o no adherido al esporangio luego de la descarga. Sistema rizoidal profusamente ramificado, ocasionalmente septado, formando un seudoparénquima característico en esta especie. Zoosporas esféricas, 7-10 µm diám., con un gran glóbulo refringente, que se forman en una masa envuelta por material mucilaginoso de 32-41 µm diám.; posteriormente se separan y dispersan rápidamente. Esporas de reposo esféricas (15-) 17- 20 (-26) µm diám., de pared lisa, hialinas o amarillas, formadas a partir de ensanchamientos miceliares y ramas laterales cortas.
Hábitat : especie saprótrofa aislada a partir de suelo húmedo sobre tallos de Triticum vulgare , hojas de diversas gramíneas y celofán (Sparrow, 1960), y a partir de núculas en descomposición de Chara sp. (Sparrow & Barr, 1955). En nuestro trabajo ha sido encontrada creciendo en hojas de Zea mays colocadas en el cuerpo de agua durante 10 días.
Distribución geográfica : Brasil, Egipto, Estados Unidos de América, Hungría, India, Sudáfrica y Argentina (material estudiado).
Material examinado : ARGENTINA. Buenos Aires . Partido de Ensenada : arroyo Las Cañas (Reserva Natural Selva Marginal Punta Lara), sitio 1 y sitio 2, 28-VI- 06, a partir de sustratos celulósicos colocados in situ (hojas de Zea mays ), leg . Marano, Melo & Saparrat. Marano (LPS 47767).
Obs. : la especie no ha podido ser cultivada en medio agarizado. Es fácilmente reconocible por la presencia de rizomicelio formando un seudoparénquima característico.
Como fue descripto por Roberts (1948) se observaron en ocasiones esporas de reposo con pared rugosa.
Sparrow (1960) describe para N. ramosa , esporangios esféricos levemente mayores (hasta 50 µm diám.), mientras que nuestras mediciones del tamaño de las esporas de reposo coincide con las observaciones realizadas por este autor.

Frecuencia y abundancia en los ambientes analizados: La frecuencia de colonización del género Nowakowskiella en ambientes acuáticos y terrestres se observa en la Tabla 1. En la Tabla 2 se detalla la frecuencia de colonización (FC %) y abundancia (A %) de este género para los ambientes acuáticos analizados. Las frecuencias de colonización (FC %) y la abundancia (A %) de cada especie se muestran en la Tabla 3 y la frecuencia (FC %) y abundancia (A %) en cada ambiente se detalla en la Tabla 4. En la Tabla 5 se muestran las variaciones en la frecuencia y abundancia en cada fecha de muestreo para N. elegans y N. hemisphaerospora en el arroyo Las Cañas. Arroyo Las Cañas : Se registraron N. elegans, N. hemisphaerospora y N. ramosa. El género se encontró presente en 40 cápsulas de las 120 analizadas y 75 unidades de sustrato de las 600 empleadas (Tabla 2). N. elegans y N.
Tabla 1. Frecuencia de colonización porcentual (FC %) y abundancia porcentual (A %) de Nowakowskiella en ambientes acuáticos y en ambientes terrestres.

Tabla 2. Frecuencia de colonización (FC %) y abundancia (A %) del género para los ambientes acuáticos analizados.

Tabla 3. Frecuencia de colonización porcentual (FC %) y abundancia porcentual (A %) de las especies encontradas.

Tabla 4. Frecuencia de colonización porcentual (FC %) y abundancia porcentual (A %) de las especies encontradas para cada ambiente estudiado.
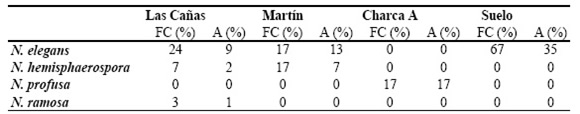
Tabla 5. Variaciones en la frecuencia (FC %) y abundancia (A %) en cada fecha de muestreo (otoño e invierno) para N. elegansy N. hemisphaerospora en el arroyo Las Cañas.

hemisphaerospora se encontraron en otoño e invierno con diferentes frecuencias y abundancias (Tabla 5); N. ramosa sólo se halló en invierno. En relación con las cápsulas de Petri colonizadas por otros hongos zoospóricos (n= 91), el género mostró una frecuencia del 44 %. No se registraron diferencias en el número de cápsulas de Petri colonizadas por Nowakowskiella en los sitios 1 y 2 del arroyo (20 y 19 cápsulas positivas respectivamente).
Arroyo Martín : Se registraron N. elegans en otoño
y N. hemisphaerospora en verano, ambas en los sitios 1 y 3 (no se registró la presencia del género en el sitio 2). Se obtuvieron 6 cápsulas positivas para Nowakowskiella (Tabla 2), de las cuales 3 fueron positivas para N. elegans y 3 para N. hemisphaerospora . En lo referente al número de aislamientos obtenidos, 18 unidades de sustrato fueron colonizadas por alguna de las dos especies (Tabla 2), de los cuales 12 corresponden a N. elegans (AR= 67 %) y 6 a N. hemisphaerospora (AR= 33 %). De las cápsulas de Petri colonizadas por otros hongos zoospóricos (n=10), el género se encontró presente en 6 de ellas (FR %= 60). Charcas de la zona de inundación del arroyo El Pescado : Se registraron N. profusa en la charca A y Nowakowskiella sp. en ambas charcas. N. profusa sólo fue encontrada colonizando una de las cápsulas (el resto corresponde a Nowakowskiella sp.). De las 60 unidades de sustrato empleadas, 13 fueron positivas para Nowakowskiella (Tabla 2), correspondiendo cinco a esta especie (AR= 38 %). La frecuencia relativa de este género en celulosa fue del 50 % (colonizó cinco de las 10 cápsulas de Petri colonizadas por otros hongos zoospóricos). Lotes de frutilla : Solamente N. elegans fue aislada de los lotes M y R. De las unidades muestrales analizadas, ocho fueron colonizadas por N. elegans. Se obtuvieron 21 aislamientos de esta especie, correspondiendo 16 al lote M y 5 al lote R. La frecuencia y abundancia en este ambiente terrestre se detallan en la Tabla 1. Teniendo en cuenta las unidades de sustrato empleadas para cada lote (n s =30), la abundancia fue mayor en el lote M (53 %) que en el R (17 %).
DISCUSION
El género Nowakowskiella ha sido citado por primera vez para Sudamérica (Brasil) por Karling (1944) y posteriormente por Joffily (1947), pero a pesar de ser cosmopolita y ubicuo en su distribución, no existían registros hasta el momento para la Argentina. Las especies descriptas en el presente trabajo han sido encontradas en Brasil, por lo que nuestros hallazgos amplían la distribución para la parte sur del continente americano y representan la primera cita de la familia Cladochytriaceae (Chytridiales) para nuestro país.
Según la escala de Braun-Blanquet, Nowakowskiella es un género escaso en ambientes acuáticos y común en ambientes terrestres; sin embargo en los ambientes acuáticos analizados se han encontrado las cuatro especies de Nowakowskiella y sólo N. elegans en los ambientes terrestres . Comparando los ambientes acuáticos observamos que Nowakowskiella fue más frecuente y abundante en las charcas analizadas que en los ambientes lóticos donde mostró aproximadamente los mismos valores (33 % de frecuencia de colonización y entre un 13-20 % de abundancia). Entre los dos ambientes lóticos estudiados, el género Nowakowskiella se encontró mejor representado en el arroyo Las Cañas que en el Martín, con tres y dos especies respectivamente; sin embargo su frecuencia relativa fue mayor en el arroyo Martín que en Las Cañas. De las especies encontradas N. elegans y N. profusa mostraron los mayores valores de frecuencia y abundancia; mientras que la primera fue de escasa ocurrencia, la segunda al igual que N. hemisphaerospora y N. ramosa , fue una especie rara. En los suelos agrícolas analizados, N. elegans fue más abundante en el lote M que en el R. En el arroyo Las Cañas, N. elegans fue más frecuente y más abundante en invierno, mientras que N. hemisphaerospora lo fue en otoño. En el arroyo Martín las dos especies mostraron los mismos valores de frecuencia, siendo N. elegans más abundante que N. hemisphaerospora.
Estudios realizados en Brasil, han registrado a N. elegans en el proceso de descomposición de hojas sumergidas de Ficus microcarpa durante los meses de abril, mayo y junio (Schoenlein-Crusius & Milanez, 1989); en Alchornea triplinervia , sin embargo, se ha registrado un mayor número de hallazgos de esta especie en hojas colocadas sobre el suelo que en hojas sumergidas (Schoenlein-Crusius & Milanez, 1998b). En Quercus rubur, por otra parte, fue registrada sólo en el mes de febrero y en marzo en Ficus microcarpa (Schoenlein-Crusius et al ., 1992). Estos resultados coinciden con los obtenidos en el presente estudio, en relación al período del año en que ha sido registrada (verano y otoño en el arroyo Martín y otoño e invierno en Las Cañas).
Como ha sido mencionado por Willoughby (1964), N. elegans es una especie frecuente en suelo y se encuentra en los ambientes terrestres cumpliendo un importante rol en la descomposición de sustratos celulósicos.
CONCLUSIONES
N. elegans , N. hemisphaerospora , N. profusa y N. ramosa (Cladochytriaceae, Chytridiomycota) son descriptas e ilustradas por primera vez para la Argentina y se amplían sus distribuciones para América del Sur. El género Nowakowskiella es citado por primera vez en nuestro país, siendo también el primer registro de un quitridio policéntrico perteneciente a la familia Cladochytriaceae. Nowakowskiella es un descomponedor de sustratos celulósicos con gran actividad saprofítica tanto en ambientes acuáticos como en terrestres. El hecho de mostrar mayores valores de frecuencia y abundancia en los ambientes terrestres, y particularmente en el caso de N. elegans , podría deberse a una mayor concentración de estructuras de resistencia en el suelo, indispensables para la supervivencia de la especie ante condiciones fluctuantes en los niveles de humedad, por lo que estaría mejor adaptada a ambientes efímeros que el resto de las especies estudiadas. Concordantemente con esto, el género, se encontró mejor representado en las muestras provenientes de las charcas semipermanentes ubicadas en la zona de inundación del arroyo El Pescado que en los ambientes lóticos (arroyos Las Cañas y Martín).
AGRADECIMIENTOS
Los autores desean expresar su agradecimiento al ANPCyT N° 13404 BID 1201/OC-AR y al PIP N° 5931 por el financiamiento brindado para la realización de este trabajo, como así también a la Universidad Nacional de La Plata, por el subsidio automático N11/ 440, otorgado para el estudio de los hongos acuáticos zoospóricos. Expresamos nuestro mayor agradecimiento a la Ing. Beatriz González por facilitarnos las muestras de suelo y al Dr. Mario Saparrat por su valiosa colaboración en los muestreos.
BIBLIOGRAFÍA
DA ROCHA, M. & C. L. A., PIRES-ZOTTARELLI. 2002. Chytridiomycota e Oomycota da represa do Guarapiranga, São Paulo. Acta Bot. Bras. 16: 287-309. [ Links ]
FULLER, M.S. & A., JAWORSKI.1987. Zoosporic fungi in the teaching and research. Southeastern Pub. Corp., Athens, Georgia. [ Links ]
INDEX FUNGORUM. 2006. CABI Bioscience & CBS database of fungal names.- http://indexfungorum.org/Names/ NamesRecord.asp. [ Links ]
JOFFILY, I. M. 1947. Alguns ficomicetos aquáticos e terrícolas do Brasil. Boletim da Sociedade Brasileira de Agronomia 10: 95-113. [ Links ]
JOHNSON, T. W. JR. 1973. Aquatic fungi of Iceland: some polycentric species. Mycologia 65: 1337-1355. [ Links ]
KARLING, J. S. 1944. Brazilian chytrids. I. Species of Nowakowskiella. Bull. Torrey Bot. Club 71: 374-389. [ Links ]
KARLING, J. S. 1977. Chytridiomycetarum Iconographia . Lubrecht & Cramer, Vaduz. [ Links ]
KERSHAW, K. A. 1973. Quantitative and dynamic plant ecology . American Elsevier Publishing Co., New York. [ Links ]
KIRK, P. M., P. F., CANNON, J. C., DAVID & J. A., STALPERS. 2001. Ainsworth & Bisby's Dictionary of the fungi . 9 th ed. CABI Publishing, Wallingford, Oxon. [ Links ]
LETCHER, P. M., M. J., POWELL, P. F., CHURCHILL & J. G. CHAMBERS. 2006. Ultrastructural and molecular phylogenetic delineation of a new order, the Rhizophydiales (Chytridiomycota). Mycol. Res . 110: 898-915. [ Links ]
MARANO, A. V. & M. M., STECIOW. 2006. Metodología para el análisis cuali-cuantitivo de comunidades de hongos zoospóricos. Actas del XX Congreso Argentino de la Ciencia del Suelo (CD-ROM). [ Links ]
MARANO, A. V., M. M., STECIOW & B. A., GONZÁLEZ. 2006. Primer registro para la Argentina de Rhizophlyctis rosea (Spizellomycetales, Chytridiomycota) y notas sobre su frecuencia y abundancia en suelos cultivados. Boletín de la Sociedad Argentina de Botánica 41 (3-4): 183-191. [ Links ]
MILANEZ, A. I. 1992. Zoosporic fungi in the Neotropics. In : KHULBE, R. D. (ed.), Microbial ecology in the Hymalaias , pp. 14-20. Naini Tal. [ Links ]
MÜELLER, G. M., G. F., BILLS & M. S., FOSTER. 2004. Biodiversity of Fungi: inventory and Monitoring Methods. Elsevier Academic Press, Burlington. [ Links ]
PIRES-ZOTTARELLI, C. L. A. 1990. Levantamento dos fungos zoospóricos da Represa do Lobo («Broa»), São Carlos-SP. Dissertação de Mestrado. Universidade Estadual Paulista, Rio Claro (São Paulo). [ Links ]
PIRES-ZOTTARELLI, C. L. A. 1999. Fungos zoospóricos dos Vales dos Rios Moji e Pilões, Região de Cubatão, São Paulo SP. Tese de Doutorado. Universidade Estadual Paulista, Rio Claro (São Paulo). [ Links ]
PIRES-ZOTTARELLI, C. L. A., A. I., MILANEZ, I. H., SCHOENLEIN-CRUSIUS & L. G., LOHMANN. 1996. Criptógamos do Parque Estadual das Fontes do Ipiranga, São Paulo, SP. Fungos, 6: Chytridiales. Hoehnea 23: 77-90. [ Links ]
ROBERTS, J. M. 1948. Development studies of two species of Nowakowskiella Schroeter: N. ramosa Butler and N. profusa Karling. Mycologia 40: 127- 157. [ Links ]
SHOENLEIN-CRUSIUS, I. H. & A. I., MILANEZ. 1989. Sucessão fúngica en folhas de Ficus microcarpa submersas no lago frontal situado no Parque Estadual Das Fontes Do Ipiranga, São Paulo. Rev. Microbiol. 20: 95-101. [ Links ]
SHOENLEIN-CRUSIUS, I. H. & A. I., MILANEZ. 1998a. Fungos zoospóricos (Mastigomycotina) da mata atlântica da Reserva Biológica do Alto da Serra de Paranapiacaba, municipio de Santo André, SP. Revta. Brasil. Bot. : 177-181. [ Links ]
SHOENLEIN-CRUSIUS, I. H. & A. I., MILANEZ. 1998b. Fungos microcópicos da mata Atlântica de Paranapiacaba, São Paulo, Brasil. Rev. Brasil. Bot. : 73-79. [ Links ]
SHOENLEIN-CRUSIUS, I. H., C. L. A., PIRES-ZOTTARELLI & A. I., MILANEZ. 1992. Aquatic fungi in leaves submerged in a stream of the Atlantic rainforest. Rev. Microbiol. 223: 167-171. [ Links ]
SPARROW, F. K. JR. 1960. Aquatic Phycomycetes . 2 nd ed. Ann. Arbour, Univ. Michigan Press, Michigan. [ Links ]
SPARROW, F. K. JR. & M. E., BARR. 1955. Additions to the Phycomycete flora of the Douglas Lake region. I. New taxa records. Mycologia 47: 546-556. [ Links ]
STEVENS, R. B. 1974. Mycological Guidebook . University of Washington Press, Seattle. [ Links ]
WHIFFEN, A. J. 1943. New species of Nowakowskiella and Blastocladia. J. Elisha Mitchell Sci. Soc . 59: 37-43. [ Links ]
WILLOUGHBY, L. G. 1964. A study of the distribution of some lower fungi in soil. Nova Hedwigia 7: 133-150. [ Links ]
Recibido el 04 de Noviembre de 2006,
aceptado el 09 de Marzo de 2007.














