Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Boletín de la Sociedad Argentina de Botánica
versión On-line ISSN 1851-2372
Bol. Soc. Argent. Bot. v.44 n.3-4 Córdoba ago./dic. 2009
MICOLOGÍA
Comparación de condiciones de cultivo para el aislamiento y recuento simultáneo de levaduras de suelos de bosques nativos de Nothofagus spp. (Fagaceae) de la Patagonia Argentina
María Cecilia Mestre1, Diego Libkind1 y Sonia Fontenla1
1: Laboratorio de Microbiología Aplicada y Biotecnología, INIBIOMA: Universidad Nacional del Comahue - CONICET (Consejo Nacional de Investigaciones Científicas y Técnicas, República Argentina), Bariloche, Río Negro, Argentina.
Resumen: Se compararon las condiciones de cultivo para aislar y contar levaduras del suelo de los bosques nativos de Nothofagus spp. en la Patagonia de Argentina. En este trabajo se propone la utilización de medios de cultivo adicionados con Rosa de Bengala 25 µg/mL y 200 µg/mL de Cloranfenicol. En estas condiciones se obtuvieron recuentos de levaduras que rondan 103 UFC/g de suelo (aproximadamente 4% de la flora microbiana detectada). Se compararon los resultados de aislamientos por el método enriquecimiento-remoción utilizando las condiciones sin-enriquecimiento y con-enriquecimiento. Las levaduras aisladas fueron clasificadas en 7 grupos por características morfológicas y fisiológicas. Utilizando la técnica de MSP-PCR se obtuvieron 10 perfiles de bandas diferentes, que indicarían la presencia de al menos 10 especies en el suelo. La obtención de perfiles de bandas diferentes en los ensayos sin-enriquecimiento y con-enriquecimiento revelan la necesidad de utilizar estas dos formas de cultivo de manera complementaria para la recuperación de otras cepas, inhibidas o subestimadas por el cultivo directo sin-enriquecimiento.
Palabras clave: Levaduras; Suelo; Bosque; Nothofagus; Medios de cultivo medios de aislamiento.
Summary: Comparison of culture conditions for isolation and count of soil yeasts from Nothofagus spp. (Fagaceae) native forest of Argentinean Patagonia. This research proposes the use of culture medium added with 25 µg/mL of Rose Bengal and 200 µg/mL of Chloramphenicol. Under these culture conditions the yeast counts were about 103 CFU/g of soil (approximately 4% of detected microflora). Isolation with and without a previous enrichment step was compared. Isolated yeasts were classified into 7 groups based on morphological and physiological characteristics. 10 different banding patterns were observed using MSP-PCR technique, which indicate the presences of at least 10 species. Different banding pattern was observed between cultures with and without enrichment, this revealed the need of using both isolation techniques in a complementary way to recover strains inhibited or underestimated by direct non-enrichment methods.
Key words: Yeast; Soil; Forest; Nothofagus; Culture media; Isolation medium.
INTRODUCCIÓN
A lo largo de la Cordillera de Los Andes y situados en la porción más occidental de la Región Andino-Patagónica se encuentran los bosques Andino-patagónicos. Muchos de ellos están dominados por especies del género Nothofagus (Cabrera, 1976). Los bosques Andino-patagónicos se caracterizan por el bajo impacto antrópico, una mínima conta-minación atmosférica (Perakis & Hedin, 2002; Perez et al., 2003) y suelos de origen volcánico poco desarrollados (Satti et al., 2007) con alta capacidad para almacenar agua, amortiguar cambios de pH y baja disponibilidad de P (Diehl et al., 2003).
Los suelos constituyen un importante reservorio de diversidad biológica y metabólica; siendo un hábitat favorable para la proliferación de distintos grupos de microorganismos, como virus, bacterias, actino-micetes, hongos, algas y protozoos (Moreira & Siquiera, 2006) Las bacterias representan, en general, el mayor número, y los hongos, el mayor porcentaje de la biomasa microbiana de los suelos. Las bacterias y hongos filamentosos son los integrantes de la comunidad del suelo más estudiados per se y en cuanto a su relación con otros microorganismos. En particular los suelos de bosques suelen ser considerados "puntos calientes" de diversidad, con una gran riqueza de especies, representando ambientes estables (Slavikova & Vadkertiova, 2000).
Las levaduras son hongos de los Phyla Ascomycota o Basidiomycota, con un ciclo de vida predominantemente unicelular, capaces de reproducirse vegetativamente por fisión o gemación, y cuyas estructuras reproductivas no se encuentran incluidas en cuerpos fructíferos (Spencer & Spencer,1997; Kurtzman & Fell, 1998). Las levaduras son ungrupo frecuente en el suelo, aunque en menor número que las bacterias y otros hongos. Se distribuyen en forma desigual tanto en número como en composición de especies con valores que oscilan entre 1 y 106 células viables por gramo de suelo (Botha, 2006). Los métodos para el recuento y aislamiento simultáneo de levaduras son laboriosos, ya que la presencia de otros microorganismos puede inhibir y/o enmascarar el crecimiento de las levaduras en el medio de cultivo. Esto es particularmente importante en el caso de los hongos filamentosos que por tener un crecimiento rápido cubren la superficie de las placas de cultivo, haciendo difícil tanto el recuento como el aislamiento de levaduras. La utilización de compuestos antifúngicos, muchas veces imprescindibles, está condicionada al efecto de estos compuestos sobre las levaduras, ya que por ser hongos pueden ser susceptibles a los mismos componentes (Phaff & Stamer, 1987). Por otra parte la presencia de bacterias puede ser un factor de incertidumbre en el recuento dado que algunas colonias de levaduras y bacterias presentan morfologías similares.
En líneas generales son pocos los trabajos tendientes a estudiar la diversidad de levaduras en suelos como objetivo central. En la Argentina, se aislaron levaduras en suelos de zonas desérticas en la provincia de San Juan (Toro et al., 2005) y a partir de suelo rizosférico y raíces de maíz en la provincia de Buenos Aires (Fraccia et al., 2003). Sin embargo, estos estudios sobre levaduras en suelo apuntan mása la identificación de las levaduras que al número presente. Libkind et al. (2004), estudiaron levaduras pigmentadas de suelos de bosques de Austreocedrus chilensis en el Parque Nacional Nahuel Huapi. En dicho trabajo se utilizaron métodos directos de aislamiento en los que se obtuvo un número reducido de aislamientos y no se realizaron recuentos. Es poco lo que se conoce de la abundancia y diversidad microbiológica de los suelos de los bosques Andino-patagónicos, en particular de las poblaciones de levaduras.
En este contexto se plantean como objetivos de este trabajo formular un medio de cultivo para cuantificar y aislar en forma eficiente y rápida levaduras en suelos de bosques Andino-patagónicos, de forma tal que permita conocer la abundancia y diversidad de levaduras en suelos de bosques nativos de Nothofagus.
MATERIALES Y MÉTODOS
Sitio de muestreo y toma de muestras
Para realizar este trabajo se utilizó suelo de 2 procedencias diferentes: el Cerro Otto (San Carlos de Bariloche, Provincia de Río Negro, Argentina), con un bosque dominado por la especie Nothofagus pumilio (Poepp. & Endl.) Krasser, conocida comúnmente como Lenga, y la zona de Pampa de Trompul (San Martín de los Andes, Neuquén, Argentina), cuyo bosque está dominado por individuos de la especie Nothofagus antarctica (G. Forster) Oerst, conocida comúnmente como Ñire.
Se tomaron 3 sub-muestras de suelo por cada árbol del género Nothofagus, sobre un total de 6 árboles por sitio, para conformar una muestra conjunta por árbol. Cada sub-muestra se colectó a una distancia de 60 cm del tronco y equidistantes entre si. Para ello se utilizó un sacabocado de 10 cm de diámetro, tomando los primeros 40 cm de profundidad, previa remoción de la hojarasca y capa superficial (primeros 2 cm). En cada toma de suelo, el sacabocado fue desinfectado con alcohol etílico y calor.
Las muestras fueron transportadas en bolsas plásticas individuales y conservadas a 4º C hasta su procesamiento en el término de 10 días. Cada una de las muestras fue tamizada a través de una malla de 2 mm, recogiendo así la fracción tamizada de suelo, sin raíces u otros componentes particulados.
Medios de cultivo
Los medios de cultivo utilizados en este trabajo poseen la siguiente formulación: MYP agar (% p/v): extracto de malta 0,7; extracto de levadura 0,05; peptona de soja 0,25; agar 1,5; pH = 4,5; MYP líquido con la misma composición y pH, sin agar. YM agar (% p/v): extracto de malta 0,3; extracto de levadura 0,3; peptona de soja 0,5; glucosa 1; agar1,5; pH = 4,5. MEA (% p/v): extracto de malta 2; agar 1,5; pH = 4,5. Agar Mosto (AM, Merk®; % p/v): extracto de malta 1,5; peptona 0,075; maltosa 1,275;dextrosa 0,275; glicerina 0,235; KH2PO4 0,04; ClNH4 0,1; agar 2 (Yarrow, 1998). Se adicionaron en los distintos ensayos distintas combinaciones y concentraciones de antimicrobianos. Como antibióticos de uso frecuente se usaron cloranfenicol (Clo; Anedra®), estreptomicina (Str; Richet®) y/o ampicilina (Amp; Sigma®) (Yarrow, 1998), y como fungistáticos Rosa de Bengala (RB, Cicarelli®) y Benomil (Ben; Fungicap®) (King et al., 1979).
Ensayos cualitativos
En éste ensayo se utilizaron YM o MYP, y se probaron diversas combinaciones de antimicrobianos a fin de seleccionar las condiciones necesarias para realizar el recuento y aislamientos de levaduras en forma simultánea. Los tratamientos sin fungistáticos tenían Clo 0,1 y 0,4 µg/mL sólo o en conjunto con Amp 0,1 µg/mL. Los tratamientoscon fungistáticos presentaban Cl 0,1 y 0,4 µg/mL sólo o en conjunto con RB 25 µg/mL o YM agar con Clo 0,4 µg/mL sólo o conjunto con Str 0,2 µg/mL. Se probó Ben en distintas concentraciones: 0,1, 0,15y 0,20 µg/mL.
Se realizaron diluciones decimales del suelo proveniente de Cerro Otto en solución fisiológica (NaCl 0,9%), con inóculo de 1 gr de suelo y diluciones partir de 10-1 hasta 10-3. Las mismas se agitaron a 250 rpm por 30 min para liberar losmicroorganismos de las partículas de suelo. Entodos los casos se sembraron por agotamiento ensuperficie 100 µL de la suspensión del suelo enplacas de Petri conteniendo medio sólido, que seincubaron 72 hs a 20º C y hasta 120 hs a 4º C. A las72 hs de cultivo se realizó el recuento aproximadode unidades formadoras de colonia (UFC) por gramo de suelo, utilizando microscopioestereoscópico Olympus SZX9.
Ensayos de recuento
Se suspendieron 4 g de suelo de Cerro Otto, ensolución fisiológica (NaCl 0,9%) alcanzando unaconcentración final de 1:25 (p/v). La misma se agitó a 250 rpm por 30 min para liberar los microorganismos de las partículas de suelo. Se sembraron por agotamiento en superficie 100 µL de la suspensión del suelo, en placas de Petri conteniendo medio sólido (YM, MEA, MYP o AM), por triplicado. Se realizó el recuento de unidades formadoras de colonia (UFC) por placa, utilizando microscopio estereoscópico Olympus SZX9, a las72 hs de incubación a 20º C. Las placas de recuento contenían Clo 200 µg/mL y/o Str 100 µg/mL. Los fungistáticos utilizados fueron 25 µg/mLde RB o 100 µg/mL de Ben. Los resultados se registraron como UFC/g de suelo para cada medio de cultivo, que se presentaron como valores porcentuales promedio respecto del total de microorganismos.
Ensayo de enriquecimiento-remoción
Se inocularon 4 g de suelo de Pampa del Trompul, en caldo MYP con Str 100µg/mL alcanzando una concentración final de 1:25 (p/v), que se incubó durante 72 hs a temperatura ambiente en agitador a 200 rpm. Se centrifugó a baja velocidad por 10 min a fin de facilitar la remoción de los hongos filamentosos en el precipitado y se recuperó el sobrenadante (= con-enriquecimiento). Se utilizó como control del ensayo, la misma dilución de suelo en solución fisiológica sin enriquecimiento. A partir de ambas suspensiones, con-enriquecimiento y sin-enriquecimiento, se sembró una alícuota de 100 µL en placas de Petri conteniendo medio MYP agar con Clo 200 µg/ mL, con o sin RB 25 µg/mL, por triplicado. Se incubaron72 hs a 20º C y hasta 120 hs a 4º C. En estas placas se realizó el recuento de UFC a las 72hs de cultivo y los resultados se registraron como UFC/g de suelo.
Se picaron 3 colonias de levaduras de cada morfotipo observado en ambas condiciones. Se realizó el aislamiento y purificación de dichas colonias en medio MYP agar sin agregado de antibiótico, ni antifúngico. Se registraron las características macro y micromorfológicas (color, aspecto, textura, tipo de crecimiento y morfología celular) utilizando una microscopio óptico Olympus BX40 y la producción de compuestos amiláceos (PCA, Yarrow, 1998) de todos los aislamientos, con las que se conformaron grupos preliminares según similitud. Todos los aislamientos se criopreservaron en caldo MYP con 12% glicerina a -20º y los representantes de los grupos se depositaron en la colección de cultivos de levaduras del Centro Regional Universitario Bariloche, Universidad Nacional del Comahue, Argentina.
PCR fingerprinting.
A fin de estudiar la posible existencia de diferencias entre las poblaciones de levaduras obtenidas con o sin enriquecimiento (condiciones del ensayo de enriquecimiento-remoción y su control) se seleccionaron 16 aislamientos del total, representantes de los diferentes grupos preliminares (entre 2 y 4 por grupo, si era posible y en correspondencia con el número de aislamientos por grupo) (Tabla 3). Sobre estos 16 aislamientos se estudió el patrón de "huellas moleculares" del ADN por el método de "Mini/Microsatellite primed PCR" (MSP-PCR), con los iniciadores (GTG)5 y M13 por separado, según Libkind et al. (2003) y Libkind (2007). La visualización se realizó por electroforesis en gel de agarosa al 1,5% en tampón TBE 0,5 X. El gel fue teñido con una solución de bromuro de etídio (5 µg/mL) y el patrón de bandas se registró con un sistema de captura de imágenes VilberLourmat.
RESULTADOS
Ensayos cualitativos y de recuento (cuantitativo)
Para la formulación de los medios de cultivo, se realizaron ensayos cualitativos sobre suelo del Cerro Otto, correspondiente al bosque de "lenga" (Nothofagus pumilio). En estos ensayos sin fungistáticos se observó que el recuento de microorganismos totales del suelo estudiado ronda nentre 104 y 105 UFC/g de suelo. En estas placas se observó un desarrollo fúngico elevado, con micelio denso y de rápido crecimiento que dificultó la individualización de los otros grupos de microorganismos, que crecieron por debajo del micelio, y el aislamiento de levaduras. En general la morfología de las colonias de bacterias y levaduras fue similar (blancas a beige, cremosas, de borde liso o mucoso) resultando difícil distinguir entre ambos grupos en una observación directa a las 72 hs de cultivo a 20º C.
Al incluir Rosa de Bengala en los medios de cultivo se observó la reducción del tamaño de las colonias de hongos filamentosos y de la formación de micelio aéreo. Los recuentos de microorganismos totales, tras 72 hs de cultivo a 20º C, alcanzaron valores de 105 UFC/g de suelo. A las 120 hs de cultivo mejoró el reconocimiento diferencial entre bacterias y levaduras y los hongos filamentosos permanecen relativamente inhibidos con un crecimiento limitado, siendo los recuentos de levaduras entre 103 y 104 UFC/g de suelo, según la concentración de antibiótico.
Al utilizar Benomil en bajas concentraciones (0,1 µg/mL) se observó un número menor de hongos filamentosos que en presencia de Rosa de Bengala, pero las colonias presentaron mayor diámetro y micelio más denso. Tras 120 hs de cultivo, luego del cambio de temperatura de incubación, las colonias no filamentosas quedan cubiertas por el denso micelio. El recuento promedio de microorganismos totales en suelo fue de 104 UFC/g de suelo, inferior que en los cultivos con Rosa de Bengala (105 UFC/g de suelo). La concentración de antibióticos (0,4 µg/mL) en este medio, al igual que cuando se usó Rosa de Bengala, fue insuficiente para controlar el crecimiento bacteriano, dificultando el reconocimiento diferencial de levaduras y bacterias. El recuento aproximado de levaduras fue de 102 UFC/g de suelo.
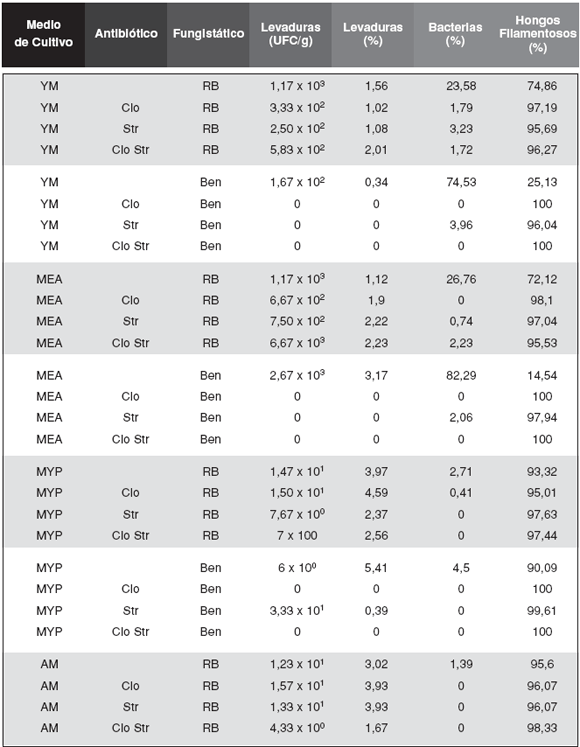
Los resultados obtenidos a partir de los ensayos cualitativos, permiten establecer las bases para realizar los ensayos cuantitativos sobre suelo de Cerro Otto. En los ensayos de recuento la utilización de concentraciones mayores (unas 1000 veces) de antibióticos que en el ensayo cualitativo preliminar, fue efectiva para controlar el crecimiento de bacterias y facilitar el aislamiento de levaduras y su posterior purificación. En general se obtuvo una mejor inhibición del crecimiento bacteriano cuando se usó Cloranfenicol (Tabla 1). En las placas con Rosa de Bengala se pudo realizar el recuento y aislamiento de levaduras. La utilización de Benomil en mayor concentración (100 µg/mL) fue efectiva en el control de los hongos filamentosos, observando colonias más pequeñas. En presencia de Rosa de Bengala el recuento de hongos filamentosos fue mayor que con Benomil, ya que crecieron colonias pequeñas y diseminadas que no se solapan unas con otras permitiendo su individualización. Cuando se utilizó en forma combinada el Benomil con los antibióticos se observó inhibición del crecimiento de las levaduras, hecho no observado con Rosa de Bengala (Tabla 1).
Tabla 1: Recuento de levaduras (UFC/g de suelo de Cerro Otto) y proporción de colonias de bacterias, levaduras y hongos filamentosos respecto del total de microorganismos del suelo (%) en el Ensayo deRecuento
Ensayo de enriquecimiento-remoción.
En la Tabla 2 se observan los valores de recuento de microorganismos del suelo proveniente de Pampa del Trompul, correspondientes al ensayo de enriquecimiento-remoción. El número de hongos filamentosos es de 2 órdenes de magnitud menor que el del control sin enriquecimiento, producto de la remoción por centrifugación posterior al enriquecimiento. Como resultado del tratamiento con-enriquecimiento las levaduras alcanzaron valores superiores en uno o dos ordenes de magnitud y se obtuvieron 18 aislamientos. En el control sin enriquecimiento los valores de levaduras fueron de 102 - 103 UFC/gr de suelo y fue posible obtener 20 aislamientos de levaduras. El total de los aislamientos (38) se reunieron en siete grupo preliminares: tres exclusivos del cultivo sin-enriquecimiento (I a III), tres exclusivos del tratamiento con-enriquecimiento (V aVII) y un grupo con representantes de ambos tipos de cultivo (IV) (Tabla 3).
Tabla 2: Recuento de microorganismos del suelo de Pampa del Trompul (UFC/g de suelo) en el Ensayo de enriquecimiento-remoción.
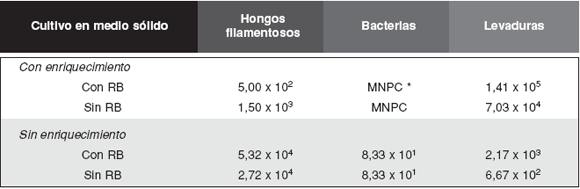
Condiciones de cultivo: temperatura 20º C, 72 hs. de cultivo, medio de cultivo MYP con Cloranfenicol 200µg/mL, RB: Rosa de Bengala 25µg/mL. *MNPC: muy numeroso para contar.
Tabla 3: Características de los aislamientos obtenidos a partir del Ensayo de Enriquecimiento-Remoción y grupos preliminares formados por macro-micromorfología y producción de compuestos amiláceos.
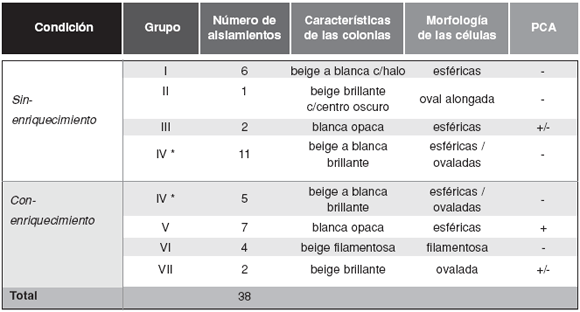
PCA: producción de compuestos amiláceos. * Grupo IV posee representantes de ambas condiciones.
A partir del análisis de PCR fingerprinting (con el iniciador GTG5) realizado sobre los aislamientos representantes de los grupos preliminares se observaron 5 perfiles de bandas diferentes entre los provenientes del cultivo post-enriquecimiento y 6 de los aislamientos sin-enriquecimiento. Los aislamientos Ib, VIIa y VIIb son el único caso que presenta perfiles de bandas similares entre el cultivo con y sin enriquecimiento (Fig. 1).
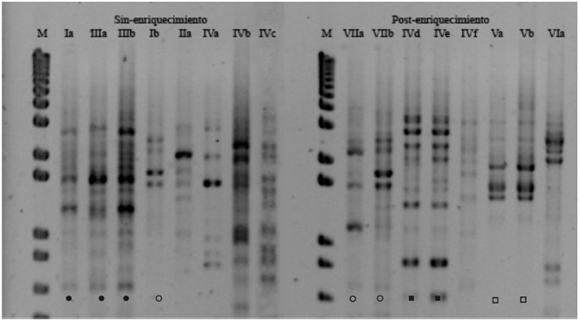
Fig. 1.: Perfil molecular obtenidos por MSP-PCR fingerprinting con el cebador (GTG)5, del Ensayo deenriquecimiento-remoción. Aislamientos representantes de los grupos preliminares formados por macromicromorfología y compuestos amiláceos. M: marcador de peso molecular 1Kb Plus DNA Ladder Invitrogen®. I a VII: grupos preliminares. Diferentes aislamientos pertenecientes al mismo grupo preliminar se identifican con letrascorrelativas.![]() marcan perfiles de bandas similares.
marcan perfiles de bandas similares.
En la condición sin-enriquecimiento, solo el grupo III es homogéneo en cuanto a perfiles de banda y macro-micromorfología. Este perfil de bandas es compartido con el aislamiento Ia que pertenece al grupo I de macro-micromorfología. Los integrantes de los grupos I y IV presentan perfiles de bandas diferentes. Los grupos conformados por los aislamientos provenientes del cultivo con-enriquecimiento presentaron perfiles homogéneos y los representantes de un mismo grupo de macro-micromorfología coinciden en sus perfiles de bandas. El grupo IV reúne aproximadamente el 40% de los aislamientos obtenidos, incluyendo aislamientos deambas condiciones de cultivo, y resulta heterogéneo en cuanto a los perfiles de bandas incluidos en él (Fig. 1, Tabla 3). Resultados similares se observaron utilizando el cebador M13 en experimentos de MSP-PCR (datos no mostrados).
DISCUSIÓN Y CONCLUSIÓN
Luego de 72 hs de cultivo a 20º C la distinción entre colonias de bacterias y de levaduras resulta difícil dado su pequeño tamaño. Ante esta dificultad una alternativa es prolongar el tiempo de incubación (hasta que el tamaño de las colonias permita diferenciarlas) y bajar la temperatura a 4C, para disminuir la velocidad de crecimiento de los hongos filamentosos. Cuando el cultivo alcanzó las 120 hs (luego del cambio de temperatura) los hongos filamentosos cubrieron completamente las placas de cultivo y esto impide realizar un recuento diferencial y exacto de cualquiera de los grupos de microorganismos. Por ello la inhibición del crecimiento de hongos y bacterias es fundamental para el recuento y aislamiento de levaduras a partir de suelo. Los medios de cultivo con Rosa de Bengala y Benomil se proponen en la bibliografía (King et al., 1979) como una opción para el aislamiento y recuento de mohos de crecimiento rápido, ya que tienen la capacidad de limitar su crecimiento. En este mismo sentido, el Benomil se ha utilizado en los bosques andino-patagónicos para limitar el crecimiento de hongos filamentosos a partir de muestras naturales de madera de Nothofagus (Pozzi, comunicación personal). En este trabajo estos compuestos también mostraron la capacidad de restringir el crecimiento de los hongos filamentosos de las muestras de suelo, generando colonias más pequeñas. Sin embargo el uso conjunto de Benomil con antibióticos inhibió totalmente el crecimiento de levaduras y dada la carga bacteriana de los suelos (aproximadamente 104 UFC/g) es imprescindible el uso de antibacterianos. Por otro lado, en el cultivo con Rosa de Bengala, el micelio puede ser retirado fácilmente con ansa estéril, facilitando así el recuento y el aislamiento simultaneo de levaduras, aún cuando las colonias se encuentren por debajo del micelio fúngico. Es por esto que en las condiciones de este trabajo se selecciona al Rosa de Bengala y se desestima el uso de Benomil para el aislamiento de levaduras en suelo. Un aspecto poco ventajoso a tener en cuenta al incluir Rosa de Bengala, es que este compuesto dificulta la visualización de colonias pigmentadas, ya que tiñe el medio y la mayoría de las colonias de color rosa.
En el ensayo de enriquecimiento-remoción, se observó una remoción eficaz de los hongos filamentosos por centrifugación. Al comparar los resultados de los cultivos con-enriquecimiento y sin-enriquecimiento se desprende que las diferentes condiciones de cultivo favorecen el desarrollo de diferentes poblaciones de levaduras y excluyen otras. La utilización de uno solo de ellos para aislar levaduras, subestimaría la diversidad presente en el suelo. Las levaduras aisladas con y sin enriquecimiento fueron clasificadas en 7 grupos por su macro-micromorfología y la producción de compuestos amiláceos; y el análisis de los patrones de banda obtenidos por la técnica de MSP-PCR reveló la presencia de al menos 10 especies de levaduras. De esta forma la técnica de MSP-PCR se percibe como una forma complementaría y más potente para observar diferencias en las poblaciones de levaduras. La identificación a nivel de especie de los aislamientos, se encuentra en progreso, y permitirá ampliar los estudios de diversidad de levaduras en los suelos en estudio.
Como conclusión de este trabajo se puede afirmar que la elección del compuesto antimicrobiano a utilizar en la formulación del medio de cultivo es clave y su efectividad no puede medirse únicamente en el valor obtenido en el recuento, ya que muchas veces los efectos sobre los microorganismos también se reflejan en su aspecto y velocidad de crecimiento. Un aspecto a tener en cuenta es la factibilidad de realizar simultáneamente el recuento y el aislamiento de levaduras con relativa celeridad y practicidad. Teniendo en cuenta los resultados obtenidos, se propone el uso de Rosa de Bengala 25 µg/mL en combinación con Cloranfenicol 200 µg/mL, para realizar recuentos y aislamientos simultaneos, si el objetivo del trabajo es estudiar la abundancia y diversidad de levaduras en suelos.
Así mismo la obtención de perfiles de bandas diferentes en los ensayos post-enriquecimiento y sin-enriquecimiento revelan la necesidad de utilizar además éstas dos formas de cultivo de manera complementaria para la recuperación de otras cepas, inhibidas o subestimadas por el cultivo directo sin enriquecimiento. La remoción de los hongos filamentosos con centrifugación post-enriquecimiento es un método fácil y potencialmente permite recuperar aislamientos de levaduras que estén inhibidos por los fungistáticos.
En los suelos estudiados se obtuvieron recuentos de levaduras que rondan 102 - 101 UFC/g de suelo en suelo asociados a N. pumilio (Cerro Otto) y 103 en suelo asociados a N. antárctica (Pampa el Trompul). En ambos casos, las levaduras constituyen aproximadamente el 4% de la flora microbiana total detectada en estas condiciones de cultivo (MYP+Clo+RB). Estos datos constituyen la primera prospección de levaduras de suelos Andino patagónicos.
AGRADECIMIENTOS
El presente trabajo ha sido financiado por la Universidad Nacional del Comahue (proyectoB143), y la ANPCyT (proyecto PICT04-22200, PMT - BID 1728/OC-AR). Se agradece el permiso de muestreo a la administración de Parques Nacionales.
BIBLIOGRAFÍA
1. BOTHA, A., 2006. Yeast in Soil. In: ROSA C. & P. GÁBOR (eds.) Biodiversity and Ecophysiology of Yeast. pp. 221-240. Springer-Verlag, Berlin Heidelberg. [ Links ]
2. CABRERA, A. L. 1976. Regiones fitogeográficas de la República Argentina. In: Enciclopedia Argentina de Agricultura y Jardinería 2 (1). pp. 1-85 Editorial ACMES. A.C.I., Buenos Aires. [ Links ]
3. DIEHL P., M. J. MAZZARINO, F. FUNES, S. FONTENLA, M GOBBI & J. FERRARI. 2003. Nutrient conservation strategies in native Andean-Patagonian forests. J. Veg. Sci.14: 63-70. [ Links ]
4. FRACCHIA S., A. GODEAS, J. M. SCERVINO, I. SAMPEDRO, J. A. OCAMPO & I. GARCÍA-ROMERA. 2003. Interaction between the soil yeast Rhodotorula mucilaginosa and the arbuscular mycorrhizal fungi Glomus mosseae and Gigaspora rosea. Soil Biol. Biochem. 35: 701-707. [ Links ]
5. KING A. D., HOCKING A. D. & J. I. PITT. 1979. Dichloran-Rose Bengal Medium for Enumeration and Isolation of Molds from Foods. Appl. Environm. Microbiol. 37(5): 959-964. [ Links ]
6. KURTZMAN, C. P. & J. W. FELL. 1998. Definition, Clasification and Nomenclature of the Yeast. In: KURTZMAN, CP. & JW. FELL (eds.). The yeast. A taxonomic study, pp. 3-5. Elsevier Science Publishers, Amsterdam [ Links ]
7. LIBKIND D., A. RUFFINI & M. R. VAN-BROOCK. 2004. Levaduras teleomórficas pigmentadas de ambientes naturales de la Patagonia nor-occidental. Bol. Soc. Argent. Bot. 39(1-2): 5-12. [ Links ]
8. LIBKIND D., S. BRIZZIO, A. RUFFINI, M. GADANHO, M. R. VAN BROOCK & J. P. SAMPAIO. 2003. Molecular characterization of carotenogenic yeasts from aquatic environments in Patagonia, Argentina. Antonie van Leeuw. Int. J. G. 84(4): 313-322. [ Links ]
9. LIBKIND, D. 2007. Evaluación de la tecnica de MSP-PCR para la caracterización molecular de aislameintos de Rodhotorula mucilaginosa provenientes de la Patagonia noroccidental. Revista Argent. de Microbiol. 39(3): 133-137. [ Links ]
10. MOREIRA F. M. S. & J. O. SIQUIERA. 2006 Os organismos do solo. In: Microbiologia e Bioquimica do Solo. 2nd ed. Lavras. pp.17-82. UFLA [ Links ]
11. PERAKIS S. S. & L. O. HEDIN. 2002. Nitrogen loss from unpolluted South American forests mainly via dissolved organic compounds. Nature 415(24): 416-419. [ Links ]
12. PEREZ C. A., J. J. ARMESTO, C. TORREALBA & M. R. CARMONA. 2003. Litterfall dynamics and nitrogen use efficiency in two evergreen temperate rainforests of southern Chile. Austral Ecol. 28: 591-600. [ Links ]
13. PHAFF, H. J. & W. T. STAMER. 1987. Yeasts associated with plants, insects and soil. In: ROSE A. H. & J. S. HARRISON (eds.). The Yeasts. Volume 1, pp. 123-180. Academic Press, London. [ Links ]
14. SAMPAIO J. P., M. GADANHO, S. SANTOS, F. DUARTE, C. PAIS, A. FONSECA & J. W. FELL. 2001. Polyphasic taxonomy of the genus Rhodosporidium: R. kratochvilovae and related anamorphic species. Int. J. Syst. Evol. Microbiol. 51: 687-697. [ Links ]
15. SATTI P., M. J. MAZZARINO, L. ROSELLI & P. CREGO. 2007. Factors affecting soil P dynamics in temperate volcanic soils of southern Argentina. Geoderma 139: 229-240. [ Links ]
16. SLAVIKOVÁ E., VADKERTIOVÁ R. 2000. The ocurrence of yeast in Forest soils. J. Basic Microbiol. 40(3): 207-212. [ Links ]
17. SPENCER JFT. & DM. SPENCER. 1997. Yeast as lining objects:Yeast Nutrition. In: SPENCER JFT. & DM. SPENCER (eds.). Yeast in natural and artificial habitats, pp.67-79.Springer, Berlin. [ Links ]
18. TORO M. E, N. P. ORO, A. D. VEGA, Y. P. MATURANO, M. C. NALLY, E. FERNANDEZ, E. PUCHETA & F. VAZQUEZ. 2005. Diversidad de levaduras en canopias y suelos asociados a Bulnesia retama y Larrea divaricada. Revista Argent. Microbiol. 37: 209-213. [ Links ]
19. YARROW D. 1998. Methods for the isolation, maintenance and identification of yeasts. In: KURTZMAN, CP. & JW. FELL (eds.). The yeast. A taxonomic study, pp.77-100. Elsevier Science Publishers, Amsterdam. [ Links ]
Recibido el 17 de noviembre de 2008
Aceptado el 25 de junio de 2009.














