Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Boletín de la Sociedad Argentina de Botánica
On-line version ISSN 1851-2372
Bol. Soc. Argent. Bot. vol.44 no.3-4 Córdoba Aug./Dec. 2009
MICOLOGÍA
Levaduras fermentadoras aisladas de Cyttaria hariotii (Fungi) en bosques Andino-Patagónicos (Argentina)
José Ulloa1, Diego Libkind2, Sonia Fontenla2 y María Van Broock2
1 Laboratorio de Biolixiviación, FAIN - Universidad Nacional de Comahue - IDEPA - CONICET. Buenos Aires 1400. Neuquén. CP: 8300 - E-mail: ricardofull@gmail.com
2 Laboratorio de Microbiología Aplicada y Biotecnología, CRUB-Universidad Nacional del Comahue. Quintral 1250. S. C. de Bariloche, Río Negro. Argentina. CP: 8400.
Resumen: Las levaduras han estado asociadas al hombre desde épocas muy tempranas. Entre estas se destacan las fermentadoras debido a su importancia en la industria de los alimentos. Las implicancias biotecnológicas de estas levaduras han sido extensamente estudiadas, sin embargo la distribución en la naturaleza y la ecología de estas no se encuentra igualmente documentada. El presente estudio se realizó en el Parque Nacional Nahuel Huapi (Noroeste Patagónico, Argentina) sobre Cyttaria hariotii, hongo ascomicético parásito de árboles del género Nothofagus. Mediante el uso de un medio selectivo con etanol 8 % se obtuvieron 72 aislamientos. Los mismos fueron ordenados en cinco grupos en base a pruebas morfológicas y fisiológicas, tres de los cuales fueron asignados a los géneros Saccharomyces, Pichia y Kloeckera. El grupo Saccharomyces presentó el mayor número de aislamientos y se subdividió en tres subgrupos, dos de ellos presentan alta afinidad con S. bayanus y/ó S. uvarum. La totalidad de los aislamientos fueron psicrotolerantes y la temperatura máxima de crecimiento osciló entre 35 y 37 ºC. El presente trabajo contribuye al conocimiento de la biodiversidad de levaduras de la Patagonia y representa el primer aislamiento masivo de levaduras sacaromicéticas en ambientes naturales de la región.
Palabras clave: Levaduras fermentadoras; Cyttaria hariotii; Biodiversidad de levaduras; Fisiología de levaduras; Psicrotolerantes; Bosque Andino-patagónico.
Summary: Fermenting yeasts isolated from Cyttaria hariotii (Fungi) in the Andean Patagonic Forest. Yeasts have been associated with mankind from early ages. Among these, fermentative yeasts played the most relevant role, due to its importance in the food industry. The biotechnological implications of these yeasts have been extensively studied. However there is a lack of information about its distribution in nature and ecology. In this study samples of Cyttaria hariotii, ascomycete fungus parasite of trees of the genus Nothofagus, were collected in Nahuel Huapi National Park (Northwestern Patagonia, Argentina). 72 isolates were obtained using a selective culture medium with 8% ethanol. Identification of the isolates was based on morphological and physiological tests, and then sorted into five groups. Three groups were assigned to the genera Saccharomyces, Pichia and Kloeckera respectively. The Saccharomyces group was the prevailing one, and was sorted into three subgroups. Two of them were related to S. bayanus and /or S. uvarum. All the isolates were psychrotolerant and the maximum growth temperature ranged between 35 and 37 ºC. This work contributes to the knowledge of the biodiversity of yeasts in the region and represents the first massive isolation of Saccharomyces yeasts in natural environments of Patagonia.
Key words: Fermenting yeasts; Cyttaria hariotii; Yeasts biodiversity; Yeasts physiology; Psychrotolerant; Andean Patagonic Forest.
INTRODUCCIÓN
El hombre ha estado en contacto con las levaduras desde épocas muy tempranas, las ha utilizado principalmente y dada su capacidad fermentativa, en la elaboración empírica de alimentos. Entre las levaduras fermentadoras las especies del géneroSaccharomyces se destacan por poseer alta eficiencia de producción de etanol y elevada tolerancia al mismo (Deak, 2006). Han sido descriptos otros géneros de levaduras fermentadoras (también conocidas como no-sacaromicéticas) entre los que se encuentran Brettanomyces, Debaryomyces, Dekkera, Hanseniaspora, Pichia, Torulaspora, Zygosaccharomyces y sus respectivos anamorfos (Kurtzman & Fell, 1998). La mayoría de dichos géneros tienen importancia en la industria alimenticia dado que pueden alterar positiva o negativamente la calidad del producto final. Tal es así el caso de las levaduras floculantes en la industria vinícola que confieren características organolépticas no deseadasa los vinos (Fleet, 1992; Stratford, 2006). Las utilidades e implicancias biotecnológicas de las levaduras fermentadoras han sido extensamente estudiadas, sin embargo la distribución en la naturaleza y la ecología de estas levaduras se encuentra mucho menos documentada.
En América del Sur y en particular en Argentina, los estudios respecto de levaduras fermentadoras asociadas a la producción vínica están adquiriendo relevancia (Lopes et al., 2002; Sangorrín et al., 2002; Dorneles et al., 2005; Lopes et al., 2005); sin embargo, los estudios sobre la diversidad de levaduras fermentadoras de ambientes naturales y los aspectos ecológicos que intervienen sobre estas poblaciones nativas son escasos. Entre estos, se puede mencionar el estudio de levaduras asociadas a canopias y suelo lindante de especies arbustivas próximas a viñedos de la provincia de San Juan, Argentina, entre las que se aislaron especies fermentadoras como S. cerevisiae (Toro et al., 2005). Así mismo en el Noreste Argentino se han realizado estudios de ecología de levaduras y su asociación con plantas del género Prosopis (Fabaceae) y Opuntia (Cactaceae) en los que se han aislado levaduras fermentadores (Spencer et al., 1996; de Figueroa et al., 2004). En la Patagonia, Brizzio & vanBroock (1998) aislaron de los estromas del hongo Cyttaria hariotii los géneros Kloeckera, Candida, Rhodotorula y Saccharomyces entre los que podrían existir especies fermentadoras. Cyttaria hariotii es un hongo ascomicético del Orden Cyttariales, Familia Cyttariaceae, parásito de árboles del género Nothofagus (Gamundí & de Lederkremer, 1989;Gamundí, 1991). Dichos estromas se caracterizan por poseer un alto contenido en carbohidratos, correspondiendo el 10,2% de su peso seco a azúcares simples como glucosa, fructosa y sacarosa, entre otros (de Lederkremer & Cirelli, 1988; Gamundí & deLederkremer, 1989). Los hallazgos preliminares de géneros, que incluyen especies fermentadoras, las características químicas de los estromas, la constatación empírica de procesos fermentativos en estos hongos maduros y los registros de su utilización para producir bebidas fermentadas, sugieren que C. hariotii es un sustrato factible de sustentar el crecimiento de levaduras fermentadoras. Por lo antes expuesto, el objetivo de este trabajo es estudiar la presencia y caracterizar fisiológicamente las levaduras fermentadoras asociadas a estromas de C. hariotii en el Parque Nacional Nahuel Huapi (PNNH), Río Negro, Argentina. Al mismo tiempo se pretende establecer un medio de cultivo apropiado para aislar levaduras fermentativas de un inóculo fúngico.
MATERIALES Y MÉTODOS
Aislamiento de levaduras. Las levaduras estudiadas en el presente trabajo fueron aisladas de estromas de Cyttaria hariotii E. Fisch. obtenidos de árboles de Nothofagus dombeyi (Mirb.) Blume. y Nothofagus antarctica (G. Forst.) Oerst. en proximidades del lago Mascardi (Parque Nacional Nahuel Huapi, Provincia de Río Negro, Patagonia, Argentina). Los estromas fueron procesados según se describe en Libkind et al. (2007) y las levaduras fueron aisladas utilizando un medio selectivo para levaduras fermentadoras basado en la presencia de etanol 8 % v/v (Sampaio & Gonçalves, 2008).
Los aislamientos, una vez purificados, fueron conservados mediante repiques periódicos, en tubos en pico de flauta con medio YMA a 4 ºC. Simultáneamente se conservaron por crio conservación, en caldo YM con glicerol (12 % v/v) a -20 ºC. Los aislamientos fueron ingresados al cepario de levaduras del Centro Regional Universitario Bariloche-UNCo.
Caracterización morfológica de los aislamientos. Para la caracterización macro y micro-morfológica se evaluaron los siguientes caracteres: color, textura, morfología del borde y elevación de las colonias sobre el medio; forma celular, tipo de brotación y tipo de gemación de las células vegetativas (Yarrow, 1998). Todos los aislamientos fueron estudiados respecto de su capacidad de producir estructuras sexual utilizando un medio de cultivo para la inducción de la esporulación (acetato de potasio 0,35% p/v; agar-agar 2% p/v). La observación de las estructuras sexuales se llevó a cabo bajo microscopio óptico BX40. Los grupos se organizaron utilizando las características morfológicas y sexuales de los distintos aislamientos de levaduras, estableciendo la identificación taxonómica preliminar (cuando fuese factible).
Caracterización fisiológica de los aislamientos. Se seleccionó un número representativo de aislamientos por grupo a los que se les realizó un conjunto de pruebas fisiológicas (33 pruebas de asimilación de diferentes fuentes de carbono y 13 pruebas de fermentación). Los ensayos se realizaron de acuerdo a la metodología descripta por Yarrow (1998), se incubaron a 20 °C y se realizó una apreciación cualitativa del crecimiento en cada una de ellas (positivo, positivo débil). Las fuentes de carbono testeadas en las pruebas de asimilación fueron: D-glucosa, D-galactosa, L-sorbosa, D-glucosamina, D-ribosa, D-xilosa, L-arabinosa, D-arabinosa, L-ramnosa, sacarosa, maltosa, a,a-trehalosa, celobiosa, salicina, arbutina, melibiosa, lactosa, rafinosa, a-melezitosa, almidón soluble, glicerol, meso-eritritol, ribitol, xilitol, D-glucitol, D-manitol, D-galactitol, myo-inositol, glucono-d-lactona, D-glucuronato, DL-lactato, succinato y citrato. Se evaluó también la producción de compuestos amiláceos (PCA).
El ensayo de fermentación se realizó utilizando las siguientes fuentes de carbono: celobiosa, fructosa, galactosa, glucosa, inulina, lactosa, maltosa,a?- melezitosa, melibiosa, rafinosa, sacarosa, a,a-trehalosa y xilosa. Los resultados fueron analizados con la siguiente escala de valores: (+f): fermentación fuerte (campana de Durham llena antes de tres días), (+d): fermentación débil (campana de Durham llena en más de tres días), (-): fermentación negativa.
Se estudió el crecimiento de los aislamientos representativos de los grupos a distintas temperaturas, el rango utilizado fue entre 5 a 40 °C, cada 5 °C, en medio YMA.
Se incluyeron en los ensayos cepas testigo de S. cerevisiae (NRRL Y-12632NT), S. paradoxus (NRRL Y-17217T), S. kudriavzevii (NRRL Y-27339T) y S. uvarum (NRRL Y-17034T).
RESULTADOS
A partir de los estromas de C. hariotii se obtuvieron un total de 72 aislamientos. Todas las colonias presentaron color blanco, aspecto liso, borde entero y uniforme. Los resultados de la caracterización micro-morfológica permitieron la organización de los aislamientos en 5 grupos (Tabla 1). Las formas celulares variaron de esféricas a elipsoidales y en el caso del grupo 2 presentaron forma de limón. El tipo de brotación vegetativo fue mayormente multilateral, con la excepción de los aislamientosdel grupo 2 que mostraron gemación bipolar característica de levaduras del género Hanseniaspora y su anamorfo Kloeckera. Los grupos 1 y 3 formaron estructuras sexuales, mientras que en los grupos restantes no se observaron estructuras de este tipo en las condiciones de cultivo empleadas en el presente trabajo. El 86% de los aislamientos del grupo 1 desarrollaron ascos con 4 ascosporas esféricas en su interior, correspondiente a la morfología típica de Saccharomyces spp. (Fig. 1A). La totalidad de los aislamientos incluidos en el grupo 3 desarrollaron ascos con 4 ascosporas producto de la conjugación de 2 células que se corresponden morfológicamente al género Pichia (Fig. 1B).
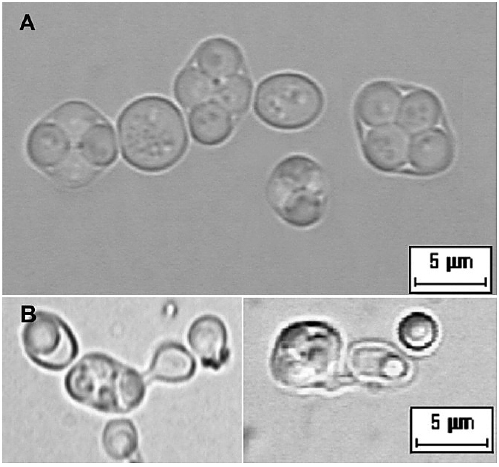
Fig. 1.- Estructuras sexuales de los aislamientos de las levaduras fermentadoras de Cyttaria hariotii. A: ascos característicos del género Saccharomyces con cuatro ascosporas en su interior (G1); B: conjugación, ascos y ascosporas no sacaromicéticas (G3).
Tabla 1. Grupos y características micro-morfológicas de los aislamientos de levaduras de Cyttaria hariotii
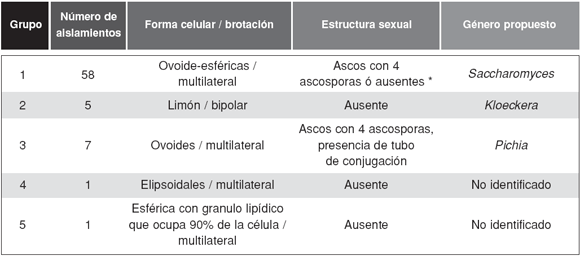
* El 86% de los asilamientos presentaron estructuras sexuales, todos estos casos pertenecieron a los subgrupos G1-a y G1-b.
La totalidad de los aislamientos presentaron crecimiento entre 5 y 30 ºC, el 94 % de los aislamientos lo hicieron a 35 ºC, con excepción de los grupos 3 (Pichia) y 5. No se registro crecimiento a 37 y 40ºC. Los aislamientos incubados a 5 ºC presentaron crecimiento a las 96 hs de cultivo, mientras que a 20y 30 ºC el crecimiento se registró a las 24 hs de incubación.
Los resultados de las pruebas de asimilación de carbono se presentan en la Tabla 2. Ninguna de las levaduras estudiadas presentó crecimiento en las siguientes pruebas de asimilación de carbono: L-sorbosa, D-glucosamina, D-ribosa, D-xilosa, L-arabinosa, D-arabinosa, L-ramnosa, lactosa, almidón soluble, meso-eritritol, ribitol, xilitol, D-galactitol, myo-inositol, D-glucuronato y citrato. Los aislamientos delgénero Saccharomyces presentaron diferencias en la asimilación de las fuentes carbonadas y en la vigorosidad con que asimilaron a éstas, conduciendo a la subdivisión en 3 subgrupos (G1-a, G1-b, G1-c). Los subgrupos G1-a y G1-b se diferenciaron en la asimilación de D-manitol, DL-lactato y a-melezitosa (Fig. 2), mientras que el subgrupo G1-c asimiló un grupo de fuentes carbonadas restringido únicamente a: glucosa, D-galactosa, sacarosa, maltosa y rafinosa (Tabla 2). La asimilación de fuentes carbonadas presentada por los aislamientos de los subgrupos G1-a y G1-b es similar al de las cepas tipo de S. bayanus y S. uvarum. Por otra parte el conjunto de fuentes carbonadas asimiladas por el subgrupo G1-c no presenta semejanzas con otras especies del género, sin embargo estudios previos, con herramientas moleculares, no mostrados en este trabajo, confirman la inclusión del subgrupoG1-c dentro del grupo de levaduras sacaromicéticas. Resultados similares se observaron para los aislamientos del género Kloeckera los cuales fueron separadosen 2 subgrupos de acuerdo a diferencias en la asimilación de arbutina, celobiosa, salicina y gluco-δ-lactona (Tabla 2).
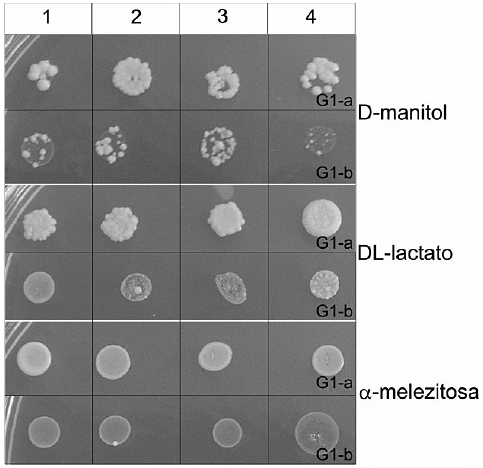
Fig. 2.-Diferencias de vigorosidad de crecimientoen las pruebas de asimilación de fuentes carbonadasentre los subgrupos G1-a y G1-b de Saccharomyces.
Tabla 2. Asimilación de compuestos carbonados de aislamientos de levaduras de Cyttaria hariotii y cepas de colección
Los resultados de la fermentación de carbono de los subgrupos mayoritarios correspondientes a Saccharomyces spp. se presentan en la Tabla 3. Las fuentes de carbono celobiosa, xilosa e inulina no fueron fermentadas.
Tabla 3. Capacidad fermentativa de aislamientos representantes de los grupos de levaduras mayoritarios asociados a C. hariotii
DISCUSIÓN Y CONCLUSIONES
En el presente trabajo se obtuvieron un total de 72 aislamientos de levaduras ascomicéticas a partirde C. hariotii. Los cultivos presentaron colonias con características morfológicas semejantes sugiriendo, por un lado, la presencia de un grupo limitado de taxones, coincidente con los resultados de la caracterización fisiológica que arrojó un total de 5 grupos, dos de los cuales presentaron subgrupos. Por otro, los resultados obtenidos destacan la eficiencia de selección del medio de cultivo (basado en altas concentraciones de etanol) y su utilidad para estudiar levaduras fermentadoras tanto del grupo sacaromicético como del no-sacaromicético. Resulta interesante destacar que los géneros no-sacaromicéticos Kloeckera y Pichia (registrados en este trabajo en los estromas de C. hariotii) fueron también aislados frecuentemente en ambientes donde se producen bebidas fermentadas, junto con especies de Saccharomyces (Jespersen et al., 2005; Stratford, 2006; Fugelsang & Edwards, 2007; Suárez Valles et al., 2007) y que estas levaduras presentaron también tolerancia a altas concentraciones de etanol (Deak,2006).
Trabajos previos con levaduras de C. hariotii, en los que se utilizaron para aislar medios no selectivos, reportaron la existencia de mayor diversidad de levaduras pertenecientes tanto al Phylum Ascomycota como al Basidiomycota, entre los que se encontraban los géneros Phaffia, Cryptococcus, Sporobolomyces, Rhodotorula, Rhodosporidium, Kloeckera, Candida y Saccharomyces (Brizzio & van Broock, 1998; Libkind et al., 2004; Libkind et al., 2007). A partir de los resultados del estudio de los estromas de C. hariotii en bosques del géneroNothofagus de este trabajo y de los antes mencionados, es posible afirmar que los estromas de C. hariotii poseen diversas poblaciones de levaduras y que junto a sus hospedadores conforman un ambiente propicio para el establecimiento y/o desarrollo de las levaduras fermentadoras. Asimismo la presencia de levaduras en todas las muestras analizadas sugiere que las poblaciones de levaduras se encuentran frecuentemente asociadas con estos estromas en las condiciones ambientales de los bosques Andino patagónicos.
Respecto al crecimiento a diferentes temperaturas se registro que todos los aislamientos carecieron de crecimiento a temperaturas iguales o mayores a 37 ºC y que la mayoría de los mismos crecieron a 35ºC, determinándose así una temperatura máxima de crecimiento comprendida entre 35 y 37 ºC. Todos los aislamientos crecieron entre 5 y 30 ºC. Estos registros concuerdan con el clima templado frío de la región donde la temperatura media anual es de 8,1 ºC y rara vez la temperatura sobrepasa los 30 ºC (Pereyra et al., 2005). Por otra parte la capacidad de crecimiento entre 5 y 15 ºC de todos los aislamientos permite afirmar que estos serían psicrotolerantes (Morita, 1975). Dentro del género Saccharomyces, S. bayanus y S. uvarum son especies psicrotolerantes, que han sido aisladas en zonas frías de Europa (Naumov et al., 2000; Suárez Valles et al., 2007). Es probable que los aislamientos sacaromicéticos del presente trabajo pertenezcan a una o ambas especies. La existencia de un aislamiento previo de S. bayanusen exudados de árboles del género Nothofagus en la Patagonia (Naumov et al., 2006) sustenta, asímismo, esta hipótesis. A diferencia de los subgrupos sacaromicéticos G1-a y G1-b el subgrupo G1-c presentó la capacidad de asimilar sólo unas pocas fuentes de carbono. A su vez, fue el único subgrupo que no desarrollo ascos típicos sacaromicéticos, lo que puede deberse a que algunas cepas, tanto naturales como de uso industrial, pierden la capacidad de esporular o presentan alguna anomalía en su ploidíalo que provoca una meiosis anormal o defectuosa (Rainieri et al., 2003). Estas características no son suficientes para poder plantear una identificación a nivel de especie para el subgrupo G1-c, siendo necesarios para ello realizar estudios moleculares. El 80,5 % de los aislamientos obtenidos corresponden al género Saccharomyces, representando el primer registro numeroso de este género en sustratos naturales de la región. Así mismo constituye un importante registro debido a que estos aislamientos sacaromicéticos provienen de un área natural con poca acción antrópica y separada geográficamente del área de producción de bebidas fermentadas. Asímismo existe la posibilidad de que las especies sacaromicéticas aisladas en el presente trabajo hayan sido las responsables de la actividad fermentativa en las bebidas alcohólicas que los nativos de la regiónr ealizaban en base a los estromas de C. hariotii. Resta investigar si estas levaduras sacaromicéticas conforman poblaciones salvajes en C. hariotii o si se encuentran en ellas ocasionalmente por la acción devectores (ej. insectos). La primera hipótesis no sería precipitada considerando los descubrimientos recientes de poblaciones salvajes de varias especies de Saccharomyces en corteza de diversas especies de árboles (Sniegowski et al., 2002; Naumov et al., 2006; Sampaio & Gonçalves, 2008). Los resultados obtenidos en el presente trabajo son de suma importancia dado que los hábitats naturales de las especies de Saccharomyces aún no han sido identificados y algunas especies fueron encontradas en tan raras ocasiones que sólo se conocen unas pocas cepas. Estudios tendientes a investigar la ocurrencia de levaduras sacaromicéticas en estromas de C. hariotii provenientes de diferentes puntos geográficos de la Patagonia, así como también en corteza de las distintas especies de Nothofagus nativas, se encuentran actualmente en curso y permitirán determinar si se tratan o no de poblaciones salvajes. El restante 19,5 % correspondería a géneros no sacaromicéticos tales como Kloeckera y Pichia, siendo éste el primer registro de la ocurrencia del género Pichia en estromas de Cyttaria. Se encuentran en progreso estudios moleculares en los aislamientos no-sacaromicéticos a fin de poder confirmar las agrupaciones y asignaciones a género realizadas en el presente estudio y además alcanzar la identidad a nivel de especie. En el presente trabajo, se aislaron numerosas levaduras sacaromicéticas que por sus diferentes características morfológicas y fisiológicas entre ellas podrían pertenecer a 3 especies diferentes, de las cuales dos podrían ser S. bayanus y S. uvarum. Además, se obtuvieron aislamientos pertenecientes a levaduras no-sacaromicéticas asignadas a los géneros Pichia y Kloeckera. El presente trabajo provee las bases para estudio de las levaduras fermentadoras asociadas a los estromas de C. hariotii, demuestra la eficiencia y selectividad del medio de cultivo utilizado para levaduras fermentadoras, previamente descrito para el aislamientos de levaduras de corteza (Sampaio & Gonçalves, 2008). Contribuye así mismo al conocimiento de la diversidad, ecogeografía y fisiología de las levaduras fermentadoras en el Parque Nacional Nahuel Huapi, Patagonia, Argentina.
AGRADECIMIENTOS
El presente trabajo fue financiado por la Universidad Nacional del Comahue (B143) y el CONICET (PIP6536) y por la ANPCyT (PICT22200). Las cepas tipo fueron donadas por el Dr. Sampaio (CREM, Portugal). Se agradece a Parques Nacionales por el permiso de muestreo.
BIBLIOGRAFÍA
1. BRIZZIO, S. & M. VAN BROOCK. 1998. Characteristics of wild yeast killer from Nahuel Huapi National Park (Patagonia, Argentina). Food Technol. Biotechnol. 36: 273-278. [ Links ]
2. DE FIGUEROA, L. I. C., M. A. MARTÍNEZ & J. F. T. SPENCER. 2004. Ecology in Northwest Argentina. In J. F. T. SPENCER & A. L. RAGOUT DE SPENCER, (eds.), Environmental Microbiology: Methods & Protocols, pp. 83-96. Humana Press Inc., Totowa, New Jersey. [ Links ]
3. DE LEDERKREMER, R. M. & A. CIRELLI. 1988. Hidratos de carbono en hongos del género Cyttaria. Su importancia. Anales Acad. Ci. Exact. Natur. 4: 153-161. [ Links ]
4. DEAK, T. 2006. Environmental factors influencing Yeasts. In ROSA, C. & G. PÉTER, (eds.), The yeast Handboock:Biodiversity and Ecophysiology of Yeasts, pp. 155-174. Springer-Verlag, Berlin, Heidelberg, New York. [ Links ]
5. FAY, J. C. & J. A. BENAVIDES. 2005. Evidence for domesticated and wild populations of Saccharomyces cerevisiae. PLoS Genet. 1: 66-71. [ Links ]
6. DORNELES, D., I. M. PEREIRA MACHADO, M. BLUMEL CHOCIAI & T. M BORDIN BONFIM. 2005. Influence of the use of selected and non-selected yeasts in red wine production. Braz. Arch. Biol. Technol. 48: 747-751. [ Links ]
7. FLEET, G. 1992. Spoilage yeast. Critical Rev. Biotechnol. 12: 1-44. [ Links ]
8. FUGELSANG, K. C. & C. G. EDWARDS. 2007. Wine Microbiology: Practical Applications and Procedures. Springer Science+Business Media, LLC, New York. [ Links ]
9. GAMUNDÍ, I. J. 1991. Review of recent advances in the knowledge of the Cyttariales. Systema Ascomycetum 10: 69-77. [ Links ]
10. GAMUNDÍ, I. J. & R. M. DE LEDERKREMER. 1989. Los Hongos Andino-Patagónicos del género Cyttaria. Sus hidratos de carbono. Ciencia e Investigación 43: 4-13. [ Links ]
11. JESPERSEN, L., D. S. NIELSEN, S. HØNHOLT & M. JAKOBSEN. 2005. Occurrence and diversity of yeasts involved in fermentation of West African cocoa beans. FEMS Yeast Res. 5: 441-453. [ Links ]
12. KURTZMAN, C. P. & J. W. FELL. 1998. The Yeasts, a Taxonomic Study. 4th ed. Elsevier Science Publishers, Amsterdam. [ Links ]
13. LIBKIND, D., A. RUFFINI & M. R. VAN BROOCK. 2004. Levaduras teleomórficas pigmentadas de ambientes naturales de la Patagonia noroccidental. Bol. Soc. Argent. Bot. 39: 5-12. [ Links ]
14. LIBKIND, D., A. RUFFINI, M. VAN BROOCK, L. ALVES & J. P. SAMPAIO. 2007. Biogeography, host specificity, andmolecular phylogeny of the Basidiomycetous yeast Phaffia rhodozyma and its sexual form, Xanthophyllomyces dendrorhous. Appl. Environ. Microbiol. 73: 1120-1125. [ Links ]
15. LOPES, C. A., T. L. LAVALLE, A. QUEROL & A. C. CABALLERO. 2005. Combined use of killer biotype andmtDNA-RFLP patterns in a Patagonian wine Saccharomyces cerevisiae diversity study. Antonie van Leeuwenhoek 89: 147-156. [ Links ]
16. LOPES, C. A., M. VAN BROOCK, A. QUEROL & A. C. CABALLERO. 2002. Saccharomyces cerevisiae wine yeast populations in a cold region in Argentinean Patagonia. Astudy at different fermentation scales. J. Appl. Microbiol. 93: 608-615. [ Links ]
17. MORITA, R. Y. 1975. Psychrophilic bacteria. Bacteriol. Rev. 39: 144-167. [ Links ]
18. NAUMOV, G. I., I. MASNEUF, E. S. NAUMOVA, M. AIGLE & D. DUBOURDIEU. 2000. Association of Saccharomyces bayanus var. uvarum with some French wines: geneticanalysis of yeast populations. Res. Microbiol. 151: 683-691. [ Links ]
19. NAUMOV, G. I., E. V. SERPOVA & E. S. NAUMOVA. 2006. A genetically isolated population of Saccharomyces cerevisiae in Malaysia. Microbiology 75: 201-205. [ Links ]
20. NAUMOVA, E. S., I. V. KORSHUNOVA & G. I. NAUMOV. 2003. Molecular analysis of the a-Galactosidase MEL genes in yeast Saccharomyces sensu stricto. Mol. Biol. 37: 699-706. [ Links ]
21. PEREYRA, F., J. ALBERTONI, C. BRÉARD, S. CAVALIARO, M. COCCIA, E. DUCÓS, M. DZENDOLETAS, S. FOOKES, E. GETINO, F. HELMS, W. KRUCK, R. LÓPEZ, C. MUZIO, D. ROVERANO, M. TOBIO, M. TOLOCZYKI & C. WILSON. 2005. Estudio geocientífico aplicado alordenamiento territorial: San Carlos de Bariloche, Rio Negro, Argentina. Servicio Geológico Minero Argentino (SEGEMAR). Anales nº 42. [ Links ]
22. RAINIERI, S., C. ZAMBONELLI & Y. KANEKO. 2003. Saccharomyces sensu stricto: systematics, genetic diversityand evolution. J. Biosci. Bioengineer. 96: 1-9. [ Links ]
23. SAMPAIO, J. P. & P. GONÇALVES. 2008. Natural populations of Saccharomyces kudriavzevii in Portugal are associatedwith oak bark and sympatric with S. cerevisiae and S. paradoxus. Appl. Environ. Microbiol. 47: 2144-2152. [ Links ]
24. SANGORRÍN, M., I. ZAJONSKOVSKY, M. van BROOCK & A. CABALLERO. 2002. The use of killer biotyping in anecological survey of yeast in an old patagonian winery. World J. Microbiol. Biotechnol. 18: 115-120. [ Links ]
25. SNIEGOWSKI, P. D., P. G. DOMBROWSKI & E. FINGERMAN. 2002. Saccharomyces cerevisiae and Saccharomyces paradoxus coexist in a natural woodland site in North America and display different levels of reproductiveisolation from European conspecifics. FEMS Yeast Res. 1: 299-306. [ Links ]
26. SPENCER, D. M., J. F. T. SPENCER, L. I. DE FIGUEROA, O. GARRO & E. FENGLER. 1996. Yeasts associated with podsand exudates of algarrobo trees (Prosopis spp.) and speciesof columnar cacti in northwest Argentina. Appl. Microbiol. Biotechnol. 44: 736-739. [ Links ]
27. STRATFORD, M. 2006. Food and Beverage Spoilage Yeasts. In A. QUEROL & G. FLEET, (eds.), The Yeast Handbook, Vol. 2: Yeasts in Food and Beverages, pp. 335-379. Springer-Verlag, Berlin, Heidelberg. [ Links ]
28. SUÁREZ VALLES, B. , R. PANDO BEDRICANA, N. FERNÁNDEZ TASCÓN, A. QUEROL & R. RODRÍGUEZ MADRERA. 2007. Yeast species associated with thespontaneous fermentation of cider. Food Microbiol. 24: 25-31. [ Links ]
29. TORO, M. E., N. P. ORO, A. D. VEGA, Y. P. MATURANO, M. C. NALLY, E. FERNANDEZ, E. PUCHETA & F. VÁZQUEZ. 2005. Diversidad de levaduras en canopias y suelos asociados con Bulnesia retama y Larrea divaricata. Revista Argent. Microbiol. 37: 209-213. [ Links ]
30. YARROW, D. 1998. Methods of isolation, maintenance and identification of yeasts. In KURTZMAN C. P. & J. W. FELL, (eds.), The Yeasts, A Taxonomic Study, pp. 77-100. Elsevier Science Publishers, Amsterdam. [ Links ]
Recibido el 20 de noviembre de 2008
Aceptado el 9 de septiembre de 2009.














