Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Boletín de la Sociedad Argentina de Botánica
versión On-line ISSN 1851-2372
Bol. Soc. Argent. Bot. v.44 n.3-4 Córdoba ago./dic. 2009
ANATOMÍA Y MORFOLOGÍA
Comparación anatómica de Nitrophila australis var. australis y Nitrophila occidentalis (Chenopodiaceae). Su importancia taxonómica
Vanesa Pérez Cuadra1 y Paula M. Hermann2
1 Becaria de Posgrado de CONICET. Lab. Plantas Vasculares. Dep. Biología, Bioquímica y Farmacia. Universidad Nacional del Sur, 8000 Bahía Blanca, Argentina. E-mail: vperezcuadra@uns.edu.ar
2 Lab. Plantas Vasculares. Dep. Biología, Bioquímica y Farmacia. Universidad Nacional del Sur, 8000 Bahía Blanca, Argentina. E-mail: phermann@criba.edu.ar
Resumen: Nitrophila australis es una halófita endémica de la Argentina mientras que Nitrophila occidentalis es una halófita nativa de Norteamérica; ambas pertenecen a las Polycnemoideae (Chenopodiaceae). Su anatomía foliar es similar: epidermis uniestratificada, clorénquima homogéneo, tejido acuífero y un haz vascular central con un número variable de haces menores a cada lado del mismo; la principal diferencia reside en las estrías cuticulares y carenas marginales. El tallo de ambas especies posee una epidermis uniestratificada, colénquima angular subepidérmico y parénquima cortical aerenquimatoso. La estela de N. australis posee cuatro haces vasculares mientras que la de N. occidentalis tiene ocho; ambas especies presentan casquetes de colénquima asociados a los haces vasculares. En el rizoma de la especie argentina el felógeno es superficial mientras que el de la americana se diferencia más profundamente. En ambas especies se observa un número variable de haces vasculares en la estela. Si bien las características morfológicas y anatómicas generales son similares en estas especies, cada una presenta algunas variaciones específicas, por lo cual su estudio anatómico reviste valor taxonómico a nivel de especie.
Palabras clave: Nitrophila australis; Nitrophila occidentalis; Anatomía vegetativa; Halófitas; Polycnemoideae; Chenopodiaceae; Adaptaciones.
Summary: Anatomic comparison between Nitrophila australis var. australis and Nitrophila occidentalis (Chenopodiaceae). Its taxonomic importance. Nitrophila australis is an endemic halophyte species of Argentina while Nitrophila occidentalis is a native halophyte of North America, both belonging to Polycnemoideae (Chenopodiaceae). They are similar in foliar anatomy: one-layered epidermis, homogeneous chlorenchyma, acqueous tissue and one large central bundle with a variable number of smaller ones on each side of the latter; the main difference stands in the cuticular striae and marginal ribs on each side of the leaf. The stem of both species shows a one-layered epidermis, subepidermic angular collenchyma and a cortical aerenchymatous parenchyma. Four bundles occur in the stele of N. australis while in N. occidentalis there are eight; both show caps of collenchyma associated with each bundle. A superficial phellogen originates in the rhizome of the argentinean species, whereas in the american one it differenciates deep in the cortex. The number of bundles in the rhizome stele of both is variable. Although the general morphological and anatomical characteristics are similar in the species studied, each one has certain specific features, rendering the anatomical study taxonomically valuable at the species level.
Key words: Nitrophila australis; Nitrophila occidentalis; Vegetative anatomy; Halophytes; Polycnemoideae; Chenopodiaceae; Adaptations.
INTRODUCCIÓN
Las Chenopodiaceae-actualmente consideradas como Amaranthaceae (Stevens, 2001)- comprenden alrededor de 102 géneros y unas 1400 especies de amplia distribución mundial, aunque, en su mayoría, confinadas a áreas xéricas o salitrosas (especialmente las estepas y semidesiertos de Norte y Sud América, Asia Central y Sud África, las costas de los mares Rojo, Caspio y Mediterráneo y las llanuras salitrosas de Australia) (Giusti, 1967, 1984). Dentrode las Dicotiledoneae, las Chenopodiaceae tienen la proporción más alta de géneros de plantas halófilas, con aproximadamente 300 especies; probablemente es la familia donde la tolerancia a la sal está más extendida (Flowers et al., 1986). La mayoría de las especies de esta familia presentan caracteres de tipo xeromórfico que les permiten desarrollarse en ambientes donde los parámetros ecológicos son: déficit de agua, radiación solar elevada y cambios bruscos de temperatura (Simon, 1997).
El género Nitrophila S. Watson está basado en Banalia occidentalis Moq. (Amaranthaceae). Este género fue incluido originalmente en las Amaranthaceae pero luego fue ubicado en las Chenopodiaceae en la subfamilia Polycnemoideae (Soriano, 1944). Los tres géneros reunidos en esta tribu-Hemichroa R. Br., Nitrophila y PolycnemumL.- guardan entre sí estrechas relaciones, pero el género Polycnemum se diferencia de los otros dos (Nitrophila y Hemichroa) por sus anteras biloculares, en tanto que en éstos son tetraloculares. Llama la atención este carácter de Polycnemumporque ningún género de Chenopodiaceae lo posee, en tanto que, entre las Amaranthaceae, la subfamilia Gomphrenoideae presenta anteras biloculares (Soriano, 1944). Para Kadereit et al. (2003) es claro que las Polycnemoideae forman un clado biendefinido y aparentemente más estrechamente relacionado con las Amaranthaceae que con las Chenopodiaceae. Para otros autores, como Müller & Borsch (2005), la posición sistemática de esta subfamilia no parece ser algo tan concreto y estiman que dilucidar su ubicación filogenética es crucial para entender la relación entre Amaranthaceae y Chenopodiaceae.
Si bien actualmente Amaranthaceae y Chenopodiaceae son consideradas como una misma familia, Amaranthaceae (Stevens, 2001), la identidad de este grupo aún no es totalmente indiscutida, por lo cual la mayoría de la literatura florística y de los estudios ecológicos se refieren a las Amaranthaceae y Chenopodiaceae por separado (Müller & Borsh,2005). Por las razones expuestas, en el estudio anatómico aquí desarrollado se considerarán las familias como Amaranthaceae sensu stricto y Chenopodiaceae sensu stricto.
El género Nitrophila, de acuerdo con Mabberley (1987), está formado por siete especies (una de ellas con dos variedades, consideradas en algunos casos como dos especies diferentes) exclusivas deAmérica: N. atacamensis Hieron. ex Ulbr., N. australis Chodat & Wilczek var. australis y N. australis Chodat & Wilczek var. kuntzei (Ulbr.) A. Soriano, N. densiflora (Phil.) Ulbr., N. mexicana Ulbr., N. mohavensis Munz & Roos, N. mucronata (Phil.) Ulbr. y N. occidentalis (Nutt.) Moq. (IPNI,2008). Este género se caracteriza por poseer flores bisexuales, bibracteadas, axilares, solitarias o reunidas de a dos o tres. Poseen cinco sépalos papiráceos, imbricados, cóncavos, de color blanco amarillento y con una carena dorsal. Presentan cinco estambres soldados en la base formando un disco. El estilo es filiforme con dos estigmas tubulados y el ovario, turbinado. El fruto es ovoideo rodeado por las piezas del cáliz y contiene una semilla vertical con el embrión curvo y la radícula ascendente (Ulbrich, 1934; Soriano, 1944; Giusti, 1967).
Según Chodat & Wilczek (1901), Soriano (1944) y Giusti (1967) N. australis var. australis es una especie glabra, perenne, rizomatosa, de entrenudos breves, tallos aéreos de 5-7 cm; hojas de 7 mm delargo, opuestas, carnosas, oblongas o sublineares, de ápice agudo o subobtuso, levemente carenadas en la parte dorsal inferior. Las flores, axilares y con los sépalos siempre blancos, se disponen en espigas terminales, de densidad variable. Es una especie endémica de la Argentina que habita a lo largo de las provincias andinas desde Jujuy a Mendoza y también al sur de la provincia de Buenos Aires (Soriano, 1944).
N. occidentalis es una especie glabra, rizomatosa, de tallos aéreos densamente ramosos de 10-30 cm de largo, decumbentes; hojas de 1-2 cm delargo, opuestas, lineares, sésiles o abrazadoras, carnosas, mucronadas, algo reducidas en la parte apical de los tallos. Las flores son axilares de sépalos blancos o rosados, en este último caso tornándose blancos a la madurez (Munz & Keck,1959; Hickman, 1993). Es una especie nativa de la zona oeste de los Estados Unidos de Norteamérica (muy común en la región de California) y del noroeste de México (Calflora, 2008).
El objetivo de este trabajo es realizar la descripción anatómica de dos especies no estudiadas hasta el momento y tan parecidas que en un tiempo fueron confundidas (Soriano, 1944). Se pretende evaluar si las características anatómicas son de importancia taxónomica, de manera que contribuyan a resolver alguno de los problemas sistemáticos, ya mencionados, que presentan los integrantes de la subfamilia Polycnemoideae.
MATERIAL Y MÉTODO
Las especies estudiadas habitan en áreas disjuntas. N. australis var. australis fue colectada en el Salitral de la Vidriera (Part. de Villarino), situado aproximadamente a 30 kilómetros de la ciudad de Bahía Blanca, Prov. Buenos Aires, Rep. Argentina.
N. occidentalis fue coleccionada en Springtown, hacia el norte de Livermore, Condado de Alameda, Estado de California, Estados Unidos de Norteamérica. Los ejemplares de herbario de referencia fueron depositados en el herbario del departamento de Biología, Bioquímica y Farmacia (BBB) de la Universidad Nacional del Sur y en el herbario de la Universidad de California, Davis (DAV).
Los muestreos fueron realizados durante noviembre de 2004 (N. australis) y julio de 2008 (N. occidentalis). Muestras de hojas, tallos aéreos y rizomas fueron fijadas en formol-ácido acético-alcohol (FAA), deshidratadas en una serie de concentración creciente de alcohol etílico-alcohol butílico terciario, infiltradas en parafina e incluidas en Paramat (punto de fusión 56°C). Se realizaron cortes transversales y longitudinales de 10 µm de espesor con micrótomo rotativo. Se tiñeron con safranina-fast green, y se montaron con bálsamo deCanadá.
Se analizaron aproximadamente cinco muestras de cada órgano por cada especie estudiada. Para ladescripción de la anatomía foliar se utilizaron cortes obtenidos a partir de la parte media de la hoja, en tanto que para la anatomía del tallo aéreo y del subterráneo (rizoma), los cortes se obtuvieron de la zona media del entrenudo. Para la descripción de la anatomía vascular se realizaron cortes seriados a lo largo de tres entrenudos sucesivos de los tallos aéreos de cada una de las especies.
Hojas maduras de ambas especies, tomadas al azar, fueron fijadas en FAA y posteriormente seccionadas manualmente a fin de poder obtener por separado las epidermis adaxiales y abaxiales. Debido a la naturaleza carnosa de las hojas fue posible cortarlas longitudinalmente por su parte media, quitando posteriormente el mesofilo, a fin de obtener las epidermis adaxiales y abaxiales libres. Estas muestras fueron sometidas a una diafanización (Dizeo de Strittmatter, 1973). Las epidermis fueron teñidas con safranina y montadas en gelatina glicerinada con el objeto de describir sus características y obtener sus índices estomáticos. Éstos se determinaron en ambas caras de la hoja en ambas especies. Para este procedimiento se dispusode un microscopio óptico con tubo de dibujo y se utilizó la técnica descripta en la Norma IRAM Nº 37503 (1993), con la siguiente modificación: se utilizó un objetivo de 25X y un ocular de 10X obteniéndose una magnificación total de 250X. El conteo de estomas se realizó sobre un cuadrado de 10 cm de lado. Se analizaron 15 campos en la epidermis abaxial y 15 en la adaxial. Las 15 observaciones se registraron sobre diferentes hojas. Todas las observaciones se efectuaron con microscopio óptico y se registraron mediante microfotografías y dibujos.
RESULTADOS
Hoja
Para una mejor interpretación de la anatomía foliar cabe recalcar que las hojas de ambas especies son carnosas y de sección subcircular y presentan carenas en los márgenes (Fig. 1 G-H, M-N) (desde la región proximal hasta los dos tercios distales) y un pequeño mucrón en el extremo distal de las mismas. Mientras que los mucrones son de aspecto similar en ambas especies, las carenas son notoriamente más evidentes en N. occidentalis que en N. australis.
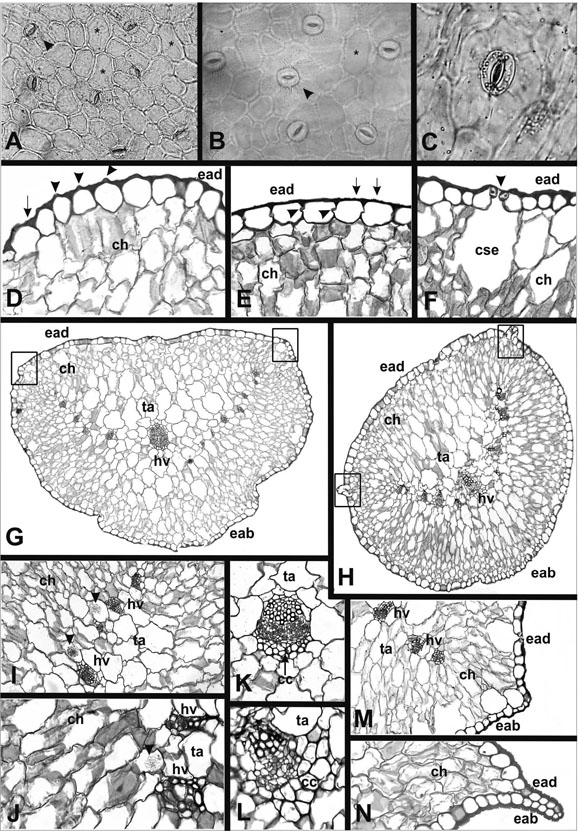
Fig. 1. Hojas de N. australis var. australis y N. occidentalis. Epidermis en vista superficial y cortes transversales de la hoja. A-B, Epidermis adaxial en planta (asteriscos indican células largas, cabezas de flecha, estomas ciclocíticos); C, Epidermis abaxial en planta; D-E, Detalle de la epidermis en corte (cabezas de flecha en D indican papilas; en E, lóbulos de las paredes anticlinales; flechas indican estrías cuticulares); F, Estoma (cabeza de flecha indica proyección de lacutícula); G-H, Aspecto general de la hoja (recuadros marcan las carenas); I-J, Detalle de las drusas (cabezas de flecha);K-L, Haz principal de la hoja; M-N, Detalle de las carenas. A, C, D, F, G, I, K, M, N. australis var. australis; B, E, H,J, L, N, N. occidentalis. Ref.: cc: casquete de colénquima; ch: clorénquima homogéneo; cse: cámara subestómatica; eab: epidermis abaxial; ead: epidermis adaxial; hv: haces vasculares; ta: tejido aquífero. A: x117; B: x243; C: x333; D: x128; E: x122; F: x179; G: x53; H: x76; I: x88; J: x136; K: x134; L: x178; M: x76; N: x153.
Epidermis, vista en superficie. Índice estomático
La cutícula es estriada tanto en N. australis (Fig.1 A) como en N. occidentalis (Fig. 1 B), pero las estrías son más profundas, espaciadas y menos numerosas en la primera que en la segunda especie. En ninguna de ellas se observaron tricomas ni glándulas de sal, y en ambas los estomas son típicosde dicotiledóneas (Fig. 1 A-B).
La epidermis adaxial de las dos especies presenta células poligonales de formas y tamaños variados (Fig. 1 A-B), encontrándose algunascélulas alargadas (Fig. 1 A-B, asteriscos). En ambas especies los estomas están rodeados por cuatro a seis células epidérmicas y son de tipo anomocítico y ciclocítico (Fig. 1 A-B, cabezas de flecha).
La epidermis abaxial de N. australis está formada mayormente por células alargadas más angostas y más largas que las células alargadas de la epidermis adaxial, y su eje mayor es paralelo al eje mayorde la hoja. Los estomas son ciclocíticos y sus células subsidiarias aproximadamente isodiamétricas (Fig. 1 C). En esta cara las células oclusivas, en general poseen su eje mayor paralelo al eje mayor de las células alargadas y de la hoja, aunque en algunos casos existe una leve variación en esta orientación. Si bien los estomas no presentan un patrón específico de distribución se observa una tendenciaa ubicarse en hileras y a distancias variables entre sí: en algunas zonas se ubican relativamente próximos y en otras algo más separados. La epidermis abaxial de N. occidentalis presenta características similaresa las descriptas para su epidermis adaxial, incluidos los estomas.
La determinación del índice estomático arrojó un promedio de 6,71 para la cara adaxial de N. australis y de 6,3 para N. occidentalis, mientras que para la cara abaxial el índice es de 7,63 en la especie argentina y de 5,28 en la americana.
Corte transversal por lámina
Ambas especies presentan una cutícula estriada relativamente gruesa, con estrías más profundas en N. australis y más finas y numerosas en N. occidentalis (Fig. 1 D-E, flechas), como se mencionó anteriormente. Tanto la epidermis abaxial como la adaxial de ambas especies, es uniestratificada (Fig. 1 DH, M-N) y está formada por células aproximadamente cuadrangulares o rectangulares. Las paredes periclinales externas están engrosadas; en N. australis este engrosamiento es mayor hacia el centro de la célula otorgándole un aspecto papiloso (Fig. 1 D, cabezas de flecha). Las paredes periclinales internas y las anticlinales están poco engrosadas (Fig. 1 DF); estas últimas son lisas en N. australis (Fig. 1 D) y con algunos lóbulos en N. occidentalis (Fig. 1 E, cabezas de flecha). Los estomas de estas especies se ubican a nivel epidérmico en ambas caras de la hoja y se observa una proyección cuticular hacia el ostiolo (estomas apiculados) en la cara tangencial externa de las células oclusivas (Fig. 1 F, cabeza de flecha). La cámara subestomática es de mayor tamaño en la especie argentina que en la americana. Por debajo de la epidermis no se observa tejido de sostén en ninguna de las dos especies; en cambio, hay un clorénquima homogéneo (Fig. 1 D-H), formado por células relativamente pequeñas tanto en la cara adaxial como en la cara abaxial (Fig. 1 G-H), lo que determina que la hoja sea isobilateral. Hacia el interior, en ambas especies, se encuentra el tejido acuífero (Fig. 1 G-H), con células de gran tamaño y con drusas de variadas dimensiones (Fig. 1 I-J, cabezasde flecha). Éste rodea al tejido vascular constituido, en N. australis, por un haz central mayor y cuatro a ocho haces menores a cada lado del mismo (Fig. 1G) mientras que en N. occidentalis se observan cuatro a cinco haces menores a los lados del mayor (Fig. 1 H). Los haces vasculares son colaterales en ambas especies; el central (Fig. 1 K-L) y en algunos casos los más cercanos a él poseen un casquete de células de tipo colenquimatoso en contacto con el floema. Rodeando a cada haz se observa una vaina poco diferenciada.
Las carenas de las hojas son proyecciones de células epidérmicas que, en ambas especies, son más notorias hacia el tercio proximal reduciéndose hacia el tercio distal; en N. australis la proyección en la zona proximal está formada por tres a cinco células de la epidermis adaxial y otras tantas de la abaxial que, ocasionalmente, incluyen una pequeña parte de clorénquima (Fig. 1 M); hacia la partemedia de la hoja la proyección solo está formada, en general, por una célula (Fig. 1 G, recuadro) no siendo reconocible hacia el tercio distal. En N. occidentalis la proyección es más notoria que en la especie anterior y está formada, hacia el tercio proximal, por hasta siete u ocho células de la epidermis adaxial y otras tantas de la abaxial, que, a diferencia de la anterior, no incluye clorénquima (Fig. 1 N); esta proyección se torna menos notoria hacia el tercio medio de la hoja donde solo se observan dos a tres células de cada epidermis formando las carenas (Fig. 1 H, recuadro), las que no son reconocibles hacia el tercio distal. El mucrón apical de las hojasen ambas especies está formado por epidermis y una pequeña porción de mesofilo.
Tallo aéreo
Epidermis, vista en superficie
La cutícula es lisa en N. australis y estriada en N. occidentalis. La epidermis caulinar está formada por células poligonales alargadas cuyo eje mayor es paralelo al eje mayor del tallo; son más angostas en N. occidentalis que en N. australis. Ambas especies presentan escasos estomas ciclocíticos que se ubican en hileras aproximadamente paralelas con orientaciones variables de las células oclusivas.
Corte transversal por entrenudo
En corte transversal el tallo presenta una epidermis uniestratificada (Fig. 2 A-D) en las dos especies. La cutícula en N. australis es lisa, a diferencia de lo observado en las hojas, mientras que en N. occidentalis es similar a la descripta para sus hojas, observándose un reducido número de estomas en las dos especies. Las células epidérmicas son más o menos piriformes (papilosas) en N. australis (Fig. 2 A) y aproximadamente cuadrangulares en N. occidentalis. Las paredes anticlinales son levemente engrosada sen ambas especies presentando un mayor engrosamiento la pared periclinal externa (Fig. 2 A-B) y algo menor la interna; en este caso se confunde su grosor por estar en contacto con una capa de colénquima angular de una célula de espesor en posición subepidérmica (Fig. 2 A-D) que da comienzo a la corteza. Hacia el centro del tallo se observan células parenquimáticas isodiamétricas, de paredes lisas en N. australis (Fig. 2 A, C) y algo lobuladas en N. occidentalis (Fig. 2 B, D). Los grandes espacios intercelulares de esta región, en ambas especies, dan lugar aun parénquima aerenquimatoso en cuyas células se encuentran drusas equivalentes a las halladas en las hojas (Fig. 2 E, cabeza de flecha). En N. australis el tejido vascular se dispone en cuatro haces colaterales, dos mayores y dos menores, enfrentados mayor con mayor y menor con menor (Fig. 2 C, E). En la especie americana se observan ocho haces vasculares colaterales, seis de constitución compacta con poco tejido parenquimático y dos de constitución algo más laxa con mayor cantidad de parénquima entre los vasos; se enfrentan tres a tres los compactos y uno a uno los laxos (Fig. 2 D, F). En ambas especies, sobre el floema de cada haz se encuentra un casquete de colénquima esencialmente angular (Fig.2 E-F), aunque se observan unos pocos espacios intercelulares dispersos, y uno semejante pero mucho más pequeño sobre el xilema. En N. australis una vaina colenquimatosa, generalmente amilífera, rodea al conjunto de los cuatro haces vasculares por fuera de los casquetes de colénquima (Fig. 1 E). Cada haz vascular está rodeado por una vaina incompleta y menos notoria de células colenquimatosas sin gránulos de almidón. Esta última incluye al casquete del xilema llegando hasta la base del casquete que se encuentra sobre el floema (Fig. 2 E). En la especie americana la vaina que rodea al conjunto de haces es colenquimatosa pero carece de gránulos de almidón; tanto ésta como las vainas incompletas que rodean a cada haz son poco evidentes (Fig. 2 F). En ambas especies, a partir de la vaina que rodea a todos los haces y entre las vainas que rodean a cada haz se continúa el tejido colenquimático por el radio medular hasta casi alcanzar la médula. En N. occidentalis, por fuera de los casquetes de células colenquimáticas de cada haz se diferencian algunas fibroesclereidas. Ambas especies presentan un incipiente crecimiento secundario demostrado por la diferenciación del cámbium fascicular (Fig. 2 E). La médula de la especie argentina es de menor tamaño que la de la especie americana (Fig. 2 C-F); en las dos especies está formada por células parenquimáticas isodiamétricas, algunas de ellas con drusas (Fig. 2 F, cabeza de flecha). En la especie argentina las paredes celulares son mayormente lisas (Fig. 2 E) mientras que en la especie americana son muy lobuladas (Fig. 2 F), al igual que las células de la corteza. En ambas especies los espacios intercelulares le confieren a la médula un aspecto aerenquimatoso.
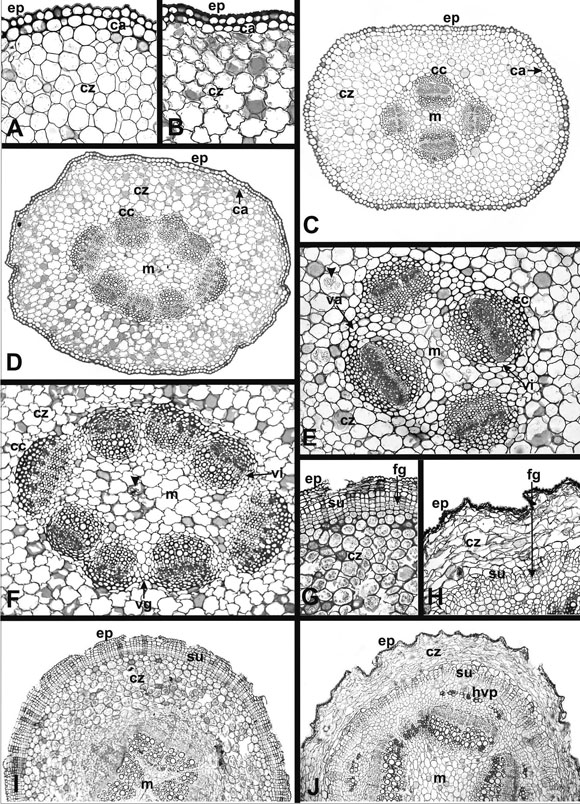
Fig. 2. Tallos aéreos y tallos subterráneos (rizomas) de N. australis var. australis y N. occidentalis en corte transversal. A-B, Detalle de epidermis y corteza del tallo aéreo; C-D, Aspecto general del tallo aéreo; E-F, Detalle de la estela del tallo aéreo (cabezas de flecha indican drusas); G-H, Detalle del súber del rizoma; I-J, Aspecto general del rizoma. A, C, E, G, I, N. australis var. australis; B, D, F, H, J, N. occidentalis. Ref.: ca: colénquima angular; cc: casquete decolénquima; cz: corteza; ep: epidermis; fg: felógeno; hvp: haces vasculares periféricos; m: médula; su: súber; va: vaina amilífera; vg: vaina general; vi: vaina colenquimatosa incompleta. A: x89; B: x100; C: x40; D: x39; E: x80; F: x78; G: x102; H: x95; I: x46; J: x33.
Anatomía vascular
Al seguir la trayectoria ascendente de los haces vasculares en N. australis, se observa que en el entrenudo los dos haces mayores aumentan paulatinamente de tamaño hacia el nudo hasta dividirse y formar tres haces vasculares (Fig. 3), resultando un total de ocho haces vasculares (tres originados por la división de cada uno de los dos mayores originales y los dos originales de menor tamaño). Los haces de menor tamaño, decusados con respecto a los de mayor tamaño, son los que fusionándose con parte del tejido vascular de los haces contiguos recientemente formados, constituirán la traza vascular de las hojas (Fig. 3). La fusión de estos haces se produce antes de su entrada en las mismas, por lo cual solo un haz ingresa en ellas. Luego de la salida de los haces hacialas hojas, se observan seis haces en la estela, donde los que se encuentran adyacentes a la laguna foliar se fusionarán para reconstituir el ordenamiento inicialde cuatro haces (Fig. 3): dos mayores y dos menores enfrentados mayor con mayor y menor con menor, al igual que anteriormente pero en este caso en forma decusada con respecto a la primera.
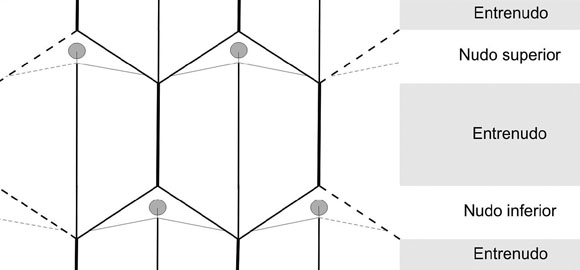
Fig. 3. Secuencia de la anatomía vascular del tallo de N. australis. Ref.: – haces menores, – haces mayores,
nervio medio, l hoja.
En el entrenudo de la especie americana, los dos haces vasculares laxos dejan la estela para entrar a las hojas (Fig. 4). Solo los seis haces vasculares compactos enfrentados tres a tres permanecen en la estela, donde los contiguos a la laguna foliar aumentan de tamaño. Parte del tejido vascular de cada uno de éstos se separa del original y se fusionan entre sí para reconstituir los haces faltantes, mientras que los más alejados de la laguna foliar se ensanchan formando los haces con tejido vascular más laxo que serán los que ingresarán a las hojas en el próximo nudo. De este modo se regresa al patrón original de la estela (Fig. 4), pero en forma decusada en relación a la disposición anterior.
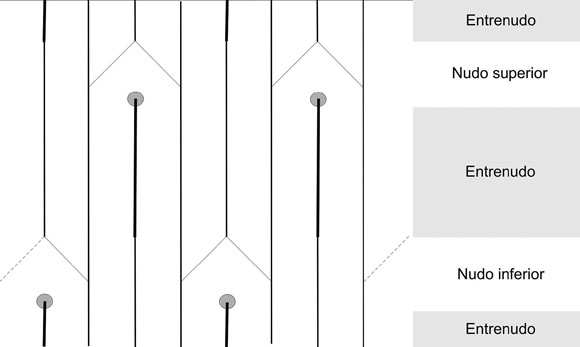
Fig. 4. Secuencia de la anatomía vascular del tallo de N. occidentalis. Ref.: – haces laterales, – haces laxos, l hoja.
Tallo subterráneo (rizoma)
El corte transversal del rizoma de ambas especies muestra una epidermis con una gruesa cutícula. Las demás características epidérmicas son similares a las descriptas para el tallo aéreo de cada una de ellas; pero en N. occidentalis la cutícula del rizoma es lisa en lugar de estriada. La diferenciación de la peridermis ocurre más superficialmente en N. australis (Fig. 2 G, I) que en N. occidentalis (Fig. 2 H,J), por lo que se observan restos de corteza por fuera del súber en esta última especie (Fig. 2 H, J). Las células que forman estos restos de corteza pierden su forma original y presentan sus paredes levemente engrosadas. En las dos especies estudiadas se observa una peridermis donde el súber está formado por unas pocas capas de células más o menos cuadrangulares y de paredes poco engrosadas (Fig. 2 GH); a medida que se alejan del meristema que les dioorigen van tornándose más poligonales. También enlas dos especies, por dentro del felógeno se observan algunas hileras de células pequeñas dispuestas demanera compacta y ordenada que constituirían la felodermis. Por debajo de ella se encuentra la corteza, que en la especie argentina está formada por dos a tres capas de células colenquimatosas y aproximadamente ocho capas de células parenquimáticas grandes de paredes apenas engrosadas que mantienen grandes espacios intercelulares (Fig. 2 G). En la especie americana la cantidad de corteza remanente por debajo de la felodermis es mucho menor que en la especie argentina y está formada por tres a cuatro capas de células parenquimáticas de menor tamaño que las que forman la misma zona en la especie anterior y presentan espacios intercelulares pequeños entre ellas. En las células de la corteza de ambas especies se encuentra gran cantidad de gránulos de almidón y en algunos casos drusas. Parte de los gránulos de almidón presentan una zona refringente muy evidente, la que se correspondería con posibles fracturas del hilo. El tejido vascular de N. australis consta de cuatro a seis haces vasculares colaterales mientras que en N. occidentalis se observa un número variable de haces del mismo tipo llegando a contarse hasta ocho. Por fuera del floema primario, en N. australis, ocasionalmente se observan grupos de fibras; en N. occidentalis se observan algunos haces vasculares menores que se disponen por fuera de los centrales (Fig. 2 J) y que posiblemente constituyenlas trazas de algunas brácteas. La médula de N. australis, de menor tamaño que la de N. occidentalis (Fig.2 I-J), está formada por células parenquimáticas pequeñas y de paredes delgadas, con numerosos gránulos de almidón, mientras que en la de N. occidentalis se observan células parenquimáticas, grandes, de paredes algo engrosadas, también con gránulos de almidón. Ambas especies muestran espacios intercelulares pequeños en la médula, encontrándose algunas drusas solo en N. occidentalis. En cada una de las especies los radios medulares están formados por células semejantes a las observadas enlas médulas.
DISCUSIÓN Y CONCLUSIONES
Las especies del género Nitrophila usualmente se encuentran en zonas donde las condiciones climáticas y ambientales son desfavorables para el crecimiento de otras especies vegetales. La presencia de estas plantas en este tipo de hábitat implica la posesión de características únicas, resultado de la adaptación a estos ambientes, las que les permiten, por ejemplo, menores pérdidas de agua, menor incidencia de la radiación, mejor absorción de nutrientes, etc. En determinados casos, son las estructuras morfológicas o anatómicas las que permiten el desarrollo de la estrategia en cuestión, mientras que en otros, la adaptación parece ser netamente fisiológica.
N. australis var. australis y N. occidentalis presentan un patrón similar en cuanto a sus distribuciones espaciales, ya que aparecen en parches en áreas con condiciones ambientales similares. Es importante destacar que su estudio y colección resulta dificultosa ya que no es sencillo identificar las poblaciones, solo se las puede encontrar en las estaciones de crecimiento activo (primavera y verano) ya que durante las estaciones de condiciones más rigurosas pierden su parte aérea manteniendo activo solo el rizoma.
La descripción original de N. australis (Chodat & Wilczek, 1901), hace referencia a que sus flores presentan siempre sépalos blancos sin excepciones.
Por el contrario, en la descripción original de N. occidentalis (Chodat & Wilczek, 1901), en general, no se enfatiza la presencia de sépalos de color rosado; solo Munz & Keck (1959) y Hickman (1993) lo mencionan en sus descripciones. Es importante señalar que en el momento en que se coleccionó esta especie no se detectaron flores de sépalos blancos, observándose solo el extremo distal de los mismos de una tonalidad blanquecina. Otro carácter destacable de la flor, también omitido en la descripción original, es que tanto el gineceo como el androceo son rosados en ambas especies (excepto las anteras al madurar), característica que resulta muy llamativa al disecar las flores. La presencia de un mucrón notorio en el ápice, carenas evidentes en los márgenes de las hojas y el hecho de que sean visibles a simple vista y de mayor desarrollo en N. occidentalis que en N. australis, colaboran en la rápida identificación de la primera por lo que deberían tenerse en cuenta como caracteres diagnósticos. En la descripción de N. occidentalis realizada por Chodat & Wilczek (1901) y de N. australis por Chodat & Wilczek (1901) y Soriano (1944) se indica que "...las hojas son levementecarenadas en la parte dorsal e inferior...". Esta descripción no se ajusta a lo observado en este trabajo ya que, en ambas especies, las hojas son levemente carenadas en los dos tercios proximales y la posición de las carenas es marginal.
Por el carácter halófilo de las especies estudiadas, se esperaba encontrar varios de los caracteres anatómicos típicos de plantas halófilas y xerófilas -estructuras secretoras de sal, estomas hundidos en criptas, numerosos tricomas, importante desarrollo de tejido esclerenquimático (Bianco et al., 2004)- descriptos en estudios previos sobre especies relacionadas o afines; sin embargo no todos estos caracteres fueron encontrados. La característica xerofítica saliente, y tal vez la única presente en las especies estudiadas y compartida con otras especies halófilas, es la presencia de una gruesa cutícula sobre las células epidérmicas. Este carácter es de gran importancia ya que impide la pérdida de grandes cantidades de agua por evaporación (Taiz & Zeiger, 1991).
Al comparar los índices estomáticos, se observó que N. australis presenta un índice estomático mayor en ambas caras de la hoja que N. occidentalis. La primera presenta mayor proporción de estomas en la cara abaxial mientras que la segunda lo hace en la cara adaxial. Esto resulta llamativo; era de esperar que ambas especies siguieran un patrón similar de distribución de sus estomas, ya que ambas habitan en ambientes de características similares y presentan una morfología y disposición foliar semejante. Por lo tanto y aún considerando que el índice estomático es un carácter cuantitativo y algo variable, se concluye que la diferencia observada poseerelevancia a nivel taxonómico.
La presencia de gran cantidad de tejido esclerenquimático en las hojas es una característica considerada muy importante como indicador de xeromorfismo (Ragonese, 1990). Ninguna de las dos especies presenta tejido esclerenquimático foliar y falta por completo cualquier tipo de tejido de sostén subepidérmico; en cambio sí se observa un tejido acuífero muy desarrollado. El gran desarrollo del tejido acuífero es un carácter compartido con otras halófitas suculentas (Bianco et al., 2004), como por ejemplo muchas Aizoaceae, Cactaceae y Portulacaceae (Landrum, 2002). La acumulación de agua o mucílagos en este tejido produce turgencia; ésta otorga sostén a las hojas por lo que los tejidos especializados resultarían innecesarios.
Las dos especies aquí tratadas poseen hojas sin estructura Kranz, lo que concuerda con observaciones previas (Carolin et al., 1975; Jacobs, 2001), y resultan de tipo "Austrobassioid" ya que son isobilaterales, tienen una gran cantidad de tejido acuífero, los haces vasculares se hallan en un plano en la parte media de la hoja e inmersos en el tejido acuífero que los separa del clorénquima (Carolin et al., 1975). Bianco (2004) menciona que las plantas de climas áridos, que poseen hojas gruesas y con proporciones superficie/volumen relativamente bajas suelen utilizar el metabolismo ácido de las Crasulaceae (CAM) para fotosintetizar. El mismo autor menciona que las características anatómicas frecuentes en especies CAM son: mesofilo homogéneo y células de la vaina del haz poco diferenciadas. Si bien estas características anatómicas se encuentran en las especies estudiadas, no se puede asegurar que posean dicho metabolismo, ya que para hacerlo se debe realizar un análisis diurno y nocturno del contenido de malato. Se puede concluir que las especies aquí estudiadas son de tipo No Kranz y que existe la posibilidad de que empleen el metabolismo fotosintético CAM, mecanismo que debe ser comprobado mediante pruebas bioquímicas.
En los tallos y rizomas de las especies estudiadas se observan tejidos de tipo aerenquimatoso; si bien estas plantas no están sometidas a condiciones de anegamiento permanente, es frecuente su ubicaciónen zonas de alta humedad en el suelo por lo que es posible que la oxigenación sea escasa y la posesión de un tejido capaz de retener aire probablemente sea una adaptación muy valiosa.
En el rizoma de N. occidentalis, la peridermis se diferencia profundamente en la corteza, lo cual la diferencia completamente de N. australis, donde dicha diferenciación es superficial. Esta variación no es inusual dentro de las Chenopodiaceae, ya que el felógeno puede encontrarse en regiones subepidérmicas (por ejemplo en Camphorosma) o en zonas muy cercanas a la estela en algunas Atripliceae, Salsoleae y Suaedeae (Metcalfe & Chalk, 1957). Solo el rizoma de la especie americana presenta haces vasculares pequeños por fuera de los haces mayores que forman parte de la estela. Estos haces pequeños divergen hacia la periferia del mencionado órgano y presumiblemente constituyen trazas foliares que llegarán a las brácteas o tallos aéreos que se disponen sobre los primeros.
En N. australis se observa una gran cantidad de drusas de oxalato de calcio en todos los órganos estudiados, a diferencia de N. occidentalis donde se encuentran en menor cantidad. Al parecer las Polygonaceae, Amaranthaceae y Chenopodiaceae (todas Centrospermales) incluyen muchas especies que presentan concentraciones muy altas de oxalato. La relación entre las especies que poseen drusas y los tejidos en que se encuentran en dichas especies sugiere que existen vías biosintéticas similares y que el rol funcional del oxalato es común en estas familias (Siener et al., 2005).
Según recientes estudios en hojas (Franceschi & Horner, 1980; Monje & Baran, 2002; Nakata, 2002; Franceschi & Nakata, 2005), a pesar de presentarse en un amplio rango de especies, los cristales conservan su morfología y distribución constantes, constancia que es usada como un rasgo taxonómico que caracteriza taxa desde familias hasta especies dentrode un género (Lersten & Horner, 2008). Las dos especies estudiadas presentan igual tipo de cristales y con un patrón de distribución similar en los órganos estudiados, por lo que si bien este carácter no tiene valor taxonómico para la separación de estasd os especies, constituye una base de comparación para estudios futuros en especies pertenecientes a los demás géneros integrantes de las Polycnemoideaeque hasta el momento no han sido investigadas en este aspecto.
La falta de estudios anatómicos de especies de los restantes géneros de la subfamilia Polycnemoideae no permite realizar comparaciones con las especies aquí observadas. Comparaciones anatómicas con otras subfamilias, dentro de las Chenopodiaceae, no resultan relevantes ya que las Polycnemoideae, únicas rizomatozas, poseen características disímiles respecto a las presentadas como generalidades para las subfamilias más importantes (Salicornioideae, Salsoloideae y Chenopodioideae) (Metcalfe & Chalk,1957).
Metcalfe & Chalk (1957) señalan que el carácter anatómico común más importante entre las Chenopodiaceae y Amaranthaceae es el desarrollo decrecimiento secundario anómalo, carácter que no está presente en ningún representante de la subfamilia Polycnemoideae donde se ubica Nitrophila. Al comparar los caracteres anatómicos hallados en las especies estudiadas del género Nitrophila con las generalidades descriptas por los autores citados anteriormente para Amaranthaceae y Chenopodiaceae, se puede concluir que la posesión de una estructura de mesofilo diferente a la estructura dorsiventral y el gran desarrollo de tejido acuífero en sus hojas, emparenta más a estas especies con las Chenopodiaceae que con las Amaranthaceae, ya que dichos caracteres no están citados para esta última. De todas formas la anatomía general de las especies de Nitrophila parece no corresponderse exactamente con las generalidades anatómicas de ninguna de las dos familias, lo cual hace retomar el interrogante de su filiación y reconsiderar si será conveniente la formación de una nueva familia que reúna a los integrantes de la subfamilia Polycnemoideae y así solucionar la controversia sistemática.
Si bien las características morfológicas y anatómicas generales son similares en N. australis y N. occidentalis -estomas no hundidos, abundante desarrollo de tejido acuífero en hojas, tejidos aerenquimatosos en tallos, drusas, rizomas reservantes, etc-, cada una presenta variaciones puntuales en caracteres estructurales específicos: estrías de la cutícula, células de la epidermis abaxial vista en planta, número de haces vasculares en tallos, anatomía vascular, etc., por lo cual su estudio anatómico reviste valor taxonómico a nivel de especie. Esto apoya el estudiode Soriano (1944) donde comenta que N. australis ha sido considerada muchas veces como sinónimo de N. occidentalis y que a su criterio, basándose en ambas descripciones, son dos especies diferentes.
El estudio aquí desarrollado además de contribuir a la descripción anatómica de dos especies no estudiadas hasta el momento, revela que las diferencias morfológicas y anatómicas encontradas son de interés sistemático. Considerando las complicaciones taxonómicas en las que siempre se encontraron las especies que forman la subfamilia Polycnemoideae, se remarca la importancia de un estudio anatómico minucioso de otras especies integrantes de la misma, para así contribuir al esclarecimiento de las relaciones filogenéticas entre éste y otros grupos conflictivos de la alianza Amaranthaceae-Chenopodiaceae. Según Müller y Borsch (2005) los resultados del estudio dela sistemática molecular no aseguran por sí solos que las dos familias puedan ser tratadas por separado si se trasladara la subfamilia Polycnemoideae a las Amaranthaceae (Müller & Borsch, 2005). Estos autores subrayan la necesidad de ampliar al máximo los estudios en estos taxa conflictivos, por lo cual trabajos anatómicos, como el aquí desarrollado, contribuyen como herramienta para la sistemática moderna.
AGRADECIMIENTOS
Este trabajo ha sido financiado por la Secretaría de Ciencia y Tecnología, Universidad Nacional del Sur (PGI 24/B125). Las autoras desean agradecer a C. Villamil por sugerir el estudio en la familia Chenopodiaceae, a R. Scoffield por indicar la ubicación de una población de N. australis, a D. Potter por permitir el estudio del material de herbario de DAV, a J. Shepard por su constante ayuda con los ejemplares de herbario y el contacto con informantes sobre la locación de N. occidentalis, a J. Greenhouse por señalarnos la población de esta especie, a J. Jernstedt por facilitarnos líquido conservador, a S. Villamil y familia por transportar y acompañar a P. Hermann a los diversos lugares sugeridos como hábitat de la especie americana y a todos aquellos que de alguna forma contribuyeron anónimamente a la realización de este trabajo.
BIBLIOGRAFÍA
1. BIANCO, C. A., T. A. KRAUS & A. C. VEGETTI. 2004. La hoja: Morfología y anatomía. 1era ed. Universidad Nacional de Río Cuarto, Córdoba. [ Links ]
2. CALFLORA. 2008. Information on California plants for education, research and conservation. (web application). Berkely, California. http\\www.calflora.org (accesed october 2008). [ Links ]
3. CAROLIN, R. C., S. W. L. JACOBS & M. VESK. 1975. Leaf Structure in Chenopodiaceae. Bot. Jahrb. Sist. 95: 226-255. [ Links ]
4. CHODAT, R. & E. WILCZEK. 1901. Flore de la Rèpublique Argentine. Bull. Herb. Boiss., 2º ser.: 535-536. [ Links ]
5. DIZEO DE STRITTMATTER, C. G. 1973. Nueva técnica de diafanización. Bol. Soc. Argent. Bot. 15: 126-129. [ Links ]
6. FLOWERS, T. J., M. A. HAJIBAGHERI & N. J. W. CLIPSON. 1986. Halophytes. Q. Rev. Biol. 61: 313-337. [ Links ]
7. FRANCESCHI, V. R. & H. T. HORNER, Jr. 1980. Calcium oxalate crystals in plants. Bot. Rev. 46: 361-427. [ Links ]
8. FRANCESCHI, V. R. & P. A. NAKATA. 2005. Calcium oxalate in plants: formation and function. Annu. Rev. Plant Biol. 56: 41-71. [ Links ]
9. GIUSTI, L. 1967. Chenopodiaceae. In Cabrera, A. L. (ed.), Flora de la provincia de Buenos Aires, Volumen 3, pp 81-127. Colección Científica del INTA, Buenos Aires. [ Links ]
10. GIUSTI, L. 1984. Chenopodiacea. In Correa, M. N. (ed.), Flora Patagónica, Volumen 8 Tomo 4a, pp 99-139. Colección Científica del INTA, Buenos Aires. [ Links ]
11. HICKMAN, J. C. 1993. The Jepson Manual: Higher Plants of California. University of California Press, California. [ Links ]
12. IPNI. 2004. The International Plant Names Index. Published on the Internet http:\\www.ipni.org (accessed 26 october 2008). [ Links ]
13. IRAM. 1993. Instituto Argentino de Racionalización de Materiales. Drogas vegetales. Determinacion del índice de estomas. Norma IRAM Nº37503. [ Links ]
14. JACOBS, S. W. L. 2001. Review of Leaf Anatomy and Ultrastructure in the Chenopodiaceae (Caryophyllales). J. Torrey Bot. Soc. 128: 236-253. [ Links ]
15. KADEREIT, G., T. BORSCH, K. WEISING & H. FREITAG. 2003. Phylogeny of Amaranthaceae and Chenopodiaceae and the evolution of C4 photosynthesis. Int. J. Plant Sci. 164: 959-986. [ Links ]
16. LANDRUM, J. V. 2002. Four succulent families and 40 million years of evolution and adaptation to xeric environments: What can stem and leaf anatomical characters tell us about their phylogeny?. Taxon 51: 463-473. [ Links ]
17. LERSTEN, N. R. & H. T. HORNER. 2008. Crystal macropatterns in leaves of Fagaceae and Nothofagaceae: acomparative study. Plant Syst. Evol. 271: 239-253. [ Links ]
18. MABBERLEY, D. J. 1987. The plant book: a portable dictionary of the higher plants. 1rst ed. Cambridge University Press, New York. [ Links ]
19. METCALFE, C. R. & L. CHALK. 1957. Anatomy of the Dicotyledons; leaves, stem and wood in relation to taxonomywith notes on economic uses. Clarendon Press, Oxford. [ Links ]
20. MONJE, P. V. & E. J. BARAN. 2002. Characterization of calcium oxalates generated as biominerals in cacti. Plant Physiol. 128: 707-713. [ Links ]
21. MÜLLER, K. & T. BORSCH. 2005. Phylogenetics of Amaranthaceae based on matK/trnK sequence data - Evidence from parsimony, like lihood, and Bayesiananalyses. Ann. Missouri Bot. Gard. 92: 66-102. [ Links ]
22. MUNZ, P. A. & D. D. KECK. 1959. A California Flora. University of California Press, California. [ Links ]
23. NAKATA, P. A. 2002. Calcium oxalate cristal morphology. Trends Plant Sci. 7: 324. [ Links ]
24. RAGONESE, A. M. 1990. Caracteres xeromorfos foliares de Nassauvia lagascae (Compositae). Darwiniana 30: 1-10. [ Links ]
25. SIENER, R., R. HÖNOW, A. SEIDLER, S. VOSS & A. HESSE. 2005. Oxalate contents of species of the Polygonaceae, Amaranthaceae and Chenopodiaceae families. Food Chem. 98: 220-224. [ Links ]
26. SIMON, L. 1997. Morphologie, ontogénie et valeur adaptativedes surfaces glandulaires mucilagènes dans le genre Chenopodium L. (Chenopodiaceae). C. R. Acad. Sci. París 320: 615-620. [ Links ]
27. SORIANO, A. 1944. El Género "Nitrophila" en la Argentina y su posición sistemática. Rev. Arg. Agron. 11: 302-308. [ Links ]
28. STEVENS, P. F. 2001 onwards. Angiosperm Phylogeny Website. Version 9, June 2008 and more or less continuously updatedsince. http://www.mobot.org/MOBOT/research/APweb/. [ Links ]
29. TAIZ, L. & E. ZEIGER. 1991. Plant Physiology. The Benjamin/Cummings Publishing Company, Inc., California. [ Links ]
30. ULBRICH, E. 1934. Chenopodiaceae. In Engler, A. & H. Harms (eds), Die Natürlichen Pflanzenfamilien, pp 379-584. 2nd ed. Engelmann, Leipzig. [ Links ]
Recibido el 20 de abril de 2009
Aceptado el 5 de agosto de 2009.














