Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Boletín de la Sociedad Argentina de Botánica
versión On-line ISSN 1851-2372
Bol. Soc. Argent. Bot. v.45 n.1-2 Córdoba ene./jun. 2010
BIOLOGÍA REPRODUCTIVA
Sobre las causas ontogénicas de la productividad diferencial de semillas en la especie anficárpica Trifolium polymorphum (Leguminosae)
Gabriela Speroni1, Primavera Izaguirre1 y Gabriel Bernardello2
1 Laboratorio de Botánica, Dpto. Biología Vegetal, Facultad de Agronomía, Universidad de la República, Av. E. Garzón 780, CP 12900, Montevideo, Uruguay. E-mail: speronig@fagro.edu.uy
2 Instituto Multidisciplinario de Biología Vegetal (CONICET-Universidad Nacional de Córdoba), Av. Vélez Sársfield 299, 5000 Córdoba, Argentina.
Resumen: Trifolium polymorphum es una leguminosa de pradera con buena adaptación y persistencia en este tipo de vegetación. Combina diferentes estrategias reproductivas como la reproducción vegetativa por estolones y la reproducción por semillas producidas en dos tipos de frutos y flores, subterráneas y aéreas. Las subterráneas son cleistógamas y las aéreas son casmógamas. Empíricamente se ha detectado mayor formación de semillas en los frutos subterráneos que en los aéreos. En el presente trabajo se realizan estudios embriológicos y de desarrollo de semillas en ambos tipos de flores para dilucidar si existen causas ontogenéticas que determinan la productividad diferencial de semillas en ambos tipos de frutos. No se detectaron causas embriológicas pre-cigóticas que expliquen el menor número de semillas en los frutos de las flores aéreas. Ambos tipos de semillas comparten características ontogenéticas y presentan apropiado desarrollo de los óvulos, sacos embrionarios y establecimiento de vías nutricionales para saco embrionario, embrión y endosperma. En general las floraciones insumen un costo energético importante para las especies vegetales. La floración aérea de T. polymorphum, aunque sometida a una fuerte presión de herbivoría del ganado, incorpora variabilidad genética a sus poblaciones a través de la polinización cruzada y permite la dispersión a distancia.
Palabras clave: Trifolium polymorphum; Leguminosae; Semillas; Embriología.
Summary: On the causes of the differential seed production in the anficarpic species Trifolium polymorphum (Leguminosae). Trifolium polymorphum is recognized as one of the best adapted legume in field conditions. It combines different reproductive strategies such as stoloniferous vegetative reproduction and seed reproduction by two types of fruits produced in underground and aerial flowers. These last ones are chasmogamous and underground flowers are cleistogamous. A higher seed production has empirically been detected in underground flowers rather than in aerial ones. In the present work, embryological studies in aerial and underground flowers were carried out in order to determine the existence of ontogenetic causes which may promote productivity differences in both types of seeds. No embryological pre-zygotic cause explaining aerial flowers low productivity was detected. Aerial and underground seeds share ontogenetic characteristics as both types of flowers showed normal ovule and embryo sac development. Similar nutritional pathways for embryo sacs, embryos and endosperms were also observed. In general, flowering represents a high energetic inversion for plant species. Aerial flowering in T. polymorphum, though subjected to a strong herbivorous pressure, incorporates genetic variability to populations through cross-pollination and succeeds in facilitating long distance dispersion.
Key words: Trifolium polymorphum; Leguminosae; Seeds; Embryology.
INTRODUCCIÓN
Trifolium polymorphum Poir. es una leguminosa pratense que habita en Argentina la estepa pampeana virgen en las Provincias de Buenos Aires, Entre Ríos, Córdoba, Chaco, Santa Fe (Burkart, 1987; Izaguirre, 2001), Corrientes, La Pampa, Río Negro y Misiones (Rossow, 1999), en Brasil en el Estado de Rio Grande do Sul, y en Paraguay, Chile central y Uruguay (Burkart, 1987; Izaguirre, 2001).
Es una especie perenne, que vegeta desde marzoabril hasta diciembre, cuya parte aérea desaparece durante el verano. Como leguminosa, constituye un importante componente de las praderas naturales de la región por su buena calidad y palatabilidad (Rosengurtt, 1943, 1946; Burkart, 1952; Coll & Zarza, 1992; Izaguirre, 2005). Durante el invierno es apetecida por el ganado, posee valores de proteínas de 15,2 % (Coll & Zarza, 1992) y, si bien la producción vegetativa no es alta, responde muy bien a la fertilización con fósforo, mejorando la cobertura de 10% a 30-60% (Fernández et al., 1988). En Uruguay presenta muy buena adaptación a las condiciones locales y al pastoreo. Su persistencia en el campo es uno de los atributos de especial interés para los mejoradores que llevan adelante programas en el género Trifolium (Abberton & Marshall, 2005; Taylor, 2008). Esta persistencia, lograda en parte por el hábito perenne y la reproducción vegetativa (García & Zamora, 2003), está favorecida por la combinación de esta última estrategia reproductiva con la reproducción sexual en dos tipos diferentes de flores: subterráneas y aéreas.
Las flores subterráneas son producidas en los nudos del estolón, en manojos geotrópicamente positivos, son cleistógamas y autógamas obligadas (Speroni, 2000; Speroni & Izaguirre, 2001; Speroni & Izaguirre, 2003). Según Culley & Klooster (2007) se trataría de un tipo de cleistogamia dimórfica, donde se producen dos tipos de morfologías florales, cleistógama y casmógama, con separación espacial y/o temporal de ambos. Datos empíricos en poblaciones uruguayas indican que, cuando hay floración subterránea, es significativa la producción de frutos y semillas alrededor de la planta madre. Este modo de reproducción, junto con la vegetativa, contribuye a la persistencia de la especie en el mismo lugar que habita la planta madre. Las flores aéreas se agrupan en cabezuelas que presentan entre 10-20 (40) flores y se ha registrado escasa producción de frutos, con valores entre 0,6 y 12% (Speroni, 2009). El modo de reproducción y el grado de alogamia y autogamia en ellas ha sido un punto controvertido. Burkart (1952) basándose en las características morfológicas comunes a las flores polinizadas por insectos, las cita como alógamas, igual que Coll & Zarza (1992), aunque estos últimos autores no ofrecen datos que lo sustenten. Speroni & Izaguirre (2001, 2003) encontraron formación de cigoto previo a la antesis de la flor, lo que indicaría la posibilidad de procesos de autogamia en la especie. Real et al. (2007) trabajaron con marcadores moleculares y proponen que la especie es alógama y autocompatible. Por último, en estudios llevados adelante sobre la fenología intrafloral por Speroni et al. (2009) se encontraron características funcionales de la flor que favorecen la polinización cruzada.
Teniendo en cuenta, la importancia de la especie como componente de las praderas naturales y los escasos estudios comparativos sobre la ontogenia de las diferentes morfologías florales en especies con flores cleistógamas y casmógamas (Gotelli et al., 2006), se plantea el presente trabajo con estudios embriológicos y de desarrollo de semillas en los frutos de las flores subterráneas y las aéreas. Se procura establecer si existen causas ontogenéticas que favorezcan o restrinjan la formación de frutos y semillas en uno u otro tipo floral.
MATERIAL Y MÉTODO
El material se obtuvo de tres poblaciones naturales uruguayas de T. polymorphum var. polymorphum ubicadas en los departamentos de Florida, Durazno y Treinta y Tres (P1, P2 y P3, respectivamente; Tabla 1). Se extrajeron terrones de aproximadamente 60 x 40 x 10 cm de profundidad, con plantas que tuvieran buena cantidad de cabezuelas muy jóvenes, de modo de asegurar un alto número de flores aéreas para el trabajo experimental en cultivo. Dado el hábito estolonífero de la especie, se forma una intrincada trama con otras especies del tapiz que impide diferenciar y cuantificar individuos. Cada terrón por lo tanto puede tener uno o más individuos de la especie y los resultados del trabajo harán referencia entonces a cada población. Se instaló un ensayo en la Facultad de Agronomía (Montevideo, Uruguay) y se fijó material en FAA (formol, ácido acético, alcohol 70o; 5:5:90) para los estudios embriológicos. Teniendo en cuenta la antesis de las flores aéreas, se fijaron cinco flores diariamente durante los cinco días anteriores a la antesis (daa) y los 12 días posteriores a la misma (dpa) (los estadios fenológicos se muestran en la Fig. 1) en las tres poblaciones. Luego se fijó material cada dos días en P2 y P3 y en forma más espaciada en P1, dado que no presentaba la misma disponibilidad de flores que las otras poblaciones. Para los estudios en flores subterráneas se colectaron y fijaron flores y frutos en P1 y P2. En P3 no se encontraron flores ni frutos subterráneos en la fecha de la colecta del material.
Se establecieron siete estadios fenológicos para analizar, que se muestran en la Fig. 2. Ambos tipos de flores se disecaron y deshidrataron utilizando alcohol etílico en una serie de graduaciones ascendentes. La inclusión en parafina del material se realizó utilizando toluol como intermediario. Los cortes seriados se realizaron con micrótomo de rotación Minot American Optical, obteniéndose cortes entre 6 y 9 ?m. Se tineron con la doble coloración safraninafast green y se montaron con Bálsamo de Canadá. Los cortes así obtenidos se analizaron en microscopio óptico Leitz 718549 y se tomaron fotografías con cámara digital Nikon Coolpix P5100 en microscopio Nikon Eclipse E100. En las flores aéreas se contabilizó el número de óvulos por ovario para establecer el número promedio y relacionar con los estudios embriológicos observados.
Tabla 1. Ubicación de las tres poblaciones uruguayas de Trifolium polymorphum estudiadas.

RESULTADOS
Flores aéreas
La mayor parte de las flores analizadas presentaron cuatro óvulos por ovario (Tabla 2). Sin embargo, P3 mostró un mayor porcentaje de ovarios con cinco y seis óvulos que las otras poblaciones.
Tabla 2. Número de óvulos por gineceo para las tres poblaciones analizadas de Trifolium polymorphum (N: número de ovarios analizados).

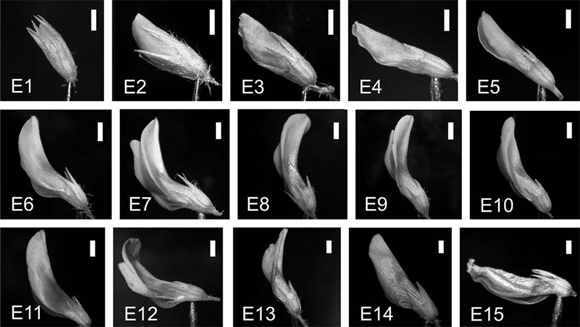
Fig. 1. Estadios fenológicos de las flores aéreas de Trifolium polymorphum (E, estadio). La escala equivale a 1 mm.
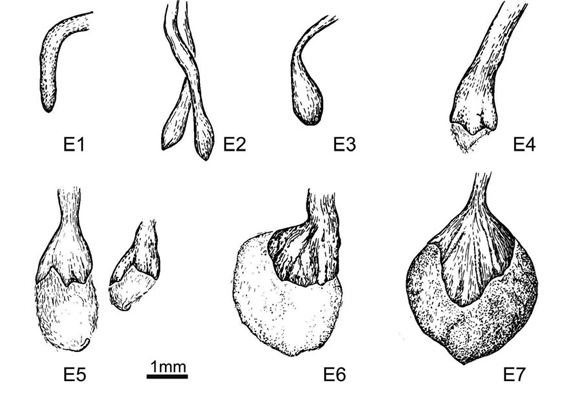
Fig. 2. Estadios fenológicos de las flores subterráneas de Trifolium polymorphum (E, estadio). La escala equivale a 1 mm.
Estadios pre-antesis. Cinco días antes de la antesis P1 mostró óvulos con sacos embrionarios en formación en la totalidad de los gineceos analizados, tanto en estadio binucleado, como 4- y 8-nucleado (Fig. 3 A-D). En P2, de cuatro gineceos analizados en este estadio, tres presentaban sacos embrionarios en formación y sólo uno con sacos embrionarios maduros. En los primeros, los óvulos no mostraban sincronización en la ontogenia de los sacos embrionarios, observándose óvulos con sacos 2- y 4-nucleados o 4- y 8-nucleados en el mismo gineceo. En P3, de cinco gineceos analizados, tres presentaron sacos embrionarios desarrollados y los restantes en formación, observándose también la falta de sincronización entre los eventos ontogenéticos de óvulos de un mismo gineceo. Los óvulos son campilótropos, bitégmicos y 5 daa ya presentaban micrópila en zig-zag definida (Fig. 3E).
Cuatro días antes de la antesis las tres poblaciones mostraron óvulos con sacos embrionarios bien desarrollados y maduros. En el polo micropilar se ubican las dos sinérgidas acompanando la oósfera (Fig. 4A). Los núcleos polares se encuentran próximos al aparato oosférico, resaltando sus nucleolos prominentes de color rojo (Fig. 4B), aún sin fusionarse. Las antipodales no se observaron, por lo que se asume que son efímeras. Los tegumentos del óvulo están bien diferenciados (Fig. 5A). El externo tiene siete a nueve capas de células y el interno, dos o tres. Anivel de este último ya se observa endotelio diferenciado, por agrandamiento de las células epidérmicas internas (Fig. 5B). En la epidermis externa del tegumento externo comienzan a diferenciarse células cuadrangulares que se tinen intensamente de rojo, comenzando desde este momento la diferenciación de lo que será la futura cubierta seminal (Fig. 5A).
Desde este estadio hasta un día antes de la antesis, todos los óvulos completan el desarrollo de sacos embrionarios. Los tegumentos se van diferenciando progresivamente. En la epidermis externa del tegumento externo, las futuras esclereidas de forma cuadrangular, tenidas intensamente de rojo, se diferencian y agrandan. A nivel de la calaza, estas células se alargan para formar las macroesclereidas que constituirán el lente. A la altura del hilo comienzan a destacarse un grupo de células isodiamétricas, que formarán la barra de esclereidas a ese nivel. En el tegumento interno se observa una reducción en el número de capas que lo constituyen, quedando prácticamente reducido al endotelio (Fig. 6A). Las células que lo forman tienen mayor tamano que en estadios anteriores y se observa actividad mitótica en ellas (Fig. 6A). La vascularización se acentúa, distinguiéndose un haz vascular importante que penetra por el funículo y se extiende hacia la calaza, alcanzando a las células organizadas de la nucela que forman el podio (Fig. 6B). En el funículo, se agrandan y destacan las células placentarias que cubren la pared interna del carpelo hasta la base del estilo y que actúan como tejido transmisor (Fig. 6C).
Inicio de la antesis. En este momento, las tres poblaciones presentaron gineceos con óvulos bien desarrollados, con tegumentos que se estructuran y lignifican, con mecanismos de nutrición activos, como un endotelio bien desarrollado y la acentuación de la vascularización que llega a la calaza (Fig.7A). La totalidad de los óvulos analizados en las tres poblaciones mostraron sacos embrionarios bien desarrollados. En todas ellas se observó fecundación, detectada por la presencia de cigoto en este estadio (Fig. 7B).
Estadios post-antesis. Los porcentajes de ovarios fecundados (considerados así los que por lo menos presentaban un óvulo con saco embrionario fecundado) se muestran en la Tabla 3. Se registró fecundación a partir del estadio correspondiente al inicio de la antesis en P1 y P3, y a partir de los dos días de inicio de la antesis en P2. El endosperma comienza su formación durante la antesis de la flor, como se muestra en la Tabla 3 para las tres poblaciones.
En P1 se observó formación de embrión globoso y endosperma nuclear rodeándolo a los 10 dpa (Fig. 8A) en uno de los óvulos analizados. Los restantes óvulos del mismo ovario presentaban cigoto formado, pero no había desarrollo de endosperma, por lo que no hay sincronización en los eventos que ocurren dentro de los óvulos de un mismo ovario. En esta misma población se observó la organización de las células calazales a los 3 dpa, que se agrandan y proliferan hacia el interior del saco embrionario formando el podio o postamento (Fig. 8B). Estas células están estrechamente vinculadas al haz vascular que llega a la calaza. Aún en los óvulos que no mostraron signos de fecundación en este período, el tegumento externo continúa su desarrollo, incrementando el tamano de las macroesclereidas en la zona del lente (Fig. 8C) y de las esclereidas ubicadas a nivel del hilo. El material fijado para P1, hasta 30 dpa, no mostró desarrollo de frutos y semillas, por lo que no pudieron llevarse adelante observaciones en estos estadios.
En P2 se encontraron semillas desarrolladas a partir de los 18 dpa, con embrión cordiforme ocupando todo el interior de la semilla y a los 44 dpa se registraron semillas maduras. Igual que en P1, muchos óvulos fecundados fallaron en su desarrollo posterior, aunque presentaban formación incipiente de testa y vías nutricionales como las descriptas. En P2 también se observaron las células calazales organizadas a partir de los 5 dpa, y que se vinculan posteriormente con el endosperma formado en semillas ya desarrolladas (Fig. 8D).
En P3 se registraron semillas en desarrollo a partir del los 11 dpa, pudiendo coexistir con semillas fecundadas pero en degeneración, como en las otras poblaciones. Sólo se obtuvo una semilla completamente desarrollada a los 32 dpa.

Fig. 3. Flores aéreas de Trifolium polymorphum 5 días antes de la antesis en población 1. A. Saco embrionario bi-nucleado. B. Saco embrionario tetra-nucleado. C. Saco embrionario ocho-nucleado, detalle de núcleos micropilares. D. Saco embrionario ocho-nucleado, detalle de núcleos calazales. E. Óvulo (m, micrópila; v, haz vascular). Las escalas equivalen a: 18 ?m en A, 15 ?m en B-D y 50 ?m en E.
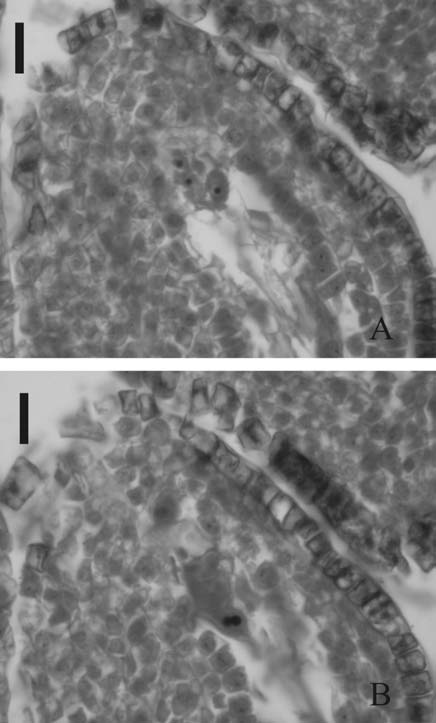
Fig. 4. Flores aéreas de Trifolium polymorphum 4 días antes de la antesis en población 3. A. Sinérgidas y oósfera en saco embrionario. B. Núcleos polares del mismo saco embrionario anterior. Las escalas equivalen a 13 ?m.

Fig. 5. Flores aéreas de Trifolium polymorphum 4 días antes de la antesis en población 1. A. Óvulo (c, células cuadrangulares del tegumento externo; m, micrópila; v, haz vascular). B. Detalle del endotelio (flecha). Las escalas equivalen a 25 ?m.
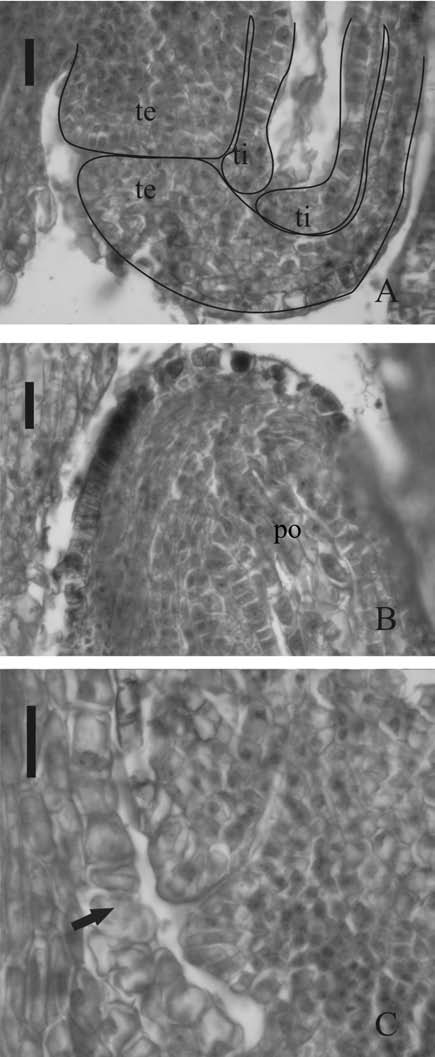
Fig. 6. Flores aéreas de Trifolium polymorphum 1 día antes de la antesis en población 1. A. Reducción del tegumento interno para formar el endotelio (te, tegumento externo; ti, tegumento interno). B. Vascularización en la calaza y células organizadas formando el podio (po). C. Células placentarias (flecha) cercanas a la micrópila. Las escalas equivalen a 25 ?m.

Fig. 7. Flores aéreas de Trifolium polymorphum en antesis. A. Óvulo (e, endotelio; l, lente; m, micrópila) de población 1. B. Detalle de cigoto en población 3. Las escalas equivalen a: 100 ?m en A y 25 ?m en B .
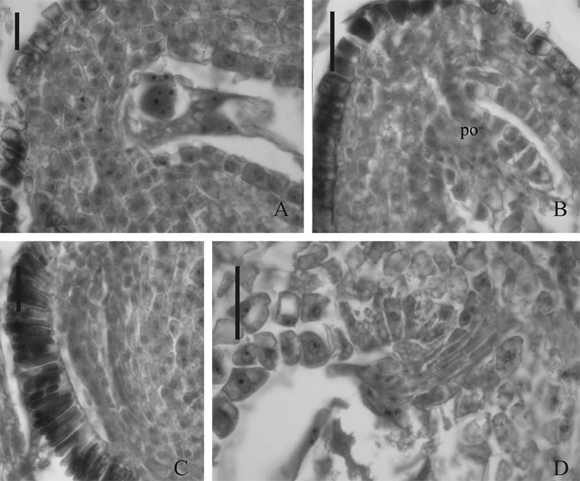
Fig. 8. Flores aéreas de Trifolium polymorphum en estadios post-antesis. A. Embrión globoso rodeado de endosperma nuclear, 10 días posteriores a la antesis, población 1. B. Células calazales organizadas formando el podio (po), 3 días posteriores a la antesis, población 1. C. Detalle de las esclereidas del lente, 3 días posteriores a la antesis, población 1. D. Detalle de la vinculación del endosperma con la calaza, 5 días posteriores a la antesis, población 2. Las escalas equivalen a: 100 ?m en A, 50 ?m en B, 25 ?m en C y 40 ?m en D.
Tabla 3. Ovarios analizados y porcentaje de ovarios fecundados (por lo menos con un óvulo fecundado) para las tres poblaciones de Trifolium polymorphum, indicando el momento observado para los eventos de fecundación e inicio del desarrollo de endosperma. dpa = días post-antesis.

Flores subterráneas
Cada flor contiene dos óvulos en las dos poblaciones estudiadas, que generalmente prosperan en su desarrollo hacia semillas maduras.
Estadio 1. Las flores subterráneas presentan óvulos muy jóvenes, tanto en P1 como en P2. La nucela es homogénea y los tegumentos se desarrollan desde la base hacia el ápice. En P1 se encontró la célula arquespórica diferenciada (Fig. 9A).
Estadio 2. Se registraron diferentes etapas del proceso de megasporogénesis. En P1 se detectaron óvulos con nucela homogénea, o con célula madre de megáspora o megáspora funcional ya formada. En P2, a pesar del desarrollo externo más avanzado de las flores, los óvulos analizados presentaron menor evolución que en el estadio 1.
Estadio 3. En P1 se detectó la presencia de megáspora funcional (Fig. 9B), en óvulos con buena definición de su morfología campilótropa, micrópila en zig-zag y células placentarias formadas, que se extienden hasta el funículo y muy cercanas a la micrópila (Fig. 9C), como se observó en las flores aéreas. También se encontraron óvulos con sacos embrionarios en formación, tanto en estado binucleado, como tetranucleado (Fig. 9D) y sacos embrionarios maduros (Fig. 10 A y B). En el material analizado para P2 se encontraron también sacos embrionarios en distintas etapas de formación como en P1. En los óvulos con saco embrionario maduro, las células calazales de la nucela se organizan en forma radiada (Fig. 10 C), como se observó en las flores aéreas, se diferencia el endotelio y las futuras esclereidas de forma cuadrangular a nivel del tegumento externo para formar la testa (Fig. 10 C). También se detectaron fecundación y formación de endosperma (Fig. 11 A), con una acentuación de la morfología final característica de la semilla y formación del lente (Fig. 11 B).
Estadio 4. En ambas poblaciones se encontró formación de embrión globoso, abundante endosperma nuclear (Fig. 12 A), con organización haustorial hacia la calaza, zona a donde llega una importante vascularización. Algunas muestras de P2 presentaron fecundación, sin haberse iniciado la formación del endosperma y embrión.
Estadios 5 y 6. Ambos estadios se caracterizan por la presencia de embriones en diferentes estadios de desarrollo en ambas poblaciones, tanto embrión globoso, como cordiforme con endosperma celularizado (Fig. 12 B). Éste se relaciona con la zona micropilar y calazal (Fig.12 C), donde parece anclarse para el suministro de nutrientes. Se continúa diferenciando la testa y se acentúa el lente (Fig. 12 B y C).
Estadio 7. En este estadio sólo se obtuvo material de P1. Se encontraron semillas con diferentes estadios de desarrollo. Las de mayor tamano contenían embriones completamente desarrollados, ocupando todo el interior de la semilla y endosperma consumido, quedando sólo restos de sus paredes celulares (Fig. 12 D).

Fig. 9. Flores subterráneas de Trifolium polymorphum. A. Óvulo en estadio 1, población 1, con tegumentos en desarrollo y célula arquespórica (flecha). B. Óvulo en estadio 3, población 1, con megáspora funcional y restos de megásporas degeneradas (flecha). C. Células placentarias cercanas a la micrópila en óvulo en estadio 3, de población 1. D. Saco embrionario 4-nucleado en estadio 3, población 1. Las escalas equivalen a: 40 ?m en A, 15 ?m en B, 18 ?m en C y 50 ?m en D.
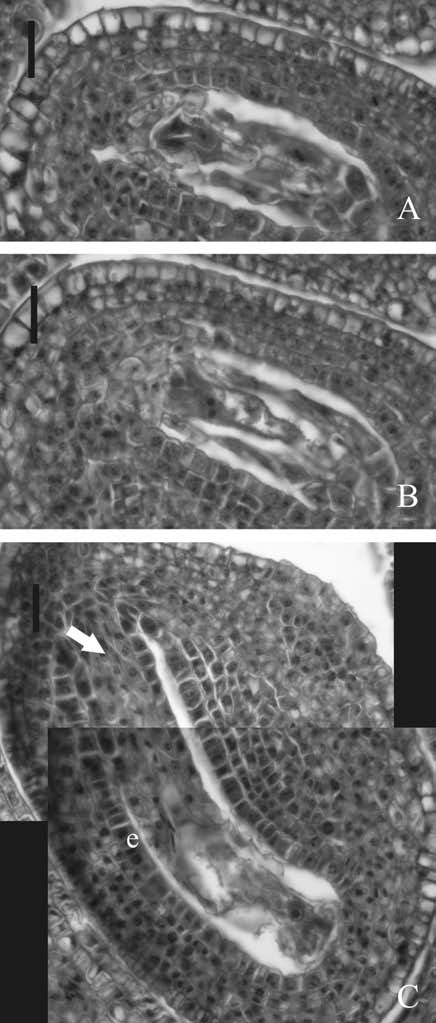
Fig. 10. Flores subterráneas de Trifolium polymorphum. A. Saco embrionario en estadio 3 de población 1, con las dos sinérgidas y la oósfera. B. Núcleos polares del saco embrionario anterior. C. Saco embrionario en estadio 3 de población 2, con oósfera, endotelio (e) y células organizadas de la calaza (flecha). Las escalas equivalen a: 20 ?m en A y B y 25 ?m en C.

Fig. 11. Flores subterráneas de Trifolium polymorphum. A. Embrión globoso en estadio 3, población 2. B. Óvulo en estadio 3, población 2, con esclereidas desarrolladas (flecha: macroesclereidas del lente). Las escalas equivalen a 25 ?m en A y 50 ?m en B.

Fig. 12. Frutos subterráneos de Trifolium polymorphum. A. Embrión globoso rodeado de endosperma, en estadio 4, población 2 (escala 13 ?m). B. Embrión cordiforme rodeado de endosperma celular, en estadio 5, población 2 (escala 170 ?m). C. Relacionamiento del endosperma con la calaza (flecha) en estadio 5, población 2 (escala 90 ?m). D. Semilla de estadio 7, población 1, con embrión completamente desarrollado (escala 400 ?m). Las escalas equivalen a: 13 ?m en A, 170 ?m en B, 90 ?m en C y 400 ?m en D.
DISCUSIÓN Y CONCLUSIONES
Desarrollo de saco embrionario y semillas
Si bien las flores aéreas y subterráneas poseen marcadas diferencias morfológicas, los procesos ontogenéticos que ocurren a nivel del óvulo son muy similares. Comparten el tipo de óvulo campilótropo con micrópila en zig-zag y el saco embrionario tipo Polygonum, como fuera descripto por Speroni & Izaguirre (2001) y es común en la familia (Prakash, 1987). Se confirma la presencia de células antipodales efímeras observadas por Speroni & Izaguirre (2001) para esta especie y por otros autores para otras especies del mismo género o familia (Hindmarsh, 1964; Krupko, 1973; Prakash, 1987; Faigón et al., 2003). También las vías que se establecen para nutrir al saco embrionario y luego al embrión son similares. El endotelio se diferencia tempranamente en ambos tipos de flores, como ocurre en otras Papilionoideas como Adesmia securigerifolia (Izaguirre et al., 1994), Melilotus alba (Roti-Michelozzi et al., 1989) y Trifolium pratense (Hindmarsh, 1964). Las células nucelares se organizan radialmente en la calaza con función haustorial. Esta estructura, observada en otras leguminosas como Lotus glaber (Galati et al., 2006), fue denominada postament por Mogensen (1973) y podium por Bouman (1984). Posee una organización similar a la hipostasa, compuesta por células nucelares organizadas radialmente, que persisten y conectan el saco embrionario con la zona calazal. Las células centrales elongadas actúan como ruta de transporte para la nutrición del megagametofito (Mogensen, 1973). El tegumento externo comienza a diferenciarse desde etapas precigóticas para formar la futura testa en ambos tipos de flores. Las células precursoras de esclereidas externas se agrandan y alargan, especialmente a la altura de la calaza, donde formarán el lente, que cumple un rol importante en la permeabilidad de la testa en esa zona (Manning & Van Staden, 1985). Comparten además la presencia de células secretoras desde la base del estilo hasta la micrópila. Estas células epiteliales de la placenta que se han descripto para algunas especies como Lilium regale (Liliaceae) se denominan placentarias (Singh & Walles, 1992) y cumplen un rol destacado en la dirección de los tubos polínicos hacia la micrópila del óvulo. Se confirma para T. polymorphum su presencia en esta zona del carpelo, caracterizadas por citoplasma denso, muy vacuolizado, núcleo grande con nucleolo prominente en ambos tipos de flores.
Semillas de frutos aéreos vs. semillas de frutos subterráneos
En general la floración implica un costo energético importante para las especies vegetales. En el caso de las especies que producen dos morfologías florales diferentes, no están establecidas claramente aún las causas que determinan la formación de unas u otras, citándose entre los principales factores los ambientales (densidad, tipo de suelo y condiciones nutricionales, niveles de luminosidad, tamano de la planta) (Cheplick, 2005). En algunas especies la relación flores cleistógamas/casmógamas fluctúa entre individuos y entre poblaciones (Culley & Klooster, 2007). Observaciones a campo en poblaciones uruguayas de T. polymorphum demuestran que la floración subterránea puede preceder a la aérea durante los meses de invierno, ocurrir simultáneamente en primavera o no ocurrir durante todo el ano. Este aspecto sería importante abordarlo en futuros trabajos para cuantificar la producción de flores aéreas y subterráneas y la consecuente formación de semillas en los frutos, como componente importante para evaluar el éxito reproductivo de la especie. Otro tema a explorar sería las posibles causas que determinan la diferencia en número de ambos tipos florales. Si tomamos en cuenta las observaciones embriológicas realizadas en el presente trabajo, ambos tipos de flores exigen una inversión energética pre-cigótica importante en la preparación de los óvulos, considerando la formación de los sacos embrionarios, el establecimiento de las vías nutricionales y la preparación del tegumento externo para formar la testa. En las tres poblaciones uruguayas estudiadas todos los óvulos de las flores aéreas en la etapa de inicio de antesis presentan desarrollo de saco embrionario apto o potencialmente fecundable, como ocurre en los dos óvulos de las flores subterráneas. Sin embargo, en las flores subterráneas los dos óvulos se desarrollan exitosamente como semillas que resultan de mayor tamano que las producidas en las flores aéreas. Estas últimas presentan un promedio de cuatro óvulos por flor y muestran una baja proporción en la formación de semillas con relación a ese número. Se ha registrado que las flores subterráneas producen frutos con semillas más grandes (Imbert, 2002), asegurando así una exitosa germinación y un establecimiento seguro de las plántulas, pero en menor cantidad que las aéreas (Kaul et al., 2000; Gotelli et al., 2006). La predación ha sido considerada como una de las fuerzas de selección para el origen de la anficarpia en las plantas (Kaul et al., 2000). La herbivoría en la vegetación de pradera, así como el manejo del campo natural y/o mejorado, pueden considerarse como otras causas en la determinación de esta estrategia reproductiva. En T. polymorphum, coincidiendo con los ejemplos anteriores, las flores subterráneas conjuntamente con la reproducción vegetativa por estolones, contribuyen a la persistencia de la especie en el campo natural.
Fallas en el desarrollo de embriones
Gran parte de las flores aéreas analizadas en este estudio mostraron óvulos fecundados que no culminaron su desarrollo, así como embriones abortados. Los valores de fecundación encontrados (44-78%) resultan altos comparados con el porcentaje de fructificación de 0,6-12% registrado por Speroni (2009) en las cabezuelas de flores aéreas. Si bien se produce efectivamente la fecundación, el porcentaje de embriones que se desarrolla es bajo. Esta reducción del número de semillas producidas por fruto en relación al número de óvulos inicial se ha observado en varias especies de leguminosas (Medicago, Melilotus y Trifolium) y otras familias, proponiéndose como las principales causas la evaluación por parte materna de la carga genética masculina durante el desarrollo de los embriones (Wiens et al., 1987), así como la competencia entre embriones (Korbecka et al., 2002). Esta interpretación podría incluirse dentro de los efectos de la depresión por endocría. Por otro lado, la falta de desarrollo exitoso de los cigotos podría explicarse por un sistema de incompatibilidad tardía que actuara a nivel del óvulo. Este sistema de incompatibilidad se ha interpretado como un sistema costoso para la especie, dado el estado embriológico avanzado en el que ocurre, pero se ha constatado que es más frecuente en la naturaleza de lo que se ha encontrado hasta el momento (Seavey & Bawa, 1986) ya que fue confirmado para 20 especies pertenecientes a 16 familias (Bianchi et al., 2005). La forma de diferenciarla de la depresión por endocría no es sencilla (Charlesworth & Charlesworth, 1987; Bianchi et al., 2005), aunque se ha establecido que la incompatibilidad tardía se manifiesta en un determinado momento del desarrollo intra-ovular, produciéndose una detención del desarrollo a un mismo nivel en todos los óvulos de un gineceo (Seavey & Bawa, 1986; Gibbs et al., 1999). En la depresión por endocría sin embargo, la detención en el desarrollo ocurre en diferentes etapas de formación de los embriones y/o de las plántulas, en la medida que se van expresando diferentes alelos recesivos letales. En Medicago sativa se observó rechazo post-cigótico del embrión, acompanado de crecimiento anormal de los tejidos somáticos del tegumento interno. Esta hiperplasia local de los tejidos maternos fue interpretada por Cooper & Brink (1940) como una expresión de depresión por endocría, más que como un modo de incompatibilidad. Sin embargo, Seavey & Bawa (1986) consideran que la esterilidad somatoplástica puede ser una forma de activo rechazo a los embriones autógamos. En cruzamientos interespecíficos del género Trifolium se encontraron barreras de incompatibilidad determinando el aborto de los embriones en diferentes estadios de desarrollo o en la hiperplasia del endotelio, que comprime el saco embrionario (Repková et al., 2006). En el presente trabajo no se determinó un momento específico de incompatibilidad en el desarrollo intra-ovular de las flores aéreas. Se observaron cigotos y embriones que al detener su desarrollo, no mostraron síntomas de hiperplasia o crecimiento anómalo de los tejidos maternos o en las vías nutricionales que indicaran rechazo de los mismos. Para establecer las causas de la detención del desarrollo de los embriones en las flores aéreas, sería pertinente plantear futuros trabajos para el seguimiento de la ontogenia de los embriones en polinizaciones manuales autógamas y alógamas, para determinar si ocurre en diferentes momentos de acuerdo con el origen del polen.
Las flores subterráneas de T. polymorphum son autocompatibles, con autogamia obligada. Si las flores aéreas presentaran algún sistema de autoincompatibilidad, estarían actuando dos sistemas distintos en la misma planta. Speroni (2009) observó desarrollo exitoso de tubos polínicos en flores aéreas de T. polymorphum en polinizaciones manuales autógamas, resultando con mayores tasas de desarrollo que los obtenidos en polinizaciones alógamas. Se midió mayor productividad de semillas en los frutos provenientes de polinizaciones autógamas que alógamas. Speroni et al. (2009) encontraron características fenológicas intraflorales que tienden a favorecer la polinización con polen foráneo y evitar la autopolinización. Esto indica que las flores aéreas son también autocompatibles al igual que las flores subterráneas. Si ocurren procesos de geitonogamia entre flores de una misma cabezuela o inflorescencias de un mismo individuo, la descendencia sería equivalente a la de las flores subterráneas (Masuda et al., 2001; Culley & Klooster, 2007). Pero si la polinización es cruzada, entonces las flores aéreas actúan incorporando variabilidad genética a las poblaciones.
Estrategia reproductiva
Se ha establecido que períodos prolongados de reproducción clonal, reducen la capacidad de la especie de dispersarse a larga distancia y afectan negativamente la diversidad genética dentro de las poblaciones (Silander, 1985; McLellan et al., 1997), aunque se ha detectado alta diversidad genotípica en poblaciones clonales (Honnay & Bossuyt, 2005). En este trabajo no se detectaron causas ontogenéticas precigóticas que restrinjan la producción de semillas en los frutos de las flores aéreas con respecto a las subterráneas, por lo que ambos tipos de flores hasta el momento del inicio de la formación de los embriones, no tienen restricciones ontogenéticas para eventualmente desarrollarse dando frutos y semillas.
T. polymorphum por su condición perenne y la reproducción asexual por estolones, reúne las características consideradas por autores como García & Zamora (2003) para perdurar en el campo natural, ya que valoran positivamente la longevidad de los individuos y la reproducción vegetativa como factores básicos para la regeneración y persistencia de las especies; además, la reproducción sexual por semillas producidas en frutos de flores subterráneas favorece esta persistencia y le confiere homogeneidad genética a sus poblaciones. Mientras tanto, la floración aérea, que consume una alta inversión energética en la producción de flores y óvulos, incorpora variabilidad genética y consigue la dispersión de la especie en el espacio hacia nuevos ambientes, factores ambos que en esencia determinan el otro factor del éxito de la especie en el campo natural.
AGRADECIMIENTOS
GS agradece al Programa de Desarrollo en Ciencias Básicas (PEDECIBA) de la Universidad de la República, en el cual realizó su Doctorado y del que esta publicación forma parte, así como también a la Comisión Sectorial de Investigación Científica (CSIC) de la Universidad de la República por la financiación de este trabajo a través del Programa de Proyectos, Iniciación a la Investigación, Modalidad I, 2006. GS y PI agradecen a la Facultad de Agronomía y la Universidad de la República. GB agradece al CONICET a cuya carrera del investigador pertenece y a la Universidad Nacional de Córdoba.
BIBLIOGRAFÍA
1. ABBERTON, M. T. & A. H. MARSHALL. 2005. Progress in breeding perennial clovers for temperate agriculture. J. Agric. Sci. 143: 117-135. [ Links ]
2. BIANCHI, M. B., S. A. HARRIS, P. E. GIBBS & D. E. PRADO. 2005. A study of the mating system in Dolichandra cynanchoides (Bignoniaceae): an Argentinian Chaco woodlands liane with a late-acting self-incompatibility. Plant Syst. Evol. 251: 173-181. [ Links ]
3. BOUMAN, F. 1984. The ovule. In: JOHRI, B. M. (ed.). Embryology of angiosperms, pp. 123-157. Springer-Verlag, Berlin. [ Links ]
4. BURKART, A. 1952. Las Leguminosas argentinas silvestres y cultivadas. Ed. ACME, Buenos Aires. [ Links ]
5. BURKART, A. 1987. Flora Ilustrada de Entre Ríos. III. Colección del INTA 6, Buenos Aires. [ Links ]
6. CHARLESWORTH, D. & B. CHARLESWORTH. 1987. Inbreeding depression and its evolutionary consequences. Annu. Rev. Ecol. Syst. 18: 237-268. [ Links ]
7. CHEPLICK, G. P. 2005. Plasticity of chasmogamous and cleistogamous reproductive allocation in grasses. In: COLUMBUS, J. T., FRIAR, E. A., HAMILTON, C. W., PORTER, J. M., PRICE, L. M. & SIMPSON, M. G. (eds.). Monocots: comparative biology and evolution, pp.145-155. Rancho Santa Ana Botanical Garden, Claremont, California. [ Links ]
8. COLL, J. & A. ZARZA. 1992. Leguminosas nativas promisorias: Trébol polimorfo y babosita. Boletín de Divulgación No 22. Instituto Nacional de Investigación Agropecuaria (INIA), Montevideo. [ Links ]
9. COOPER, D. C. & R. A. BRINK. 1940. Partial selfincompatibility and the collapse of fertile ovules as factors affecting seed formation in alfalfa. J. Agric. Res. 60: 453- 472. [ Links ]
10. CULLEY, T. & M. R. KLOOSTER. 2007. The Cleistogamous Breeding System: A Review of Its Frequency, Evolution, and Ecology in Angiosperms. Bot. Rev. 73: 1-30. [ Links ]
11. FAIGÓN SOVERNA, A., B. GALATI & P. HOC. 2003. Study of Ovule and Megagametophyte Development in Four Species of Subtribe Phaseolinae (Leguminosae). Acta Biol. Cracov., Ser. Bot. 42: 63-73. [ Links ]
12. GALATI, B. G., S. ROSENFELDT & G. M. TOURN. 2006. Embryological studies in Lotus glaber (Fabaceae). Ann. Bot. Fennici 43: 97-106. [ Links ]
13. GARCÍA, D. & R. ZAMORA. 2003. Persistence, multiple demographic strategies and conservation in long-lived Mediterranean plants. J. Veget. Sci. 14: 921-926. [ Links ]
14. GIBBS, P. E., P. E. OLIVEIRA & M. B. BIANCHI. 1999. Postzygotic control of selfing in Hymenaea stigonocarpa (Leguminosae-Caesalpinoideae), a bat-pollinated tree of the Brazilian Cerrados. Int. J. Plant Sci. 160: 72-78. [ Links ]
15. GOTELLI, M., B. GALATI & P. HOC. 2006. Embryology of Macroptilium arenarium (Leguminosae). Aust. J. Bot. 54: 531-542. [ Links ]
16. HINDMARSH, C. J. 1964. Gametophyte development in Trifolium pratense L. Austr. J. Bot. 12: 1-14. [ Links ]
17. HONNAY, O. & B. BOSSUYT. 2005. Prolongued clonal growth: escape route or route to extinction?. Oikos 108: 427-432. [ Links ]
18. IMBERT, E. 2002. Ecological consequences and ontogeny of seed heteromorphism. Perspect. Plant Ecol. Evol. Syst. 5: 13-36. [ Links ]
19. IZAGUIRRE, P. 2001. Trifolium polymorphum Poir. In: Grassland and Pasture Crops. http://www.fao.org /WAICENT/FAOINFO/AGRICULT/AGP/AGPC/doc/pasture/ pasture.htm [ Links ]
20. IZAGUIRRE, P. 2005. Uruguay y sus recursos fitogenéticos en Leguminosas. Agrociencia 9: 77-83. [ Links ]
21. IZAGUIRRE, P., S. MEROLA & R. BEYHAUT. 1994. Seed ontogeny in Adesmia securigerifolia (Fabaceae- Adesmieae). Nord. J. Bot. 14: 547-556. [ Links ]
22. KAUL, V., A. K. KOUL & M. C. SHARMA. 2000. The underground flower. Curr. Sci. 78: 39-44. [ Links ]
23. KORBECKA, G., P. G. L. KLINKHAMER & K. VRIELING. 2002. Selective Embryo Abortion Hypothesis Revisited – A Molecular Approach. Plant Biol. 4: 298-310. [ Links ]
24. KRUPKO, S. 1973. Megasporogenesis and development of the embryo sac in the Palestine variety of Trifolium alexandrinum L. Acta Soc. Bot. Pol. 42: 617-625. [ Links ]
25. McLELLAN, A. J., D. PRATI & O. KALTZ. 1997. Structure and analysis of phenotypic and genetic variation in clonal plants. In: de KROON, H. & J. van GROENENDAEL (eds.), The ecology and evolution of clonal plants, pp. 185-210. Backhuys Publishers, Leiden. [ Links ]
26. MANNING, J. C. & J. VAN STADEN. 1985. The development and ultrastructure of the testa and tracheid bar in Erythrina lysistemon Hutch. (Leguminosae: Papilionoideae). Protoplasma 129: 157-167. [ Links ]
27. MASUDA, M., T. YAHARA & M. MAKIS. 2001. An ESS model for the mixed production of cleistogamous and chasmogamous flowers in a facultative cleistogamous plant. Evol. Ecol. Res. 3: 429-439. [ Links ]
28. MOGENSEN, H. L. 1973. Some histochemical, ultrastructural, and nutritional aspects of the ovule of Quercus gambelii. Amer. J. Bot. 60: 48-54. [ Links ]
29. PRAKASH, N. 1987. Embryology of the Leguminosae. In: POLHILL, R. & P. RAVEN (eds.). Advances in Legume Systematics, 3: 241-278. Royal Botanical Gardens, Kew. [ Links ]
30. REAL, D., M. DALLA RIZZA, R. REYNO & K. H. QUESENBERRY. 2007. Breeding system of the aerial flowers in an amphicarpic clover species: Trifolium polymorphum. Crop Sci. 47: 1401-1406. [ Links ]
31. REPKOVÁ, J., B. JUNGMANNOVÁ & H. JAKESOVÁ. 2006. Identification of barriers to interspecific crosses in the genus Trifolium. Euphytica 151: 39-48. [ Links ]
32. ROSENGURTT, B. 1943. Estudios sobre praderas naturales del Uruguay. 3a Contribución. La estructura y el pastoreo de las praderas en la región de Palleros. Flora de Palleros. Barreiro y Ramos S.A., Montevideo. [ Links ]
33. ROSENGURTT, B. 1946. Estudios sobre praderas naturales del Uruguay. 5a Contribución. Normas usuales de manejo de praderas naturales en J. Jackson. Flora de J. Jackson. Imprenta Rosgal, Montevideo. [ Links ]
34. ROSSOW, R. A. 1999. Trifolium L. In: F. O. ZULOAGA & O. MORRONE (eds.). Catálogo de las Plantas Vasculares de la República Argentina II. Fabaceae-Zygophyllaceae (Dicotyledonae), pp. 734-737. Missouri Botanical Garden Press, St. Louis. [ Links ]
35. ROTI-MICHELOZZI, G., L. RIGGIO-BEVILACQUA & P. BOCA. 1989. Development of the tissues surrounding the embryo in Melilotus alba Med. Phytomorphology 39: 157-160. [ Links ]
36. SEAVEY, S. R. & K. S. BAWA. 1986. Late-acting selfincompatibility in Angiosperms. Bot. Rev. 52: 195-219. [ Links ]
37. SILANDER, J. A. 1985. Microevolution in clonal plants. In: JACKSON, J. B. C., L. S. BUSS & R. E. COOK (eds.), Population biology and evolution of clonal organisms, pp. 107- 152. Yale University Press, London. [ Links ]
38. SINGH, S. & B. WALLES. 1992. The ovarian transmitting tissue in Lilium regale. Int. J. Plant Sci. 153: 205-211. [ Links ]
39. SPERONI, G. 2000. Aspectos de la Biología Reproductiva de Trifolium polymorphum Poir. (Fabaceae, Papilionoideae). Tesis de Maestría, opción Botánica, área Biología. Programa de Desarrollo en Ciencias Básicas. Universidad de la República, Montevideo. [ Links ]
40. SPERONI, G. 2009. Fenología intrafloral y modo de reproducción de las flores aéreas de la especie anficárpica Trifolium polymorphum Poir. (Leguminosae, Papilionoideae), una estratega de nuestros campos naturales. Tesis de Doctorado, opción Botánica, área Biología. Programa de Desarrollo en Ciencias Básicas. Universidad de la República, Montevideo. [ Links ]
41. SPERONI, G. & P. IZAGUIRRE. 2001. Morfología y esporogénesis en flores aéreas y subterráneas de la especie anficárpica Trifolium polymorphum (Fabaceae, Papilionoideae). Bol. Soc. Argent. Bot. 36: 253-265. [ Links ]
42. SPERONI, G. & P. IZAGUIRRE. 2003. Características biológicas de la leguminosa nativa promisoria forrajera Trifolium polymorphum Poir. (Fabaceae, Faboideae). Agrociencia 7: 68- 76. [ Links ]
43. SPERONI, G., P. IZAGUIRRE, G. BERNARDELLO & J. FRANCO. 2009. Intrafloral phenology of Trifolium polymorphum Poir. (Leguminosae) aerial flowers and its reproductive implications. Acta Bot. Bras. 23: 881-888. [ Links ]
44. TAYLOR, N. L. 2008. A century of clover breeding developments in the United States. Crop Sci. 48: 1-13. [ Links ]
45. WIENS, D., C. L. CALVIN, C. A. WILSON, C. I. DAVERN, D. FRANK & S. R. SEAVEY. 1987. Reproductive success, spontaneous embryo abortion, and genetic load in flowering plants. Oecologia 71: 501-509. [ Links ]
Recibido el 7 de julio de 2009
Aceptado el 28 de abril de 2010.














