Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Boletín de la Sociedad Argentina de Botánica
versión On-line ISSN 1851-2372
Bol. Soc. Argent. Bot. vol.46 no.1-2 Córdoba ene./jun. 2011
ECOLOGÍA Y FITOGEOGRAFÍA
Adquisición de carbono en frutos de color verde del muérdago Tristerix corymbosus (Loranthaceae)
Cecilia I. Núñez1 y Guillermo C. Amico2
1 Laboratorio Ecotono, Universidad Nacional del Comahue, Quintal 1250, (8400) Bariloche, RN, Argentina. Tel.: (+54-2944) 423374, Fax.: (+54-2944) 422111. E-mail: cecilia.nunez@crub.uncoma.edu.ar; cecinu@gmail.com
2 Laboratorio Ecotono, INIBIOMA (CONICET-Universidad Nacional del Comahue. E-mail: guilleamico@gmail.com
Resumen: El color verde de los frutos maduros podría atribuirse a la capacidad de adquirir carbono mediante fotosíntesis, lo cual disminuye los costos reproductivos e incrementa la recompensa nutritiva para los dispersores de semillas. En el muérdago Tristerix corymbosus (Loranthaceae) el color de los frutos maduros varía según el bioma: en el matorral chileno los frutos son amarillos mientras que en el bosque templando son verdes. Nuestro objetivo fue determinar si el color de los frutos se relacionaba con la capacidad de ganar carbono vía fotosíntesis y si esta capacidad variaba con la madurez y el bioma. Realizamos mediciones fisiológicas en plantas provenientes de poblaciones de cada bioma. Los frutos, tanto inmaduros como maduros de cada bioma no mostraron adquisición neta de carbono; las hojas mostraron actividad fotosintética, éstas poseen estomas en ambas caras y los frutos carecen de ellos. Estos resultados permiten descartar la hipótesis de que el color verde de los frutos de T. corymbosus se encuentra asociado a la adquisición neta de carbono vía fotosíntesis y mantiene la necesidad de indagación de otras hipótesis sobre la variación del color de los frutos entre biomas.
Palabras clave: Bosque templando austral; Estomas; Fotosíntesis; Matorral chileno; Variación de color en frutos.
Summary: Carbon acquisition in green fruits of Tristerix corymbosus (Loranthaceae). In some species fruits are green when they are ripe. This can be attributed to the ability to acquire carbon via photosynthesis, which reduces reproductive costs and increases nutritional reward for seed dispersers. The color of mature fruits of the mistletoe Tristerix corymbosus (Loranthaceae) differ between biomes. In the Chilean matorral ripe fruits are yellow while in the temperate forest are green. Our objective was to determine whether or not fruits photosynthesize and if this ability varied with maturity stage and biome. We performed physiological measurements in plants from populations of each contrasting biome. Fruits did not denote carbon acquisition, regardless the biome or maturity stage. Leaves showed photosynthetic activity, they are amphistomatic, but fruits lacked stomata. These results prove false the hypothesis that the green color at maturity is associated to the ability to acquire carbon via photosynthesis, allowing to persevere in inquiring alternative hypotheses to explain fruit color variation in T. corymbosus.
Key words: Chilean matorral; Color variation; Temperate forest of South America; Stoma.
INTRODUCCIÓN
En las plantas, el color que presentan los frutos carnosos a la madurez es diverso y sus variaciones han tratado de ser explicadas según diferentes hipótesis que incluyen tanto factores abióticos como bióticos y genéticos. Entre los factores que determinan la variación del color se han sugerido: selección por parte de los dispersores de semillas, evitar predadores, heterogeneidad del hábitat y efectos del clima (Willson & O'Dowd, 1989; Willson & Whelan, 1990; Traveset & Willson, 1998; Bach & Kelly, 2007). En aquellas especies donde los frutos maduros mantienen el color verde se han planteado hipótesis que consideran factores fisiológicos y energéticos, por ejemplo, Cipollini & Levey (1991) sostienen que el color verde en los frutos maduros en muchas especies está asociado a la capacidad de fotosintetizar. La adquisición de carbono por parte de las estructuras no foliares representa una importante contribución para disminuir los costos reproductivos en muchas especies (Benzing & Pockman, 1989; Aschan & Pfanz, 2003). En el caso de las plantas que presentan frutos carnosos, se ha sugerido que la capacidad de adquirir recursos por fotosíntesis incrementaría la recompensa nutritiva para los dispersores (Cipollini & Levey, 1991).
El muérdago Tristerix corymbosus (Loranthaceae) es un sistema de estudio ideal para poner a prueba distintas hipótesis que expliquen la variación geográfica en el color de los frutos; esta especie tiene una amplia distribución, estando presente en dos biomas contrastantes, el matorral chileno, al norte de su distribución y el bosque templado austral, al sur (Kuijt, 1988; Amico & Nickrent, 2009). Dos características llamativas de la especie son que en las poblaciones del matorral chileno los frutos maduros son de color amarillo, mientras que en las poblaciones del bosque templando austral mantienen el color verde y que los agentes de dispersión son diferentes en cada bioma, i.e., aves en el matorral y un marsupial en el bosque (Amico et al., 2011). Esto sugiere que la coloración de los frutos a la madurez podría ser una respuesta a diferentes presiones de selección por parte de los dispersores de semillas. Por otra parte, el color de los frutos a la madurez podría deberse a factores fisiológicos asociados a cada ambiente y por lo tanto el color determinaría a los posibles dispersores. En este trabajo consideramos esta segunda posibilidad y ponemos a prueba la hipótesis que plantea que la coloración verde de los frutos de Tristerix corymbosus está asociada la capacidad de ganar carbono mediante fotosíntesis. Esta hipótesis predice que los frutos inmaduros tendrán la capacidad de adquirir carbono en ambas poblaciones y que esta capacidad se mantendría en los frutos de las poblaciones del bosque templando austral, que son verdes en su madurez. Si esto fuera así, los frutos del bosque podrían alcanzar sus requerimientos energéticos aun en condiciones ambientales de menor temperatura (que enlentece los procesos fisiológicos, en particular el crecimiento) y una temporada de crecimiento más corta que en el matorral.
MATERIALES Y MÉTODOS
Especie y área de estudio
El muérdago austral Tristerix corymbosus (L.) Kuijt "Quintral", es una especie hemiparásita que está distribuida desde el nivel del mar hasta cerca de los 2500 m s.n.m. Latitudinalmente se encuentra desde los 30º S hasta aproximadamente los 42º S en Chile, mientras que en Argentina se lo encuentra entre los 40º y 41ºS en zonas boscosas adyacentes a la Cordillera de los Andes (Kuijt, 1988; Amico & Nickrent, 2009). En relación al uso de hospedadores es considerada una especie generalista, debido a que parasita a más de 25 especies arbustivas y arbóreas, tanto nativas como introducidas. Presenta flores tubulares de color rojo (ca. 5 cm de largo) que a lo largo de todo el rango geográfico de distribución es polinizada principalmente por el picaflor Sephanoides sephaniodes. El periodo de floración es de otoño a primavera. Las flores maduran en una baya que contiene una semilla (ca. 0.6 cm de largo) rodeada por una pulpa viscosa. En las poblaciones del matorral chileno los frutos maduran en primavera (octubre-noviembre) y los agentes dispersores son las aves Elaenia albiceps (Tyrannidae), Turdus falcklandii (Turdidae) y Mimus thenca (Mimidae); mientras que en las poblaciones del bosque templado los frutos maduran de enero a abril y son dispersados de forma eficiente únicamente por el marsupial endémico Dromiciops gliroides (Microbiotheriidae) (Amico & Aizen, 2000; Amico et al., 2011.
A lo largo de la distribución de T. corymbosus se seleccionaron dos poblaciones, una en cada bioma. La población del matorral chileno está ubicada en la localidad de San Felipe, V Región, Chile (32° 47' S, 70° 51'O, 460 m s.n.m.) y la del bosque templado austral en Llao Llao, Bariloche, Río Negro, Argentina (41° 03'S, 71° 32' O, 785 m.s.n.m).
Mediciones fisiológicas
Para determinar si los frutos de T. corymbosus tenían la capacidad de adquirir carbono mediante fotosíntesis y si esta capacidad variaba con el estado de maduración y bioma, se realizaron mediciones en laboratorio y campo (condiciones naturales) de tasas de adquisición de carbono neta. Las mediciones se realizaron en los periodos en los cuales se encuentran tanto frutos inmaduros como maduros en la plantas de T. corymbosus, los cuales corresponden a octubre para el matorral chileno y febrero para el bosque templado austral. Por problemas logísticos no fue factible realizar mediciones en condiciones naturales en la población del matorral chileno. Para las mediciones en laboratorio se colectaron ramas de siete individuos de T. corymbosus de cada población. Las ramas fueron conservadas con buena hidratación, a baja temperatura y en la oscuridad durante 24 horas hasta llegar al laboratorio donde permanecieron cerca de dos horas, con luz (incidencia cenital, radiación fotosintéticamente activa, RFA en μmol m-2 s-1) y temperatura constante, para permitir su aclimatación. Luego se seleccionaron las ramas más lozanas para realizar las mediciones (sin modificar las condiciones de luz y temperatura). En el bosque templado austral se realizaron, además, mediciones en condiciones naturales en la población de Llao Llao donde se seleccionaron siete individuos en los cuales se midieron de cinco a siete frutos inmaduros y la misma cantidad de frutos maduros y de hojas, las cuales se incluyeron para realizar comparaciones como control positivo.
La tasa neta de adquisición de carbono (A; μmol CO2 m-2 s-1) se midió utilizando la cámara acrílica de 250cc de un equipo Li-6200 (LICOR Corp., Lincoln, NE). Los valores obtenidos (i.e., 5-7 estructuras de 5-7 individuos) se promediaron por individuo, para cada estructura (frutos inmaduros, frutos maduros y hojas). La superficie expuesta a la luz, en las hojas, se midió en imágenes calibradas de las hojas, utilizando el programa SigmaScan Pro 5 (SPSS), mientras que en los frutos, dado que son esféricos, la superficie expuesta a la luz se calculó en base a una semiesfera. Las comparaciones se realizaron mediante ANOVA utilizando el programa JMP (SAS Institute Inc. 2003). Por otro lado, se determinó la presencia o ausencia de estomas en las superficies de hojas y frutos de diferentes individuos (n = 10 frutos maduros, n = 10 frutos inmaduros y N = 5 hojas, por población). Para observar estomas se cubrió la superficie de las hojas (ambas caras) y frutos con esmalte para uñas transparente, de esta forma al retirar la capa de esmalte se obtuvieron muestras de cutícula, también se realizaron cortes de la epidermis, que luego se observaron en el microscopio (Zhao et al., 2006).
RESULTADOS
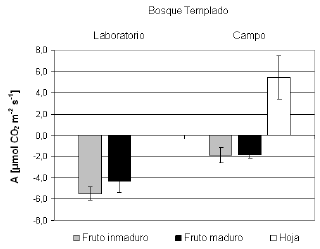
Los frutos provenientes de matorral chileno y del bosque templado, tanto inmaduros como maduros mostraron tasas negativas de adquisición de carbono (A<0), i.e., producción de CO2 debido a actividad respiratoria. No hubo diferencias significativas entre frutos inmaduros y maduros, tanto para el matorral chileno (F1,4 = 1.97; P = 0.232 ) como para el bosque templado (F1,8 = 4.36; P = 0.070), medidos en condiciones de laboratorio (Fig. 1), ni para los frutos medidos en el campo (F1,9 = 0.01; P = 0.919; Fig. 2). No obstante, las tasas de respiración mostraron diferencias según la procedencia de los frutos y las condiciones de medición, tanto en inmaduros como en los maduros (Tabla 1). Las hojas (medidas en condiciones naturales) mostraron tasas positivas de adquisición de CO2 (Fig. 2). En los frutos no se encontraron estomas, tanto inmaduros como maduros de ambas poblaciones, mientras que las hojas presentaron estomas tanto en la cara abaxial como en la adaxial (i.e., son anfiestomáticas).
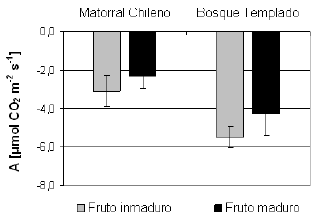
Fig. 1. Tasa neta de adquisición de carbono (A) en frutos inmaduros (barra gris) y maduros (barra negra) de Tristerix corymbosus provenientes de poblaciones del matorral chileno y del bosque templado. Se muestra el promedio de A ± desvío estándar (DE) de las mediciones de laboratorio. Los valores negativos de A indican producción de CO2 (i.e. respiración).
Fig. 2. Tasa neta de adquisición de carbono (A) en frutos inmaduros (barra gris), maduros (barra negra) y en hojas (barra blanca) de Tristerix corymbosus del bosque templado. Se muestra el promedio de A ± desvío estándar (DE) de las mediciones realizadas en condiciones naturales. Los valores negativos de A indican producción de CO2 (i.e. respiración), los positivos señalan consumo de CO2 (i.e., fotosíntesis).
Tabla 1. Tasa neta de adquisición de carbono en frutos (A, promedio), desvío estándar (DE) y sus comparaciones. Los valores negativos de A indican producción de CO2 (i.e. respiración).

Las condiciones de luz durante las mediciones, en todos los casos, oscilaron entre 600 y 1000 μmol m-2 s-1 de RFA. La temperatura ambiental varió según el momento y/o lugar de medición (F1,2 = 32.52; P < 0.0001). Para las plantas provenientes del matorral chileno (medidas en laboratorio en octubre) fue de 28.3 ± 0.6º C, de mientras que para las plantas provenientes del bosque templado (medidas en laboratorio en febrero) fue de 32.3 ± 0.8 º C y para las mediciones hechas en el campo (bosque templado, febrero) fue de 24.3 ± 0.8 º C. Dadas estas diferencias y que la tasa de respiración está afectada por temperatura, calculamos el índice de correlación entre el promedio de las tasas de respiración en frutos (i.e, matorral chileno en laboratorio en octubre, boque templado en laboratorio en febrero y boque templado en el campo en febrero) con la valor promedio de la temperatura ambiental durante las mediciones, su valor fue r2 = 0.93, lo que indica que la temperatura influyó en las tasas de respiración.
DISCUSIÓN
Las mediciones realizadas en plantas de Tristerix corymbosus provenientes del matorral chileno y del bosque templado austral no evidencian ganancia neta de carbono en ninguno de los frutos medidos y éstos tampoco presentan estomas.Las hojas mostraron actividad fotosintética y son anfiestomáticas. Por lo tanto, los resultados obtenidos no apoyan la hipótesis que la coloración verde de los frutos maduros está asociada a la ganancia neta de carbono, dado que los frutos de T. corymbosus no mostraron un balance positivo, en ambos estadios de madurez y biomas. Esto sugiere que en las poblaciones de T. corymbosus dentro del bosque templado, el color verde de los frutos maduros obedecería a otras razones que no es la adquisición neta de carbono.
En el caso de los frutos de T. corymbosus la falta de estomas confirmaría la ausencia de fijación de CO2 atmosférico, pues su provisión, mediante la difusión de este gas a través de la cutícula, es muy lenta (Cipollini & Levey, 1991; Boyer et al., 1997), sin embargo, no se descarta la existencia de fisuras en la cutícula de los frutos que podrían representar una alternativa de intercambio gaseoso (Blanke & Lenz, 1989).
Si bien no se detectó el consumo de CO2, sí se comprobó su producción; esto no excluye la posibilidad que exista actividad fotosintética reciclando el CO2 respirado. Se ha observado que este fenómeno ocurre en estadios tempranos del desarrollo de ciertos frutos, tallos y otras estructuras no foliares (Aschan & Pfanz, 2003; Blanke & Lenz, 1989) y en las vainas infladas de de los frutos Isomeris arborea (Capparidaceae), un arbusto siempreverde endémico del desierto de California, que le permiten acumular y luego fijar el CO2 producido por la respiración (Goldstein et al., 1991). Dado que los frutos de T. corymbosus carecen de estructuras de almacenamiento de CO2, de existir el reciclado (fijación) del CO2 respirado, sería mínimo. Aún así, es posible que estas cantidades mínimas contribuyan a mejorar el balance de C, pudiendo contrarrestar hasta cierto punto las pérdidas por respiración (Aschan & Pfanz, 2003; Blanke & Lenz, 1989), futuras investigaciones deberían enfocarse en este punto, evaluando con detalle diferencias en las tasas de respiración.
El color verde a la madurez de los frutos en el bosque templado podría deberse a otras razones, por ejemplo, las condiciones climáticas del bosque templado austral limitarían el desarrollo completo del fruto, dado que el clima es más frío y la temporada de crecimiento más corta que el matorral chileno. De ser así, los fruto del bosque templado estarían evidenciando el carácter "stay green"(i.e., variantes genéticas que retrasan o evitan la senescencia de estructuras vegetales, Thomas & Howarth, 2000). De hecho, los frutos maduros del bosque templando austral son similares en tamaño y coloración a los inmaduros del matorral chilenos (Amico, 2007).
Las diferencias en las tasas de respiración encontradas entre el matorral chileno, el bosque templado (medidas en laboratorio pero en distintas épocas) y las mediciones a campo pueden explicarse por diferencias en la temperatura en los distintos eventos de medición. En las plantas, la tasa de respiración aumenta de forma lineal con la temperatura, dentro de los rangos considerados moderados para la mayoría de las especies (i.e., 20 a 40 ºC; Atkin & Tjoelker, 2003). Los valores observados en este estudio se encuentran dentro este rango, las tasas de respiración promedio de los frutos mostraron una alta correlación con las distintas condiciones de temperatura.
La actividad fotosintética de las hojas es esperable dado que esta planta no es holoparásita. Dado que las plantas hemiparásitas adquieren agua del xilema de su hospedador, el agua no es limitante y esto explicaría que las hojas tengan estomas en ambas caras (Hollinger, 1983). Muchas plantas de vida libre presentan estomas sólo en la cara abaxial (inferior) de las hojas lo que limita la pérdida de agua.
Las evidencias mostradas en este trabajo de que la coloración verde de los frutos no se debería a la capacidad de adquirir carbono (i.e., ganancia neta) permite continuar con la indagación de hipótesis alternativas que permitirán dilucidar las causas ecológicas y evolutivas asociadas la llamativa variación geográfica en la coloración de los del muérdago T. corymbosus.
AGRADECIMIENTOS
Agradecemos a M. Rodríguez-Cabal por su colaboración en los muestreos y por sus comentarios al manuscrito. A N. Tercero-Bucardo por sus valiosas críticas y sugerencias y a L. Roselli por sus recomendaciones. Tres revisores anónimos realizaron una excelente revisión de trabajo. Este trabajo fue financiado por la Universidad Nacional del Comahue y CONICET.
BIBLIOGRAFÍA
1. AMICO, G. C. 2007. Variación geográfica en la coloración de los frutos del muérdago Tristerix corymbosus (Loranthaceae): efecto de la historia evolutiva, del ambiente, de los dispersores de semillas y de los hospedadores, Universidad Nacional del Comahue, Bariloche, RN, Argentina. [ Links ]
2. AMICO, G. C. & M. A. AIZEN. 2000. Mistletoe seed dispersal by a marsupial. Nature 408: 929-930. [ Links ]
3. AMICO, G. C. & M. A. AIZEN. 2005. Dispersión de semillas por aves en un bosque templado de Sudamérica austral: ¿quién dispersa a quién? Ecol. Austral 15: 89-100. [ Links ]
4. AMICO, G. C. & D. L. NICKRENT. 2009. Population structure and phylogeography of the mistletoes Tristerix corymbosus and T. aphyllus (Loranthaceae) using chloroplast DNA sequence variation. Amer. J. Bot. 96: 1571-1580. [ Links ]
5. AMICO, G. C., M. RODRIGUEZ-CABAL & M. A. AIZEN. 2011. Geographic variation in fruit colour is associated with contrasting seed disperser assemblages in a south-Andean mistletoe. Ecography 43: 318-326. [ Links ]
6. ASCHAN, G. & H. PFANZ. 2003. Non-foliar photosynthesis-a strategy of additional carbon acquisition. Flora 198: 81-97. [ Links ]
7. ATKIN, O.K. & TJOELKER, M.G. 2003. Thermal acclimation and the dynamic response of plant respiration to temperature. Trends Plant Sci. 8: 343- 351. [ Links ]
8. BACH, C. E. & D. KELLY. 2007. Mistletoe fruit-colour polymorphism and differential success in a habitat mosaic. Austral Ecol. 32: 509-514. [ Links ]
9. BENZING, D. H. & W. T. POCKMAN. 1989. Why do nonfoliar green organs of leafy orchids fail to exhibit net photosynthesis? Lindleyana 4: 53-60. [ Links ]
10. BLANKE, M. M. & F. LENZ. 1989. Fruit photosynthesis. Plant, Cell & Environ. 12: 31-36. [ Links ]
11. BOYER, J. S., S. C. WONG & G. D. FARQUHAR. 1997. CO2 and water vapor exchange across leaf cuticle (epidermis) at various water potentials. Plant Physiol. 114: 185-191. [ Links ]
12. CIPOLLINI, M. L. & D. J. LEVEY. 1991. Why some fruits are green when they are ripe: carbon balance in fleshy fruits. Oecologia 88: 371-377. [ Links ]
13. GOLDSTEIN, G., M. R. SHARIFI, L. U. KOHORN, J. R. B. LIGHTON, L. SHULTZ & P. W. RUNDEL. 1991. Photosynthesis by inflated pods of a desert shrub, Isomeris arborea. Oecologia 85: 396-402. [ Links ]
14. HOLLINGER, D. Y. 1983. Photosynthesis and water relations of the mistletoe, Phoradendron villosum, and its host, the California valley oak, Quercus lobata. Oecologia 60: 396-400. [ Links ]
15. KUIJT, J. 1988. Revision of Tristerix (Loranthaceae). Syst. Bot. Monogr. 19: 1-61. [ Links ]
16. MATHIASEN, R. L., D. L.NICKRENT, D. C. & D. M. WATSON. 2008. Mistletoes: pathology, systematics, ecology, and management. Plant Dis. 92: 988-1006. [ Links ]
17. SAS INSTITUTE INC. 2003. JMP. The Statistical Discovery Software. [ Links ]
18. THOMAS, H. & C. J. HOWARTH. 2000. Five ways to stay green. J. Exp. Bot. 51: 329-337. [ Links ]
19. TRAVESET, A. & M. F. WILLSON. 1998. Ecology of the fruit-colour polymorphism in Rubus spectabilis. Evol. Ecol. 12: 331-345. [ Links ]
20. WILLSON, M. F. & D. J. O'DOWD. 1989. Fruit color polymorphism in a bird-dispersed shrub (Rhagodia parabolica) in Australia. Evolutionary Ecology 3: 40-50. [ Links ]
21. WILLSON, M. F. & C. J. WHELAN. 1990. The Evolution of the fruit color in fleshy-fruit plants. Amer. Nat. 136: 790-809. [ Links ]
22. ZHAO, X., X. DAI, G. WANG, Z. SHEN, H. ZHANG & M. QIU. 2006. Developmental mechanism and distribution pattern of stomatal clusters in Cinnamomum camphora. Russ. J. Plant Physiol. 53:310-315. [ Links ]
Recibido 2 de agosto de 2010
Aceptado el 16 de noviembre de 2010.