Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Boletín de la Sociedad Argentina de Botánica
versión On-line ISSN 1851-2372
Bol. Soc. Argent. Bot. vol.46 no.3-4 Córdoba jul./dic. 2011
ANATOMÍA Y MORFOLOGÍA VEGETAL
Ecoanatomía foliar deárboles y arbustos delos distritos chaqueños occidental y serrano (Argentina)
Ana M. Arambarri1*, María C. Novoa1, Néstor D. Bayon1, Marcelo P. Hernández1, Marta N. Colares1 y Claudia Monti1
1 Área de Botánica, Facultad de Ciencias Agrarias y Forestales, Calle 60 y 119, C.C. 31, 1900 La Plata, Universidad Nacional de La Plata, Argentina.
* Corresponding author: Tel. +54-221-423-6758 int. 461; Fax +54-221-425-2346. E-mail: botgral@agro.unlp.edu.ar; anaramba@yahoo.com.ar
Resumen: El objetivo de este trabajo fue evaluar parámetros micrográficos foliares que permitan comprender mejor la relación planta-ambiente y contribuyan al desarrollo de nuevas tecnologías para el aprovechamiento sustentable y conservación de los bosques de esta región. Se empleó material de hoja de ejemplares recolectados en la región subtropical seca de la provincia chaqueña y material fresco de especies creciendo en zona templado-húmeda para comparar las variaciones de la estructura foliar. Se determinaron densidades por mm-2 de células epidérmicas, estomas y tricomas, tipos de mesofilo y tipo y distribución de los tejidos vascular y de sostén. Se encontró que estos caracteres anatómicos de la hoja son influenciados por una combinación de factores intraespecíficos y del ambiente. Los caracteres xeromórficos puestos de manifiesto fueron: presencia de ceras epicuticulares, estrías cuticulares, estomas hundidos con reborde peristomático, de epidermis bistrata o pluristrata y/o de hipodermis, mesofilo en empalizada o isolateral y abundante esclerénquima. Algunas especies tales como: Celtis ehrenbergiana, C. iguanaea, Jodina rhombifolia, Lycium cestroides y Parkinsonia aculeata, muestran desde caracteres xeromórficos (e.g. hojas anfistomáticas, equifaciales) hasta caracteres mesomórficos (e.g. hojas hipostomáticas, bifaciales) incluyendo algunos hidromórficos como la ausencia de esclerénquima.
Palabras clave: Anatomía foliar; Árboles; Argentina; Provincia Biogeográfica Chaqueña.
Summary: Leaf ecoanatomy of trees and shrubs from Chacoan Occidental and Serrano Districts (Argentina). The objective of this work was to evaluate foliar micrographic parameters to deepen our understanding of the plant-environment relationships, contributing to new technologies to preserve the forests of this area. Leaf material of specimens collected in chacoan biogeographic province with subtropical and dry climatic conditions, and from species growing in template and humid conditions were studied to compare leaf structure variations. Epidermal cells, stomata and trichomes by unit of area (mm-2), types of mesophyll, sclerenchymatic tissue and distribution were analyzed. These characters are affected by intraspecific and environmental factors. The main xeromorphic traits were: presence of epicuticular waxes, striate cuticle, sunken stomata with peristomatal ridges, epidermis bi or pluristratified and/or hypodermis, whole palisade or bilateral mesophyll with palisade tissue direct toward both epidermis, and presence of sclerenchyma. Some species like: Celtis ehrenbergiana, C. iguanaea, Jodina rhombifolia, Lycium cestroides, and Parkinsonia aculeata, exhibit from xeromorphic (e.g. amphistomatic and equifacial leaves) to mesomorphic characters (e.g. hypostomatic and bifacial leaves) with some hydromorphic features such as absence of sclerenchyma.
Key words: Argentina; Chacoan province; Leaf anatomy; Trees.
Introducción
El Dominio Chaqueño ocupa un área disyunta que comprende seis provincias fitogeográficas. Una de estas provincias se ubica al noreste de Brasil, mientras que las otras cinco ocupan gran parte del territorio de la República Argentina, parte de Bolivia, Paraguay y sur de Brasil. Específicamente, en Argentina, este Dominio se extiende desde el Atlántico al este hasta la Cordillera de los Andes al oeste y desde el límite con Paraguay al norte, hasta la provincia de Chubut al sur. La Provincia Biogeográfica Chaqueña de Argentina abarca una extensa región la que está dividida en cuatro distritos: Distrito de las Sabanas, Distrito Chaqueño Oriental (o Chaco húmedo); Distrito Chaqueño Occidental (o Chaco semiárido) y Distrito Chaqueño Serrano, de acuerdo principalmente con el régimen de precipitaciones pluviales (Cabrera, 1994). A los dos últimos Distritos mencionados pertenecen los representantes arbóreos y arbustivos analizados en este estudio. El Distrito Occidental se extiende por la mitad oeste de Formosa y Chaco, casi todo Santiago del Estero, este de Jujuy, Salta y Tucumán, penetrando en el este de Catamarca. Esta región posee clima continental, con precipitaciones anuales entre 500 y 800 mm, presenta una gran diversidad fisonómica y ecológica, predominando los bosques xerófilos caducifolios, palmares, estepas halófilas y sabanas naturales o inducidas por los desmontes y los incendios. El Distrito Serrano se extiende, por el este de Jujuy, centro de Salta y Tucumán, este de Catamarca, por las sierras de La Rioja, San Luis y Córdoba hasta aproximadamente los 33° de latitud S. Ocupa las laderas bajas de cerros y quebradas formando un amplio ecotono con las Provincias de las Yungas y del Monte, alcanzando alturas de 1800 m s.n.m. (Cabrera, 1994; Cabrera & Willink, 1973).
En general, la Provincia Chaqueña cuenta con una vegetación arbórea que es fuente de recursos maderables, ornamentales, aromáticos, alimenticios y/o medicinales. Por otro lado, cumple una función significativa en la fijación de anhídrido carbónico y la regulación del clima, en la protección de otras especies y en el control del desplazamiento de las masas acuosas, cumpliendo un indiscutible rol dentro del ecosistema (Vervoorst, 1979; Brown & Grau, 1993). Los bosques de los Distritos Chaqueños semiárido y serrano están integrados predominantemente por especies espinosas, caducifolias y con hojas pequeñas. Estas especies brindan madera para muebles y herramientas, leña, colorantes y principios medicinales (Burkart, 1952, 1979; Digilio & Legname, 1966; Toursarkissian, 1980; Boelcke, 1981; Martínez Crovetto, 1981; Legname, 1982; Biloni, 1990; Novara, 1993a, 1993b; Marzocca, 1993, 1997; Juárez de Varela, 1994; Muñoz, 2000; Arenas, 2003; Carrizo et al., 2005; Demaio et al., 2002; Peña-Chocarro et al., 2006; del Valle Perea et al., 2007; Juárez de Varela & Novara, 2007; Scarpa, 2007; Giménez & Hernández, 2008). Actualmente es una región en peligro ante las amenazas ambientales a que está sometida y la rápida expansión agrícola que reemplaza los ambientes naturales con la consiguiente pérdida de biodiversidad (Adámoli et al., 2008). El desarrollo de un manejo conservacionista de la flora nativa debe comenzar por conocer en profundidad la vegetación en sí y ésta en su relación con el ambiente. El conocimiento sobre adaptaciones histológicas de las hojas a diferentes ambientes podría establecer las bases para inferir y desarrollar tecnologías de manejo sustentable, controlando la actividad antrópica en los bosques de la región. Bernardello (1982), Roth (1995), Luna & de la Sota (2003), Wagner & Ponessa (2004), Perrotta & Arambarri (2004), Gatelli (2007), Perrotta et al. (2007), Ruíz et al. (2007), Colares & Arambarri (2008) han realizado estudios anatómicos previos en especies de la región bajo estudio. En el presente trabajo se estudia la anatomía foliar de 32 especies de árboles y arbustos que representan 18 familias de los Distritos Occidental y Serrano de la Provincia Biogeográfica Chaqueña con el fin de determinar los caracteres estructurales, en especial aquellos referidos al tejido epidérmico, mesofilo y tejidos de sostén que muestren notable variación relacionada con las condiciones ambientales y del suelo.
Materiales y Métodos
Material
Para el estudio se emplearon hojas de ejemplares recolectados en el territorio de los Distritos Chaqueños Occidental y Serrano, que forman parte de las colecciones existentes en los herbarios BA, CTES, LIL, LP, LPAG y SI (abreviaturas de acuerdo con Thiers, 2011). Para enriquecer el análisis sobre las variaciones estructurales de las hojas producidas por los factores ambientales, en 16 de las 32 especies, se estudió material fresco recolectado en el Jardín Botánico y Arboretum ¨Carlos Spegazzini¨ de la Facultad de Ciencias Agrarias y Forestales, Universidad Nacional de La Plata, ubicado en zona templado-húmeda de la provincia de Buenos Aires. Las familias, taxones y material estudiado figuran en el Apéndice 1.
Anatomía
Las hojas maduras en completo estado de desarrollo se tomaron de la parte media de las ramas. Las muestras frescas se fijaron en FAA (formol, agua destilada, ácido acético y alcohol etílico; 100:350:50:500 V/V/V/V). Las hojas de los ejemplares de herbario fueron reconstituidas por imbibición en agua con una gota de detergente en estufa a 30-35 °C durante 24-72 h, en forma previa a su fijación en FAA. Para la obtención de las hojas transparentes se empleó la técnica de diafanización de Dizeo de Strittmatter (1973). Otro método empleado consistió en colocar el material en una mezcla de hidróxido de sodio al 5% e hipoclorito de sodio al 5%, en partes iguales durante 4-5 días. Luego, el material fue lavado con agua destilada y decolorado con hipoclorito de sodio al 50%, nuevamente lavado tres veces con agua destilada y colocado por 24 h en hidrato de cloral al 5% para su clarificación. Los cortes transversales se realizaron a mano alzada en la parte media de la lámina y en la mitad de la longitud del pecíolo. Las secciones obtenidas fueron de espesor variable, oscilando desde una a varias capas celulares, de los cuales se eligieron aquellos de menor espesor donde las estructuras eran perfectamente visibles. Los cortes fueron decolorados con hipoclorito de sodio al 50% y lavados con agua caliente para eliminar las burbujas de aire. Tanto los materiales diafanizados como las secciones transversales, sin colorear o coloreados con solución alcohólica de safranina O al 80% fueron montados en gelatina-glicerina. Asimismo, para realizar los recuentos, las hojas transparentes se montaron temporariamente en glicerina al 90%.
Se contaron células epidérmicas, estomas y tricomas en ocho campos, ubicados en la parte media de los semilimbos de la lámina y sobre ambas epidermis. Las células y estomas que se encontraban en el borde del campo visual, quedando visible en una proporción inferior a su mitad no fueron considerados en el recuento. Esta metodología se repitió en dos a cuatro muestras por especie. La densidad promedio de los tipos celulares se expresó por milímetro cuadrado (mm-2) (Tabla 1). En el caso de los tricomas se consideraron los siguientes rangos para describir la densidad: alta > 70; media 35 a 70 y baja < 35 tricomas / mm-2.
Tabla 1. Densidad por unidad de superficie (milímetro cuadrado) de estomas, células epidérmicas y tricomas. Abreviaturas: abx: abaxial; adx: adaxial; STS: región chaqueña, subtropical seca. TH: región templado-húmeda. Tricomas: densidad baja < 35; media 35 a 70; alta > 70. No det.: no determinado. Tipo de tricomas: Egl: eglandular; Gl: glandular.

Las descripciones anatómicas y morfológicas fueron realizadas según la terminología utilizada por Metcalfe & Chalk (1950, 1979), Stace (1965) y Bianco et al. (2004). Para describir las características ecoanatómicas foliares (Tabla 2) se consideró a las hojas tipo sol (xeromorfismo), tipo intermedia (mesomorfismo) y tipo sombra (hidromorfismo) según sus caracteres representativos y propios para cada condición (Roth, 1984).
Tabla 2. Caracteres xeromórficos, mesomórficos e hidromórficos de 32 especies del Distrito Chaqueño Occidental y Distrito Serrano. Los caracteres fueron discriminados para cada condición según Roth (1984). Abreviaturas: abx: abaxial; adx: adaxial; cel: células. E: epidermis; ext: externa; M: mesofilo; P anticl: paredes anticlinales; P pericl: pared periclinal; pp: parénquima en empalizada.




Las imágenes y mediciones fueron capturadas y digitalizadas con un microscopio óptico equipado con una cámara color PAL CCD conectada al software Hyper Media Center.
Para la nomenclatura de las especies estudiadas se consultó el Catálogo de Cono Sur (Zuloaga et al., 2008) y el sitio www.darwin.edu.ar/ (mayo 2010).
Resultados y Discusión
Morfología foliar
Las hojas son simples con una lámina dilatada, a veces de consistencia membranácea, cuando se trata de especies con amplia distribución en el territorio argentino, donde crecen bajo diferentes condiciones ambientales (e.g. Lycium cestroides). La expansión laminar se reduce en especies xeromórficas y la consistencia es carnosa, papirácea, subcoriácea y coriácea. Las hojas bipinnaticompuestas son frecuentes, estando caracterizadas por el reducido tamaño de sus foliólulos. Muy pocas especies son inermes, en su mayoría presentan aguijones o espinas. Con respecto a la persistencia de su follaje la mayoría son caducifolias (Tabla 2).
Anatomía foliar
Células epidérmicas: las especies hidromórficas, que viven en lugares húmedos, (más de 800 mm de precipitación anual), sometidas a menor radiación solar, presentan células epidérmicas con paredes anticlinales sinuosas, onduladas o levemente curvadas, mientras que en las especies xeromórficas dichas paredes son rectas y gruesas (Fig. 1 A). Stace (1965) y Roth (1984) informan que cuando la epidermis foliar está expuesta a mayor luminosidad y reducida humedad, se desarrollan caracteres epidérmicos de ¨hojas de sol¨, tales como las paredes anticlinales rectas de las células. La presencia de este carácter no solo aparece en condiciones de aridez, sino también ocurre en los árboles de mayor altura, cuyas copas quedan expuestas a las condiciones de alta luminosidad y viento desecante, como ha sido observado en las especies estudiadas (e.g. Cupania vernalis Cambess. y Nectandra spp.) de la selvas de las Provincias Paranaense y de las Yungas (Arambarri et al., 2006, 2008, 2009b). Roth (1984) comunica que las especies perennifolias expuestas a condiciones de elevada iluminación y vientos deshidratantes desarrollan caracteres xeromórficos, aún cuando crezcan en zonas húmedas. Por otra parte, se observa que en condiciones xerofíticas aumenta la densidad de las células epidérmicas, alcanzando en Bulnesia sarmientoi, Schinopsis balansae, S. lorentzii y Scutia buxifolia valores mayores a 10.000 células por mm-2 (Tabla 1; Fig. 1 B). A esta elevada densidad de células epidérmicas le corresponde una reducción de las dimensiones de las mismas. Este menor tamaño de las células determina una reducción del volumen celular (Cosa & Dottori, 2010), a veces, acompañado del engrosamiento de las paredes periclinales como adaptaciones xeromórficas y/o halomórficas que reducen el colapso por deshidratación.

Fig. 1. Fotomicrografías de epidermis vista en superficie. A: Maytenus vitis-idaea: epidermis cristalífera cuyas células presentan paredes anticlinales rectas; estomas ciclocíticos hundidos. B: Schinopsis lorentzii: epidermis con paredes anticlinales rectas, células en número mayor a 10.000 por milímetro cuadrado. C: Acanthosyris falcata: con ceras epicuticulares manifiestas en forma granular y estomas paracíticos y paralelocíticos. D: Capparis retusa: epidermis con notables estrías cuticulares. Abreviaturas: ba tr, base de tricoma; cr, cristales; es, estomas. Escalas: 50 µm.
En las especies estudiadas es frecuente reconocer la presencia de ceras epicuticulares (e.g. Acanthosyris falcata, Fig. 1 C) y/o estrías cuticulares notables sobre la pared externa (e.g. Capparis retusa, Fig. 1 D). La presencia de estas ceras representan una respuesta al ambiente ya que impiden la rápida deshidratación (Fahn & Cutler, 1992).
Con frecuencia, en las especies de Fabaceae (e.g. Acacia spp.) la pared externa de las células epidérmicas es convexa y forma papilas en una o ambas caras foliares. También se observaron papilas en la cara abaxial de los representantes de la familia Anacardiaceae (Schinopsis lorentzii y S. marginata). De acuerdo con Metcalfe & Chalk (1979) las papilas generalmente se encuentran en especies tropicales. Ancibor (1992) refiere su presencia en la vegetación xerófita de la Puna de Mendoza.
En general, las epidermis son unistratas aunque hay especies que muestran epidermis bistratas o pluristratas (e.g. Ceiba chodatii y Jodina rhombifolia), como lo comunican Perrotta et al. (2007) y Luna & De la Sota (2003), respectivamente. La presencia de epidermis formada por varios estratos celulares y/o hipodermis es una adaptación que tiene por función economizar agua y también actúa en la protección del clorénquima de la excesiva radiación solar (Roth, 1984, 1990, 1995). Los resultados muestran que, tanto las especies perennifolias como las caducifolias, pueden presentar estos caracteres. Entre las perennifolias, Castela coccinea y Maytenus vitis-idaea presentan hipodermis adaxial y abaxial (Tabla 2; Fig. 2 A, B). Campagna et al. (2011) refieren la presencia de mucílagos en la hipodermis de Castela, compuesto amorfo con propiedad hidrófila, que facilita la retención de agua en el cuerpo de la planta (Fahn & Cutler, 1992). Los resultados permiten inferir que dichas características responden al factor intensidad lumínica y, en algunas especies (e.g. Castela coccinea y Maytenus vitis-idaea), tolerancia a la salinidad, coincidiendo con lo observado en las especies caducifolias Ceiba chodatii y Prosopis ruscifolia. Por un lado, Ceiba chodatii presenta epidermis bistrata y posee la capacidad de crecer tanto en condiciones de semiaridez como de humedad. Por otra parte, Prosopis ruscifolia presenta hipodermis abaxial, creciendo en grupos casi puros llamados ¨vinalares¨, donde los suelos sufren inundaciones periódicas y salinización (Roig, 1993). La presencia de hipodermis y epidermis pluristrata coincide con los caracteres xeromórficos observados en árboles de gran porte de la Selva de la Provincia Paranaense, cuyas hojas están expuestas a la fuerte radiación solar y a la acción deshidratante de los vientos (Arambarri et al., 2006, 2008).
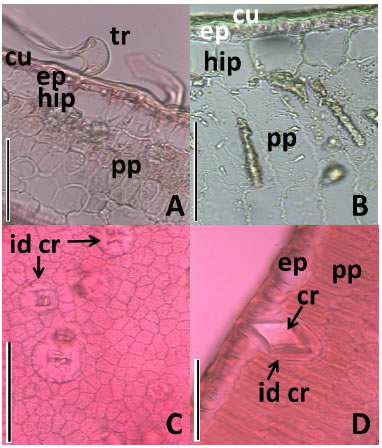
Fig. 2. Fotomicrografías de estructuras reservantes de agua. A: Castela coccinea: epidermis pubescente e hipodermis adaxial. B: Maytenus vitis-idaea: epidermis glabra e hipodermis adaxial y parénquima en empalizada con paredes elásticas. C y D, Scutia buxifolia: C: vista en superficie de la epidermis adaxial mostrando células epidérmicas idioblásticas cristalíferas. D: lámina en corte transversal mostrando la epidermis adaxial y una célula epidérmica cristalífera penetrando en el mesofilo. Abreviaturas: cr, cristal; cu, cutícula; ep, epidermis; hip, hipodermis; id cr, idioblasto cristalífero; pp, parénquima en empalizada; tr, tricomas. Escalas: A y D, 50 µm; B y C, 100 µm.
Algunas especies tienen epidermis cristalíferas, como Maytenus vitis-idaea. Dado que esta especie habita en suelos con alto contenido salino, el carácter podría relacionarse a la inmovilización de sales que se hallan en exceso en el cuerpo de la planta. Sin embargo, se cree que puede ser un carácter taxonómico dado que también ha sido encontrado en Maytenus ilicifolia Mart. ex Reissek (Arambarri et al., 2008). En las dos epidermis de Scutia buxifolia hay conspicuas células epidérmicas idioblásticas cristalíferas que penetran en el mesofilo. En estas células el cristal está acompañado de un compuesto amorfo, posiblemente mucílagos, que facilitarían la retención de agua (Fahn & Cutler, 1992) (Fig. 2 C, D).
Tricomas: en las especies estudiadas se hallaron tricomas glandulares y eglandulares, predominando estos últimos (Tabla 2). Capparicordis tweediana, Castela coccinea, Celtis ehrenbergiana, C. iguanaea, Schinopsis lorentzii y S. marginata mostraron alta densidad de tricomas, evidenciando los mayores valores en las hojas de las especies procedentes de la región subtropical-seca comparado con las muestras de la región templado-húmeda (Tabla 1; Fig. 3 A). Una densidad media a baja de tricomas se encontró en por lo menos la mitad de las especies estudiadas. Mientras que una cuarta parte de las especies exhibieron hojas glabras (Anisocapparis speciosa, Capparis retusa, Jodina rhombifolia, Kageneckia lanceolata, Lithraea molleoides, Maytenus vitis-idaea, Prosopis ruscifolia, Scutia buxifolia y Ximenia americana). Los resultados de este trabajo no permiten establecer una relación entre densidad de tricomas y factores ambientales. Sin embargo, se observa un elevado porcentaje de especies con tricomas en las zonas húmedas, como se informa para árboles y arbustos de la Provincia Biogeográfica de las Yungas (Arambarri et al., 2009a, 2009b) y un elevado número de especies glabras en la región subtropical-seca bajo estudio. Tal como lo establecieran Metcalfe & Chalk (1979), el tipo de tricomas es un carácter estable y constituye una valiosa herramienta desde el punto de vista taxonómico. Los tricomas eglandulares estrellados multiangulados con pie pluriseriado (tipo penacho) caracterizan a Capparicordis tweediana (Fig. 3 B) y, los de tipo porrecto fueron hallados en Ruprechtia triflora (Fig. 3 C). Los tricomas con cistolitos se encontraron en Celtis ehrenbergiana y C. iguanaea. Estos tricomas ya fueron citados con valor diagnóstico para Moraceae por Metcalfe & Chalk (1950, 1979), familia muy relacionada a Celtidaceae. Los tricomas escamoso-peltados ubicados en depresiones de la epidermis se encuentran en Zanthoxylum coco, tal como fue comunicado para otras especies del género (Arambarri et al., 2006, 2008, 2009a, 2009b). Los tricomas glandulares con pie unicelular y cabeza pluricelular, alargada, se observaron en Schinus fasciculatus var. fasciculatus y en las especies de Schinopsis. Dado que este tipo de tricoma también fue hallado en otras especies de Schinus (Perrotta & Arambarri, 2004; Arambarri et al., 2006, 2008, 2009a), el mismo constituye un carácter distintivo de la familia Anacardiaceae. Castela coccinea presenta tricomas de pared delgada y amplio lumen celular (Fig. 3 D). De acuerdo con la función en la economía del agua que realizan los tricomas en ambientes xéricos (Ancibor, 1992; Bianco et al., 2004; Cosa & Dottori, 2010) se infiere que podrían cumplir una importante función en ese aspecto.

Fig. 3. Fotomicrografías de tricomas. A: Schinopsis lorentzii: tricomas eglandulares uniseriados, uni-pluricelulares. B: Capparicordis tweediana: tricoma estrellado multiangulado en penacho con pie pluriseriado. C: Ruprechtia triflora, tricoma estrellado multiangulado porrecto. D: Castela coccinea. Abreviatura: (tr) tricomas simples con pared delgada con amplio lumen celular. Escalas: 100µm.
Estomas: el 69% de las especies tienen estomas anomocíticos y el 30% los poseen paracíticos y paralelocíticos. Unas pocas especies presentan estomas ciclocíticos. Frecuentemente, estos tipos de estomas están acompañados por otros (anisocíticos, anomoestaurocíticos, parahexacíticos y tetracíticos) (Fig. 1 A, C; Fig. 4 A). El 56% de las especies posee hojas anfistomáticas (Fig. 4 B) con numerosos estomas. Este resultado está de acuerdo con Roth (1984, 1990), quien expresa que una adaptación de las especies que crecen en ambientes con déficit de agua es el incremento de la densidad estomática y consiguiente reducción del tamaño de los mismos. Aparentemente las plantas regulan mejor la pérdida de agua con un número elevado de estomas de pequeñas dimensiones, que con un número bajo de estomas grandes (Roth, 1984).

Fig. 4. Fotomicrografías de caracteres xeromórficos. A y B, Anisocapparis speciosa: A: epidermis vista en superficie mostrando estomas hundidos con reborde peristomático. B: lámina en corte transversal mostrando en ambas epidermis estomas hundidos. C y D, Prosopis ruscifolia: C: red venosa densa. D: vena media en corte transversal mostrando el haz vascular y el grueso anillo esclerenquimático perivascular. Abreviaturas: co, célulasoclusivas; cu, cutícula; ep, epidermis; es, estomas; Fi, fibras; Fl, floema; Xi, xilema. Escalas: A y B, 50 µm; C, 500 µm; D, 100 µm.
Con respecto a la posición de los estomas en relación con el nivel de las restantes células epidérmicas, más del 60% de las especies estudiadas presentan los estomas a nivel o solo ligeramente hundidos (Tabla 2). Mientras que Anisocapparis speciosa, Capparis retusa, Jodina rhombifolia, Maytenus vitis-idaea, Moya spinosa, Prosopis ruscifolia, Schinopsis lorentzii y S. marginata exhiben estomas hundidos (Fig. 1 A; Fig. 4 A, B), y Capparicordis tweediana los muestra hundidos en criptas (Tabla 2).
Mesofilo: más del 50% de las especies presentaron mesofilo totalmente en empalizada o isolateral (Tabla 2). Algunas especies (e.g. Acacia caven, Celtis ehrenbergiana y Jodina rhombifolia) cuando crecen en ambiente húmedo presentan un mesofilo dorsiventral pero con parénquima esponjoso denso. Más del 40% de las especies tienen mesofilo dorsiventral, ya sea que crezcan en condiciones de semiaridez o de húmedad (e.g. Bulnesia bonariensis, Calycophyllum multiflorum, Capparicordis tweediana, Ceiba chodatii, Celtis iguanaea, Kageneckia lanceolata, Lycium cestroides, Parkinsonia aculeata, Ruprechtia triflora, Schinopsis marginata, Scutia buxifolia, Zanthoxylum coco y Ziziphus mistol) (Tabla 2). A su vez, estas especies presentan una combinación de caracteres xeromórficos y mesomórficos, e.g. Zanthoxylum coco posee como adaptación al déficit de agua una capa de parénquima en empalizada de células largas y delgadas; mientras que, el mesofilo esponjoso es laxo. Podría suponerse que en estas especies la presencia constante de un mesofilo dorsiventral respondería más a un control genético que a condiciones ambientales (Metcalfe & Chalk, 1979).
De los resultados se desprende que en zonas semiáridas con vegetación menos densa que en zonas húmedas y, expuestas a mayor intensidad lumínica, predominan especies con el mesofilo con varias capas en empalizada que se acortan hacia el lado abaxial o el mesofilo es isolateral. De acuerdo con Roth (1984), el mesofilo en empalizada es una adaptación a la intensidad de la radiación solar. Los rayos solares inciden en forma perpendicular a la superficie de la hoja y penetran paralelos al eje longitudinal de las células alargadas en empalizada. Esta condición protege a los cloroplastos de la radiación UV pues tienden a ubicarse en las paredes laterales de estas células. Hacia el interior del mesofilo, donde la intensidad luminosa decrece, las células del parénquima en empalizada se acortan, aumentan de diámetro y el número de cloroplastos que contienen es menor. Esta característica hace más eficiente a la hoja en su actividad asimiladora y en el intercambio gaseoso.
En otras especies, la intensa radiación solar induce al desarrollo de un mesofilo isolateral, donde las células en empalizada hacia la cara abaxial son cortas y anchas, y se hallan distribuidas en uno o dos estratos. De acuerdo con Roth (1984) las células asociadas a la cara abaxial son siempre cortas y anchas porque a ellas llega una baja intensidad lumínica. Esto no solamente ocurre en la región chaqueña semiárida. Arambarri et al. (2006, 2008) encontraron un mesofilo isolateral en árboles que viven en la Selva Paranaense, por ejemplo en especies de Myrtaceae que están adaptados a lugares muy luminosos.
Relación estomas-mesofilo. En el presente estudio se pudo establecer una relación entre la distribución de los estomas (hojas anfistomáticas e hipostomáticas), con el tipo de mesofilo en empalizada o isolateral y dorsiventral, respectivamente. Entre las especies con hojas anfistomáticas se encontró que la densidad de estomas es similar en ambas caras. En estas especies frecuentemente el mesofilo es en empalizada o isolateral (e.g. Acanthosyris falcata, Anisocapparis speciosa, Jodina rhombifolia, Maytenus vitis-idaea y Moya spinosa), excepto en las xerófitas Bulnesia bonariensis y Capparicordis tweediana que muestran mesofilo dorsiventral. Cuando en las hojas anfistomáticas predominan los estomas en la cara adaxial, como en Acacia atramentaria, A. caven y Cercidium praecox subsp. glaucum, se observa un mesofilo isolateral o en empalizada, estando bien adaptadas a condiciones xerofíticas, manteniendo caracteres mesomórficos y siendo muy plásticas adaptativamente (Tabla 2). Específicamente, Cercidium praecox subsp. glaucum es una especie escapista. Esto quiere decir que puede perder rápidamente sus hojas favoreciendo la economía del agua sin verse afectada su fisiología, ya que continúa realizando el proceso fotosintético con su tallo y ramas verdes. Esta observación coincide con las efectuadas por Roth (1984), quien encontró que los árboles caducifolios que crecen en ambientes secos pueden guardar algunos caracteres mesomórficos, pues la caída de sus hojas les permite escapar a los períodos desfavorables. Finalmente, las especies con hojas anfistomáticas y predominio de estomas en la cara abaxial tienen mesofilo dorsiventral en su mayoría (e.g. Acacia aroma, Capparis retusa, Celtis ehrenbergiana, C. iguanaea, Lycium cestroides, Parkinsonia aculeata, Ruprechtia triflora, Ximenia americana y Ziziphus mistol) (Tablas 1 y 2). Sin embargo, existen excepciones, por un lado, Bulnesia sarmientoi, Capparis retusa, Schinopsis balansae y Ximenia americana presentan mesofilo isolateral y, por otro lado, Prosopis ruscifolia muestra un mesofilo en empalizada. Esta última especie es tolerante a un mesofilo dorsiventral pero con parénquima esponjoso denso. Más del 40% de las especies tienen mesofilo dorsiventral, ya sea que crezcan en condiciones de semiaridez o de húmedad (e.g. Bulnesia bonariensis, Calycophyllum multiflorum, Capparicordis tweediana, Ceiba chodatii, Celtis iguanaea, Kageneckia lanceolata, Lycium cestroides, Parkinsonia aculeata, Ruprechtia triflora, Schinopsis marginata, Scutia buxifolia, Zanthoxylum coco y Ziziphus mistol) (Tabla 2). A su vez, estas especies presentan una combinación de caracteres xeromórficos y mesomórficos, e.g. Zanthoxylum coco posee como adaptación al déficit de agua una capa de parénquima en empalizada de células largas y delgadas; mientras que, el mesofilo esponjoso es laxo. Podría suponerse que en estas especies la presencia constante de un mesofilo dorsiventral respondería más a un control genético que a condiciones ambientales (Metcalfe & Chalk, 1979).
De los resultados se desprende que en zonas semiáridas con vegetación menos densa que en zonas húmedas y, expuestas a mayor intensidad lumínica, predominan especies con el mesofilo con varias capas en empalizada que se acortan hacia el lado abaxial o el mesofilo es isolateral. De acuerdo con Roth (1984), el mesofilo en empalizada es una adaptación a la intensidad de la radiación solar. Los rayos solares inciden en forma perpendicular a la superficie de la hoja y penetran paralelos al eje longitudinal de las células alargadas en empalizada. Esta condición protege a los cloroplastos de la radiación UV pues tienden a ubicarse en las paredes laterales de estas células. Hacia el interior del mesofilo, donde la intensidad luminosa decrece, las células del parénquima en empalizada se acortan, aumentan de diámetro y el número de cloroplastos que contienen es menor. Esta característica hace más eficiente a la hoja en su actividad asimiladora y en el intercambio gaseoso.
En otras especies, la intensa radiación solar induce al desarrollo de un mesofilo isolateral, donde las células en empalizada hacia la cara abaxial son cortas y anchas, y se hallan distribuidas en uno o dos estratos. De acuerdo con Roth (1984) las células asociadas a la cara abaxial son siempre cortas y anchas porque a ellas llega una baja intensidad lumínica. Esto no solamente ocurre en la región chaqueña semiárida. Arambarri et al. (2006, 2008) encontraron un mesofilo isolateral en árboles que viven en la Selva Paranaense, por ejemplo en especies de Myrtaceae que están adaptados a lugares muy luminosos.
Relación estomas-mesofilo. En el presente estudio se pudo establecer una relación entre la distribución de los estomas (hojas anfistomáticas e hipostomáticas), con el tipo de mesofilo en empalizada o isolateral y dorsiventral, respectivamente. Entre las especies con hojas anfistomáticas se encontró que la densidad de estomas es similar en ambas caras. En estas especies frecuentemente el mesofilo es en empalizada o isolateral (e.g. Acanthosyris falcata, Anisocapparis speciosa, Jodina rhombifolia, Maytenus vitis-idaea y Moya spinosa), excepto en las xerófitas Bulnesia bonariensis y Capparicordis tweediana que muestran mesofilo dorsiventral. Cuando en las hojas anfistomáticas predominan los estomas en la cara adaxial, como en Acacia atramentaria, A. caven y Cercidium praecox subsp. glaucum, se observa un mesofilo isolateral o en empalizada, estando bien adaptadas a condiciones xerofíticas, manteniendo caracteres mesomórficos y siendo muy plásticas adaptativamente (Tabla 2). Específicamente, Cercidium praecox subsp. glaucum es una especie escapista. Esto quiere decir que puede perder rápidamente sus hojas favoreciendo la economía del agua sin verse afectada su fisiología, ya que continúa realizando el proceso fotosintético con su tallo y ramas verdes. Esta observación coincide con las efectuadas por Roth (1984), quien encontró que los árboles caducifolios que crecen en ambientes secos pueden guardar algunos caracteres mesomórficos, pues la caída de sus hojas les permite escapar a los períodos desfavorables. Finalmente, las especies con hojas anfistomáticas y predominio de estomas en la cara abaxial tienen mesofilo dorsiventral en su mayoría (e.g. Acacia aroma, Capparis retusa, Celtis ehrenbergiana, C. iguanaea, Lycium cestroides, Parkinsonia aculeata, Ruprechtia triflora, Ximenia americana y Ziziphus mistol) (Tablas 1 y 2). Sin embargo, existen excepciones, por un lado, Bulnesia sarmientoi, Capparis retusa, Schinopsis balansae y Ximenia americana presentan mesofilo isolateral y, por otro lado, Prosopis ruscifolia muestra un mesofilo en empalizada. Esta última especie es tolerante ainundaciones periódicas y a la salinidad. En todos ellos, también influye en el desarrollo de estructuras xeromórficas, la intensa radiación solar a que están expuestos en los lugares donde crecen (Roig, 1993).
Se ha comprobado que cuando los ejemplares de Jodina rhombifolia crecen en zonas húmedas sus hojas son hipostomáticas con mesofilo dorsiventral, mientras que cuando crecen en zonas semiáridas son anfistomáticas y con mesofilo isolateral o en empalizada (Luna & De la Sota, 2003). En Lycium cestroides se observó que las hojas pueden ser hipostomáticas o anfistomáticas, según crezcan en un ambiente templado-húmedo o subtropical-seco, respectivamente. Por otra parte, en Celtis ehrenbergiana se cree que los cambios de estructura serían producidos por la intensidad lumínica que incide sobre las hojas. Estos resultados están de acuerdo con los factores y cambios estructurales propuestos por Roth (1984).
Por último, hay un grupo de especies que muestra de manera constante hojas hipostomáticas, variando el tipo de mesofilo, el cual es predominantemente dorsiventral (e.g. Calycophyllum multiflorum, Ceiba chodatii, Kageneckia lanceolata, Lithraea molleoides, Schinopsis marginata, Scutia buxifolia y Zanthoxylum coco); otras veces, es isolateral o en empalizada (e.g. Castela coccinea, Lithraea molleoides, Schinopsis lorentzii y Schinus fasciculatus var. fasciculatus). En el caso de Lithraea molleoides la hoja hipostomática presenta mesofilo dorsiventral en la muestra de la zona templado-húmeda y el desarrollo incipiente de una capa en empalizada abaxial en las muestras de la región subtropical seca (Tabla 2). La variación de los caracteres estructurales refleja una alta capacidad de adaptación a diferentes condiciones ambientales y de suelos. Por ello, estas especies se caracterizan por su plasticidad fenotípica adaptativa, integrando las Provincias Biogeográficas Chaqueña, del Espinal, del Monte, Paranaense y de las Yungas.
Tejido de sostén: un carácter indicador de la estructura xeromórfica es la presencia de tejido esclerenquimático. Este actúa como soporte al prevenir el colapso y el daño de los tejidos causado por la desecación, en aquellas plantas expuestas a condiciones de aridez (Metcalfe & Chalk, 1979). El 63% de las especies estudiadas presentaron fibras esclerenquimáticas formando casquetes o anillos perivasculares (Fig. 4 C, D) (e.g. Acacia aroma, A. atramentaria, A. caven, Acanthosyris falcata, Calycophyllum multiflorum, Capparis retusa, Castela coccinea, Ceiba chodatii, Jodina rhombifolia, Kageneckia lanceolata, Lithraea molleoides, Maytenus vitis-idaea, Moya spinosa, Prosopis ruscifolia, Ruprechtia triflora, Schinopsis balansae y Scutia buxifolia) o esclereidas idioblásticas en el mesofilo (e.g. Anisocapparis speciosa, Capparicordis tweediana, Maytenus vitis-idaea y Ximenia americana) o perivasculares (Ziziphus mistol). En Schinopsis lorentzii, S. marginata y Schinus fasciculatus var. fasciculatus raramente se observan algunas fibras en la proximidad del tejido vascular. Esto respondería a la alta capacidad de adaptación a diferentes condiciones ambientales observadas en estas especies de Anacardiaceae (Tabla 2). Por último, se caracterizan por la ausencia de colénquima o esclerénquima perivascular las siguientes especies: Bulnesia bonariensis, B. sarmientoi, Celtis ehrenbergiana, C. iguanaea, Cercidium praecox subsp. glaucum, Lycium cestroides, Parkinsonia aculeata y Zanthoxylum coco (Tabla 2). Estas especies presentan una compleja combinación de caracteres xeromórficos-mesomórficos o xeromórficos-meso-hidromórficos asociada a una gran capacidad de adaptación. En consecuencia se distribuyen en varias Provincias Biogeográficas como Chaqueña, del Espinal, del Monte, de las Yungas y Paranaense. Por otra parte, el desarrollo del tejido esclerenquimático no es exclusivo de las especies de zonas xerofíticas. En las Selvas, los árboles cuyas copas quedan expuestas a la acción deshidratante de la radiación solar, vientos y sequía diaria o estacional, desarrollan estructuras xeromórficas equivalentes a aquellas que son propias de regiones secas (Roth, 1984). Esto fue registrado por Arambarri et al. (2006, 2009b) al estudiar la estructura de las hojas de árboles (e.g. Myrsine laetevirens (Mez.) Arrechav., Ocotea acutifolia (Nees) Mez., Pouteria salicifolia (Spreng.) Radlk.), cuyas copas quedan expuestas a la acción de los factores deshidratantes en las Provincias Paranaense y de las Yungas.
Formaciones cristalinas: los cristales en angiospermas usualmente son sales del ácido oxálico (Metcalfe & Chalk, 1979). Con excepción de la familia Capparaceae, todas las restantes contienen cristales, ya sean estos solitarios, o en forma de maclas o drusas. Por su parte, Rubiaceae y Solanaceae se caracterizan por la presencia de arena cristalina Arambarri et al. (2006, 2008, 2009b).
Conclusiones
Los resultados mostraron que las hojas de las especies que habitan los Distritos Chaqueños Occidental y Serrano presentan las siguientes estrategias adaptativas: (1) predominio de especies espinosas con hojas pequeñas y caducifolias; (2) consistencia de las hojas desde carnosas (e.g. Maytenus vitis-idaea, halófita) hasta subcoriáceas y coriáceas; (3) hojas frecuentemente glabras o glabrescentes, con densidad de tricomas / mm-2 baja a media; (4) presencia de estomas en ambas superficies de la hoja (hojas anfistomáticas); (5) densidad estomática (e / mm-2) elevada. Sin embargo, la densidad de estomas es baja en halófitas (e.g. Maytenus vitis-idaea); (6) presencia de ceras epicuticulares y/o estrías cuticulares notables en la epidermis; (7) paredes anticlinales de las células epidérmicas rectas y en casos extremos rectas y gruesas; (8) cutícula que penetra en las paredes anticlinales; (9) células epidérmicas con la pared externa o en ocasiones ambas caras periclinales gruesas; (10) células epidérmicas pequeñas llegando a densidades superiores a 10.000 células / mm-2; (11) aparición de epidermis bistrata y pluristrata; (12) desarrollo de hipodermis abaxial o hacia ambas caras de la hoja. Este es un carácter frecuente en hojas de especies halófitas o tolerantes a la salinidad del suelo (e.g. Castela coccinea, Maytenus vitis-idaea y Prosopis ruscifolia); (13) predominio de mesofilo en empalizada (en empalizada denso con paredes elásticas en especies halófitas, e.g. Maytenus vitis-idaea), o isolateral con desarrollo de una o dos capas de empalizada hacia la cara abaxial; (14) mesofilo dorsiventral xeromórfico con una sola capa de parénquima en empalizada de células largas y delgadas y el parénquima esponjoso con pequeños espacios intercelulares; (15) presencia de vainas o anillos esclerenquimáticos perivasculares o esclereidas idioblásticas. Estas últimas, ubicadas en el mesofilo foliar, son frecuentes en especies halófitas o tolerantes a la salinidad del suelo (e.g. Maytenus vitis-idaea y Ximenia americana); (16) vascularización densa.
Por último, los resultados de este trabajo, así como de otros trabajos previos (Arambarri et al., 2006, 2008, 2009a, 2009b) indican que la combinación hojas anfistomáticas y mesofilo isolateral o en empalizada son caracteres propios de lugares con intensa radiación solar. Mientras que las hojas hipostomáticas con mesofilo dorsiventral corresponden a zonas con menor radiación solar u hojas menos expuestas a la radiación solar. Se considera que las estructuras intermedias (hojas anfistomáticas con mesofilo dorsiventral y hojas hipostomáticas con mesofilo isolateral o en empalizada) se encuentran en especies con capacidad de adaptación a diferentes hábitats.
Agradecimientos
Agradecemos a los Curadores de los herbarios que permitieron el estudio de los ejemplares y lo hacemos extensivo a los evaluadores anónimos. Nuestro especial reconocimiento a Nancy Apóstolo por su detallado análisis y acertadas sugerencias y recomendaciones que contribuyeron a mejorar el manuscrito. Este trabajo ha sido financiado por la Universidad Nacional de La Plata en el marco del Programa de Incentivos a los docentes-investigadores, Decreto. 2427/93, Secretaría de Políticas Universitarias, Ministerio de Educación de la Nación Argentina.
Bibliografía
1. ADÁMOLI, J. R. GUINZBURG & S. TORRELLA. 2008. III Congreso Nacional de Conservación de la Biodiversidad, Facultad de Ciencias Exactas y Naturales, Universidad Nacional de Buenos Aires, CONICET, Temaiken, Fundación de Historia Natural Félix de Azara. [ Links ]
2. ANCIBOR, E. 1992. Anatomía ecológica de la vegetación de la Puna de Mendoza. I. Anatomía foliar. Parodiana 7: 63-76. [ Links ]
3. ARAMBARRI, A. M., S. E. FREIRE, M. N. COLARES, N. D. BAYÓN, M. C. NOVOA, C. MONTI & S. A. STENGLEIN. 2006. Leaf anatomy of medicinal shrubs and trees from Gallery forests of the Paranaense Province (Argentina). Part 1. Bol. Soc. Argent. Bot. 41: 233-268. [ Links ]
4. ARAMBARRI, A. M., S. E. FREIRE, M. N. COLARES, N. D. BAYÓN, M. C. NOVOA, C. MONTI & S. A. STENGLEIN. 2008. Leaf anatomy of medicinal shrubs and trees from Misiones forest of the Paranaense Province (Argentina). Part 2. Bol. Soc. Argent. Bot. 43: 31-60. [ Links ]
5. ARAMBARRI, A. M., S. E. FREIRE, N. D. BAYÓN, M. N. COLARES, C. MONTI, M. C. NOVOA & M. P. HERNÁNDEZ. 2009a. Morfoanatomía foliar de árboles medicinales de la Provincia Biogeográfica de las Yungas (Argentina). Bol. Latinoam. Caribe Plant. Med. Aromat. 8: 342-379. [ Links ]
6. ARAMBARRI, A. M., S. E. FREIRE, N. D. BAYÓN, M. N. COLARES, C. MONTI, M. C. NOVOA & M. P. HERNÁNDEZ. 2009b. Micrografía foliar de arbustos y pequeños árboles medicinales de la Provincia Biogeográfica de las Yungas (Argentina). Kurtziana 35: 1-31. [ Links ]
7. ARENAS, P. 2003. Etnografía y alimentación entre los Toba-Nachilamole´ek y Wichi- Lhuku´tas del Chaco central (Argentina). CONICET, CEFYBO, IBODA. [ Links ]
8. BERNARDELLO, L. M. 1982. Estudios en Lycium (Solanaceae) I. Anatomía de hoja y tallo, y sus diferencias con Grabowskia. Bol. Soc. Argent. Bot. 21: 153-185. [ Links ]
9. BIANCO, C. A., T. A. KRAUS & A. C. VEGETTI. 2004. La hoja. Morfología externa y anatomía. Universidad Nacional de Río Cuarto, Universidad Nacional del Litoral, REUN. [ Links ]
10. BILONI, J. S. 1990. Árboles autóctonos argentinos. Tipográfica Editora Argentina, Buenos Aires. [ Links ]
11. BOELCKE, O. 1981. Plantas vasculares de la Argentina, nativas y exóticas. FECIC. [ Links ]
12. BROWN, A. D. & H. R. GRAU. 1993. La naturaleza y el hombre en las selvas de montaña. Colección nuestros ecosistemas. Proyecto GTZ. Desarrollo agroforestal en comunidades rurales del noroeste argentino. Salta. [ Links ]
13. BURKART, A. 1952. Las leguminosas argentinas. Ed. Acme, Buenos Aires. [ Links ]
14. BURKART, A. 1979. Sapotaceae. En: BURKART, A. (ed.), Flora ilustrada de Entre Ríos. 6: 43-47. Colección Científica INTA, Buenos Aires. [ Links ]
15. CABRERA, A. L. 1994. Regiones fitogeográficas argentinas. Enc. Argent. Agricul. y Jard. 1st. reimpresión, T 2, Ed. Acme, Buenos Aires. [ Links ]
16. CABRERA, A. L. & A. WILLINK. 1973. Biogeografía de América Latina. Programa regional de desarrollo científico y tecnológico. OEA, Washington, D.C. [ Links ]
17. CAMPAGNA, M. N., M. S. RATTI, M. SCIARA, E. GARCÍA VESCOVI, M. GATTUSO & M. L. MARTÍNEZ. 2011. Biological activities of Castela coccinea Griseb. extracts. Lat. Am. J. Pharm. 30: 39-44. [ Links ]
18. CARRIZO, E. DEL V., M. O. PALACIO & L. D. ROIC (ex aequo). 2005. Uso medicinal de algunas especies nativas en Santiago del Estero (República Argentina). Dominguezia 21: 25-32. [ Links ]
19. COLARES, M. N. & A. M. ARAMBARRI. 2008. Ziziphus mistol (Rhamnaceae): morfo-anatomía y arquitectura foliar. Lat. Am. J. Pharm. 27: 568-577. [ Links ]
20. COSA, M. T. & N. DOTTORI. 2010. Adaptaciones anatómicas de plantas medicinales a la diversidad de ambientes. X Simposio Argentina y XIII Simposio Latinoamericano de Farmacobotánica, Córdoba. [ Links ]
21. DEL VALLE PEREA, M., G. PEDRAZA & J. DEL VALLE LUCEROS. 2007. Relevamiento de la flora arbórea autóctona en la provincia de Catamarca. Consejo Federal de Inversiones, Ciudad Autónoma de Buenos Aires y Gobierno de la provincia de Catamarca. [ Links ]
22. DEMAIO, P., U. O. KARLIN & M. MEDINA 2002. Árboles nativos del centro de Argentina, Literature of Latin America, Buenos Aires. [ Links ]
23. DIGILIO, A. P. & P. LEGNAME 1966. Los árboles indígenas de la provincia de Tucumán. Opera Lilloana 15: 7-76. [ Links ]
24. DIZEO DE STRITTMATTER, C. 1973. Nueva técnica de diafanización. Bol. Soc. Argent. Bot. 15: 126-129. [ Links ]
25. FAHN, A. & D. F. CUTLER. 1992. Xerophytes. Encyclop. Plt. Anat. Vol 1, Part 9, Gebrüder Borntraeger, Berlín. [ Links ]
26. GATELLI, E. B. R. 2007. Sistemática, morfología y ensayos biológicos de Celtis iguanaea (Jacquin) Sargent, Celtidaceae. Tesis de Maestría en Plantas Medicinales, Facultad de Ciencias Exactas, Universidad Nacional de La Plata. Argentina. [ Links ]
27. GIMÉNEZ, A. M. & P. HERNÁNDEZ. 2008. Biodiversidad en ambientes naturales del Chaco Argentino. Vegetación del Chaco semiárido, provincia de Santiago del Estero. Agencia Nacional de Promoción Científica y Tecnológica (FCF. UNSE). Fascículo 1: 110. [ Links ]
28. JUÁREZ DE VARELA, F. 1994. Rutaceae. Flora del Valle de Lerma. Aportes Botánicos de Salta. Serie Flora 2: 5-6. Facultad de Ciencias Naturales, Universidad Nacional de Salta. [ Links ]
29. JUÁREZ DE VARELA, F. & L. J. NOVARA. 2007. Anacardiaceae. Flora del valle de Lerma. Aportes Botánicos de Salta. Serie Flora 8: 1-28. Facultad de Ciencias Naturales, Universidad Nacional de Salta. [ Links ]
30. LEGNAME, P. R. 1982. Árboles indígenas del noroeste argentino. Opera Lilloana 34: 11-215. [ Links ]
31. LUNA, M. L. & E. R. DE LA SOTA. 2003. Estructura foliar de Jodina rhombifolia (Santalaceae) y sus variaciones en relación al área de distribución. Iheringia 58: 3-12. [ Links ]
32. MARTÍNEZ CROVETTO, R. 1981. Las plantas utilizadas en medicina popular en el noroeste de Corrientes. Fundación Miguel Lillo. Tucumán. Miscelánea 69: 7-139. [ Links ]
33. MARZOCCA, A. 1993. Index de plantas colorantes, tintóreas y curtientes. Manual de las especies de Argentina. Serie de la Academia Nacional de Agronomía y Veterinaria N° 9, Ed. Estilos Gráfica, Buenos Aires. [ Links ]
34. MARZOCCA, A. 1997. Vademécum de malezas medicinales de la Argentina, indígenas y exóticas. Orientación Gráfica Editora, Buenos Aires. [ Links ]
35. METCALFE, C. R. & L. CHALK. 1950. Anatomy of the Dicotyledons. Vol. 1, 2. Clarendon Press, Oxford. [ Links ]
36. METCALFE, C. R. & L. CHALK. 1979. Anatomy of the Dicotyledons. Vol. 1, 2. Clarendon Press, Oxford. [ Links ]
37. MUÑOZ, J. D. 2000. Anacardiaceae. Flora Fanerogámica Argentina 65:1-28. [ Links ]
38. NOVARA, L. J. 1993a. Bombacaceae. Flora del Valle de Lerma. Aportes Botánicos de Salta. Serie Flora 1: 2-7. Facultad de Ciencias Naturales, Universidad Nacional de Salta. [ Links ]
39. NOVARA, L. J. 1993b. Rosaceae. Flora del Valle de Lerma. Aportes Botánicos de Salta. Serie Flora 2: 6-8. Facultad de Ciencias Naturales, Universidad Nacional de Salta. [ Links ]
40. PEÑA-CHOCARRO, M. C., J. DE EGEA JUVINEL, M. VERA, H. MATURO & S. KNAPP. 2006. Guía de árboles y arbustos del Chaco húmedo, The Natural History Museum, Guyra Paraguay, Fundación Moisés Bertoni y Fundación Hábitat y Desarrollo: Asunción. [ Links ]
41. PERROTTA, V.G. & A.M. ARAMBARRI. 2004. Schinus longifolia var. longifolia (Anacardiaceae): anatomía foliar y caulinar. Acta Farm. Bonaerense 23:142-147. [ Links ]
42. PERROTTA, V. G., S. A. STENGLEIN & A. M. ARAMBARRI. 2007. Leaf anatomy of Ceiba chodatii and C. speciosa (Bombacaceae). Kurtziana 33: 17-25. [ Links ]
43. ROIG, F. A. 1993. Informe nacional para la selección de germoplasma en especies de Prosopis de la República Argentina. Contribuciones mendocinas a la quinta reunión regional para América Latina y el Caribe de la red de forestación del CIID. [ Links ]
44. ROTH, I. 1984. Stratification of tropical forests as seen in leaf structure. Junk Publ., The Hague, Boston Lancaster. [ Links ]
45. ROTH, I. 1990. Leaf structure of a Venezuela cloud forest (in relation to the microclimate). Encyclop. Plt. Anat. Vol 14, Part 1, Gebrüder Borntraeger, Berlín. [ Links ]
46. ROTH, I. 1995. Leaf structure: montane regions of Venezuela with an excursion into Argentina. Encyclop. Plt. Anat. Vol 14, Part 3, Gebrüder Borntraeger, Berlín. [ Links ]
47. RUIZ, A. I., M. I. MERCADO & G. I. PONESSA. 2007. Morfología y anatomía foliar de Jodina rhombifolia (Hook. et Arn.) Reissek (Santalaceae). Lilloa 44: 75-83. [ Links ]
48. SCARPA, G. F. 2007. Plantas asociadas a la pesca y a sus recursos por los indígenas Chorote del Chaco semiárido (Argentina). Bol. Soc. Argent. Bot. 42: 333-345. [ Links ]
49. STACE, A. 1965. Cuticular studies as an aid to plant anatomy. Bull. Br. Mus. Nat. Hist. Bot. 4: 1-78. [ Links ]
50. THIERS, B. 2011. Index Herbariorum: A global directory of public herbaria and associated staff. New York Botanical Garden´s Virtual Herbarium. http://sweetgum.nybg.org/ih/: 06.06.2011. [ Links ]
51. TOURSARKISSIAN, A. 1980. Plantas medicinales de la Argentina. Ed. Hemisferio Sur, Buenos Aires. [ Links ]
52. VERVOORST, F. 1979. La vegetación del noroeste argentino y su degradación. Serie Conservación de la naturaleza N°1, Fundación Miguel Lillo, Tucumán. [ Links ]
53. WAGNER, M. L. & G. I. PONESSA. 2004. Morfología foliar y seminal de Fagara coco (Gill.) Engler (Rutaceae). Lilloa 41: 71-84. [ Links ]
54. ZULOAGA, F. O., O. MORRONE & M. J. BELGRANO (eds.). 2008. Catálogo de las plantas vasculares del Cono Sur (Argentina, Sur de Brasil, Chile, Paraguay y Uruguay). II. Monogr. Syst. Bot. Missouri Bot. Gard. 107: 1905-1908. http://www.darwin.edu.ar/ (mayo 2010). [ Links ]
Recibido el 28 de septiembre de 2010,
aceptado el 8 de junio de 2011.
Apéndice 1. Taxones y material estudiado.
















