Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Boletín de la Sociedad Argentina de Botánica
versión On-line ISSN 1851-2372
Bol. Soc. Argent. Bot. vol.47 no.1-2 Córdoba ene./jun. 2012
ECOLOGÍA Y FITOGEOGRAFÍA
Biogeografía histórica de Cardiospermum y Urvillea (Sapindaceae) en América: Paralelismos geográficos e históricos con los Bosques secos estacionales neotropicales
Juan Pablo Coulleri1 y María Silvia Ferrucci1
1 Instituto de Botánica del Nordeste (UNNE-CONICET), C.C. 209, 3400-Corrientes, Argentina. E-mail del primer autor: juancoulleri@gmail.com
Resumen: Los géneros Cardiospermum y Urvillea (Paullinieae) están ampliamente distribuidos en América, desde el centro de los Estados Unidos hasta el centro de la Argentina. Los registros fósiles correspondientes al Eoceno tardío de América del Norte hasta el Plioceno de América del Sur registran patrones de distribución en ambos géneros durante la Era Cenozoica. El objetivo de este trabajo es establecer las áreas de endemismo y los patrones de distribución de Cardiospermum y Urvillea mediante un análisis de simplicidad de endemismos (PAE) basado en cuadrantes y un análisis panbiogeográfico basado en el algoritmo propuesto por Echeverry & Morrone (2010). El área de estudio está comprendida por las regiones Neártica y Neotropical, la Zona de transición sudamericana y la Zona de transición mexicana. La información de la distribución proviene del tratamiento taxonómico realizado por Ferrucci (2000) y especímenes de herbario de 33 especies de ambos géneros. El PAE permitió detectar y mapear seis áreas de endemismo. Los resultados del análisis panbiogeográfico y el registro fósil nos permitieron relacionar estas áreas de endemismos entre ellas, demostrando que coinciden con la actual distribución geográfica de los bosques secos estacionales neotropicales. Estos resultados sugieren un temprano evento de dispersión y una posterior serie de eventos vicariantes relacionados con la expansión y reducción de los bosques secos estacionales neotropicales que explicarían los patrones de distribución actuales de Cardiospermum y Urvillea en América.
Palabras clave: Análisis de simplicidad de endemismos; Análisis de trazos; Eventos dispersivos; Eventos vicariantes; Región Neotropical; Registro fósil.
Summary: Historical biogeography of Cardiospermum and Urvillea (Sapindaceae) in America: Geographic and historical parallelism with the Neotropical seasonally dry forest. The genera Cardiospermum and Urvillea (Paullinieae) are widely distributed in the Americas, from central United States to central Argentina. The fossil records from the late Eocene of North America to the Pliocene of South America record an early distribution pattern of both genera during the Cenozoic Era. This study aimed to establish areas of endemism and distribution patterns of Cardiospermum and Urvillea by means of a grid-based parsimony analysis of endemicity (PAE) and a panbiogeographical analysis based in the algorithm proposed by Echeverry & Morrone (2010). The study area includes the Nearctic and Neotropical regions, the South American transition zone and the Mexican transition zone. We used the distribution information of Ferrucci´s (2000) taxonomic treatment and the herbarium specimens for 33 species of both genera. The PAE led us to detect and map six areas of endemism. The panbiogeographic results and the fossil records allowed us to relate these areas of endemism between them, showing that they match with the current geographical distribution of the Neotropical seasonally dry forests. These results reveal an early dispersal event and a posterior series of vicariant events linked with the expansion and reduction of the Neotropical seasonally dry forests, which could explain the current distribution patterns of Cardiospermum and Urvillea in the Americas.
Key words: Dispersal events; Fossil records; Neotropical region; Parsimony analysis of endemicity; Track analysis; Vicariant events.
INTRODUCCIÓN
La familia Sapindaceae se encuentra representada ampliamente en las regiones tropicales y subtropicales, su distribución disminuye hacia las zonas templadas. Comprende 141 géneros y ca. 1900 especies (Acevedo-Rodríguez et al., 2011). Radlkofer (1931-1934) reconoció catorce tribus para Sapindaceae s.s., nueve en Sapindoideae y cinco en Dodonaeoideae. Cardiospermum L. y Urvillea Kunth pertenecen a la subfamilia Sapindoideae, y a la tribu Paullinieae, ésta caracterizada por especies de hábito trepador. Cardiospermum es un género relativamente pequeño, que cuenta con 16 especies, 3 de ellas son cosmopolitas, C. corindum L., C. halicacabum L. y C. grandiforum Sw.; mientras que Urvillea registra 17 especies americanas (Ferrucci, 2000; Ferrucci, 2006; Ferrucci & Urdampilleta 2011a, 2011b, en prensa), siendo U. ulmacea Kunth la especie de mayor distribución. Ambos géneros en América se encuentran representados desde el centro de los Estados Unidos hasta el centro de la Argentina, es decir que sus distribuciones abarcan las regiones Neártica y Neotropical. Los patrones de distribución actuales de Cardiospermum y Urvillea podrían deberse a una serie de eventos dispersivos y vicariantes ocurridos durante la era Cenozoica. Evidencia de ello son los registros fósiles representados por Cupanieidites cloudii Cookson & Pike, considerada "ancestral" a la tribu Paullinieae (van der Ham, 1990; van der Ham & Tomlik, 1994), correspondiente al sur de California durante el Paleoceno (Chmura, 1973), como así también Cardiospermum coloradensis MacGinitie y C. terminalis Lesquereux (MacGinitie, 1969) procedentes de la formación Green river (Eoceno medio), y por último, los registros pertenecientes a C. corindum en el sur de Estados Unidos (Manchester, 1999) y Panamá (Graham, 1985) correspondientes al Eoceno tardío y Plioceno en Venezuela (Barlett & Barghoorn, 1973). En consecuencia, el registro fósil refeja una progresión geográfica y cronológica desde el norte hacia el sur en el continente americano.
El primer paso en un estudio biogeográfico es la delimitación de las unidades de estudio o las áreas a comparar (Nelson & Platnick, 1981, Quijano-Abril et al., 2006). Morrone (1994) propuso que el análisis de simplicidad de endemismos (PAE) de Rosen (1988) podría ser usado para identificar áreas de endemismo. El algoritmo de PAE basado en cuadrantes (Morrone, 1994) optimiza los patrones de distribución de diferentes taxones mediante cuadrantes de tamaño arbitrario como unidades operativas, a fin de obtener un mayor grado de resolución. El análisis de simplicidad de endemismos (PAE) ha sido criticado ya que ignora las relaciones cladísticas entre los taxones considerando solo sus distribuciones (Humphries, 1988). También, se le critica que algunas especies resultan sinapomorfías de un conjunto de cuadrantes, pudiendo dicha sinapomorfía defnir varias áreas de endemismo, violando el principio mismo de endemicidad, el de estar restringido a un lugar determinado (Szumik et al., 2002). Sin embargo, la búsqueda de homología primaria entre áreas es un necesario primer paso en biogeografía histórica. De acuerdo a Rosen (1988) un cladograma de PAE representa una hipótesis de las condiciones ecológicas actuales, donde localidades hermanas son aquellas que comparten dichas condiciones (Posadas et al., 2011). Garzón-Orduña et al. (2008) sostienen que PAE tiene como objetivo describir y no explicar la actual distribución de los organismos. Es decir, PAE no puede explicar el alcance de las influencias históricas y ecológicas de los patrones de distribución (Posadas & Miranda-Esquivel, 1999). Dichas influencias pueden ser detectadas mediante un análisis panbiogeográfico, es decir, detectar trazos generalizados que permitan enfatizar la importancia de la información histórica y espacial (Craw, 1988; Craw et al., 1999; Morrone, 2001).
El objetivo de esta contribución es proponer una hipótesis de homología primaria biogeográfica (Morrone, 2001) de los géneros Cardiospermum y Urvillea en América, mediante un análisis de simplicidad de endemismos y un enfoque panbiogeográfico como dos métodos independientes con dos propuestas diferentes, aunque complementarios.
MATERIALES Y MÉTODOS
Área de estudio
Se empleó el sistema de provincias biogeográficas de Morrone (2006), basado en el análisis de patrones de distribución de diferentes taxones (fauna y fora). Esto nos permitió aplicar el concepto de homología primaria que establece áreas biogeográficas naturales definidas por especies endémicas (Morrone, 2001). Las áreas de estudio fueron las Regiones Neotropical y Neártica y las Zonas de transición sudamericana y mexicana.
La región Neotropical comprende desde el sur de México hasta el centro de Argentina y está conformada por las subregiones Caribeña, Amazónica, Chaqueña y Paranaense. La región Neártica básicamente comprende las áreas templadofrías de Canadá, los Estados Unidos de América y el norte de México (Rapoport, 1968; Morrone, 2006). Esta región está estrechamente relacionada con la región Paleártica, la cual incluye las áreas templado-frías del Viejo Mundo, constituyendo en conjunto el reino Holártico (Morrone, 1996, 1999). La Zona de transición sudamericana comprende la cordillera de los Andes desde el norte de Venezuela hasta Colombia, Ecuador, Puna, Prepuna y Monte. Por otra parte, la Zona de transición mexicana, está compuesta por las provincias biogeográficas de la Sierra Madre Occidental, Sierra Madre Oriental, el Cinturón Volcánico Transmexicano, la cuenca del Balsas y Sierra Madre del Sur.
Material estudiado
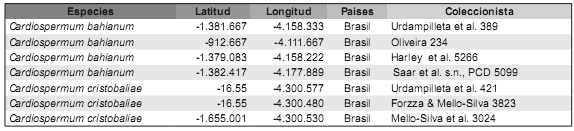
Nuestra fuente primaria proviene del material estudiado en el tratamiento taxonómico de Cardiospermum y Urvillea realizado por Ferrucci (2000), donde se analizaron especímenes depositados en los herbarios A, ALCB, BA, BAA, BAB, BACP, BAF, BAH, BCMEX, BM, BOLV, CAR, CEN CEPEC, CPAP, CORD, CTES, EAC, EM, ENCB, F, FCQ, FHO, G, GH, GUA, HAS, HAO, HB, HRB, HUEFS, HUT, ICN, IPA, K, LE, LIL, LP, MAC, MBM, MCNS, MEXU, MO, MOL, MVFA, MVM, MYF, NY, OXF, P, PACA, PAMG, PEUFR, PY, R, RB, RBR, SI, SP, SPF, UB, UC, UEC, UFMT, UFP, UPCB, US, USM, USZ, VEN. La fuente secundaria fueron los especímenes coleccionados con posterioridad al año 2000, depositados en el herbario del Instituto de Botánica del Nordeste (Tabla 1).
Tabla 1. Especímenes incluidos en el análisis proveniente del herbario CTES (Ferrucci & Urdampilleta, 2011a, 2011b).
En la base de datos se incluyó el 100% de las especies del continente americano, alcanzando un total de 460 registros en ambos géneros que suman un total de 33 especies cuya distribución fue mapeada. Las especies que conforman este registro son: Cardiospermum anomalum Cambess., C. bahianum Ferrucci & Urdampilleta, C. corindum L., C. cuchujaquense Ferrucci & Acev.-Rodr., C. cristobaliae Ferrucci & Urdampilleta, C. dissectum (S. Watson) Radlk., C. grandiflorum Sw., C. halicacabum L., C. heringeri Ferrucci, C. integerrimum Radlk., C. oliveirae Ferrucci, C. procumbens Radlk., C. pterocarpum Radlk., C. pygmaeum Radlk., C. tortuosum Benth., C. urvilloides (Radlk.) Ferrucci, Urvillea andersonii Ferrucci, U. biternata Weath., U. chacoensis Ferrucci, U. dasycarpa Radlk., U. flipes Radlk., U. glabra Cambess., U. intermedia Radlk., U. laevis Radlk., U. paucidentata Ferrucci, U. peruviana Ferrucci, U. rufescens Cambess., U. stipitata Radlk., U. stipularis Ferrucci, U. triphylla Radlk., U. ulmacea Kunth., U. uniloba Radlk. y U. venezuelensis Ferrucci.
Análisis de Simplicidad de Endemismos
Para establecer las áreas de endemismo se procedió a realizar un análisis de simplicidad de endemismos (PAE) basado en cuadrantes (Morrone, 1994). Para ello se diseñó una cuadrícula con cuadrantes de 10º latitud x 10º longitud, la cual se superpuso sobre un mapa de América. Es conocido que los resultados de un análisis de endemismo pueden depender de la escala (Morrone & Escalante, 2002), por esta razón, es importante mencionar que el tamaño de los cuadrantes es totalmente operacional. Diferentes autores han utilizado diferentes unidades de operativas (Linder, 2001; Szumik et al., 2002; Mast & Nyffeler, 2003; Hausdorf et al., 2003). Cuadrantes más pequeños pueden disminuir el número absoluto de los pasos en el cladograma de áreas, mientras que cuadrantes grandes pueden aumentar el número de sinapomorfías. En este trabajo, en la selección del tamaño de los cuadrantes se consideraron el tamaño del área de estudio en relación a la distribución de las especies de ambos géneros.
Todos los cuadrantes fueron numerados y se construyó una matriz de presencia/ausencia, en la cual las especies son consideradas como caracteres y los terminales son los cuadrantes en los cuales fue dividido el mapa (Tabla 2), utilizando como grupo externo un cuadrante donde no se encuentra presente ninguna especie de ambos géneros. El análisis de simplicidad fue llevado a cabo con el programa Mix del paquete PHYLIP 3.69 (Felsenstein, 1985). Los árboles fueron examinados con WINCLADA 1.0 (Nixon, 2002). Los grupos de cuadrantes que compartían al menos dos especies fueron considerados como áreas de endemismo (Platnick, 1991; Morrone, 1994). Luego de un primer análisis se eliminaron del mismo C. corindun, C. halicacabum y U. ulmacea (las especies de más amplia distribución) puesto que generaban homoplasias en los clados (áreas). Además, las áreas definidas por una sola especie fueron tenidas en cuenta como potenciales áreas de endemismo. Como los resultados consistían en múltiples soluciones, éstas fueron resumidas utilizando el cladograma de consenso estricto, y luego las áreas de endemismo fueron delineadas y mapeadas.
Tabla 2. Matriz de datos biogeográficos, las especies analizadas están ubicadas horizontalmente y los cuadrantes en los cuales fue dividido el mapa se encuentran ubicados verticalmente, se utilizó el cuadrante 1 como grupo externo.

Análisis de trazos
La construcción de los trazos generalizados se realizó mediante la construcción de trazos individuales para cada taxón. Un trazo individual es la unidad básica de un estudio panbiogeográfico, constituyendo las coordenadas primarias de un taxón en el espacio, y consiste en una línea que conecta las localidades donde se distribuye una especie o taxón supraespecífico, de modo que la suma de los segmentos que conectan las localidades sea la menor posible (criterio de distancia mínima). Desde el punto de vista topológico, un trazo individual es un árbol de tendido mínimo, que para n localidades contiene n-1 conexiones (Craw 1988; Morrone, 2004).
A partir de los trazos individuales y el mapa dividido en cuadrantes (el mismo que se utilizó para PAE), se confeccionó una matriz r x c, donde las filas (r) representan las unidades operativas geográficas (los cuadrantes) y las columnas (c) representan a los trazos individuales (Morrone, 2004). Cada entrada en la matriz es "1" cuando un trazo se encuentra presente o cruza un cuadrante y "0" si está ausente o no lo cruza. Como grupo externo, en la matriz fue incluida un área hipotética donde no se encuentran o cruzan ningún trazo. Dicha matriz fue sujeta a un análisis de parsimonia con el programa TNT 1.1 (Goloboff et al., 2003). En el cladograma resultante los clados representan la superposición de los trazos individuales, dicha superposición corresponde a los trazos generalizados (Zunino & Zullini, 2003). Estos trazos representan patrones de distribución actuales de biotas ancestrales, las cuales fueron fragmentadas por eventos geológicos o tectónicos (Craw et al., 1999), los trazos generalizados equivalen a componentes bióticos (Morrone, 2009).
Finalmente se remueven de la matriz los trazos individuales que soportan los clados obtenidos y se vuelve a analizar reiteradas veces eliminando cada vez los trazos que soporten los clados obtenidos hasta no obtener clados soportados (Echeverry & Morrone, 2010).
Como resultado de los datos de la distribución geográfica de ambos géneros, 22 de los 39 cuadrantes fueron ocupados por dos o más especies con carácter informativo. La región Neotropical presenta la mayor riqueza específica y dentro de ésta las dos subregiones más ricas son la Chaqueña y la Paranaense, acumulando más del 50% de las especies entre ambas (Tabla 3).
Tabla 3. Número y porcentaje de especies por subregión, las subregiones Chaqueña y Paranaense de la región Neotropical son las dos con mayor riqueza específica.

El análisis de simplicidad de endemismos, mediante el consenso estricto de los árboles obtenidos (Fig. 1), evidenció la presencia de seis áreas de endemismo (Fig. 2) distribuidas en todo el continente. El árbol de consenso estricto (ACE) presenta dos secciones: 1. una politomía explicada por la ausencia de sinapomorfías, a excepción de los clados que representan a las áreas de endemismo F soportada por U. peruviana y el área B determinada por C. cuchujaquense y C. tortuosum; 2. un clado definido por C. grandiflorum (el clado α), en éste se distinguen las áreas de endemismo por la presencia de especies únicas de cada área en particular. El área E defnida por U. venezuelensis; C. pygmaeum y U. dasycarpa soportan el área D; el área C está soportada por C. dissectum; y el área A, la mayor y más diversa, presenta las sinapomorfías correspondientes a C. anomalum, C. bahianum, C. cristobaliae, C. heringeri, C. integerrimum, C. oliveirae, C. procumbens, C. pterocarpum, C. urvilloides, U. andersonii, U. chacoensis, U. flipes y U. laevis.

Fig. 1. Cladograma de consenso estricto obtenido a partir del análisis de simplicidad de endemismos por cuadrantes, cada terminal representa un cuadrante. A, D, E, C, B y F representan las áreas de endemismo. El área A presente en el Cerrado y la Caatinga (BSEN), correspondiente a las subregiones Paranaense y Chaqueña, el área E perteneciente a las sabanas de los Altos Llanos venezolanos (subregión Amazónica) y las restantes se corresponden con los BSEN de la región Neártica (B y C), la Zona de transición sudamericana (F) y la subregión Caribeña (D).

Fig. 2. Áreas de endemismo establecidas por PAE para ambos géneros. El análisis PAE está basado en los datos de distribución de 460 registros (33 especies). Los patrones de saturación (incremento de oscuridad) siguen la siguiente escala: 1-3 especies endémicas (áreas B, E y F); 4-7 especies endémicas (áreas C y D) y 16 especies endémicas (área A).
Es interesante observar que todas las áreas de endemismo coinciden con la ubicación geográfica de los bosques secos estacionales neotropicales y sabanas sudamericanas.
Los bosques secos estacionales neotropicales son esencialmente ecosistemas boscosos caracterizados por poseer un dosel continuo o casi continuo y escasas gramíneas (Mooney et al., 1995). El índice pluviométrico es de aproximadamente 1600 mm/año y con un periodo de por lo menos 5-6 meses con precipitaciones prácticamente inexistentes (Gentry, 1995; Graham & Dilcher, 1995). El paisaje está dominado por vegetación caducifolia, aunque en las regiones más secas existen árboles perennes y especies suculentas (Mooney et al., 1995). En contraste con los bosques húmedos, los BSEN presentan flores conspicuas, y la dispersión de los frutos y semillas generalmente es anemófila.
Las sabanas en las cuales se encuentran las áreas de endemismos corresponden al Cerrado y a las pertenecientes a los Altos Llanos venezolanos.
Los patrones de distribución disyuntos en las áreas de endemismos apoyan la idea de una serie de eventos vicariantes y de especiación alopátrica, responsables de la distribución y diversidad actual de los géneros. El área de endemismo de mayor longitud y de mayor riqueza específica (el área A) perteneciente a las subregiones Chaqueña y Paranaense de la región Neotropical, coincide con la mayor extensión continua de bosques secos estacionales neotropicales, reforzando aún más la idea de dichos eventos vicariantes relacionados con la expansión y posterior retroceso de estos bosques.
Mediante el algoritmo utilizado para el análisis panbiogeográfico se obtuvieron cuatro cladogramas de consenso estricto (Fig. 3). Siete trazos generalizados fueron encontrados (Fig. 4), el trazo 1 relaciona la región Neártica con la Zona de transición mexicana y la subregión Caribeña (región Neotropical), el trazo 2 es exclusivo de la Zona de transición sudamericana; las subregiones Caribeña y Amazónica se encuentran relacionadas por el trazo 3; los trazos 4, 6 y 7 relacionan las subregiones Chaqueña y Paranaense, y el trazo 5 es exclusivo de la subregión Paranaense. A los fines de este análisis, de las 33 especies 20 resultaron informativas (se presentan como sinapomorfías que soportan trazos generalizados), en la Tabla 4 pueden observarse los trazos generalizados, las subregiones donde se encuentran y que especies los soportan.

Fig. 3. Cladogramas de consenso estricto obtenidos a partir del análisis panbiogeográfico, cada terminal representa un cuadrante. A: Árbol con todos los trazos individuales incluidos en la matriz. B: Cladograma obtenido a partir de una matriz reducida, los trazos individuales que soportaban los clados del árbol A, fueron eliminados. C: Árbol obtenido a partir de una matriz sin los trazos individuales que soportan los clados de los árboles A y B. D: Último árbol del análisis a partir de la matriz sin los trazos individuales que soportan los clados de los árboles A, B y C. El siguiente árbol (no mostrado) no presenta ningún clado y ninguna sinapomorfía. Los trazos generalizados se encuentran representados como 6, 3, 7, 1, 4, 5 y 2.

Fig. 4. A: Trazos generalizados para las especies de Cardiospermum y Urvillea, siete trazos generalizados fueron obtenidos en el análisis panbiogeográfico; el esquema de provincias biogeográficas es el propuesto por Morrone (2006). B: Trazo 1, relaciona las regiones Neártica, la Zona de transición mexicana y la subregión Caribeña. C: Trazo 2 es exclusivo de la Zona de transición sudamericana. D: Trazo 3 relaciona las subregiones del neotrópico Caribeña y Amazónica. E. Trazo 4 se corresponde con la Caatinga y el Cerrado. F: Trazo 5 es exclusivo de la subregión Paranaense (Mata Atlántica). G-H: Trazos 6 y 7 relacionan las subregiones Chaqueña y Paranaense.
Tabla 4. Trazos generalizados con sus respectivas especies que lo soportan. En las subregiones, las líneas separan trazos.

DISCUSIÓN
Áreas de endemismos
La distribución de ambos géneros sitúa a sus especies en dos regiones biogeográficas y las Zonas de transición mexicana y sudamericana. Las áreas de endemismo se corresponden con los actuales bosques secos estacionales neotropicales (BSEN) y sabanas sudamericanas, presentando ambas una distribución disyunta a lo largo del Neotrópico.
Las áreas de endemismos presentes en la región Neártica probablemente son las más antiguas, puesto que el registro fósil del taxón "ancestral" de la tribu Paullinieae, Cupanieidites cloudii (van der Ham, 1990; van der Ham & Tomlik, 1994), se encuentra en el área B (completamente Neártica). También en esta región están representados los primeros registros de Cardiospermum, C. terminalis y C. coloradensis, correspondientes al Eoceno medio del centro-oeste de Estados Unidos (MacGinitie, 1969), y los primeros registros de C. halicacabum y C. corindum pertenecientes al Eoceno tardío del desierto de Sonora (Burnham & Graham, 1999).
El registro fósil sugiere la presencia de procesos dispersivos hacia el sur en América del Norte mediante la presencia de C. corindum en el sur de Estados Unidos en registros pertenecientes al Eoceno tardío (Manchester, 1999) y hallazgos de la misma especie en estratos posteriores en Panamá (Graham, 1985) y Venezuela (Barlett & Barghoorn, 1973), los cuales se deberían a los cambios climáticos y geológicos que tuvieron lugar durante el Eoceno. Esta época se caracterizó por ser en sus etapas tempranas, hace aproximadamente 55 millones de años (55 Ma.), cálida, húmeda y estable, pudiendo encontrarse bosques en los polos. A partir del Eoceno medio (40 Ma.) se inicia un proceso de enfriamiento global y disminución del dióxido de carbono como consecuencia de la separación de Australia del continente Antártico y la circulación por todo el globo de la corriente circumpolar antártica. A raíz de ello, a finales del Eoceno (35 Ma.), las condiciones climáticas presentaban un carácter más estacional y no tan estable como al principio de esta época (Prothero & Emry, 1996). Durante esta época los bosques que se extendían por todo el continente se replegaron a sus situaciones actuales dando lugar a las grandes llanuras y pastizales que actualmente se encuentran en el centro y sur de Estados Unidos (Jacobs et al., 1999).
La región Neotropical presenta la mayor cantidad de áreas de endemismos, además del área de endemismo más extensa y de mayor riqueza específica, respecto a ambos géneros. La subregión Caribeña posee dos áreas de endemismos, una de ellas la comparte con la región Neártica (área C), la otra es completamente Neotropical (área D). Las áreas de endemismos de esta subregión presentan pocas especies endémicas debido a que sus ecosistemas (bosques secos estacionales neotropicales) si bien datan desde el Mioceno (Graham & Dilcher, 1995) han estado bajo los efectos de los procesos orogénicos que originaron Mesoamérica y el Caribe (Williams, 1989; Reddish, 1996), procesos que desestabilizarían la subregión, siendo los ecosistemas actuales relativamente recientes (Gentry, 1982). Además, los bosques secos estacionales neotropicales caribeños tienen pocas lianas comparados con sus contrapartes continentales, lo cual reflejaría que las lianas, cuyos frutos y semillas son dispersados por el viento, no se pueden dispersar a largas distancias a través del mar, perdiendo poder germinativo durante largos periodos de exposición en dichas aguas (Guillespie et al., 2000).
La subregión Amazónica presenta una potencial área de endemismo (E), defnida por la especie endémica U. venezuelensis. Esta área de endemismo coincide con la ubicación geográfica de las sabanas de los Altos Llanos venezolanos. En esta región se habrían establecido las primeras especies de Cardiospermum y Urvillea provenientes del norte, transportadas por el viento a través de las Antillas (en formación) durante el Plioceno temprano, el Istmo de Panamá no existía en ese tiempo geológico. La presencia de una única especie endémica en esta área de endemismo podría deberse al reciente retroceso de los bosques secos estacionales neotropicales a finales del Pleistoceno y el posterior establecimiento de las sabanas de los Altos Llanos venezolanos, como resultado del final del último máximo glacial, dando origen a los actuales bosques húmedos y selvas de la cuenca amazónica (Irion et al., 1995; Colinvaux, 1996; Simpson, 1997).
El área de endemismo más grande, de mayor riqueza específica y en la cual se hallan las especies con los caracteres más derivados, se encuentra presente en las subregiones Paranaense y Chaqueña. Probablemente estas dos subregiones posean los bosques secos estacionales neotropicales más estables (De Oliveira et al., 1999; Behling et al., 2000; Lavin, 2006), en los cuales dominan las zonas semiáridas. Estas dos subregiones no han sufrido importantes alteraciones durante los ciclos glacial-interglaciares ocurridos en la era Cenozoica. El sorprendente número de especies endémicas de diferentes taxones indicaría una larga historia geológica en estos ambientes (Prado, 1991). Cardiospermum y Urvillea habrían arribado al sur del continente durante el Plioceno tardío/Pleistoceno temprano cuando los bosques secos estacionales neotropicales formaban parte de casi todo el paisaje de América.
La Zona de transición sudamericana se caracteriza por la presencia de una especie endémica, U. peruviana que defne una pequeña potencial área de endemismo, correspondiente a los bosques secos estacionales de los valles interandinos peruanos y bolivianos. El bajo número de especies endémicas y de especies de ambos géneros puede deberse a los cambios orogénicos y climáticos del Cuaternario que pudieron haber causado el aislamiento de los BSEN en los valles interandinos de Perú de los BSEN en regiones más al sur, especialmente de los valles interandinos bolivianos (Linares-Palomino et al., 2006).
Análisis Panbiogeográfico
El trazo generalizado 1 relaciona el sur de la región Neártica con la Zona de transición mexicana y la región Neotropical, es decir que esta región de Centroamérica incluye taxones de distribución tanto Neártica (C. pygameum y C. tortuosum) como especies de distribución Neotropical (U. dasycarpa). Las especies de distribución Neártica incluyen especies que diversificaron en las montañas de México durante el Plioceno y Pleistoceno, constituyendo el istmo de Tehuantepec el límite sur, aunque algunas especies pueden escapar de esta barrera geográfica, dichas especies generalmente se encuentran en las regiones áridas y templadas. En cambio, las especies que poseen una distribución Neotropical habrían diversificado en la Zona de transición mexicana antes del cierre del istmo de Tehuantepec, estas especies generalmente se encuentran en las regiones de los bosques nubosos de las montañas de Oaxaca y más al sur en la subregión Caribeña. El trazo atraviesa por los BSEN presentes en México y Centroamérica.
El trazo 2 se encuentra enteramente en la Zona de transición sudamericana, relaciona las yungas de los valles interandinos de Bolivia con los BSEN de los valles interandinos peruanos. Estos bosques han divergido de manera aislada, hecho evidenciado por las diferencias en la composición florística de ambos BSEN (Berrio et al., 2002). Sin embargo, ambos biotas están relacionados por este "trazo transandino", trazo que no es exclusivo del género Urvillea (U. peruviana y U. ulmacea) ya que otros autores (Daniel, 1986; Bridgewater et al., 2003; Wood, 2006) han descripto las relaciones entre estas biotas, mediante la distribución de especies correspondientes a las familias Fabaceae, Cactaceae, Bignoniaceae, Asteraceae, Euphorbiaceae, Polygonaceae, Capparaceae, Rutaceae, Moraceae y Rubiaceae.
El trazo generalizado 3 relaciona la subregión Caribeña con la Amazónica, y las áreas de endemismo E y A, las biotas representadas en este trazo corresponden a las sabanas de los Altos Llanos venezolanos. Éstas se caracterizan por la presencia de un estrato inferior dominado por gramíneas C4 y un estrato superior conformado por arbustos, árboles o inexistente, aunque éstos nunca formarán un dosel cerrado. El agua es un factor limitante, siendo fundamental la presencia de cuerpos de agua permanentes o semipermanentes durante la estación seca, puesto que sus suelos no son permeables y no funcionan como reservorio (Hubber et al., 2006).
Los trazos 4, 5 y 6 se encuentran en el área de endemismo de mayor riqueza específica, el trazo 4 relaciona a las especies endémicas de la Caatinga (BSEN) y el Cerrado, mientras que los trazos 5 y 6 relacionan las regiones en las cuales se encuentra la mayor extensión de BSEN desde el nordeste brasileño representado principalmente por la Caatinga y la Mata Atlántica, hasta el nordeste argentino cuyos bosques secos estacionales neotropicales corresponden a los bosques del Núcleo misionero (Chaco húmedo).
La Caatinga es el tipo de bosque seco estacional neotropical que más especies endémicas de ambos géneros presenta, es de entre todos los BSEN el más antiguo y más estable, debido a que no se vio perturbado por los cambios climáticos ocurridos durante el Pleistoceno (Paganucci de Queiroz, 2006). Pennington et al. (2004) mediante análisis con secuencias transcriptas internas de varias especies del BSEN de la Caatinga demostró que la especiación y diversificación en estos bosques aparentemente tuvo lugar a partir del Plioceno. Aunque es el área más aislada de BSEN, no hay que descartar la posibilidad de múltiples invasiones de taxones presentes en los BSEN durante las etapas más secas entre el Plioceno hasta fnales del Pleistoceno cuando estos bosques experimentaron su máxima expansión (Paganucci de Queiroz, 2006).
La Mata Atlántica es un bioma que nuclea a una serie de ecosistemas casi continuos, desde el centro-oeste de Brasil hasta el nordeste de Argentina, posee un conjunto de variables geográficas y climáticas que lo hacen único, varía desde sub-húmedo en las regiones más al norte (cercanos a la Caatinga) hasta híper-húmedos en las regiones más al sur próximas al Núcleo misionero (Stehmann et al., 2009). La Mata Atlántica es quizás uno de los ecosistemas más antiguos de Sudamérica, data desde la separación de Gondwana (80 millones de años). Sin embargo, sufrió varios procesos de expansión y contracción durante los periodos glacial-interglaciares, el bioma tal cual lo conocemos hoy data de principios del Holoceno (Lendru et al., 2009).
Dentro de las sabanas, el Cerrado es el que mayor número de especies de ambos géneros presenta. Esta biota, de una riqueza específica sorprendente (Ratter et al., 2006), es relativamente joven. Estudios recientes estiman que el Cerrado data del Mioceno tardío o el Plioceno temprano, es decir, entre 10-0.4 Ma. (Simon et al., 2009). El Cerrado constituye un complejo vegetativo muy particular, caracterizado por la escleromorfía foliar y la suberificación de los tallos (Fernandes & Bezerra, 1990). Los suelos son pobres debido a la porosidad de los mismos, lo cual ayuda a la lixiviación de éstos, aunque esta misma cualidad también favorece la función de reservorio natural y constante de agua, necesario debido a los largos periodos de sequía. El Cerrado presenta dos estratos, un estrato inferior dominado por gramíneas C4 y un estrato superior, conformado por árboles de baja altura (aproximadamente 10 metros) y arbustos (Gottsberger & Silberbauer-Gottsberger, 2006; Ratter et al., 1997; Eiten, 1972). El surgimiento de esta ecoregión puede deberse a la explosión de gramíneas C4 durante el Mioceno tardío hasta el Plioceno temprano, favorecido por el ambiente seco predominante y la reducción de CO2, superando sus límites actuales de distribución, replegándose a su situación actual a mediados del Holoceno (Vieira Zanella, 2011). La mayoría de las especies de Cardiospermum y Urvillea del Cerrado son compartidas con la Caatinga, lo cual se condice con estudios florísticos en las cuales se analizan relaciones del Cerrado con las biomas que lo limitan (Sarmiento, 1983; Simon et al., 2009), mediante estudios filogenéticos de linajes del Cerrado y dichos biomas, se concluye que las especies vegetales del Cerrado son una mezcla florística de los componentes de las biotas circundantes. La posición geográfica privilegiada del Cerrado jugó un rol importante en el aumento de la riqueza específica del mismo. La misma se debió a la diversificación reciente influenciada por la capacidad de su flora a adaptarse rápidamente al fuego (Wiens & Donoghue, 2004; Donoghue, 2008; Crisp et al., 2009).
El trazo 7, relaciona los bosques secos del Núcleo misionero y el bosque seco Chiquitano. Este trazo atraviesa los bosques secos presentes en Paraguay y el estado de Mato Grosso do Sul (Brasil), estos bosques se caracterizan por presentar al Este una composición florística correspondiente a la subregión Paranaense (Chaco húmedo) y al Oeste, especies representantes de la vegetación típica del Chaco seco. Sin embargo, la composición florística de esta región es más compleja, debido a la presencia del ecotono Paraná-Paraguay (Spichiger et al., 2006), confirmando la presencia de un bioma ancestral entre ambas subregiones Paranaense (al este) y Chaqueña (al oeste). El bosque seco Chiquitano (Noroeste del trazo 7) merece especial atención, este bosque es una zona de transición entre las especies de distribución tropical húmeda y las especies de distribución semiáridas subtropicales; la distribución de las especies de este bosque está relacionada con las variables climáticas estrechamente correlacionadas con la latitud. Sin embargo, el bosque seco Chiquitano no es una mezcla de especies amazónicas y del Gran chaco, ya que su composición florística es única, constituyendo una verdadera ecoregión (Olsen & Dinerstein, 1998; Ibisch et al., 2002). Mayle et al. (2004) sostiene la hipótesis que la flora de esta región es esencialmente joven y que las especies constituyentes de estos bosques secos arribaron recientemente del norte durante el último máximo glacial.
CONCLUSIONES
Los patrones de distribución exhibidos por Cardiospermum y Urvillea son difíciles de tratar con un enfoque dispersalista, ya que las áreas de endemismos disyuntas proponen la idea de eventos vicariantes. Sin embargo, es necesario tener en cuenta toda la historia evolutiva de ambos géneros al momento de establecer una hipótesis biogeográfica. Por ello, los procesos dispersivos no pueden ser descartados, debido a que fueron necesarios para que Cardiospermum y Urvillea migrasen desde el sur de los Estados Unidos hacia el sur del continente entre el Eoceno y el Plioceno.
La mayoría de las especies exhiben una distribución limitada a una pequeña área, además de las cuatro especies de amplia distribución. Estos patrones de distribución serían el resultado de una biota fragmentada a través de la historia por cambios climáticos y tectónicos, exhibiendo un notable paralelismo con la actual distribución geográfica de los BSEN y sabanas sudamericanas, y con la historia evolutiva de estos biomas, sugiriendo que Cardiospermum y Urvillea en América, serían endémicas de estas biotas.
AGRADECIMIENTOS
Agradecemos al Dr. J. J. Morrone y al Dr. D. E. Prado, por la lectura crítica y las sugerencias realizadas sobre el manuscrito preliminar, como así mismo a los tres revisores anónimos que han enriquecido esta contribución. Este trabajo ha sido subsidiado por la Agencia Nacional de Promoción Científica, Tecnológica y de Innovación (ANPCyT-UNNE, PICTO 00096) y por el Consejo Nacional de Investigaciones Científicas y Técnicas (PIP Nº 112-200801-02248).
BIBLIOGRAFÍA
1. ACEVEDO-RODRÍGUEZ, P., P. C. WELZEN, F. ADEMA & R. W. J. M. van der HAM. 2011. Sapindaceae. In: KUBITZKI, K. (ed.), The Families and Genera of Vascular Plants: Flowering Plants. Eudicots, pp. 357-407. Springer, Berlin. [ Links ]
2. BARLETT, A. S. & E. S. BARGHOORN. 1973. Phytogeographic history of the Isthmus of Panama during the past 12,000 years (a history of vegetation, climate, and sea-level change). In: GRAHAM, A. (ed.), Vegetation and vegetational History of Northern Latin America, pp 203-299. Elsevier Publ. Co., Amsterdam. [ Links ]
3. BEHLING, H., H. W. ARZ, J. PATZOLD & G. WEFER. 2000. Late Quaternary vegetational and climate dynamics in northeastern Brazil, inferences from marine core GeoB 3104-1. Quater. Sci. Rev. 19: 981-994. [ Links ]
4. BERRIO, J. C., H. HOOGHIEMSTRA, R. MARCHANT & O. RANGEL. 2002. Late-glacial and Holocene history of the dry forest area in the south Colombian Cauca Valley. J. Quater. Sci. 17: 667-682. [ Links ]
5. BRIDGEWATER, S., PENNINGTON, R. T., REYNEL, C. A., DAZA, A. & PENINGTON, T. D. 2003. A preliminary floristic and phytogeographic analysis of the woody fora of seasonally dry forest in northern Peru. Candollea 58: 129-148. [ Links ]
6. BURNHAM, R. J. & A. GRAHAM. 1999. The history of neotropical vegetation: new developments and status. Ann. Missouri Bot. Gard. 86: 546-589. [ Links ]
7. CHMURA, C. A. 1973. Upper Cretaceous (Campanian-Maastrichtian) angiosperm pollen from the western San Joaquin Valley, California, U.S.A. Palaeontographica B 141: 89-171. [ Links ]
8. COLINVAUX, P. A. 1996. Quaternary environmental history and diversity in the Neotropics. In: JACKSON, J. B. C., A.F. BUDD & A.G. COATES (eds.), Evolution and Environment in tropical America, pp. 359-405. University of Chicago Press, Chicago. [ Links ]
9. CRAW, R. C. 1988. Panbiogeography: method and synthesis in biogeography. In: Myers, A. A. & P. S. Giller (eds.), Analytical biogeography: an integrated approach to the study of animal and plant distributions, pp. 405-435. Chapman & Hall, London and New York. [ Links ]
10. CRAW, R. C., J. R. GREHAN & M. J. HEADS. 1999. Panbiogeography: tracking the history of the life. Oxford Biogeography Series 11. Oxford University Press, New York. [ Links ]
11. CRISP, M. D., M. T. K., ARROYO, L. G., COOK, M. A., GANDOLFO, G. J., JORDAN, M. S., MCGLONE, P. H. WESTON, M., WESTOBY, P., WILF& H. P. LINDER. 2009. Phylogenetic biome conservatism on a global scale. Nature 458: 754-756. [ Links ]
12. DANIEL, T. F. 1986. Systematics of Tetramerium. Syst. Bot. Monogr. 12: 1-134. [ Links ]
13. DE OLIVEIRA, P. E., A. M. F. BARRETO & K., SUGUIO. 1999. Late Pleistocene/Holocene climatic and vegetational history of the Brazilian caatinga: the fossil dunes of the middle São Francisco River. Palaeogeogr. Palaeoclimatol. Palaeoecol. 152: 319-337. [ Links ]
14. DONOGHUE, M. J. 2008. A phylogenetic perspective on the distribution of plant diversity. Proc. Natl. Acad. Sci. USA 105: 221-225. [ Links ]
15. EITEN G. 1972. The Cerrado vegetation of Brazil. Bot. Rev. 38: 201-341. [ Links ]
16. ECHEVERRY, A. & J. J. MORRONE. 2010. Parsimony analysis of endemicity as a panbiogeographical tool: An analysis of Caribbean plant taxa. Biol. J. Linn. Soc. 101: 961-976. [ Links ]
17. FELSENSTEIN, J. 1985. Phylogenies and the comparative method. Amer. Naturalist 125: 1-15. [ Links ]
18. FERNANDES, A. & P. BEZERRA. 1990. Estudo fitogeográfico do Brasil. Stylus Comunicaçôes, Fortaleza, Brasil. [ Links ]
19. FERRUCCI, M. S. 2000. Revisión de los géneros Cardiospermum y Urvillea para el Neotrópico (Sapindaceae). PhD Thesis, Universidad Nacional de Córdoba, Argentina. [ Links ]
20. FERRUCCI, M. S. 2006. A new species of Urvillea (Sapindaceae) from Northwestern Venezuela. Brittonia 58: 83-87. [ Links ]
21. FERRUCCI, M. S. & J. D. URDAMPILLETA. 2011a. Cardiospermum cristobaliae (Sapindaceae, Paullinieae), una nueva especie de Minas Gerais, Brasil. Brittonia 63: 478-483. [ Links ]
22. FERRUCCI, M.S. & J. D. URDAMPILLETA. 2011b. Cardiospermum bahianum (Sapindaceae: Paullinieae), a New Species from Bahia, Brazil. Syst. Bot. 36: 950-956. [ Links ]
23. GARZÓN-ORDUÑA, I. J., MIRANDA-ESQUIVEL, D. R. & M. DONATO. 2008. Parsimony analysis of endemicity describes but does not explain: an illustrated critique. J. Biogeogr. 35: 903-913. [ Links ]
24. GENTRY, A. H. 1982. Neotropical floristic diversity: Phytogeographical connections between Central and South America, pleistocene climatic fluctuations, or an accident of the andean orogeny? Ann. Missouri Bot. Gard. 69: 557-593 [ Links ]
25. GENTRY, A. H. 1995. Diversity and floristic composition of neotropical dry forest. In: BULLOCK S. H., H. A. MEDINA & E. MEDINA (eds). Seasonally dry tropical forest, pp. 146-194. Cambridge University Press, Cambridge. [ Links ]
26. GOTTSBERGER, G. & I. SILBERBAUER-GOTTSBERGER. 2006. Life in the Cerrado, a south American tropical seasonal ecosystem. Ulm, Germany, Reta Verlag. [ Links ]
27. GRAHAM, A. 1985. Studies in Neotropical Paleobotany IV. The Eocene Communities of Panama. Ann. Missouri Bot. Gard. 72: 504-535. [ Links ]
28. GRAHAM, A. & D. DILCHER. 1995. The Cenozoic records of tropical dry forest in northern Latin America and the southern United States. In: BULLOCK S. H., H. A. MEDINA & E. MEDINA (eds). Seasonally dry tropical forest, pp. 124-145. Cambridge University Press, Cambridge. [ Links ]
29. GOLOBOFF, P., FARRIS, J. & K. NIXON. 2003. T.N.T.: Tree Analysis Using New Technology, vers. 1.1. www.zmuc.dk/public/phylogeny. [ Links ]
30. GUILLESPIE, T. W., A. GRIJALVA & C. FARRIS. 2000. Diversity, composition and structure of tropical dry forest in Central America. Plant Ecol. 147: 37-47. [ Links ]
31. HAUSDORF, B. & C. HENNING. 2003. Biotic element analysis in biogeography. Syst. Biol. 52: 717-723. [ Links ]
32. HUBBER, O., R. D., de STEFANO, G., AYMARD & R., RIINA. 2006. Flora and Vegetation of the Venezuelan Llanos: A review. In: PENNINGTON, T. (ed.), Neotropical Savannas and Dry Forests: Diversity, Biogeography, and Conservation, pp. 425-440. CRC Press, Florida. [ Links ]
33. HUMPHRIES, C.J., LADIGES, P.Y., ROOS, M. & M. ZANDEE. 1988. Cladistic biogeography. In: Myers, A. A. & P. S. Giller (eds.), Analytical biogeography: an integrated approach to the study of animal and plant distributions, pp. 371-404. Chapman & Hall, London and New York. [ Links ]
34. IBISCH, P.L. & G. MERIDA. 2003. Biodiversidad: La Riqueza de Bolivia. Editorial FAN, Santa Cruz, Bolivia. [ Links ]
35. IRION, G., J. MÜLLER, J. NUNES DE MELLO & W. J. JUNK. 1995. Quaternary geology of the Amazonian lowland. Geo-marine Lett. 15: 172-178. [ Links ]
36. JACOBS, B. F., J. D. KINGSTON & L. L. JACOBS. 1999. The origins of grass-dominated ecosystems. Ann. Missouri Bot. Gard. 86: 590-643. [ Links ]
37. LAVIN, M. 2006. Floristic and geographical stability of discontinuous seasonally dry tropical. Forests explains patterns of plant phylogeny and endemism. In: PENNINGTON, T. (ed.), Neotropical Savannas and Dry Forests: Diversity, Biogeography, and Conservation, pp. 425-440. CRC Press, Florida. [ Links ]
38. LEDRU, M. P, MOURGUIART, P. & C. RICCOMINI. 2009. Related changes in biodiversity, insolation and climate in the Atlantic rainforest since the last interglacial. Palaeogeogr. Palaeocl. 271: 140-152. [ Links ]
39. LINARES-PALOMINO, R. 2006. Phytogeography and Floristics of Seasonally Dry Tropical Forests in Peru. In: PENNINGTON, T. (ed.), Neotropical Savannas and Dry Forests: Diversity, Biogeography, and Conservation, pp. 249-271. CRC Press, Florida. [ Links ]
40. LINDER, P. 2001. On areas of endemism, with an example from African Restionaceae. Syst. Biol. 50: 892-912. [ Links ]
41. MACGINITIE, H. D. 1969. The Eocene Green River fora of northwestern Colorado and northeastern Utah. University of California Press, LTD. London. [ Links ]
42. MANCHESTER, S. R. 1999. Biogeographical relationships of North American tertiary foras. Ann. Missouri Bot. Gard. 86: 523-545. [ Links ]
43. MAST, A. & R. NYFFELER. 2003. Using a null model to recognize significant co-occurrence prior to identifying candidate areas of endemism. Syst. Biol. 52: 271-280. [ Links ]
44. MAYLE, F. E., BEERLING, D. J., GOSLING, W. D. & M. B. BUSH. 2004. Responses of Amazonian ecosystems to climatic and atmospheric carbon dioxide changes since the last glacial maximum. Phil. Trans. R. Soc. Lond. B. 359: 499-514. [ Links ]
45. MOONEY, H. A., S. H. BULLOCK & E. MEDINA. 1995. Introduction. In: BULLOCK S. H., H. A. MEDINA & E. MEDINA (eds). Seasonally dry tropical forest, pp. 1-8. Cambridge University Press, Cambridge. [ Links ]
46. MORRONE, J. J. 1994. On the identification of areas of endemism. Diversity & Distrib. 7: 297-300. [ Links ]
47. MORRONE, J. J. 1996. Austral biogeography and relict weevil taxa (Coleoptera: Nemonichidae, Belidae, Brentidae, and Caridae). J. Comp. Biol. 1: 123-127 [ Links ]
48. MORRONE, J. J. 1999. Presentación de un Nuevo esquema biogeográfico para América del Sur. Biogeographica 1: 1-16. [ Links ]
49. MORRONE, J. J. 2001. Homology, biogeography and areas of endemism. Diversity & Distrib. 7: 297-300. [ Links ]
50. MORRONE, J. J. 2004. Panbiogeografía, componentes bióticos y zonas de transición. Revista Brasil. Entomol. 48: 149-162. [ Links ]
51. MORRONE, J. J. 2006. Biogeographic areas and transition zones of Latin America and the Caribbean islands based on panbiogeographic and cladistic analyses of the entomofauna. Annu. Rev. Entomol. 51: 467-494. [ Links ]
52. MORRONE, J. J. & T. ESCALANTE. 2002. Parsimony analysis of endemicity (PAE) of Mexican terrestrial mammals at different area units: when size matters. J. Biogeogr. 29: 1095-1104. [ Links ]
53. NELSON G. & N. I. PLATNICK. 1981. Systematics and biogeography: cladistics and vicariance. 1st ed. Columbia University Press, New York. [ Links ]
54. NIXON, K. C. 2002. WINCLADA, beta ver. 1.0. Published by the author: L.H. Bailey Hortorium, Cornell University, Ithaca, New York. [ Links ]
55. OLSEN, D.M. & E. DINERSTEIN. 1998. The global 200: a representation approach to conserving the earth's most biologically valuable ecoregions. Conserv. Biol. 12: 502-515. [ Links ]
56. PAGANUCCI DE QUEIROS, L. 2006. The Brazilian Caatinga: Phytogeographical Patterns Inferred from Distribution Data of the Leguminosae. In: PENNINGTON, T. (ed.), Neotropical Savannas and Dry Forests: Diversity, Biogeography, and Conservation, pp. 113-150. CRC Press, Florida. [ Links ]
57. PENNINGTON, R. T, L. MATT, D. E. PRADO, C. A. PENDRY, S. K. PELL & C. A. BUTTERWORTH. 2004. Historical climate change and speciation: neotropical seasonally dry forest plants show patterns of both Tertiary and Quaternary diversification. Philos., Trans., Ser. B 359 (1443): 515-537. [ Links ]
58. PLATNICK, N. I. 1991. On areas of endemism. Austral. Syst. Bot. 4: 11-12. [ Links ]
59. POSADAS, P & D. R. MIRANDA-ESQUIVEL. 1999. El PAE (parsimony analysis of endemicity) como una herramienta en la evaluación de la biodiversidad. Revista Chil. Hist. Nat. 72: 539-546. [ Links ]
60. POSADAS, P., CRISCI, J. V. & L. KATINAS. 2011. Spatial methodologies in historical biogeography of islands. In: BRAMWELL, D. & J. CAUJAPÉ-CASTELLS (eds.) The Biology of Island Floras, pp. 37-56. Cambridge University Press, Cambridge. [ Links ]
61. PRADO, D. E. 1991. A critical evaluation of the floristic links between chaco and caatingas vegetation in South America. PhD Thesis. University of St. Andrews, Scotland. [ Links ]
62. PROTHERO, D. R. & R. J. EMRY. 1996. The terrestrial Eocene-Oligocene transition in North America. 1st ed. Cambridge University Press, Cambridge. [ Links ]
63. QUIJANO-ABRIL, M. A., CALLEJAS-POSADA, R. & D. R. MIRANDA-ESQUIVEL. 2006. Areas of endemism and distribution patterns for Neotropical Piper species (Piperaceae). J. Biogeogr. 33: 1266-1278. [ Links ]
64. RADLKOFER, L. 1931-1934. Sapindaceae. In: ENGLER A (ed.), Das Pfanzenreich IV, 165 (Heft 98a-h), pp. 1-1539. Verlag von Wilhelm Engelmann, Leipzig. [ Links ]
65. RAPOPORT, E. H. 1968. Algunos problemas biogeográficos del Nuevo mundo con especial referencia a la región Neotropical. In: DELAMARE DEBOUTTEVILLE, S.C. & E.H. RAPOPORT (eds.), Biologie de l' Amerique Australe, pp. 54-110. CNRS, Paris. [ Links ]
66. RATTER, J. A., J. F., RIBERO & S., BRIDGEWATER. 1997. The Brazilian Cerrado vegetation threats to its biodiversity. Ann. Bot. 80: 223-230. [ Links ]
67. RATTER, J. A., S., BRIDGEWATER & F., RIBERO. 2006. Biodiversity patterns of the woody vegetation of the Brazilian Cerrado. In: PENNINGTON, T. (ed.), Neotropical Savannas and Dry Forests: Diversity, Biogeography, and Conservation, pp. 113-150. CRC Press, Florida. [ Links ]
68. REDDISH, P. 1996. Spirit of the Jaguar: the Natural History and Ancient Civilizations of the Caribbean and Central America. BBC Books, London. [ Links ]
69. ROSEN, B. R. 1988. From Fossils to earth history. Applied historical biogeography. In: Myers, A. A. & P. S. Giller (eds.), Analytical biogeography: an integrated approach to the study of animal and plant distributions, pp. 437-481. Chapman & Hall, London and New York. [ Links ]
70. SARMIENTO, G. 1983. The savannas of tropical America. In: Bourlière, F. (ed.), Ecosystems of the world: Tropical Savannas, pp. 245-288. Elsevier, Amsterdam. [ Links ]
71. SIMON, M. F., R. GRETHER, L. P. de QUEIROZ, C. SKEMA & R. T. PENNINGTON. 2009. Recent assembly of the Cerrado, a neotropical plant diversity hotspot, by in situ evolution of adaptation to fre. Proc. Natl. Acad. Sci. USA 106 (48): 20359-20364. [ Links ]
72. SIMPSON, B. B. 1997. Reply of B.B. Simpson. Trends Ecol. Evol. 12: 319. [ Links ]
73. SPICHIGER, R., BISE, B., CALENGE, C. & C. CHATELAIN. 2006. Biogeography of the Forests of the Paraguay-Paraná Basin. In: PENNINGTON, T. (ed.), Neotropical Savannas and Dry Forests: Diversity, Biogeography, and Conservation, pp. 185-203. CRC Press, Florida. [ Links ]
74. STEHMANN, J. R., CAMPOSTRINI FORZZA, R., SALINO, A., SOBRAL, M., PINHEIRO DA COSTA, D. & L.H. YOSHINO KAMINO. 2009. Plantas da Floresta Atlântica. Jardim Botânico do Rio de Janeiro, Rio de Janeiro. [ Links ]
75. SZUMIK, C. A., CUEZZO, F., GOLOBOFF, P. A. & A. E. CHALUP. 2002. An optimally criterion to determine areas of endemism. Syst. Biol. 51: 806-816. [ Links ]
76. van der HAM, R. W. J. M. 1990. Nephelieae pollen (Sapindaceae): form, function and, evolution. Leiden Botanical Series 13: 1-225. [ Links ]
77. van der HAM, R. W. J. M. & A. TOMLIK.1994. Serjania pollen and the origin of the tribe Paullinieae. Rev. Paleobot. Palynol. 83: 43-53. [ Links ]
78. VIEIRA ZANELLA, F. C. 2011. Evoluçâo da biota diagonal de formaçôes abertas secas da America do Sul. In: CARVALHO, C. J. B & E. A. B. ALMEIDA (eds.), Biogeografia da América do Sul: Padrôes & Processos, pp. 198-221. Editora Roca LTDA, Sao Paulo. [ Links ]
79. WIENS, J. J. & M. J. DONOGHUE. 2004. Historical biogeography, ecology and species richness. Trends Ecol. Evol. 19: 639-644. [ Links ]
80. WILLIAMS, E. E. 1989. Old problems and new opportunities in West Indian Biogeography. In C. A. WOODS (ed.), Biogeography of West Indies: Past, Present, and Future, pp. 1-46. Sandhill Crane Press, Gainesville. [ Links ]
81. WOOD, J. R. I. 2006. Inter-Andean Dry Valleys of Bolivia-Floristic Affinities and Patterns of Endemism: Insights from Acanthaceae, Asclepiadaceae and Labiatae. In: PENNINGTON, T. (ed.), Neotropical Savannas and Dry Forests: Diversity, Biogeography, and Conservation, pp. 113-150. CRC Press, Florida. [ Links ]
82. ZUNINO, M. & A. ZULLINI. 2003. Biogeografía: la dimensión espacial de la evolución. Fondo de Cultura Económica, México, D. F. [ Links ]
Recibido el 01 de Junio de 2011
Aceptado el 06 de diciembre de 2011.














