Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Boletín de la Sociedad Argentina de Botánica
versión On-line ISSN 1851-2372
Bol. Soc. Argent. Bot. vol.47 no.3-4 Córdoba jul./dic. 2012
MICOLOGÍA
Ascomicetes sobre palmeras nativas de la Argentina. II. Anamorfos
Mariana Capdet1 y Andrea Irene Romero1
1 PROPLAME-PRHIDEB-CONICET, Depto. Biodiversidad y Biología Experimental, Facultad de Ciencias Exactas y Naturales, Universidad de Buenos Aires, Av. Int. Güiraldes 2620, Buenos Aires C1428EHA, Argentina. marianacapdet@gmail.com
Resumen: En este trabajo se registran por primera vez para Argentina ocho anamorfos de Ascomicetes provenientes de partes leñosas caídas de tres especies de palmeras nativas en dos Parques Nacionales. Todos ellos se citan por primera vez para el país y algunos de ellos también sobre estos sustratos. Los anamorfos mencionados son: Endocalyx cinctus, Gliomastix luzulae, Virgaria nigra; Gliomastix novae-zelandiae, Helicoma dennisii, Helicomyces colligatus, Spinulospora pucciniiphila y Vanakripa fascista. Las últimas cinco especies además se citan por primera vez sobre este sustrato.
Palabras clave: Hifomicetes; Taxonomía fúngica; Palmeras nativas; Argentina.
Summary: Ascomycetes on native palms from Argentina. II. Anamorphs. Eight new records of Ascomycetes anamorphs from Argentina are cited from woody fallen parts of three native palm trees in two National Parks. All of them are listed for the first for the country and some of them on these substrates too. The anamorphs mentioned are: Endocalyx cinctus, Gliomastix luzulae, Virgaria nigra; Gliomastix novae-zelandiae, Helicoma dennisii, Helicomyces colligatus, Spinulospora pucciniiphila and Vanakripa fascista. The last five species are first recorded on this substrate.
Key words: Hiphomycetes; Fungal taxonomy; Native palm; Argentina.
INTRODUCCIÓN
Este trabajo es una continuación del estudio de Ascomicetes sobre tres especies de palmeras nativas de la República Argentina (Butia yatay (Mart.) Becc., Euterpe edulis Mart. y Syagrus romanzoffiana (Cham.) Glassman) comenzado en el año 2008 (Capdet & Romero, 2010; Capdet et al., 2010).
Con el objetivo de contribuir al conocimiento de la biodiversidad de este grupo fúngico en la Argentina, en esta oportunidad, se describen e ilustran especies en estado anamórfico que se registran por primera vez para nuestro país, sobre las diferentes palmeras nativas estudiadas.
MATERIALES Y MÉTODOS
Las áreas de estudio fueron: el Parque Nacional Iguazú y el Parque Nacional el Palmar.
El Parque Nacional Iguazú, se encuentra en la Provincia de Misiones, comprende un área de 67,620 hectáreas (25º41' S, 54º18' W) (APN, 2008). El clima es subtropical, sin estación seca. La vegetación es subtropical y comprende uno de los sitios de mayor diversidad del país (Dirección de Bosques de la Argentina, 2003). En esta área se estudiaron dos especies de palmera: Euterpe edulis, comúnmente llamada "Palmito" y Syagrus romanzoffiana, denominada "Pindó".
El Parque Nacional El Palmar, se encuentra en la Provincia de Entre Ríos, alcanzando un área de 850 hectáreas (31º55'S, 58º14' W) (APN, 2008). El clima es cálido y húmedo hacia el norte, mientras que hacia el este y sur el clima es templado y seco (Dirección de Bosques de la Argentina, 2003). La vegetación incluye sabanas con palmeras, arbustos, pastizales y una selva en galería a lo largo del río Uruguay. La palmera estudiada fue Butia yatay, la única especie presente en el parque.
Se realizaron muestreos estacionales durante el año 2008, con un total de 825 muestras. Se recogieron partes leñosas caídas como por ejemplo: pecíolos, raquis floral, foliar y espata. El material fue secado y posteriormente se realizaron observaciones de los caracteres microscópicos utilizando un microscopio de luz clara. Las medidas microscópicas de todas las estructuras se basaron en 20 mediciones según metodología detallada por Capdet & Romero, (2010). Algunos especímenes se estudiaron con microscopio electrónico de barrido (MEB) para la observación de ornamentación de estructuras.
Se agrega información de las especies registradas sobre otras palmeras.
Los ejemplares se depositaron en la colección de Hongos BAFC (Holmgren et al. 1990).
RESULTADOS
Endocalyx cinctus Petch, Ann. Bot. Lond. 22: 394 (1908). Tipo: Sri Lanka, Peradaniya, 1905, T. Petch 2785, sobre Oncosperma sp. (Holotypus K (M) 174129). Fig. 1: A-C.
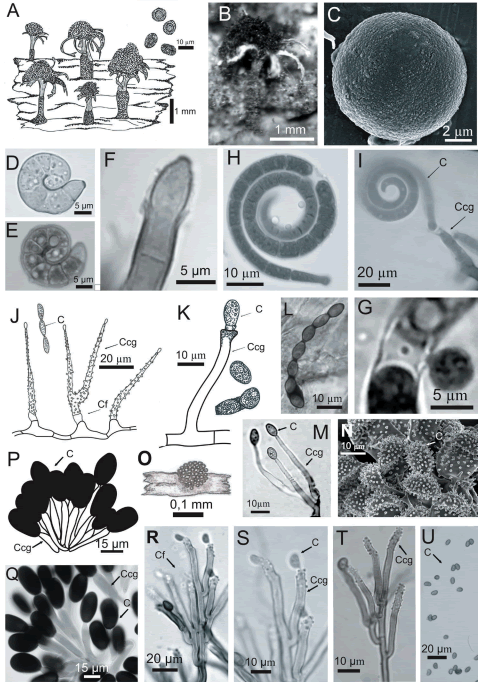
Fig. 1. Endocalyx cinctus. A: Aspecto general. B: Conidioma. C: Conidio. Helicoma dennisii. D y E: Conidios. F: Célula conidiógena. Helicomyces colligatus. G: Conidio secundario. H: Conidio. I: Conidios y célula conidiógena. Gliomastix luzulae. J: Conidióforos, célula conidiógena y conidios. Gliomastix novaezelandiae. K y M: Conidios y célula conidiógena. L: Cadena de conidios. Spinulospora pucciniiphila. N: Conidios (en MEB). Vanakripa fasciata. O: Aspecto general. P y Q: Conidios y célula conidiógena. Virgaria nigra. R: Conidióforo. S: Conidios y célula conidiógena. T: Detalle de la célula conidiógena denticulada. U: Conidios. Abreviaturas: Cf: Conidióforo. Ccg: Célula conidiógena. C: Conidio.
Teleomorfo: Desconocido.
Anamorfo: Conidiomas aislados, erectos, constan de dos partes: (1) la parte inferior cubre la columna central, cilíndrica, pared rugosa, negra, carbonosa, 0,5-0,6 x 0,1-0,14 mm. (2) la parte superior, sinematosa, se expande en forma de cáliz, verde amarilla, 0,2-0,3 x 0,06-0,1 mm. Conidióforos delgados como hilos, hialinos en la base y castaños en el ápice, con o sin protuberancias diminutas, septados, 1-1,5 µm ancho. Conidios solitarios, unicelulares, globosos u ovales, aplanados en vista ecuatorial, castaños claros cuando jóvenes a oscuros al madurar, gutulados, verrugosos, en vista lateral 10-12 (-13) x 6-7 µm, con surco germinativo hialino.
Sustrato: Pecíolo de Syagrus romanzoffiana.
Material examinado: ARGENTINA. Prov. Misiones, Dpto. Iguazú: Parque Nacional Iguazú, Sendero Macuco (25º 40 41.1" S, 54º 26 56.3"O), 25-IV-2011, Capdet, M & Romero, A.I. (BAFC 51922).
Distribución geográfica: Japón (Okada & Tubaki, 1984), China (Farr & Rossman, 2012), Sri Lanka (Mycobank).
Comentarios: El género Endocalyx Berk. & Br. incluía dos especies E. thwaiitesii Berk. & Br. y E. psilostoma Berk. & Br., más tarde Petch amplió su descripción y realizó la transferencia de Melanconium melanoxanthum Berk. & Br. a Endocalyx y llegó a la conclusión que las especies de éste género presentadas por Berkeley & Broome, en realidad eran la misma especie, designando a E. thwaiitesii como especie tipo (Okada & Tubaki, 1984). Es un género muy común en palmeras y seguramente posee una distribución pantropical.
El material fue identificado utilizando la clave provista por Okada & Tubaki (1984). La descripción coincide con la realizada por Okada & Tubaki op cit. en la mayoría de la características descriptas, la diferencia más notoria es el tamaño de los conidiomas (hasta 2 mm vs 0,9 mm), pero en la muestra observada no se encontraron muchos conidiomas enteros.
Registros sobre otras palmeras: Oncosperma fasciculatum Thwaites, Phoenix canariensis Hort. ex Chabaud, Trachycarpus fortunei (Hook.) H.Wendl. (Okada & Tubaki, 1984). Phoenix loureiroi var. loureiroi Kunth, Livistona chinensis R.Br. var. boninensis Becc. (Farr & Rossman, 2012).
Gliomastix luzulae (Fuckel) E.W. Mason ex S. Hughes. Can. J. Bot. 36: 769.1958. Tipo: Alemania. Dornbahsgraben, Nassau, 1894, Fckl. 005358, sobre hojas Luzula maxima (Holotypus G).
≡Torula luzulae Fuckel, Jb. nassau. Ver. Naturk. 23-24: 348.1870. Fig. 1: J.
Teleomorfo: Bionectriaceae (Summerbell, 2011).
Anamorfo: Colonias efusas, extensas, verde grisáceas, Micelio inmerso y superficial, liso, tabicado, hialino o subhialino. Células conidiógenas sobre ramas cortas con 1 o 2 células, 5-9 x 3-4 µm, derechas o levemente curvadas, hialinas, subuladas, agrupadas, rugosas, 20-53 x 3-4 µm. Conidios formando cadenas, fusiformes con la base truncada, subhialinas a castañas oscuras, lisas, 5-7 x 2-3 µm.
Sustrato: Vaina de Euterpe edulis.
Material examinado: ARGENTINA. Prov. Misiones, Dpto. Iguazú: Parque Nacional Iguazú, El Palmital del Cruce (25º 41 24.4"S, 54º 28 43.2"O), 26. IV. 2011, Capdet, M. & Romero, A.I. (BAFC 51950).
Distribución geográfica: Alemania, Bélgica, Inglaterra, Italia, Ghana, Nueva Zelanda, Sierra Leona (Dickinson, 1968), Japón (Matsushima, T. 1993), Surinam (Gams, 1975), Borneo, República Togolesa (Domsch et al., 1980).
Comentarios: La presente combinación es correctamente atribuible a Hughes (1958), ya que la combinación realizada por Mason en el 1953, de acuerdo con Dickinson (1968) es un "nomen non rite publicatum" = nombre no debidamente publicado.
Nuestro material coincide con la descripción dada por Hughes & Dickinson (1968) y Dickinson (1968).
Registros sobre otras palmeras: Rhopalostylis sapida (Endl.) H. Wendl. & Drude (Hughes & Dickinson, 1968), Elaeis guineensis (Gams, 1975).
Gliomastix novae-zelandiae S. Hughes & C.H. Dickinson, N.Z. Jl. Bot. 6: 108.1968. Tipo: Nueva Zelanda. Auckland, Mamaku, 22.III.1963, PDD 25762 (Holotypus DAOM 86181e). Fig. 1: K-M.
Teleomorfo: Bionectriaceae (Summerbell et al., 2011).
Anamorfo: Colonias efusas, verde oliva a negras. Células conidiógenas castaño claro con depósitos de melanina a los costados del collarete, 3-4 µm de ancho, hasta 40 µm de alto. Conidios forman cadenas y a menudo presentan una conectividad oscura con los conidios adyacentes, elipsoidales o subesféricos, redondeados en el ápice y truncados en la base, castaño claro a verde oliváceo, lisas, 7-9 x 4-5 µm.
Sustrato: Vaina de Euterpe edulis.
Material examinado: ARGENTINA. Prov. Misiones, Dpto. Iguazú: Parque Nacional Iguazú, El Palmital del Cruce (25º 41 24.4"S, 54º 28 43.2"O), 26-IV-2011, Capdet, M & Romero, A.I. (BAFC 52008).
Distribución geográfica: Nueva Zelanda (Hughes & Dickinson, 1968); Pakistán (Abbas et al., 2010).
Comentarios: El género Gliomastix Guég. fue propuesto para una sola especie Torula chartarum Corda (Hughes & Dickinson, 1968). Más tarde, Gams (1971) considera a Gliomastix como una sección dentro del género Acremonium, sin embargo, Hammill (1981) considera que no hay razones suficientes para eliminar la legitimidad de este género.
Recientemente Summerbell et al. (2011) ha realizado estudios filogenéticos con cepas del género Acremonium relacionados con el orden Hypocreales. Las relaciones hipotetizadas en uno de los cladogramas muestra el agrupamiento de especies del género Gliomastix, formando un clado con buen soporte, dentro del gran clado Gliomastix/Bionectria (Summerbell et al., 2011). Anteriormente Lechat et al. (2010) habían demostrado la relación entre Gliomastix fusigera e Hydrophisphaerea bambusicola (Bionectriaceae).
Nuestro material coincide con la descripción de G. novae-zelandiae Hughes & Dickinson (1968), pero las células conidiógenas descriptas por estos autores presentar un collarete cupulado castaño oscuro o negro, en cambio nuestro material, presenta depósitos de melanina, pero no de una manera muy evidente. Otra de las diferencias de nuestro material, es que los conidios presentan la conectividad engrosada, a diferencia de la descripta por Hughes & Dickinson op cit. Hasta el momento no se había registrado esta especie sobre palmera.
Helicoma dennisii M.B. Ellis, Mycol. Pap. 87: 23 (1963). Tipo: Venezuela. La Silla, Los Palos Grandes, Edo. Miranda. 13-VII-1958, R.W.G. Dennis (Holotypus IMI 74792a). Fig. 1: D-F.
Teleomorfo: Desconocido.
Anamorfo: Colonias con aspecto de gamuza, castañas oliváceas. Micelio arcialmente superfcial a inmerso, hifas ramifcadas, septadas, castañas.
Conodióforos solitarios o en densos fascículos, simples o raramente ramificados, rectos o flexuosos, septados, castaños, hasta 400 μm x 5-9 μm. Células conidiógenas mono a polidenticuladas, castaño pálidas. Conidios acropleurógenos, lisos, castaños claros, gutulados, de 1 ¼- 1 ½ vueltas, 4-8 septos, 19-24 μm, ápice redondeado, base cónica truncada, con una cicatriz oscura.
Sustrato: Pecíolo de Syagrus romanzoffiana.
Material examinado: ARGENTINA. Prov. Misiones, Dpto. Iguazú: Parque Nacional Iguazú, Sendero Macuco (25º 40 41.1" S, 54º 26 56.3"O), 17.VI.2009, (BAFC 52006), Capdet & Romero, A.I. Prov. Entre Ríos, Dpto. Colón, Parque Nacional El Palmar, Sendero Yatay (31° 53 12.9" S, 58° 14 28" O), 15.IV.2009, Capdet, M & Romero, A.I. (BAFC 52007).
Distribución geográfica: China, Japón, Nueva Guinea, Taiwán, Estados Unidos (Zhao et al., 2007), Venezuela (Ellis, 1963).
Comentarios: Nuestro material fue identificado utilizando la clave publicada por Zhao et al. (2007) y la descripción coincide con la realizada por Ellis (1963). Las medidas de los conidios dadas por los autores antes mencionados difieren mucho, para Zhao (op. cit.), para quién las medidas son de 10-15 μm, mientras que para Ellis (1963) miden 19-22 μm, siendo esta última más cercana al tamaño de los conidios de nuestro material. Este es el primer registro de esta especie sobre palmeras.
Helicomyces colligatus R. T. Moore, Mycologia 46:89.1954. Tipo: EEUU. Ciudad de Iowa, Iowa, 14-IV-1934, GWM1357 (Holotypus SUI). Fig. 1: G-I.
Teleomorfo: Desconocido.
Anamorfo: Colonias efusas, aracnoides, compactas, rosa pálido cuando el material está fresco pero es blanca bajo lupa. Micelio principalmente superficial, parcialmente inmerso, ramificado, hialino, septado. Conidióforos semi macronematosos, mononematoso, sin septos o 1-2 septos, corto, 10-15 de largo, 3-5 µm de ancho Células conidiógenas mono o poliblásticas, terminales, proliferación cortamente simpodial, con dientes inconspicuos. Conidios holoblásticos, acrógenos, multiseptados, quebradizos, (27) 32-46µm diám., naciendo excéntricamente. Filamento conidial espiralado de 2 ½ a 3 vueltas, afinándose hacia ambos extremos, 4-7 µm diám., cada célula contiene una gran vacuola. Conidios secundarios globosos, pequeños 4-5 µm diám., originándose por brotación del margen interno del filamento, 1-2 por filamento, hialinos.
Material examinado: ARGENTINA. Prov. Misiones, Dpto. Iguazú: Parque Nacional Iguazú, Sendero Macuco (25º 40 41.1" S, 54º 26 56.3"O), 15.X.2008, Capdet & Romero, A.I., (BAFC 52014); idem, 28/07/2008, (BAFC 52011). Prov. Entre Ríos, Dpto. Colón, Parque Nacional El Palmar, Sendero Yatay (31° 53 12.9" S, 58° 14 28" O), 15.IV.2009, Capdet, M & Romero, A.I., (BAFC 52013); idem (BAFC 52016).
Sustrato: Base foliar y espata de Butia yatay.
Distribución geográfica: India, China, USA Venezuela.
Comentarios: Esta descripción coincide con la descripción de Moore (1954), Goos (1985) y Zhao et al. (2007). Una de las diferencias notables con respecto a dichas descripciones es el tamaño de los conidios. En el material entrerriano la medida es de 32-46 µm diám., difiriendo con las medidas registradas por Moore (32-) 50-65 µm; Goos 25-65 µm y Zhao 30-55 µm. Al mismo tiempo Moore y Goos dan una medida del filamento ligeramente más grueso (8 µm), mientras que Zhao da una medida semejante al de nuestro material (3.5-6 µm).
H. colligatus se asemeja a H. roseus y H. torquatus, pero difiere del primero porque H. roseus posee un filamento de menor grosor (2.5-6 µm) y sus conidios tienen un rango más amplio de medida (25-60 µm). En cambio H. torquatus posee un conidio de mayor diámetro (50-130 µm), según las medidas dadas por Zhao (op cit.).
Con respecto a los conidios secundarios Zhao (op. cit.) los describe para otra especie H. torquatus, si bien ninguno de los autores mencionados los describe para H. colligatus, Goos (op. cit.) sólo lo ilustra en la figura 2 (:609), pero no describe. Este es el primer registro de esta especie sobre palmeras.
Spinulospora pucciniiphila Deighton, Trans. Br. Mycol. Soc. 61(1): 195.1973. Tipo: Sierra Leona, Bundulai, Loko Masama, 26.XI.1951, en hojas de Smilax krussianae Meisn., junto con Puccinia krussianae Cooke y con Scolocobasidium acanthacearum (Cooke) MB Ellis; F.C.Deoghton M 4815 pro parte (Holotypus IMI 48655c). Fig. 1: N.
Teleomorfo: Desconocido.
Anamorfo: Micelio evanescente. Esporodoquios ampliamente dispersos sobre la superficie, parcialmente agregados, 60–120 µm, amarillo a anaranjado pálido, compuesto por hifas hialinas, constreñidas en el septo, 10-20 x 8-14 µm, divergentes de la base, cada célula terminal da origen a un conidio. Conidios claviformes a cilíndricos, hialinos, ápice redondeado, 13-25 x 7-13 µm, densamente espinosos disminuyendo la ornamentación hacia la base; espinas 0,5-1 µm long.
Sustrato: Raquis floral de Syagrus romanzoffana.
Material examinado: ARGENTINA. Prov. Misiones, Dpto. Iguazú: Parque Nacional Iguazú, Salto Arrechea (25º 40 06.66" S, 54º 26 49.84"O), 28. Vii. 2008, Capdet, M & Romero, A.I. (BAFC 51850).
Distribución geográfica: Sierra Leona (Deighton, 1973).
Comentarios: Este género y especie fue descripto por primera vez por Deighton (1973), sobre hojas de Smilax kraussianae Meisn., y sobre los soros de Puccinia kraussiana Cooke (Deighton op. cit.). En Cuba se ha registrado al género, sobre Nectandra coriacea Griseb. pero no se determinó la especie (Robigalia de la trufa cibernética). Nuestro registro sería el segundo de esta especie a nivel mundial y el primero sobre palmera.
Vanakripa fasciata R.F. Castañeda, M. Stadler & Decock Mycotaxon 91: 343. 2005. Tipo: Cuba. Pinar del Río, Soroa, 20.XI.2002, Sarregui (Holotypus MUCL 45276. Isotypus INIFAT C 01/70-3). Fig. 1: O-Q.
Teleomorfo: Desconocido.
Anamorfo: Colonias formadas por esporodoquios punctiforme, negros, brillantes, dispersos y discretos, 0,1- 0,26 mm diám. Micelio superficial e inmerso en el sustrato, hialino, septado, ramificado. Conodióforos indiferenciados, mononematoso, hialinos y lisos. Células conidiógenas holoblásticas, hialinas, obipiriformes, clavada, a menudo curvados, angostos en la base, truncadas después de la secesión conidial. Conidios clavados a obipiriformes, redondeados en un extremo, truncados en la base, castaño oscuro, lisos, 22–27 x 13-18 μm.
Sustrato: Raquis foliar de Syagrus romanzoffiana.
Material examinado: ARGENTINA. Prov. Misiones, Dpto. Iguazú: Parque Nacional Iguazú, Sendero Macuco (25º 40 41.1" S, 54º 26 56.3"O), 17.VI.2009, Capdet, M. & Romero, A.I. (BAFC 51962).
Distribución geográfica: Cuba (Castañeda Ruiz et al., 2005).
Comentarios: El género Vanakripa Bhat, W.B. Kendr. & Nag Raj, actualmente está integrado por siete especies, siendo la especie tipo V. gigaspora (Index Fungorum, 2012). En la descripción original del género se interpretó a la célula claviforme que se encuentra en la parte inferior de los conidios libres, como la célula conidiógena. Posteriormente otros autores denominaron a la misma como "célula separadora" (Tsui et al., 2003; Pinnoi et al., 2003; Castañeda Ruiz et al., 2005; Arias Mota et al., 2008) considerando que para interpretar la ontogenia conidial hay que realizar más estudios. Para la presente descripción de esta especie seguimos a de Bhat & Kendrick (1993), que la interpretan como célula conidiógena.
La célula conidiógena adherida al conidio o "célula separadora" se observa en otras especies como en Berkleasmiun corticola y se cree que su función podría ser para la dispersión y flotación de los conidios, debido a que estas especies son frecuentemente hallados en hábitats acuáticos (Tsui et al., 2003). Este es el primer registro de esta especie sobre palmeras.
Virgaria nigra (Link) Nees, Nat. Arr. Brit. Pl. (London) 1: 553.1817. Tipo: (Holotypus L).
≡Botrytis nigra Link, Mag. Gesell. naturf. Freunde, Berlin 3(1-2): 14 (1809). Fig. 1: R-U.
Teleomorfo: Desconocido.
Anamorfo: Colonias efusas, aterciopeladas, castaña a verde olivácea. Micelio parcialmente inmerso en el sustrato, castaño, hifas ramifcadas. Conodióforos macronematoso, ramificado, fexuoso, septado, castaño oscuro a claro hacia los extremos, hasta 250 µm, 2-3 µm diám. Células conidiógenas poliblásticas, terminales, cilíndricas, integradas. Conidios solitarios, reniformes, castaños o verde oliváceo, lisos, sin septos, con 1 o 2 gutúlas, 4–5 × 3-4 μm.
Sustrato: Pecíolo de Syagrus romanzoffiana.
Material examinado: ARGENTINA. Prov. Misiones, Dpto. Iguazú: Parque Nacional Iguazú, Sendero Macuco (25º 40 41.1" S, 54º 26 56.3"O), 15.I.2009, Capdet, M. & Romero, A.I. (BAFC 51794).
Distribución geográfica: Sierra Leona, Zambia (Ellis, 1971); Japón (Matsushima, 1975); Nueva Zelanda (Hughes, 1978); México (Heredia et al., 1997; Arias Mota et al., 2008); Cuba (Delgado-Rodríguez et al., 2002); Grecia, Estados Unidos (Farr & Rossman, 2012).
Comentarios: El género Virgaria Nees, se encuentra integrado en la actualidad por 17 especies (Index Fungorum). V. nigra es una especie muy común encontrada en plantas herbáceas y leñosas y también ha sido aislada de suelo (Heredia et al., 1997). Las características de nuestros ejemplares coinciden con las observada por Ellis (1971); Matsushima (1975) y Heredia et al. (1997).
Registros sobre otras palmeras: Rhopalostylis sapida (Endl.) H. Wendl. & Drude (Hughes, 1978) Rhopalostylis sp. (McKenzie et al., 2004) y Roystonea regia (Delgado-Rodríguez et al., 2002).
CONCLUSIÓN
Como resultado de este estudio se incorporan a la micobiota argentina 8 especies de Ascomicetes anamórficos. A excepción de Helicomyces colligatus, que se registró en clima templado, el resto de las especies se encontraron en un clima subtropical como el que predomina en la provincia de Misiones. Con respecto a los sustratos se halló un mayor número de especies sobre Syagrus romanzoffiana, seguida por Euterpe edulis y Butia yatay. Helicoma dennisii, Helicomyces colligatus, Gliomastix novae-zelandiae, Spinulospora pucciniiphila y Vanakripa fasciata se registran por primera vez sobre palmeras. Se destaca el aporte brindado por la microscopia electrónica de barrido en la ornamentación de los conidios de Spinulospora pucciniiphila.
BIBLIOGRAFÍA
1. ABBAS, S. Q., T. IFTIKHAR, M. NIAZ & N. SADAF. 2010. New fungal records on eucalyptus spp. from district Faisalabad Pakistan. Pak. J. Bot., 42(5): 3317-3321. [ Links ]
2. APN (Administración de Parques Nacionales). 2008. Parque Nacional El Palmar. http://www.parquesnacionales.gov.ar/03_ap/11_palmar_PN/11_palmar_PN.htm. Parque Nacional Iguazú. http://www.parquesnacionales.gov.ar/03_ap/15_iguazu_PN/15_iguazu_PN.htm. [ Links ]
3. ARIAS MOTA, R.M., G. HEREDIA ABARCA, R.F. CASTANEDA RUIZ & C.I. BECERRA HERNANDEZ. 2008. Two new species of Polyschema and Vanakripa and other microfungi recorded from mangrove in Veracruz, Mexico. Mycotaxon 106: 29-40. [ Links ]
4. BHAT, D.J. & B. KENDRICK. 1993. Twenty-five new conidial fungi from the Western Ghats and the Andaman Islands (India). Mycotaxon 49: 19-90. [ Links ]
5. CAPDET, M., S. PEREIRA & A.I. ROMERO. 2010. Fungi from palms in Argentina. 1. Mycotaxon 112: 339-355. [ Links ]
6. CAPDET, M. & A.I. ROMERO. 2010. Coccostromopsis palmicola on Butia yatay from Argentina. Mycotaxon 114: 91-97. [ Links ]
7. CASTAÑEDA RUIZ, R.F., M. STADLER, M. SAIKAWA, T. ITURRIAGA, C. DECOCK & G. HEREDIA. 2005. Microfungi from submerged plant material: Zelotriadelphia amoena gen. et sp. nov. and Vanakripa fasciata sp.nov. Mycotaxon 91: 339-345. [ Links ]
8. DELGADO-RODRíGUEZ, G., J. MENA-PORTALES, M. CALDUCH, & C. DECOCK. 2002. Hyphomycetes (hongos mitosporicos) del area protegida mil cumbres, Cuba Occidental. Cryptog. Mycol. 23: 277-293. [ Links ]
9. DEIGHTON, F.C. 1973. Sclerographiopsis and Spinulospora, two new monotypic hyphomycetes genera from Sierra Leone. Trans. Br. Mycol. Soc. 61(1): 193-196. [ Links ]
10. DICKINSON, C.H. 1968. Gliomastix Guéguen. Mycological Papers 115: 24. [ Links ]
11. Secretaría de Ambiente y Desarrollo Sustentable. 2003. Atlas de los Bosques Nativos Argentinos. Dirección de Bosques, Secretaría de Ambiente y Desarrollo Sustentable, Buenos Aires. [ Links ]
12. DOMSCH, K.H, W. GAMS & T-H. ANDERSON. 1980. Compendium of soil fungi. 1. Academic Press, London. [ Links ]
13. ELLIS, M.B. 1963. Dematiaceous Hyphomycetes. IV. Mycologycal Papers 87: 1-42. [ Links ]
14. ELLIS, M.B. 1971. Dematiaceous hyphomycetes. Commonwealth Agricultural Bureaux: Farnham Royal, Slough. [ Links ]
15. FARR, D.F. & A.Y. ROSSMAN. 2012. Fungal Databases, Systematic Mycology and Microbiology Laboratory, ARS, USDA. http://nt.ars-grin.gov/fungaldatabases/. [ Links ]
16. GAMS, W. 1971. Cephalosporium- artige Schimmelpilze (Hyphomycetes). Ed. Gustav Fischer Verlag, Stuttgart [ Links ]
17. GAMS, W. 1975. Cephalosporium-Like Hyphomycetes: Some Tropical Species. Trans. Brit. Mycol. Soc. 64: 389-404. [ Links ]
18. GOOS, R.D. 1985. A rewiev of the anamorph genus Helicomyces. Mycologia, 77 (4):606-618. [ Links ]
19. HAMMILL, T. M. 1981. On Gliomastix murorum and G. felina. Mycologia 73 (2): 229-237. [ Links ]
20. HEREDIA, G., J. MENA-PORTALES & A. MERCADO-SIERRA. 1997. Hyphomycetes saprobios tropicales. Nuevos registros de Dematiáceos para México. Revista Mex. Micol. 13: 41-51. [ Links ]
21. HOLMGREN, P.K., N.H. HOLMGREN & L.C. BARNETT. 1990. Index Herbariorum. Part I: The Herbaria of the world. New York Botanical Garden, New York. [ Links ]
22. HUGHES, S.J. 1958. Revisiones Hyphomycetum aliquot cum apéndice de nominibus rejiciendis. Can. Jl. Bot. 36 (6): 728-836. [ Links ]
23. HUGHES, S.J. & C.H. DICKINSON. 1968. New Zealand Fungi. 11. Gliomastix Gueguen. N. Z. Jl. Bot. 6: 106-114. [ Links ]
24. Index Fungorum. 2012. http://www.indexfungorum.org/. [ Links ]
25. LECHAT, C.; D. F. FARR, Y. HIROOKA, A. M. MINNIS & A.Y. ROSSMAN. 2010. A new species of Hydropisphaera, H. bambusicola,is the sexual state of Gliomastix fusilera. Mycotaxon (111): 95-102. [ Links ]
26. MATSUSHIMA, T. 1975. Icones microfungia Matsushima Lectorum. Publicado por el autor, Kobe. [ Links ]
27. MATSUSHIMA, T. 1993. Matsushima Mycological Memoirs No. 7. Matsushima Fungus Collection, Kobe. [ Links ]
28. MCKENZIE, E.H.C., P.K. BUCHANAN & P.R. JOHNSTON. 2004. Checklist of fungi on nikau palm (Rhopalostylis sapida and R. baueri var. chessemanii). New Zealand. N. Z. Jl. Bot. 42: 335-355. [ Links ]
29. MOORE, R.T. 1954. Three new species of Heliscosporae. Mycologia 46: 89-92. [ Links ]
30. OKADA, G. & K. TUBAKI. 1984. A new species and a new variety of Endocalyx (Deuteromycotina) from Japan. Mycologia 76: 300-313. [ Links ]
31. Mycobank. 2012. Fungal Database Nomenclature and Species Banks Online Taxonomic Novelites Submission. Administrado por la International Micological Associaton. http://www.mycobank.org/. [ Links ]
32. PINNOI, A., E.H.C. MCKENZIE, E.B.G. JONES & K.D. HYDE. 2003. Palm fungi from Thailand: Custingophora undulatistipes sp. nov. and Vanakripa minutiellipsoidea sp. nov. Nova Hedwigia 77 (1-2): 213-219. [ Links ]
33. Robigalia de la Trufa Cibernética, Observaciones de Hongos y sus Organismos Asociados. 2012. www.cybertruffe.org.uk/robigalia/esp. [ Links ]
34. SUMMERBELL, R.C., C. GUEIDAN, H-J. SCHROERS, G.S. DE HOOG, M. STARINK, Y. AROCHA ROSETE, J. GUARRO, J. & J.A. SCOTT. 2011. Acremonium phylogenetic overview and revision of Gliomastix, Sarocladium, and Trichothecium. Studies in Mycology 68: 139–162. [ Links ]
35. TSUI, K.M., T.K. GOH & K.D. HYDE. 2003. Reflections on the genus Vanakripa, and a description of V. ellipsoidea sp. nov. Mycologia 95(1): 124-127. [ Links ]
36. ZHAO, G.Z., X.Z. LIU & W.P. WU. 2007. Helicosporous hyphomycetes from China. Fungal Diversity 26: 313-524. [ Links ]
Recibido el 14 de febrero de 2012
Aceptado el 11 de junio de 2012.














