Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Boletín de la Sociedad Argentina de Botánica
versión On-line ISSN 1851-2372
Bol. Soc. Argent. Bot. vol.48 no.1 Córdoba ene./mayo 2013
MICOLOGÍA
Hongos asociados con dos poblaciones de Acromyrmex lobicornis (Formicidae) de San Luis, Argentina
Mónica A. Lugo1, Esteban M. Crespo2, Matías Cafaro3 y Laura Jofre2
1 Diversidad Vegetal I, IMIBIO-CONICET, FQByF, UNSL.
2 Diversidad Vegetal I, FQByF, UNSL.
3 Departamento de Biología, Universidad de Puerto Rico - Mayaguez, PR 00681 E-mail: lugo@unsl.edu.ar
Resumen: Los géneros Atta y Acromyrmex comprenden a las hormigas cortadoras o podadoras de hojas de la tribu Attini, único grupo de hormigas que presenta una dependencia obligada con simbiontes fúngicos como fuente de alimento. Los fragmentos de plantas recolectados por estas hormigas son utilizados para cultivar al simbionte fúngico, el que origina gongilidios de los cuales se alimentan las larvas y la reina de la colonia. El objetivo de este trabajo fue aislar y caracterizar genómica y taxonómicamente los hongos cultivados por dos poblaciones de Acromyrmex lobicornis de la provincia de San Luis. Para ello, se recolectaron muestras del simbionte de las cámaras de cultivo más superficiales de los nidos y se cultivaron en los medios de extracto de malta (EM) y agar papa dextrosa (APD). El simbionte fúngico se identificó como Leucoagaricus gongylophorus (Möller) Singer (Holobasidiomycetes, Agaricales) por sus características morfo-anatómicas en cultivo, las secuencias del gen 5.8S ribosomal y de los espaciadores ITS1 e ITS2. El diámetro de las colonias de los simbiontes fúngicos aislados fue mayor en EM; además, mostraron crecimiento diferencial entre las poblaciones de hormigas de las que fueron aislados. Se discuten posibles implicancias nutricionales y aspectos relacionados con la distribución de los simbiontes aislados.
Palabras clave: Acromyrmex lobicornis; Centro de Argentina; Hormigas podadoras; Leucoagaricus gongylophorus; Simbionte fúngicos de hormigas.
Summary: Fungi associated with two populations of Acromyrmex lobicornis (Formicidae) from San Luis, Argentina. The ant genera Atta and Acromyrmex (Tribe Attini) include the mowers or trimmers of leaves called leaf-cutting ants, which are the only ants that show an obligate dependence of fungal symbionts as a food source. Fragments of plants collected by these ants are used to grow the fungal symbionts, which produce gongylidia for the larvae and queen of the colony to feed on. The aim of this study was to isolate and characterize both, genetically and taxonomically the fungi cultured by two populations of Acromyrmex lobicornis from San Luis province. Samples were collected from the most superficial chambers of the nests and fungal isolates were cultured in malt extract (ME) and potato dextrose agar (PDA) media. The fungal symbiont associated to A. lobicornis nests was identified as Leucoagaricus gongylophorus (Möller) Singer (Holobasidiomycetes, Agaricales) through its morpho-anatomic characteristics and sequencing of ITS1, ITS2 and 5.8S ribosomal gene. Fungal growth in ME was higher than in PDA, and symbiont isolates showed differential growth rates depending on ant populations from where they originated. Fungal symbiont nutritional features and distributional aspects are discussed.
Key words: Acromyrmex lobicornis; Central Argentina; Fungal symbiont; Leaf-cutter ants; Leucoagaricus gongylophorus.
Introducción
Los géneros Atta y Acromyrmex comprenden a las hormigas cortadoras o podadoras de hojas, las que se agrupan en la tribu Attini (Hymenoptera, Formicidae), de distribución neártica y neotropical (Cherrett et al., 1989). Estas hormigas son las únicas que muestran una dependencia obligada con simbiontes fúngicos como fuente de alimento (Currie, 2001).
Desde un punto de vista ecológico, la simbiosis entre las hormigas cortadoras de hojas y los hongos que cultivan sería de tipo nutricional. Los fragmentos de plantas recolectados por las hormigas no constituyen su alimento en forma directa, sino que son utilizados para cultivar al simbionte fúngico, el que los degrada y metaboliza (Cherret et al., 1989) originando hifas ensanchadas apicalmente denominadas gongilidios (Martin & Martin, 1970), de los que se alimentan las larvas y la reina de la colonia (Currie, 2001).
Estas hormigas cultivan los hongos dentro de sus nidos, en cámaras especiales, a las que llevan fragmentos de hojas, flores y/o frutos de diversas plantas. Estos elementos vegetales son cortados en piezas más pequeñas y son masticados por las obreras, quienes le agregan al mismo tiempo sustancias salivales y anales ricas en amonio y aminoácidos, constituyendo así el sustrato utilizado por los hongos. Las obreras, además, eliminan continuamente los invasores del nido para evitar la contaminación de los hongos. Luego de que el cultivo lleva varios meses de actividad el nido es descartado y reemplazado por otro nuevo (Paracer & Ahmadjian, 2000).
Existen distintas hipótesis sobre el origen de los hongos asociados a estas hormigas. Algunas sostienen que evolucionaron de antecesores saprofíticos como los que se encuentran en depósitos de semillas, madera putrefacta y cuerpos de artrópodos; otras, postulan que provienen de hongos micorrícicos de algunas especies vegetales (Garling, 1989). De uno u otro modo, esta asociación ha permitido que el simbionte fúngico se propagara por millones de años, resultando en un grupo monofilético dentro de los hongos leucocoprináceos (Currie, 2001). Sin embargo, Leucoprinaceae ya no se considera una familia dentro de Agaricales, aunque los hongos del género Leucoagaricus cultivados por hormigas Attini se agrupan en un mismo clado con Leucocoprinus y Sericeomyces (Vellinga, 2004a). Asimismo, para otros autores (Chapela et al., 1994), los cultivos de Atta y Acromyrmex pertenecen al denominado grupo G1 caracterizado por carecer de fíbulas y presentar gongilidios; mientras que, los hongos cultivados por representantes de Asterostigma fueron agrupados en G2 por estos autores, que demostraron la monofilia de G1 y G2 mediante el análisis del ADN ribosomal y la subunidad ribosonal nuclear mayor ("28S"). Estos autores concluyeron que la mayoría de los hongos cultivados por las Attini superiores son monofiléticos, pertenecen a Lepiotaceae y propusieron la clonalidad y transmisión vertical del simbionte fúngico asociado. Posteriormente, Bot et al. (2001) proponen que la transmisión parental del simbionte fúngico podría estabilizar el mutualismo por la restricción de la transmisión horizontal (entre nidos) del simbionte. Aunque esta transmisión puede ocurrir entre especies de un mismo género en Attini inferiores (Green et al., 2002; Mueller et al., 1998), estas hormigas se caracterizan porque el hongo cultivado también puede desarrollarse en forma libre sin asociarse al nido. Por el contrario, los simbiontes de las Attini superiores no se han encontrado libres, lo que junto a su infrecuente producción de basidiocarpos constituyen las bases que permitieron proponer la transmisión vertical y clonal de los linajes (Bot et al., 2001; Mueller et al., 1998). Sin embargo, la presencia de cuerpos de fructificación esporádica permitió especular sobre la existencia de una sexualidad críptica que fue demostrada por Mikheyev et al. (2006).
Se conocen algunos hongos de los nidos de las hormigas cortadoras de hojas (Cherrett et al., 1989; Kendrick, 2000; Mueller, 2002), tales como Attamyces bromatificus Kreisel, Leucoagaricus spp. y Lepiota spp. (Holobasidiomycetes, Agaricales), Auricularia sp. (Phragmobasidiomycetes, Auriculariales) y Xylaria spp. (Ascomycetes, Sphaeriales). Sin embargo, solo producen gongilidios en cultivo los hongos asociados a las Attini más especializadas representantes de Atta y Acromyrmex (Mueller et al., 2001; Mueller, 2002), atribuyéndolos al teleomorfo Leucoagaricus gongylophorus (Möller) Singer. Aunque actualmente las relaciones filogéneticas de estos simbiontes fúngicos se hallan en discusión, se los incluye junto con los representantes de G1 y G3 delimitados por Chapela et al. (1994) en Agaricaceae, Agaricales (Moncalvo et al. 2000, 2002; Matheny et al., 2006).
El género Acromyrmex posee 24 especies, las que forman nidos con pocas cámaras, todas superficiales (Cherrett et al., 1989). Se conocen los hongos simbiontes asociados a los nidos de A. disciger, A. crassispinus, A. hispinus atratus, A. hispinus falax, A. laticeps, A. octospinosus, A. rugosus y A. subterraneus molestans (Mueller 2002; Silva-Pinhati et al., 2004).
Acromyrmex lobicornis Emery es de distribución sudamericana y está presente en la provincia de San Luis. En nuestro país solo se han realizado estudios genéticos (Abril & Bucher, 2007) y nutricionales del simbionte fúngico de esta especie (Abril & Bucher, 2002, 2004), pero nada se conocía hasta el momento, sobre la posición taxonómica del mismo.
El objetivo de este trabajo fue aislar, cultivar y caracterizar genómica y taxonómicamente los hongos cultivados por dos poblaciones de A. lobicornis de la provincia de San Luis.
Materiales y Métodos
En diciembre de 2006 se recolectaron muestras del simbionte fúngico de las cámaras de cultivo más superficiales de nidos de dos poblaciones de A. lobicornis de San Luis: una ubicada en el municipio de Juana Koslay, a 19 km al NE de la ciudad de San Luis (33° 16' 20" lat. S; 66° 16' long. OE), y otra situada en cercanías a las Sierras de las Quijadas, a 90 Km al NO de la cuidad San Luis (ca. 32° 20' lat. S; 67° 10' long. OE). De cada población se estudiaron dos hormigueros y de cada uno de ellos se recolectó, en recipientes de vidrio previamente esterilizados, material de 3 a 4 cámaras de cultivo. Las muestras obtenidas de los nidos se sembraron en los medios de cultivo agar papa dextrosa (APD) y agar extracto de malta (EM), con el agregado de cloranfenicol al 0,005% P/V. De cada nido, denominados N1, N2 (hormigueros de Juana Koslay), N3 y N4 (hormigueros de Sierra de las Quijadas), se sembraron 20 cápsulas de Petri (10 con APD y 10 con EM), las que se mantuvieron en oscuridad y a una temperatura de 25-30 ºC.
Después de tres semanas de cultivo, en solo seis cápsulas de Petri se observó el desarrollo del simbionte fúngico. De éstas, correspondientes a N2 y N3, se realizaron repiques en los medios de cultivo mencionados (sin cloranfenicol) a fin de obtener cultivos puros del simbionte. Estos cultivos se utilizaron para seguir su desarrollo durante 2 meses (a temperatura ambiente y oscuridad), con la finalidad de observar sus características morfológicas y efectuar su determinación taxonómica. El micelio aislado en ambos medios de cultivo fue montado en KOH al 5% y teñido con solución acuosa de floxina para su observación en un microscopio Olympus BH-2. Las micrografías se obtuvieron con una cámara digital Sony Cybershot DSC-H9.
Además, los aislamientos obtenidos de N2 y N3 fueron sembraron en EM y APD sin cloranfenicol, se mantuvieron a temperatura ambiente y en oscuridad, con 10 réplicas por medio de cultivo, para registrar los datos del crecimiento de las colonias. Estos datos del simbionte fúngico se obtuvieron midiendo el diámetro de las colonias cada 7 días durante 3 meses. Al finalizar el experimento, el número de réplicas varió entre los nidos y medios de cultivo, ya que el hongo no sobrevivió en todas las cajas inoculadas inicialmente y sólo se analizaron los aislamientos vivos (4-7) que completaron el ensayo.
Para la identificación molecular de los simbiontes fúngicos de Acromyrmex lobicornis se re-aislaron y cultivaron los hongos asociados a 5 nidos localizados en Juana Koslay, San Luis (33° 15' 04" lat. S, 66° 16' 17" long. OE; 32° 15' 03" lat. S, 66° 13' 13" long. OE; 33° 15' 06" lat. S, 66° 13' 16" long. OE; 33° 15' 06" lat. S, 66° 13' 31" long. OE; 33° 15' 04" lat. S, 66° 13' 20" long. OE). Los nuevos aislamientos se obtuvieron de muestras recolectadas el 23 y 30 de septiembre de 2011, siguiendo el mismo procedimiento previamente mencionado para las muestras del 2006. Se obtuvieron aislamientos de todos los nidos excepto del nido 3; las cepas se denominaron con las letras (O= aislamiento original, PR= primer repique del original y A= aislamiento, para discriminar por un número las cepas distintas del mismo nido) y números (nido 1= 1-5), por ejemplo: PR1A1, corresponde al primer repique del nido 1 y al aislamiento 1. Estas cepas (PR1 A1, PR2A1, PR2A2, PR4A1, PR4A5, PR4A6, PR5A2, O2A1) se determinaron molecularmente a partir de la secuenciación de ADN del espaciador intergénico ribosomal ITS. La extracción de ADN se efectuó siguiendo el protocolo propuesto por Cafaro et al. (2011) con modificaciones. Las cepas puras fueron preservadas en etanol 100% para su transporte; luego, se dejó evaporar el etanol a temperatura ambiente y los micelios se transfirieron a tubos de 1.5mL con 500μL de solución CTAB (2% Hexadecyltrimethyl-ammonium bromide, 1.4 M Tris-HCl pH 8.0, 0.25 mM EDTA). A continuación se maceraron en morteros de cerámica previamente esterilizados y colocados a -80°C; el polvo fino obtenido, se recuperó y se procedió a lavar con 500μL de cloroformo. Posteriormente, se centrifugaron las muestras por 10 min. a 15000g, el sobrenadante se transfirió a un tubo nuevo al cual se le agregaron 500μL de cloroformo nuevamente, después de agitar las muestras en el vortex, se centrifugaron por segunda vez durante 15 min. a 15000g. El sobrenadante resultante de las muestras se extrajo y se le adicionó un volumen de isopropanol, se agitaron y se mantuvieron a -80°C durante 20 min. para provocar la precipitación de los ácidos nucleicos. Transcurrido este tiempo las muestras fueron centrifugadas por 15 min. a 15000g y el precipitado resultante se lavó con 100μL de etanol al 70% frío. El ADN se resuspendió en 50μL de una solución TE 1/10 (10mM Tris-HCl, 0.1mM EDTA, pH 8.0) y las muestras se guardaron a -20°C.
Con los productos de la extracción de ADN se llevó a cabo la reacción en cadena de la polimerasa (PCR). Se amplificaron los espaciadores intergénicos ITS1 y ITS2 que flanquean el gen ribosomal 5.8S de los hongos aislados en este estudio. Esta región se eligió ya que es abundante en las bases públicas de datos génicos, permitiendo comparar los datos obtenidos con los preexistentes. Además, es una región muy utilizada en hongos como marcador molecular para el nivel de especie (Begerow et al., 2010).
Para amplificar las regiones intergénicas ITS1, ITS2 y el gen 5.8S ribosomal, se usaron los primers ITS4 y ITS5 (White et al., 1990), siguiendo el protocolo de Cafaro (2005), con algunas modificaciones. Así, las reacciones de amplificación fueron estandarizadas para un volumen final de 25μL (0.25 mM de cada primer, 0.225 mM dNTPs, 10% solución buffer (M190A, Promega, Madison, WI), 2.5mM MgCl2, 2 U Taq polimerasa) y se utilizó un volumen fijo (5 μL) de ADN genómico diluido 1:50. La reacción del PCR se realizó en un termociclador BIORAD como se indica a continuación: 95°C 7 min., 30 ciclos de 90 °C 30s -53 °C 1 min. - 65 °C de 8 min., 65 °C 16 min. Los productos se visualizaron en geles de agarosa al 1% teñidos en TE 1x con 0.1% bromuro de etidio durante 20 min. Luego, las muestras positivas se enviaron a secuenciar al High Throughput Genomics Center (Seattle, WA).
La variable diámetro de las colonias se analizó por medio de la prueba no paramétrica de Mann Whitney y considerando α=0.05. Estos análisis estadísticos se realizaron utilizando el programa Infostat (versión libre). Las secuencias, en ambas direcciones por muestra, fueron editadas manualmente en el programa Sequencher 4.3 (Genecodes, MI) obteniéndose aproximadamente 700 pb. Luego de verificar la identidad de estas secuencias en BLAST, las que correspondían a Leucoagaricus gongylophorus, se alinearon en Muscle junto a secuencias representantes de otras especies de Leucoagaricus utilizando el programa SeaView 4.2.12 (Gouy et al., 2010). Se construyó un árbol filogénetico por el método de Neighbor Joining y se calculó el soporte estadístico de las ramas luego de 1000 pseudoréplicas de Bootstrap con PAUP* v 4.0b4a (Swofford, 2000).
Resultados
Características macroscópicas del cultivo
Los cultivos puros del simbionte fúngico presentaron una zona central de aspecto blancoalgodonoso, en donde se observó una elevada concentración de hifas que disminuyeron en densidad hacia la periferia, apareciendo solo hifas hialinas en los bordes externos del cultivo. Con el tiempo aparecen secreciones (gotas) hialinas en ciertas zonas del cultivo. Hacia los bordes de la colonia se observaron zonas de aspecto grumoso, farináceo, formados por agrupaciones de gongilidios denominadas estáfilos (Fig. 1 A). A los 60 días, las colonias aisladas de nidos de Juana Koslay presentaron diámetros de (35) 37,2 (40) mm en EM y (27) 29,14 (32) mm en APD, mientras que en las aisladas de Sierra de las Quijadas fueron de 43 mm en EM y (27) 30,5 (32) mm en APD.

Fig. 1. Simbionte fúngico aislado de nidos de Acromyrmex lobicornis de San Luis. A: Aspecto general de las colonias en cultivo, la flecha indica la zona de estáfilos (e). B: Gongilidios (g). En el panel A la barra representa 1 cm y en el B 15μm.
El simbionte fúngico presenta un lento crecimiento en cultivo, alcanzando 53 mm como diámetro máximo a los 3 meses de crecimiento de sus colonias en EM y 40 mm en APD. Los cultivos se desarrollaron en ambos medios, presentando, en general, mayor crecimiento en EM (Fig. 2 A y B). Por otra parte, en la zona central del cultivo en APD se observaron zonas con hifas de crecimiento erecto.
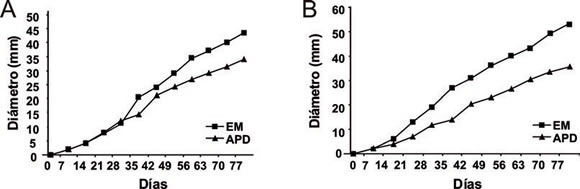
Fig 2. Crecimiento de los simbiontes fúngicos considerando el medio de cultivo (EM, APD). A: Diámetros promedio de las colonias fúngicas provenientes del nido 2 (N2). B: Diámetros promedio de las colonias del nido 3 (N3).
El aislamiento obtenido de N2 (Fig. 2 A) no presentó diferencias de crecimiento entre los medios EM y APD hasta los 21 días de cultivo, a los 28 días su crecimiento fue significativamente mayor en APD (W= 17.00, p= 0.0152) y a partir de los 35 días fue significativamente mayor en EM (35, 49 y 70 días W= 48.50, p= 0.0076; 42 W= 49.00, p= 0.0076; 56 y 63 días W= 50.00, p= 0.0025; 77 días W= 49.50, p= 0.0051). La cepa aislada de N3 (Fig. 2 B) mostró diámetros significativamente mayores en EM a partir de los 21 días de crecimiento (21, 28, 35, 42, 49, 56, 63, 70, 77 días, W= 10.00, p= 0.0286), creciendo en forma similar en ambos medios hasta los 14 días de cultivo.
El crecimiento de los simbiontes fúngicos presentó diferencias considerando el nido (N2, N3) de origen (Fig. 3 A y B). Las colonias cultivadas en APD variaron entre nidos sólo a los 21 días de cultivo (W= 17.00, p= 0.0485), con mayor crecimiento de los hongos originados de N2 para este único tiempo de crecimiento. Sin embargo, las colonias cultivadas en EM presentaron mayores diámetros en los aislamientos provenientes de N3 a partir de los 14 días de crecimiento (W= 30.00, p= 0.0159). Así, en general, los hongos aislados de N3 crecieron más en EM, mientras que los originarios de N2 no presentaron diferencias de diámetro entre los diferentes medios.
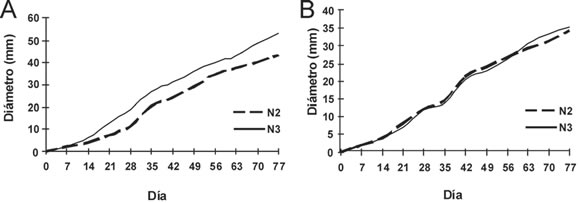
Fig. 3. Crecimiento de los simbiontes fúngicos considerando los nidos 2 y 3 (N2, N3) de origen. A: Diámetros promedio de las colonias cultivadas en EM. B: Diámetros promedio de las colonias creciendo en APD.
Características microscópicas del cultivo
Se observaron hifas hialinas de 4-8 μm de diám., de paredes delgadas, sin fíbulas y gongilidios de 30-46 x 38-54 μm (Fig. 1 B) desarrollados a los 28 días de cultivo. Las estructuras microscópicas del simbionte fúngico fueron similares en ambos medios de cultivo.
Características genómicas del cultivo
Todos los aislamientos del simbionte fúngico asociado a Acromyrmex lobicornis (representando a los simbiontes aislados de distintos nidos y a diferentes cepas dentro del mismo nido) en los que se analizaron las regiones ITS1/ITS2 y el gen 5.8S ribosomal, forman un grupo monofilético junto a otros aislamientos de Leucoagaricus gongylophous con un soporte del 100% (Fig. 4). Los aislamientos obtenidos en este estudio son indistinguibles de L. gongylophorus aislados de Atta insularis, A. bisferica, Acromyrmex hispidus falax y A. subterraneus, al menos con este marcador molecular. Todos los aislamientos de L. gongylophorus presentan poca distancia genética entre ellos, pero se distinguen claramente de otras especies de Leucoagaricus de vida libre.

Fig. 4. Relación filogenética de los hongos simbiontes de Acromyrmex lobicornis de San Luis. La topología del árbol filogenético obtenido por Neighbor Joining representa la reconstrucción basada en las secuencias de los espaciadores intergénicos ITS1/ITS2 y el gen 5.8S ribosomal. Los números en las ramas representan el soporte probabilístico obtenido por los análisis de 1000 pseudoréplicas de Bootstrap. Los números de acceso de GenBank se encuentran indicados después del nombre de la especie del hongo e inmediatamente entre paréntesis y en negrita se indica la hormiga hospedante en el caso de los hongos simbiontes. Referencias: primer repique del nido 1, aislamiento 1 (PR1 A1); primer repique del nido 2, aislamientos 1 y 2 (PR2A1, PR2A2); primer repique del nido 4, aislamientos 1, 5 y 6 (PR4A1, PR4A5, PR4A6); primer repique del nido 5, aislamiento 2 (PR5A2); cepa original del nido 2, aislamiento 1 (O2A1).
Discusión
las hormigas podadoras (Formicideae, Attini) han sido estudiadas por largo tiempo por su interesante comportamiento "hortícola" y por el simbionte fúngico que cultivan en sus nidos. En las llamadas Attini superiores, representadas por los géneros Atta y Acromyrmex, la formación de gongilidios en nidos y cultivos axénicos fue ya reportada por Möller en 1893 (Cherrett et al., 1989; Fisher et al., 1994a). En general, la producción de basidiocarpos en los nidos es infrecuente (Mueller, 2002) y el simbionte fúngico no suele fructificar en los nidos mientras es cultivado por las hormigas, sino que lo hace cuando la reina muere, la colonia se desorganiza o el nido es abandonado (Fisher et al., 1994b). En hormigueros de Atta cephalotes mantenidos en laboratorio, Fisher et al. (1994b) lograron obtener basidiocarpos de Leucoagaricus gongylophorus (Möller) Singer y, a partir de éstos, colonias fúngicas en cultivo en APD con características morfo-anatómicas similares al hongo asociado a los nidos. Además, estos autores (Fisher et al., 1994a), cultivaron en APD secciones de las laminillas y del pie de los basidiocarpos obtenidos, describiendo las colonias fúngicas aisladas, los gongilidios (agrupados en los bordes de las colonias) y el micelio afíbulado, todas características macro- y microscópicas que coinciden con las del simbionte fúngico aislado de Acromyrmex lobicornis de San Luis.
Otras especies de Leucoagaricus se han registrado asociadas a hormigas cortadoras; así, L. weberi J. J. Muchovej, Della Lucia & R. M. C. Muchovej se descubrió en nidos mantenidos en laboratorio de Atta sexdens subsp. rubropilosa (Muchovej et al., 1991) en Brasil y L. amazonicus A. Ortiz & Franco- Mol. fue hallado en pilas de detritos o "basureros" de Acromyrmex octospinosus de Colombia (Ortiz et al., 2008). Ambas especies tienen características de cultivo macroscópicas similares a L. gongylophorus y también carecen de fíbulas, pero en ellas los gongilidios están ausentes y en consecuencia no existen estáfilos en los márgenes de las colonias. Además, los basidiocarpos de L. amazonicus poseen queilocistidios capitados con contenido denso y pardo, mientras que L. weberi carece de ellos.
Si bien Fisher et al. (1994a, b) demuestran la similitud morfológica y la correspondencia entre el basidiocarpo de Leucoagaricus gongylophorus y el hongo simbiótico con gongilidios cultivados en el nido por Atta cephalotes; sólo recientemente Pagnocca et al. (2001), demuestran esta similitud a nivel molecular entre L. gongylophorus y el hongo formador de gongilidios asociado a nidos de Acromyrmex hispidus fallax de Brasil. Además, se ha demostrado la similitud en los cultivos fúngicos de las Attini superiores cortadoras de hojas (Atta y Acromyrmex) y la capacidad única de estos simbiontes fúngicos de producir gongilidios en diversas especies en particular en Acromyrmex heyeri, A. landolti y A. lundii de Argentina además de otras especies sudamericanas (Folgarait et al., 2011; Schultz & Brady, 2008). Por lo tanto, este es el primer registro confirmado molecularmente de L. gongylophorus como el simbionte fúngico de Acromyrmex lobicornis para Sudamérica.
En nuestro país, existen registros de varias especies de vida libre del género Leucoagaricus (Lechner et al., 2006; Wright & Albertó, 2002), sin embargo, no se habían reportado hasta el momento las especies cultivadas en nidos de hormigas podadoras. Anteriormente, fueron halladas fructificaciones en basureros de hormigueros (Spegazzini, 1898, 1921) de los hongos mirmecófilos Locellina mazzuchii Speg. (Cortinariaceae, Agaricales, Basidiomycota), Xylosphaera micrura (Speg.) Dennis (Xylareaceae, Xylariales, Ascomycota) y el anamorfo de Discoxylaria myrmecophila J.C. Lindq. & J.E. Wright y Hypocreodendron sanguineum Henn. (= Poroniopsis bruchi Speg.) (Xylareaceae, Xylariales, Ascomycota).
En cuanto a su ubicación taxonómica y sistemática, Leucoagaricus es un género controvertido. Si bien Leucoagaricus fue considerado un género artificial por Johnson (1999), este autor al tratar la filogenia dentro de Lepiota no incluyó en su análisis las especies de Leucoagaricus cultivadas por las hormigas podadoras. Posteriormente, Moncalvo et al. (2000, 2002) sí incorporan estos simbiontes fúngicos en el análisis filogenético, agrupándolos junto con géneros morfológicamente muy diferentes como Battarraea, Chlorophyllum, Cystolepiota, Lepiota, Melanophyllum, Podaxis y Tulostoma (entre otros), que fueron asignados a Agaricaceae. Además, la revisión de los hongos lepiotáceos (actualmente, Agaricaceae) considerando su ecología, distribución y filogenia (Vellinga, 2004a, b), mostró el agrupamiento de los representantes de Leucoagaricus cultivados por las Attini y los de vida libre, junto con Sericeomyces y Leucocoprinus, aunque Vellinga (op. cit.) rechazó la monifilia de Leucoagaricus y planteó la necesidad de estudios intensivos y extensivos en las zonas tropicales para poder dilucidar si es un sólo género o puede separarse en varios. Por lo tanto, Leucoagaricus permanece como género por sus caracteres morfológicos hasta el momento en que su filogenia se resuelva; mientras que, por ahora, hay consenso en su inclusión en Agaricaceae, Agaricales (Matheny et al., 2006), tanto de las especies de vida libre como las simbióticas asociadas a hormigas podadoras.
El crecimiento lento y escaso de estos simbiontes fúngicos es bien conocido para aislamientos de Leucoagaricus gongylophorus obtenidos de Acromyrmex hispidus fallax (Pagnocca et al., 2001) y coincide con nuestras observaciones. Estos hongos simbiontes degradan maltosa (Cherrett et al., 1989) y otras sustancias (entre ellas almidón) y recientemente se determinó la producción extracelular de α-amilasa y maltasa por el simbionte fúngico L. gongylophorus asociado a Atta sexdens (Silva et al., 2006). Estas enzimas intervienen en la degradación del almidón a glucosa y la particular capacidad para producir maltasa explicaría el mayor crecimiento en EM de los hongos obtenidos de nidos de Acromyrmex lobicornis de San Luis.
Sólo se aisló un simbionte fúngico en cada nido de Acromyrmex lobicornis de San Luis; además, el simbionte fúngico cultivado fue morfológicamente similar en las poblaciones. En nidos de Atta cephalotes de Trinidad, además de Leucoagaricus gongylophorus se aislaron 16 taxones de micromicetes epífitos o endófitos, a partir de las hojas recolectadas por las hormigas para cultivar al simbionte (Fisher et al., 1996). Leucoagaricus gongylophorus presenta baja capacidad para reconocer y actuar como antagonista frente a otros hongos y depende en gran medida del cuidado de las hormigas para suprimir el crecimiento de éstos en el nido. Para ello, las hormigas producen en las glándulas metapleurales de las obreras una secreción con actividad biológica que suprime la germinación de esporas fúngicas, sumadas a las prácticas de remoción de partículas extrañas fuera del nido (Orthius-Lechner et al., 2000) y también se asocian con actinobacterias que las protegen de patógenos específicos (Cafaro et al., 2011). Sin embargo, Bot et al. (2001), Doherty et al. (2003), Silva-Pinhati et al. (2004) y Mikheyev et al. (2006), solo aislaron a L. gongylophorus de nidos de Acromyrmex octispinosus y A. echinator de Panamá, de Atta cephalotes de Trinidad y Panamá, de cuatro especies de Atta y seis de Acromyrmex de Brasil, de Acromyrmex octospinosus de la Isla Guadalupe y de especies de Atta (datos moleculares de Brasil y Panamá) respectivamente. A pesar de la variedad de especies de Atta y Acromyrmex involucradas en estos análisis y las distancias geográficas entre los sitios estudiados, la variabilidad génica observada mediante técnicas moleculares ("AFLP", "RAPDs", "ITS1" y "ITS2", y síntesis de proteínas, "DMC1" y "RAD51", respectivamente) de los aislamientos de L. gongylophorus (obtenidos de los nidos y basidiocarpos crecidos en los nidos), demuestran que el hongo cultivado en los nidos es una única especie (L. gongylophorus) que presenta una sexualidad críptica, lo que sugiere podría basarse en la "parasexualidad" o la transmisión horizontal del hongo lo que, consecuentemente, incrementaría la variabilidad intraespecífica, mostrando un sistema coevolutivo hongo-hormigas podadoras bien establecido (Mikheyev et al. op. cit.). En nuestro país, la variabilidad génica en los simbiontes de A. lobicornis y otra cinco especies del género fue estudiada por Abril & Bucher (2007) aplicando el marcador génico de secuencias internas simples repetidas ("ISSR"), pero la variabilidad observada por estos autores fue interpretada como la existencia de distintos hongos simbióticos y no como la variabilidad intrínseca de un sola especie fúngica. Este resultado contradictorio a los obtenidos en este estudio, en apariencia, podría deberse al método de aislamiento de los hongos analizados, ya que Abril y Bucher (2007) no realizaron los aislamientos con el micelio cultivado en los nidos, como en el presente estudio y en los anteriormente citados (Bot et al., 2001; Doherty et al., 2003, Silva-Pinhati et al., 2004; Mikheyev et al., 2006), sino que los obtuvieron a partir de los fragmentos de las hojas trasladadas por las hormigas para el cultivo del hongo simbiótico. Así, Abril y Bucher (2007), habrían aislado micromicetes epífitos y otros endófitos, además de L. gongylophorus, coincidiendo con Fisher et al. (1996). Si bien no se encontraron diferencias en la posición taxonómica del simbionte fúngico hallado en ambas poblaciones de A. lobicornis de San Luis, los aislamientos difirieron en su crecimiento en los medios de cultivo, dependiendo de su nido de origen. El simbionte aislado de nidos de Sierra de las Quijadas tuvo mayor diámetro en EM, mientras que en el de Juana Koslay el diámetro no difería con el medio de cultivo. Estos resultados refuerzan las observaciones obtenidas del simbionte fúngico asociado a Atta y Acromyrmex de Brasil y el Caribe (Silva-Pinhati et al., 2004; Mikheyev et al., 2006), que muestran que el simbionte fúngico cultivado presenta diferencias génicas según la zona de origen del nido. De tal forma, estas diferencias génicas podrían redundar en capacidades fisiológicas diferenciales entre los cultivos fúngicos, como las halladas en el presente trabajo. Además, nuestros resultados refuerzan desde la morfología y la fisiología fúngica, la propuesta de Mikheyev et al. (2006), quienes postulan que esta simbiosis hongos-hormigas podadoras no sería un caso de coevolución uno-a-uno, sino varios-a-uno y que habría transmisión horizontal del simbiontes fúngico entre las Attini superiores.
Conclusiones
Las características microscópicas y genómicas de los cultivos aislados de nidos de Acromyrmex lobicornis Emery coinciden con las de Leucoagaricus gongylophorus (Möller) Singer (Basidiomycota, Agaricales, Agaricaceae). Esta es la primera cita de la especie L. gongylophorus aislada de nidos de A. lobicornis para Sudamérica y Argentina. Además, este trabajo demuestra que l. gongylophorus es la única especie fúngica cultivada en los nidos de A. lobicornis de poblaciones de San Luis. Este simbionte presenta leves diferencias funcionales entre poblaciones de hormigas, que se reflejarían en su capacidad diferencial en degradar maltosa, mientras que dichas diferencias podrían sugerir cierta variabilidad génica en la especie. Nuestros resultados acuerdan, en base a los datos obtenidos desde la morfología y la fisiología, con la propuesta de varios-a-uno del mutualismo entre hongo-hormigas podadoras pertenecientes a las Attini superiores.
Agradecimientos
Este trabajo de investigación se realizó en el marco del proyecto PROICO 2-0203, financiado por la FQByF (UNSL).
Bibliografía
1. ABRIL, B. A. & H. E. BUCHER. 2002. Evidence that the fungus cultured by leaf-cutting ants does not metabolize cellulose. Ecol. Letters 5: 325-328. [ Links ]
2. ABRIL, B. A. & H. E. BUCHER. 2004. Nutritional sources of the fungus cultured by leaf-cutting ants. Appl. Soil Ecol. 26: 243-247. [ Links ]
3. ABRIL, B. A. & H. E. BUCHER. 2007. Genetic diversity of fungi occurring in nest of three Acromyrmex leaf-cutting ants species from Córdoba, Argentina. Microbial Ecology 54: 417-423. [ Links ]
4. BEGEROW, D, H. NILSSON, M. UNTERSEHER & W. MAIER. 2010. Current state and perspectives of fungal DNA barcoding and rapid identification procedures. Appl. Microbiol. Biotechnol. 87: 99-108. [ Links ]
5. BOT, A. N. M., S. A. REHNER & J. J. BOOMSMA 2001. Partial incompatibility between ants and symbiotic fungi in two sympatric species of Acromyrmex leafcutting ants. Evolution 55: 1980-1991. [ Links ]
6. CAFARO, M. J. 2005. Eccrinales (Trichomycetes) are not Fungi, but a clade of protists at the early divergence of animals and fungi. Mol. Phylogen. Evol. 35: 21-34. [ Links ]
7. CAFARO, M. J., M. POULSEN, A. E. F. LITTLE, S. L. PRICE, N. M. GERARDO, B. WONG, A. E. STUART, B. LARGET, P. ABBOT & C. R. CURRIE. 2011. Specificity in the symbiotic association between fungus-growing ants and protective Pseudonocardia bacteria. Proc. R. Soc. B. 278: 1814-1822. [ Links ]
8. CHAPELA, I. H., S. A. REHNER, T. R. SCHULTZ & U. G. MUELLER. 1994. Evolutionary history of the symbiosis between fungus-growing ants and their fungi. Science 266: 1691-1694. [ Links ]
9. CHERRETT, J. M., R. J. Powell & D. J. Stradling . 1989. The mutualism between leaf-cutting ants and their fungus. In: WILDING, N, N. M. COLLING & J. F. WEBBER (eds.), Insect Fungus Interactions, pp. 93-120. Academic Press, London. [ Links ]
10. CURRIE C. R. 2001. A community of ants, fungi, and bacteria: a multilateral approach to studying symbiosis. Ann. Rev. Microbiol. 55: 357-380. [ Links ]
11. DOHERTY, K. R., E. W. ZWEIFEL, N. C. ELDE, M. J. McKONE & S. G. ZWEIFEL. 2003. Random amplified polymorphic DNA markers reveal genetic variation in the symbiotic fungus of leaf-cutting ants. Mycologia 95: 19-23. [ Links ]
12. FISHER, P. J., D. J. STRADLING & D. N. PEGLER. 1994a. Leucoagaricus basidiomata from live nest of the leaf-cutting ant Atta cephalotes. Mycol. Res. 98: 884-888. [ Links ]
13. FISHER P. J., D. J. STRADLING & D. N. PEGLER. 1994b. Leaf-cutting ants, their fungus gardens and the formation of basidiomata of Leucoagaricus gongylophorus. Mycologist 8: 128-131Links ] Helvetica, sans-serif">.
14. FISHER P. J., D. J. STRADLING, B. C. SUTTON & L. E. PETRINI. 1996. Microfungi in the fungus garden of the leaf-cutting ant Atta cephalotes: a preliminary study. Mycol. Res. 100: 541-546. [ Links ]
15. FOLGARAIT, P. J., J. A. MARFETÁN & M. J. CAFARO. 2011. Growth and conidiation response of Escovopsis weberi (Ascomycota: Hypocreales) against the fungal cultivar of Acromyrmex lundii (Hymenoptera: Formicidae). Biol. Control-Microb. 40: 342-349. [ Links ]
16. GARLING, L. 1979. Origin of Ants-Fungus Mutualism: A New Hypothesis. Biotropica 11: 284-291. [ Links ]
17. GUY, M., S. GUINDON & O. GASCUEL. 2010. SeaView version 4: a multiplatform graphical user interface for sequence alignment and phylogenetic tree building. Mol. Biol. Evol. 27: 221-224. [ Links ]
18. GREEN, A. M., U. G. MUELLER & R. M. M. ADAMS. 2002. Extensive exchange of fungal cultivars between sympatric species of fungus-growing ants. Mol. Ecol. 11: 191-195. [ Links ]
19. JOHNSON J. 1999. Phylogeny within Lepiota. Mycologia 91: 443-458. [ Links ]
20. KENDRICK , B. 2000. Mutualistic symbiosis between fungi and animals. In: The Fifth Kingdom, pp. 250- 256. 3th ed. Mycologue Publications, Sidney. [ Links ]
21. LECHNER, B. E., J. E. WRIGHT & O. POPOFF. 2006. New taxa and new records for Argentina of fungi from Iguazú National Park, Misiones. Fungal Diversity 21: 131-139. [ Links ]
22. MARTIN , M. M. & J. S. MARTIN. 1970. The biochemical basis for the symbiosis between the ant Atta columbica tonsiper and its food fungus. J. Insect. Physiol. 16: 109-119. [ Links ]
23. MATHENY, P. B., J. M. CURTIS, V. HOFSTETTER, M. C. AIME, J.-M. MONCALVO, Z.-W. GE, Z.-L. YANG, J. C. SLOT, J. F. AMMIRATI, T. J. BARONI, N. L. BOUGHER, K. W. HUGHES, D. J. LODGE, R. W. KERRIGAN, M. T. SEIDL, D. K. AANEN, M. DeNITIS, G. M. DANIELE, D. E. DESJARDIN, B. R. KROPP, L. L. NORVELL, A. PARKER, E. VELLINGA, R. VILGALYS & D. S. HIBBETT. 2006. Major clades of Agaricales: a multilocus phylogenetic overview. Mycologia 98: 982-995. [ Links ]
24. MIKHEYEV, A. S., U. G. MUELLER & P. ABBOT. 2006. Cryptic sex and many-to-one coevolution in the fungus-growing ant symbiosis. Proc. Nat. Acad. Sci. 103: 10702-10706. [ Links ]
25. MONCALVO, J.-M., F. M. LUTZONI, S. A. REHNER, J. JOHNSON & R. VILGALYS. 2000. Phylogenetic relationships of agaric fungi based on nuclear large subunit ribosomal DNA sequences. Syst. Biol. 49: 278-305. [ Links ]
26. MONCALVO, J.-M., R. VILGALYS, S. A. REDHEAD, J. E. JOHNSON, T. Y. JAMES, M. C. AIME, V. HOFSTETTER, S. J.W. VERDUIN, E. LARSSON, T. J. BARONI, R. G. THORN, S. JACOBSSON, H. CLÉMENÇON & O. K. MILLER Jr. 2002. One hundred and seventeen clades of euagarics. Molec. Phylog. Evol. 23: 357-400. [ Links ]
27. MUCHOVEJ, J. J., T. M. DELLA LUCCIA & M. C. MUCHOVEJ. 1991. Leucoagaricus weberi sp. nov. from a live nest of leaf-cutting ants. Mycol. Res. 95: 1308-1311. [ Links ]
28. MUELLER, U. G. 2002. Ant versus Fungus versus Mutualism: Ant-Cultivar Conflict and the Deconstruccion of the Attine Ant-Fungus Symbiosis. Am. Nat. 160: 69-98. [ Links ]
29. MUELLER, U. G., S. A. REHNER & T. R. SCHULTZ. 1998. The evolution of agriculture in ants. Science 281: 2034-2038. [ Links ]
30. MUELLER, U. G., T. R. SCHULTZ, C. R. CURRIE, R. M. M. ADAMS & D. MALLOCH. 2001. The origin of attine ant-fungus mutualism. Quart. Rev. Biol.76:169-197. [ Links ]
31. ORTIZ, A., A. E. FRANCO-MOLANO & M. BACCI Jr. 2008. A new species of Leucoagaricus (Agaricaceae) from Colombia. Mycotaxon 106: 371-378. [ Links ]
32. ORTHIUS-LECHNER, D., R. MAILE, E. D. MORGAN & J. J. BOOMSA. 2000. Metapleural gland secretions of the leaf cutter ant Acromyrmex octospinosus: new compounds and their functional significance. J. Chem. Ecol. 26: 1667-1683. [ Links ]
33. PAGNOCCA, F., M. BACCI Jr., M. H. FUNGARO, O. C. BUENO, M. J. HEBLING, A. SANT ANNA & M. CAPELARI. 2001. RAPD analysis of the sexual state and sterile mycelium of the fungus cultivated by the leaf-cutting ant Acromyrmex hispidus fallax. Mycol. Res. 105: 173-176. [ Links ]
34. PARACER, S. & V. AHMADJAIN. 2000. Fungal associations of Protozoa and Animals. In: PARACER, S. & V. AHMADJAIN (eds.), Symbiosis: An Introduction to Biological Associations, pp. 89- 108. 2nd ed. Oxford University Prees, London. [ Links ]
35. SILVA, A., M. BACCI Jr., F. C. PAGNOCCA, O. C. BUENO & M. J. A. HEBLING. 2006. Starch metabolism in Leucoagaricus gongylophorus, the symbiotic fungus of leaf-cutting ants. Microb. Res. 161: 299-303. [ Links ]
36. SILVA-PINHATI, A. C. O., M. BACCI Jr, M. L. SOGIN, F. C. PAGNOCCA, V. G. MARTINS, O. C. BUENO & M. J. A. HEBLING. 2004. Low variation in ribosomal DNA and internal tancibed spacers of the symbiotic fungi of leaf-cutting ants (Attini: Formicidae). Braz. J. Med. Biol. Res. 37: 1463-1472. [ Links ]
37. SPEGAZZINI, C. 1898. Fungi Argentini novi vel critici. Ann. Mus. Nat. Hist. 3: 81-365. [ Links ]
38. SPEGAZZINI, C. 1921. Descripción de hongos mirmecófilos. Rev. Mus. La Plata 26: 166-174. [ Links ]
39. SCHULTZ, T. R. & S. G. BRADY. 2008. Major evolutionary transitions in ant agriculture. PNAS 105: 5435-5440. [ Links ]
40. SWOFFORD, DL. 2000. Phylogenetic Analysis Using Parsimony, Version 4.0b4a. Illinois Natural History Survey, Champaign, IL. [ Links ]
41. VELLINGA, E. E. 2004a. Genera in the family Agaricaceae: evidence from nrITS and nrLSU sequences. Mycol. Res. 108: 354-377. [ Links ]
42. VELLINGA, E. E. 2004b. Ecology and distribution of lepiotaceous fungi (Agaricaceae)-a review-. Nova Hedwigia 78: 273-299. [ Links ]
43. WHITE, T. J., T. BRUNS, S. LEE, & J. W. TAYLOR. 1990. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. In: INNIS, M. A., D. H. GELFAND, J. J. SNINSKY & T. J. WHITE (eds.), PCR Protocols: A Guide to Methods and Applications, pp. 315-322. Academic Press Inc., New York. [ Links ]
44. WRIGHT, J. E. & E. ALBERTÓ. 2002. Hongos de la región pampeana. Editorial L. O. L. A., Buenos Aires. [ Links ]
Recibido el 3 de enero de 2011,
aceptado el 14 de noviembre de 2011.













