Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Boletín de la Sociedad Argentina de Botánica
versión On-line ISSN 1851-2372
Bol. Soc. Argent. Bot. vol.48 no.1 Córdoba ene./mayo 2013
ANATOMÍA Y MORFOLOGÍA VEGETAL
Anatomía y desarrollo de la flor estaminada, microsporogénesis y microgametogénesis en especies de Lophophytum (Balanophoraceae) en la Argentina
Héctor A. Sato1 y Ana M. Gonzalez2
1 Correo electrónico: hector.a.sato@gmail.com
2 CCT-NEA, Instituto de Botánica del Nordeste, Corrientes, Argentina. Correo electrónico: anitama39@gmail.com
Resumen: Se estudió la anatomía y desarrollo de la flor estaminada, microsporogénesis y microgametogénesis de Lophophytum leandrii y Lophophytum mirabile subsp. bolivianum, a fin de aportar datos para el conocimiento y taxonomía del género. Las flores estaminadas se diferencian en número y ubicación de las piezas del perianto y en la forma de las anteras, siendo caracteres taxonómicos importantes. Las piezas periánticas están constituidas de parénquima fundamental cubiertas por una epidermis uniestratificada. La pared de la antera consta de epidermis, endotecio pluriestratificado (de doble origen), capa media y tapete tipo secretor uniestratificado (de origen dual). Las tétradas de microsporas son de tipo tetraédricas, los granos de polen son tricolpados, sincolpados con exina delgada, siendo liberados en estado bicelular. Las reducciones que caracterizan el túber también se presentan en las flores estaminadas, donde aparecen "piezas periánticas" que no presentan estructura típica de sépalos o pétalos. A pesar que estas holoparásitas se caracterizan por poseer cuerpo vegetativo aberrante, carente de órganos o meristemas típicos, los procesos de microsporogénesis y microgametogénesis se desarrollan de forma normal.
Palabras clave: Lophophytum; Anteras; Endotecio; Perianto; Tapete, Tétradas.
Summary: Anatomy and development of the staminate flower, microsporogenesis and microgametogenesis of species of Lophophytum (Balanophoraceae) in Argentina. The anatomy and development of the staminate flowers, microsporogenesis and microgametogenesis of Lophophytum leandrii and Lophophytum mirabile subsp. bolivianum, were studied. The aim of this work was to provide data for knowledge and taxonomy of the genus. The staminate flowers differ between species in the number and position of perianth parts and anther shape, which are important characteristics in the taxonomy of this genus. The perianth parts are formed by parenchyma covered by a single-layered epidermis. The anther wall consists of epidermis, a multilayered endothecium (with dual origin), middle layer and single-layered secretory tapetum (with dual origin). The microspore tetrads are tetrahedral; the pollen grains are tricolpate and sincolpate with a thin exine layer. Pollen grains are shed at two-celled state. The reductions that characterize the tuber also occur in male flowers, which present "perianth pieces", lacking the typical structure of sepals or petals. Although these holoparasitic are characterized by aberrant vegetative body, and devoid of the typical organs or meristems, the microgametogenesis and microsporogenesis develop normally.
Key words: Lophophytum; Anther; Endothecium; Perianth; Tapetum; Tetrads.
Introducción
La familia Balanophoraceae comprende 17 géneros y 42 especies de plantas holoparásitas, se distribuyen principalmente en los bosques tropicales y subtropicales del mundo, algunas crecen en regiones andinas (Kuijt, 1969; Nikrent & Musselman, 2004; Heide-Jørgensen, 2008). El género Lophophytum Schott & Endl. es exclusivamente sudamericano y comprende cinco taxones, dos de los cuales crecen en la Argentina: Lophophytum leandrii Eichler, en Corrientes y Misiones y Lophophytum mirabile Schott & Endl. subsp. bolivianum (Wedd.) B. Hansen, en Salta y Jujuy (Burkart, 1949; Hansen, 1980a, 1987; Xifreda, 1999; Zuloaga et al., 2008; Novara, 2009). Son especies holoparásitas de raíces de árboles, que desarrollan un cuerpo vegetativo o túber totalmente subterráneo, del cual solo emergen las inflorescencias compuestas conspicuas, de origen endógeno (Gonzalez & Mauseth, 2010). Cada inflorescencia se compone de un eje principal de forma columnar y cónica, de 10 a 30 cm de altura (Fig. 1 A, D), cubierta por escamas esclerosadas las cuales se desprenden a medida que maduran las flores (Fig. 1 D, flecha). A lo largo del eje principal se insertan las ramas secundarias breves (Fig. 1 B-C), portadoras de flores unisexuales, las pistiladas se ubican en el tercio inferior, quedando parcialmente enterradas (Fig. 1 A, flecha), mientras que las estaminadas se disponen hasta el ápice (Kuijt, 1969; Hansen, 1980a). La reducción de las piezas florales es una de las principales características de las flores de Balanophoraceae (Kuijt, 1969). En las especies estudiadas, las flores estaminadas están representadas por dos anteras y miembros del perianto reducidos, en L. mirabile el perianto está constituido por una sola pieza y por dos en L. leandrii (Hansen & Engell, 1978; Hansen, 1980a, 1987). La forma, posición y tamaño de las anteras es un carácter taxonómico usado para separar las subespecies de Lophophytum (Hansen, 1980a).
Cada flor estaminada posee dos estambres compuestos por un filamento corto y tenue y una antera basifija y diteca. La antera de L. mirabile subsp. bolivianum posee los sacos polínicos anteriores de cada teca de ¾ de la longitud de los sacos posteriores, carácter usado para diferenciarla de L. mirabile subsp. mirabile con sacos anteriores y posteriores de igual longitud; en L. leandrii los sacos polínicos presentan igual longitud pero están insertos a diferente altura en el conectivo (Burkart, 1949; Hansen, 1980a). Los estudios anatómicos sobre desarrollo de las estructuras reproductivas en la familia Balanophoraceae son escasos: Hansen (1976, 1980a, 1980b) describió los estigmas y las características del polen de L. leandrii y L. mirabile. Cocucci (1991) estudió la macroesporogénesis y macrogametogénesis de L. leandrii.
Considerando la ausencia de datos anatómicos y la importancia de la estructura de las flores estaminadas en la taxonomía del género, el presente trabajo tiene por objetivos: a) analizar la estructura y anatomía de las flores estaminadas, b) examinar el desarrollo de la antera, c) comparar los procesos de microesporogénesis y microgametogénesis en Lophophytum leandrii y L. mirabile subsp. bolivianum a fin de aportar datos para el conocimiento y taxonomía del género.
Materiales y Métodos
Para la presente investigación se utilizaron flores en distintos estadios de desarrollo que fueron fijadas en FAA (alcohol 70º, formol, ác. acético, 90:5:5).
Lophophytum leandrii. ARGENTINA. Prov. Misiones: Dpto. San Ignacio, Selva vecina a cementerio, 27º 16' 5'' S, 55º 31' 4.2'' W, 21/06/2010, Sato 7. 14/07/2010, Gonzalez 291. 11/08/2010, Sato 10. 30/09/2010, Sato 20. 13/11/2010, Sato 28. Dpto. Cainguás, Salto Tabay, sendero aguas abajo del salto, 15/09/2011, Sato 114.
Lophophytum mirabile subsp. bolivianum. ARGENTINA. Prov. Jujuy: Dpto. Ledesma, Parque Nacional Calilegua, Zona Sur, Aº Aguas Negras, 06/03/2009, Carranza 1831. 14/02/2010, Sato 4. Sector Este, Subsector Caimancito a orillas de camino de entrada y orillas de río, 04/03/2010, Sato 3. Sendero Tëta, 25/08/2010, Sato 11. Entrada al camping Aguas Negras, 29/12/2010, Sato 67. 20/01/2011, Sato 68. Zona sur, 25/02/2011, Sato 99.
Todos los ejemplares testigo están depositados en el Herbario del Instituto de Botánica del Nordeste, Corrientes (CTES) y en el Herbario de la Universidad Nacional de Jujuy (JUA), Argentina.
Para las observaciones con microscopía óptica (MO) se realizaron preparados permanentes, el material se deshidrató utilizando deshidratantes histológicos (Gonzalez & Cristóbal, 1997), la infiltración en parafina se realizó según la técnica de Johansen (1940). Se efectuaron cortes seriados transversales (CT) y longitudinales (CL) de flores con micrótomo rotativo de 12-15 μm de espesor, utilizando la coloración safranina - astra blue (Luque et al., 1996) y safranina - fast green (Johansen, 1940) y se montaron con bálsamo de Canadá sintético. Se realizaron además cortes con ultramicrótomo de 1 μm de espesor de material incluido en resina sintética y se colorearon con azul de toluidina (Ruzin, 1999). Para las observaciones se utilizó un microscopio óptico Leica MZ6 con sistema de captura digital de imágenes. Para analizar los engrosamientos del endotecio se efectuó la diafanización de las anteras utilizando hipoclorito de Sodio al 35% a temperatura ambiente, durante 8 - 12 hs. La observación de los engrosamientos, así como la presencia de almidón, se realizó con microscopio óptico con luz polarizada.
Para la observación con Microscopio Electrónico de Barrido (MEB) los materiales fijados en FAA fueron deshidratados en serie acetónica creciente, secados a punto crítico y metalizados con Oro- Paladio. Los granos de polen fueron previamente acetolizados de acuerdo a la técnica de Erdtman (1960). La observación se realizó en un MEB Jeol LV5800 del Servicio de Microscopía Electrónica de la Universidad Nacional del Nordeste, a 20 Kv.
Observaciones
Las descripciones de los distintos estadios del desarrollo de los gametofitos masculinos de las dos especies se hacen en forma conjunta debido a sus similitudes, puntualizando las diferencias cuando las hubiere.
Estructura y anatomía floral
Cada flor estaminada está compuesta por dos estambres y piezas del perianto. Estas piezas son órganos carnosos semejantes a almohadillas, en L. mirabile subsp. bolivianum la única pieza de perianto es de color blanco-amarillento, mientras que en L. leandrii el par de piezas presentan una intensa coloración roja (Fig. 1 B-C). La forma de las piezas periánticas varía dependiendo de la compresión recibida durante el desarrollo floral, esto se puede apreciar en la figura 1 E, donde se observan varias flores de L. mirabile subsp. bolivianum. En una flor se indican los estambres (asteriscos) y su única pieza del perianto (a); en otra flor se removieron los estambres (flechas) y se señala con (b) su pieza del perianto. L. leandrii posee dos piezas periánticas: una inferior (Fig. 1 F, G, c) y otra superior (Fig. 1 F, G, d).

Fig. 1. Inflorescencias y estructura de las flores estaminadas. A-B, E, K-L: L. mirabile subsp. bolivianum. C-D, F-J: L. leandrii. A: Inflorescencia madura sin escamas, con anteras abiertas, flores pistiladas a nivel del mantillo (flecha). B-C: Detalle de ramas secundarias con flores estaminadas. D: Inflorescencia con algunas escamas en ápice (flecha). E-L: MEB. E: Rama secundaria mostrando una flor completa con su única pieza del perianto (a) y estambres (asteriscos), y otra flor indicando el perianto (b) y lugar ocupado por estambres (flechas). F: Rama secundaria indicando los estambres (asteriscos) y la pieza anterior del perianto (c) de una flor. G: Rama secundaria donde se removieron los estambres (flechas) y se muestra la pieza anterior (c) y posterior (d) del perianto de una flor, y la pieza anterior del perianto de la siguiente (e). H: CL de rama secundaria mostrando posición de piezas anterior y posterior del perianto (c, d) y estambre. I-J: Estambre, vista anterior y abaxial respectivamente, mostrando desfasaje en la inserción de las tecas. K-L: Vista adaxial y lateral mostrando distinta longitud de sacos polínicos. I-L: Las flechas señalan las líneas de dehiscencia. Escalas: A, D: 2,0 cm; B-C: 0,5 cm; E-H: 0,5 mm; I-L: 0,2 mm.
Los estambres están compuestos por un filamento tenue, en cuyo extremo se insertan las anteras (Fig. 1 F-L), existiendo diferencias de tamaño y posición entre las especies analizadas. La antera de L. mirabile subsp. bolivianum posee los sacos polínicos anteriores (adaxiales) de cada teca de ¾ de la longitud de los sacos posteriores (abaxiales) (Fig. 1 K-L), con la salvedad que cada teca tiene un saco polínico adaxial y otro posterior o abaxial. En cambio los sacos polínicos anteriores y posteriores de cada teca de L. leandrii presentan prácticamente la misma longitud, pero las tecas se insertan a diferentes alturas en el conectivo (Fig. H-J), éste desplazamiento es el resultado del ajuste que deben realizar las tecas debido a la presencia de la pieza superior del perianto (Figs. 1 G-H, d; 2 A-B, d). Las anteras de ambas especies son de color blanquecino en estadios jóvenes y amarillas a la madurez (Fig. 1 A-D).
Anatómicamente, las piezas periánticas están constituidas por parénquima fundamental cubiertas por una epidermis uniestratificada con una cutícula delgada y sin estomas (Fig. 2 A-D). Estas piezas están conectadas por un tejido procambial que más tarde se diferenciará en un haz vascular, predominantemente parenquimático, que llega sólo a la base de cada almohadilla. Este haz es de desarrollo tardío, formándose cuando se ha completado la diferenciación de las diversas capas de la pared de la antera y ya se diferenciaron las células madres de las microsporas (Fig. 2 A-C). Durante la ontogenia se produce el depósito de sustancias tánicas, de manera progresiva desde la capa dérmica hacia el interior (Fig. 2 C). En estructuras maduras la epidermis puede presentar esclereidas dispersas, estas células tienen pared secundaria, esclerosada, con puntuaciones simples, conservan lumen amplio con sustancias tánicas y se diferencian preferentemente en la región exterior de las piezas del perianto (Fig. 2 E, flecha).
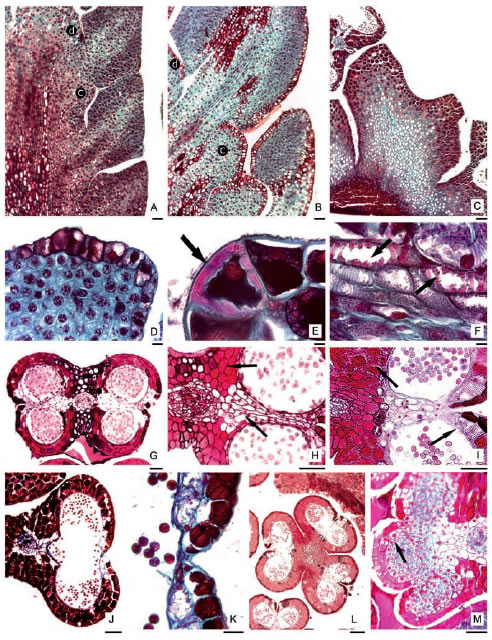
Fig. 2. Anatomía del perianto y tejido conectivo. A-D, F-G, J-K, M: L. leandrii. E, H-I, L: L. mirabile subsp. bolivianum. A-C: CL de ramas secundarias mostrando distintos estadios de desarrollo del perianto y estambre, (c) pieza anterior, (d) pieza posterior. D: CL del perianto mostrando epidermis y parénquima. E: detalle de esclereida. F: haz vascular mostrando crecimientos de la pared secundaria hacia el lumen (flechas). G-M: CT de antera. G: antera con cuatro sacos polínicos. H: zona del conectivo y septos (flechas) en estado de cmm. I: antera en estado de polen unicelular. J: antera en estado de polen bicelular, con los septos retraídos. K: estomio. L: antera anómala con tres tecas y dos haces vasculares. M: antera anómala mostrando una teca con tres sacos polínicos, estrato parietal primario originando los estratos parietales secundarios (flecha). Escalas: A-C, G-J, L-M: 0,1 mm; K: 50 μm. D-F: 10 μm.
En la antera, ambas tecas se encuentran unidas mediante un tejido conectivo donde se continúa el haz vascular colateral proveniente del filamento (Fig. 2 B, G-H). Cada teca posee dos sacos polínicos (Fig. 2 G-I), encontrándose estambres con variantes en número de tecas y sacos polínicos (Fig. 2 L-M).
Desarrollo de la pared de la antera Los primordios de los estambres se forman como protuberancias en la superficie de las ramas secundarias de la inflorescencia, son de forma subcircular en transcorte; están constituidos por una masa de células meristemáticas rodeadas de una protodermis uniestratificada (Fig. 3 A, mer, prt). A medida que se desarrolla la antera, las capas celulares subepidérmicas experimentan una serie de divisiones mitóticas que llevan a la formación de cuatro microesporangios, de este modo la antera joven adquiere gradualmente contorno tetralobado (Fig. 3 B). En cada esquina de la antera el estrato subepidérmico se diferencia en células arquesporiales (Fig. 3 C, arq), cuyas divisiones mitóticas periclinales originan hacia afuera el estrato parietal primario (Fig. 3 C, ep1) y hacia el interior células esporógenas primarias (Fig. 3 C, ce1). El ep1 origina por divisiones periclinales dos estratos parietales secundarios (Fig. 3 D, ep2). Cada ep2, por otra ronda de divisiones, forma dos nuevos estratos celulares, quedando la pared de la antera constituida por la epidermis y cuatro capas: endotecio biestratificado (Fig. 3 E, epd, end), estrato medio (Fig. 3 E, em) y tapete (Fig. 3 E, tap).

Fig. 3. Desarrollo de la pared de la antera (corte transversal en MO). A-D, F, H, K-M: L. leandrii. E, G, I-J: L. mirabile subsp. bolivianum. A: primordio de estambre. B: antera joven tetralobada. C-H: sucesivos estadios del desarrollo de la pared de un microesporangio. I: diafanizado de células del endotecio mostrando los engrosamientos fibrosos. J: pared de antera con endotecio triestratificado. K: detalle de tapete y cmm. L: tapete, célula esporógena en división (tpi), tapete externo (tpe). M: detalle de tapete en estado de polen unicelular. Abreviaturas: arq, células arquesporiales; ce1, células esporogenas primarias; cmm, células madre de las microsporas; ep1, estrato parietal primario; ep2, estrato parietal secundario; em, estrato medio; end, endotecio; epd, epidermis; mer, células meristemáticas; p1c, polen unicelular; prt, protodermis; tap, tapete; tpi, tapete interno. Escalas: A-B: 0,1 mm; C-M: 20 μm.
A medida que madura la antera, las dos capas subepidémicas acumulan gran cantidad de sustancias tánicas y se diferencian en endotecio biestratificado, desarrollando los engrosamientos fibrosos característicos (Fig. 3 F-J, end). La tercera capa constituye un estrato medio, que se comprime tangencialmente y es tempranamente digerido durante el desarrollo de las microsporas (Fig. 3 E-H, em). La cuarta capa forma el tapete que delimita el lóculo de la antera (Fig. 3 E-G, K, M, tap).
La pared de la antera madura queda constituida por las siguientes capas:
Epidermis: (Fig. 3 G-H, J, epd), constituida por una capa de células de forma rectangular a cuadrangular en transcorte, con paredes celulósicas, la pared tangencial externa es de mayor espesor. El citoplasma está fuertemente impregnado por sustancias tánicas. La epidermis está cubierta por una cutícula gruesa y estriada. No presenta estomas.
Endotecio: biestratificado (Fig. 3 H-J), el estrato externo posee células prismáticas alargadas radialmente. Se depositan engrosamientos fibrosos en forma de "U", que en su máximo desarrollo se presentan como gruesas barras lignificadas que recorren las paredes radiales, desde la placa base en la pared tangencial interna hasta la pared tangencial externa (Fig. 3 H-I). La segunda capa del endotecio posee células de menor desarrollo en sentido radial, con el mismo patrón de engrosamientos. Ambos estratos exhiben un citoplasma tanífero (Fig. 3 H, J).
El estrato medio está formado por células pequeñas y aplanadas y es normalmente aplastado por el desarrollo de los sacos polínicos (Fig. 3 G, em). En L. mirabile subsp. bolivianum es común que esta capa también engrose sus paredes conformando a la madurez un endotecio triestratificado (Fig. 3 J, end). El tapete es uniestratificado, de tipo secretor, constituido por células uninucleadas de paredes delgadas, citoplasma denso y núcleo de gran tamaño (Fig. 3 F-G, K, M, tap). Su origen es dual según su posición en la antera: en la porción externa (hacia la pared de la antera) derivan de las células parietales (Fig. 3 L, tpe) y en la parte interna (hacia los septos que separan los sacos polínicos) derivan de las células esporógenas (Fig. 3 L, tpi). Con el crecimiento en volumen de la antera y la ausencia de nuevas divisiones que incrementan su número, las células del tapete se alargan tangencialmente. Cuando las microsporas sufren la primera mitosis, la pared tangencial interna del tapete aparentemente pierde continuidad, pero su citoplasma no es liberado hacia el lóculo, quedando restringido hacia la pared de la antera (Fig. 3 M, tap). A la madurez de la antera, luego de la liberación de los granos de polen, remanentes del tapete permanecen reconocibles, adosados a la parte interna de la pared del microesporangio (Fig. 5 D). Mediante las técnicas histológicas empleadas en el presente estudio no se observaron orbículas en el tapete y/o lóculo de las anteras.

Fig. 5. Microgametogénesis. A, C-D, F: L. leandrii. B, E: L. mirabile subsp. bolivianum. A: tétradas de microsporas dentro de la pared de calosa. B-C: microsporas en estadio unicelular. D: microsporas en estadio bicelular, v: célula vegetativa, g: célula generativa. E-F: granos de polen maduros, MEB. Escalas: A, C-F: 10 μm; B: 20 μm.
Tejido conectivo
Simultáneamente con el desarrollo de la pared de la antera, en la zona central del primordio estaminal se produce la diferenciación de procambium y posteriormente un haz vascular colateral cuyo xilema presenta elementos traqueales con engrosamientos anillados característicos (Fig. 2 F, flechas).
En el conectivo, el parénquima cortical se diferencia en dos zonas (Fig. 2 G-H, flechas): la que rodea al haz vascular que se extiende formando los septos entre los sacos polínicos, consta de 3-7 capas de células con abundantes granos de almidón que comienzan a degradarse luego de la separación de las tétradas de microsporas. Por otro lado, está el parénquima que se extiende desde el haz vascular hacia ambas epidermis y presenta células de forma poliédrica que acumulan abundantes compuestos tánicos (Fig. 2 H-I). A la madurez de la antera, este parénquima tanífero desarrolla engrosamientos fibrosos similares a los del endotecio (Fig. 2 I, flechas). Estos engrosamientos se forman de manera simultánea a los de la pared de la antera, de forma centrípeta hacia el haz, y se continúan con el endotecio de la pared de la antera, constituyendo un estrato continuo. Al estado de granos de polen, previo a la dehiscencia, todas las células parenquimáticas del conectivo que rodean al haz vascular presentan los engrosamientos fibrosos característicos del endotecio, tanto del lado dorsal como del ventral del conectivo (Fig. 2 J). Tanto las células epidérmicas del estomio, cuanto las de los septos y las de la región del endotecio vinculada al conectivo, carecen de espesamientos fibrosos, mantienen sus paredes primarias delgadas y son de tamaño relativamente menor (Fig. 2 I). Cuando los granos de polen se encuentran maduros, el tejido de los septos se retrae produciéndose la unión de los sacos polínicos de cada teca (Fig. 2 J), posteriormente las anteras se abren debido a la ruptura de las células del estomio (Fig. 2 K).
Se encontraron con frecuencia en ambas especies anteras con distinto número de tecas y de sacos polínicos (Fig. 2 L-M). Se observaron estambres con 3 a 6 tecas y cada teca con dos sacos polínicos; también pueden presentarse anteras con dos tecas, pero cada teca puede tener tres sacos polínicos. En estos casos el conectivo puede presentar 1 ó 2 haces vasculares. El desarrollo de las paredes de estas anteras anómalas sigue el mismo patrón de desarrollo que las anteras normales. En la Fig. 2 M se muestra la capa parietal primaria originando los estratos parietales secundarios (flecha).
Microsporogénesis
Las células esporógenas primarias (Fig. 4 A), sufren varias divisiones mitóticas, originando las células madres de las microsporas (cmm), uninucleadas. En estado premeiotico, las cmm se destacan por su citoplasma denso con vacuoma muy reducido, núcleo distendido, con abundante cariolinfa y cromatina, en gran parte dispersa, como es característico de los procesos de transcripción y síntesis propios del estado profásico, donde se producen abundantes mensajeros y precursores de microtúbulos e histonas necesarios para completar el proceso meiótico. Acumulación de estos elementos resultan evidentes en la Fig. 4 D, donde se advierte una región clara dentro del núcleo, quedando la cromatina condensada y desplazada lateralmente, con los nucléolos ubicados hacia la región central de este campo claro (Fig. 4 C-D). En profase I, las cmm se separan entre sí y del tapete debido a la desintegración del cemento péctico, consecuencia de lo cual es que las cmm tienden a adquirir forma esférica, los cromosomas se identifican como hebras finas, ubicados en la región clara formada previamente (Fig. 4 E-F). Las restantes fases de la meiosis I transcurren de manera usual (Fig. 4 G-J), esto es, concluyen meiosis I (Fig. 4 G-H) y meiosis II (Fig. 4 K), y los 4 núcleos haploides resultantes se distribuyen en los vértices de una figura tetraédrica por acción de haces de microtúbulos ubicados en los lados, evidentes en la Fig. 4 L, lo cual permite, gracias a la posición rígida de los núcleos, que ocurra la citocinesis mediante una pared calósica, generada en forma simultánea, como es característica de las tétrades tetraédricas que forman microsporas triaperturadas. La citocinesis es de forma simultánea originando tétradas del tipo tetraédrica (Fig. 4 L-M). En una misma antera se puede presentar falta de sincronización en las etapas de la microsporogénesis entre los sacos polínicos (Fig. 4 N).

Fig. 4. Microesporogénesis. A, C-K, M-N: L. leandrii. B, L: L. mirabile subsp. bolivianum. A: célula esporógena. B: cmm. C: vista general del microesporangio en profase I temprana. D: detalle de cmm con región clara dentro del núcleo. E: profase I, formación de pared de calosa. F: profase I mostrando los cromosomas en forma de hebras. G: metafase I. H: anafase I. I-J: Telofase I. K: metafase II. L: telofase II. M: tétradas tetraédricas. N: microesporangio en distintas fases de la meiosis II. Escalas: A-B, D-I, K-M: 10 μm; C, J, N: 50 μm.
Microgametogénesis
Finalizada la citocinesis, las microsporas empiezan a separarse debido a la disolución de la pared de calosa que conformaba la tétrada (Fig. 5 A). Cuando las microsporas están separadas completamente se encuentran en estado unicelular (Fig. 5 B-C). La primera división mitótica de las microsporas forma una célula vegetativa grande y una célula generativa menor y de forma lenticular que queda contra la pared de la microspora (Fig. 5 D, v, g). Los granos de polen maduros se liberan al estado bicelular, son esferoidales, tricolpado-sincolpados, con una exina delgada y sin esculturas sobresalientes (Fig. 5 E-F). Hasta ahora, no hemos podido observar la formación de los espermios, que sería la culminación de la microgametogénesis, puesto que muy probablemente esto ocurra en los primeros momentos de la germinación del andrófito (microgametófito).
Discusión y Conclusiones
Estructura y anatomía floral El número y color de las piezas del perianto, la longitud de los sacos polínicos y la inserción de las tecas en el conectivo permiten distinguir fácilmente material de las dos especies argentinas de Lophophytum. Hansen (1980b) ya utilizó las anteras como carácter para diferenciar las subespecies de L. mirabile, pero no especifica este carácter para L. leandrii, tampoco menciona la coloración de las flores durante su desarrollo. La porción pistilada de la inflorescencia, al emerger del túber, queda parcialmente enterrada en el suelo o cubierta por la hojarasca, por lo que frecuentemente los ejemplares de herbario cuentan solo con fragmentos de las partes estaminadas de las inflorescencias, es por ello que la disposición de las anteras en los estambres permite la identificación más precisa de materiales secos.
La interpretación de las estructuras florales en Balanophoraceae es dificultosa, considerando su tamaño pequeño y la reducción de sus piezas florales. Kuijt (1969) menciona que la terminología normalmente aplicada a las flores de Eudicotiledóneas es inadecuada para esta familia. Por ejemplo, Burkart (1949) describe las flores estaminadas de L. leandrii con un par de estambres y ovarios rudimentarios de color rojo vivo. Estas estructuras fueron reconocidas por Hansen (1980a) como piezas del perianto y utilizadas en la separación taxonómica de las especies.
En el presente estudio se confirma que las excresencias carnosas que acompañan a los estambres no presentan ninguna estructura reproductiva femenina, ni remanentes de las mismas, para ser considerados ovarios reducidos. Se continúa utilizando el término perianto, aplicado por Hansen (1980a), con la particularidad de que no presentan la estructura típica de sépalos o pétalos, siendo estructuras carnosas carentes de tejido secretor. Endress y Matthews (2006) realizaron una revisión de las modificaciones que pueden presentarse a partir de los pétalos y estambres, citando entre las mismas a los pseudonectarios, que son estructuras que semejan nectarios pero no secretan néctar (Dafni, 1984). En ambas especies se registró la visita de coleópteros del genero Oxycorynus, los adultos utilizan las inflorescencias como sitio de alimentación y el parénquima de las ramas secundarias para la ovoposición y desarrollo de las larvas (Ferrer et al., 2012). Borchsenius y Olesens (1990) afirman que el fuerte olor que emite la inflorescencia de L. mirabile subsp. mirabile es el responsable de atraer especialmente a los coleópteros. Existe abundante bibliografía que cita diversas relaciones entre los coleópteros y las flores (Endress, 1994), siendo el aroma, néctar, polen en abundancia e inclusive piezas florales las recompensas ofrecidas por estas flores cantarófilas (Kiill & Gomes da Costa, 2003; Padilha de Oliveira et al., 2003). Entre las holoparásitas se encuentra además Hydnora como especie con flores cantarófilas (Musselman & Visser, 1989). A fin de realizar la correcta identificación de las denominadas piezas periánticas en Lophophytum, su origen y eventual función como pseudonectarios, es necesario un estudio exhaustivo de la ontogenia floral y vascularización de la inflorescencia, considerando que parte del desarrollo de estas piezas es posterior al de los estambres.
A pesar de la gran modificación del cuerpo vegetativo, se pueden citar puntos en común con las porciones estériles de las flores estaminadas como son la presencia de gran cantidad de compuestos tánicos y el desarrollo de engrosamientos internos en los elementos traqueales, presentes en especies como L. leandrii (Gonzalez & Mauseth, 2010) y Ombrophytum (Mauseth & Montenegro, 1992).
Desarrollo de la antera
A diferencia de las fuertes reducciones que presentan éstas especies en su cuerpo vegetativo y en su morfología floral, los patrones de desarrollo encontrados en las anteras pueden enmarcarse dentro de los tipos descriptos como normales y aplicables a un sinnúmero de especies. La serie de eventos de desarrollo de anteras descriptos por autores clásicos como Bhandari (1984) o Raghavan (1997), o revisiones modernas como las de Scott et al. (2004) o Furness et al. (2002), pueden ser comparados a los que se suceden en las anteras de ambas especies de Lophophytum. En los primordios de antera de Arabidopsis, se describen claramente tres zonas denominadas L1, L2 y L3 (Goldberg et al., 1993; Sanders et al., 1999; Scott et al., 2004); de L1 se diferenciará la epidermis, de L2 las células arquesporiales que dan origen a la pared de la antera y al tejido esporógeno, y la L3 contribuye para el conectivo y los tejidos vasculares. En los primordios de antera de Lophophytum no fue posible obtener los estadios tempranos que permitan la diferenciación de L2 y L3, si el origen de las células arquesporiales subepidérmicas, por lo que indicaría que presentan el mismo comportamiento.
Pared de la antera
Considerando el comportamiento de las capas parietales secundarias, el desarrollo de la pared de la antera puede enmarcarse dentro del tipo básico propuesto por Davis (1966), aunque presenta variaciones en el comportamiento de las capas medias, las que desarrollan engrosamientos constituyendo a la madurez un endotecio pluriestratificado. Lersten (2004) menciona que las anteras a veces se desvían de los tipos propuestos por Davis (1966), y que estas estructuras no son estáticas y no se trata de un estado maduro, por lo que solo son verificables por un estudio del desarrollo usando muestras estadísticamente validas.
Las presencia de la epidermis uniestratificada de la pared de la antera de las especies de Lophophytum concuerda con lo descripto para otras Balanophoraceae como Corynaea crassa Hook. f. var. sprucei (Eichl.) B. Hansen (Engell, 1979; Johri, 1984). Una particularidad de estas especies es que su porción vegetativa carece por completo de protodermis y epidermis como tejido protector (Gonzalez & Mauseth, 2010), sin embargo este meristema y la epidermis derivada se encuentran presentes en las estructuras florales analizadas en la presente contribución, siendo su desarrollo totalmente normal.
Según distintos autores el endotecio puede ser considerado de diferentes maneras: como la capa subepidérmica del arco de la pared de la antera que desarrolla engrosamientos fibrosos, o considerar como endotecio a todas las regiones de la antera que desarrollan engrosamientos, no solo de la región del arco de la pared (G'Arcy & Keating, 1996). Nosotros tomamos al endotecio en su sentido amplio, considerando a todas aquellas capas que desarrollan engrosamientos. Así, el endotecio de las especies de Lophophytum estudiadas presenta origen dual: el que deriva de las capas parietales y el que se origina de las células del conectivo. Bhojwani & Bhatnagar (1986) señala que un tejido similar al endotecio puede presentarse hacia la parte interna de la pared, originado a partir de las células del conectivo. Similar situación se presenta en Lophophytum, en la zona colindante con el conectivo en donde se pueden encontrar de entre 3 y 5 capas con engrosamientos endoteciales. Si bien lo usual es que el endotecio esté formado por un solo estrato originado de las capas parietales y presente solo en la parte protuberante de la antera (Bhojwani & Bhatnagar, 1986; Jacobs & Lersten, 1994; García, 2002), en algunas plantas puede ser pluriestratificado. Puede formarse por divisiones periclinales de algunas células del endotecio por ejemplo en familias como Magnoliaceae, Schisandraceae y Winteraceae donde es biseriado, en Eucomia ulmoides (biseriado), en Chelone glabra (2 a 6 capas), (Johri, 1984). Bhojwani & Bhatnagar (1986) menciona que en Lilium y Ranunculus una o más capas medias pueden persistir, y la capa interna adyacente al endotecio puede desarrollar engrosamientos, tal como se observa en Lophophytum. El endotecio pluriestratificado es un carácter relativamente común en familias más primitivas, existiendo una tendencia filogenética hacia la reducción de los tejidos endoteciales (Johri, 1984). No se han encontrado antecedentes sobre patrones de desarrollo de engrosamientos del endotecio en Balanophoraceae, pero este carácter se sugiere de importancia taxonómica en otras familias (Manning, 1996; García, 2002).
El tapete de Lophophytum también presenta origen dual según su posición en la antera, a partir de las capas parietales y el otro que deriva de las células esporógenas. Este último dato apoyaría lo mencionado por Rutishauser (1982) respecto de que las células esporógenas no se convierten en células madre de las microsporas directamente después de la división de las células arqueospóricas, sino que siguen dividiéndose, comportándose como células meristemáticas vegetativas, o al menos las mas externas, aportando las células para la formación del tapete interno. Las características de tapete secretor y uninucleado es compartido con otros géneros de la familia, como Helosis (Gonzalez & Popoff, 2011), y Corynaea crassa (Engell, 1979). La acumulación progresiva de almidón en células parenquimáticas de conectivo y septos hasta estadios intermedios del desarrollo y su posterior disminución hacia la madurez de la antera coincide con lo descripto para Lilium por Clemente et al. (1994).
La deposición de la pared de calosa se inicia desde el estado de células madres de las microsporas en profase I, manteniéndose durante las fases de la división celular hasta la liberación de las microsporas. Esto es lo normalmente observado en la mayoría de las plantas estudiadas y que originan polen viable (Johri, 1984).
Microsporogénesis y microgametogénesis
La microsporogénesis se lleva a cabo de forma normal, observándose como fase interesante un gran campo claro en la región del núcleo con la cromatina desplazada lateralmente. Para poder hacer afirmaciones claras sobre este evento, creemos conveniente la observación del núcleo con microscopia electrónica de transmisión, a fin de determinar si se trata de una "vacuola" tal como lo describiera Majewska-Sawka (1990) en meiocitos masculinos de Beta vulgaris, formada por invaginación de las membranas nucleares, o si se trata de un desplazamiento de la cromatina hacia la zona periférica. La citocinesis es simultánea en la mayoría de las Eudicotiledóneas (Furness & Rudall, 2004), carácter relacionado a la presencia de polen tricolpado, lo cual concuerda con los resultados del presente estudio. Según Hansen (1980b) los granos de polen son tricolporados para ambas especies de Lophophytum, y además menciona que L. mirabile presenta alrededor del 25% de sus granos de polen hexacolporados, los cuales no fueron detectados en nuestras observaciones. Se coincide con lo observado por Hansen (1980b) en que los granos de polen son liberados en estado bicelular.
Los resultados del análisis del desarrollo de las diversas partes de las anteras, incluyéndose microsporogénesis y microgametogénesis pueden sumarizarse en el siguiente gráfico:

Gráfico 1. Representación esquemática de la ontogenia de la pared de la antera, y microsporas.
A pesar que las especies estudiadas poseen una forma de vida muy especializada, presentan un desarrollo totalmente aberrante en su cuerpo vegetativo, marcado por fuertes reducciones y ausencias de tejidos o meristemas con organización típica, a lo que se suma reducción en sus piezas florales, se ha encontrado que los procesos de desarrollo de la antera, microsporogénesis y microgametogénesis, tanto en meristemas como tejidos derivados, se suceden de manera normal y en correspondencia respecto a los antecedentes de la mayoría de las angiospermas estudiadas, no existiendo diferencias sustanciales entre ambas especies analizadas.
Agradecimientos
Al Dr. Alfredo Cocucci por los aportes realizados durante la revisión del manuscrito. Para la realización de este trabajo se contó con el subsidio de CONICET- Beca AVG y de la Secretaría Gral. de Ciencia y Técnica de la Universidad Nacional del Nordeste, PI Nº 17/09A123.
Bibliografía
1. BHANDARI, N. N. 1984. The microsporangium. In: B. M. JOHRI (ed.), Embryology of Angiosperms, pp. 53-121. Springer-Verlag, Berlin. [ Links ]
2. BHOJWANI, S. S. & S. P. BHATNAGAR. 1986. The embryology of Angiosperms. Vanni Educational Books. [ Links ]
3. BORCHSENIUS, F. & J. M. OLESENS. 1990. The amazonian root holoparasite Lophophytum mirabile (Balanophoraceae) and its pollinators and herbivores. J. Trop. Ecol. 6: 501-505. [ Links ]
4. BURKART, A. 1949. La Balanoforácea Lophophytum leandrii en Misiones y apuntes sobre una especie vecina en Salta. Darwiniana 9 (1): 169-172. [ Links ]
5. COCUCCI, E. A. 1991. Lophophytum leandri megasporogenesis and gametogenesis. In: RANSOM J. K., MUSSELMAN L. J., WORSHAM A. D., & C. PARKER (eds.), Proceedings of the 5th International Symposium of Parasitic Weeds, pp. 31- 35. CIMMYT, Nairobi, Kenya. [ Links ]
6. CLEMENTE, C., L. CHAVANT, M. BURRUS & J. C. AUDRAN. 1994. Anther starch variations in Lilium during pollen development. Sex. Plant Reprod. 7: 347-356. [ Links ]
7. DAFNI, A. 1984. Mimicry and deception in pollination. Ann. Rev. Ecol. Syst. 15: 259-278. [ Links ]
8. DAVIS, G. L. 1966. Systematic embryology of the Angiosperms. John Wiley & Sons. New York. [ Links ]
9. ENDRESS, P. K. 1994. Diversity and evolutionary biology of tropical flowers. Cambridge University Press. [ Links ]
10. ENDRESS, P. K. & M. L. MATTHEWS. 2006. Elaborate petals and staminodes in eudicots: diversity, function, and evolution. Org. Divers. Evol. 6: 257-293. [ Links ]
11. ENGELL, K. 1979. Morphology and embryology of Scybalioideae (Balanophoraceae): I Corynaea crassa Hook. f. var. sprucei (Eichl.) B. Hansen. Bot. Tidsskr. 73 (3-4): 155-166. [ Links ]
12. ERDTMAN, G. 1960. The acetolysis method. Svensk Bot. Tidskr. 54: 561-564. [ Links ]
13. FERRER, M. S., A. E. MARVALDI, H. A. SATO & A. M. GONZALEZ. 2012. Biological notes on two species of Oxycorynus (Coleoptera: Belidae) associated with parasitic plants of the genus Lophophytum (Balanophoraceae), and new distribution records in Argentina. Rev. Soc. Entomol. Argent. 70 (3-4): 351-355. [ Links ]
14. FURNESS, C. A. & P. J. RUDALL. 2004. Pollen aperture evolution - a crucial factor for eudicot success?. Trends Plant Sci. 9: 154-158. [ Links ]
15. FURNESS, C. A., P. J. RUDALL & F. B. SAMPSON. 2002. Evolution of microsporogenesis in angiosperms. Int. J. Plant Sci. 163: 235-260. [ Links ]
16. GARCIA, C. C. 2002. An approach to the diversity of endothecial thickenings in Solanaceae. Flora 197: 214-223. [ Links ]
17. GOLDBERG, R. B., T. P. BEALS & P. M. SANDERS. 1993. Anther development, basic principles and practical applications. Plant Cell 5: 1217-1229. [ Links ]
18. G'ARCY, W. G. & R. C. KEATING. 1996. The anther, form, function and phylogeny. Cambridge University Press. [ Links ]
19. GONZALEZ, A. M. & C. L. CRISTÓBAL. 1997. Anatomía y ontogenia de semillas de Helicteres Lhotzkyana (Sterculiaceae). Bonplandia 9 (3-4): 287-294. [ Links ]
20. GONZALEZ, A. M & J. D. MAUSETH. 2010. Morphogenesis is highly aberrant in the vegetative body of the holoparasite Lophophytum leandrii (Balanophoraceae): All typical vegetative organs are absent and many tissues are highly modified. Int. J. Plant Sci. 171 (5): 499-508. [ Links ]
21. GONZALEZ, A. M & O. F. POPOFF. 2011. Estructura de las flores estaminadas, microsporogénesis y microgametogénesis de Helosis cayennensis var. cayennensis. Bol. Soc. Argent. Bot. 46 (supl.): 38-39. [ Links ]
22. HANSEN, B. 1976. Pollen and stigma conditions in the Balanophoraceae. Botanic Notiser 129: 341-345. [ Links ]
23. HANSEN, B. 1980a. Balanophoraceae. Flora Neotrópica 23: 1-80. [ Links ]
24. HANSEN, B. 1980b. Pollen dimorphism in Lophophytum mirabile Schott & Endl. (Balanophoraceae). Grana 19: 189-191. [ Links ]
25. HANSEN, B. 1987. Balanophoraceae. Flora del Paraguay9: 7-11. [ Links ]
26. HANSEN, B. & K. ENGELL. 1978. Inflorescences in Balanophoroideae, Lophophytoideae and Scybalioideae (Balanophoraceae). Svensk Bot. Tidskr. 72 (4): 177-187. [ Links ]
27. HEIDE-JØRGENSEN, S. 2008. Parasitic flowering plants. Koninklijke Brill NV, Leiden, The Netherlands. [ Links ]
28. JACOBS, C. A. & N. R. LERSTEN. 1994. Microsporogenesis and endothecial wall patterns in black maple (Acer saccharum subsp. nigrum, Aceraceae). Bull. Torrey Bot. Club 121 (2): 180-187. [ Links ]
29. JOHANSEN, D. A. 1940. Plant microtechnique. McGraw-Hill Book Co., New York. [ Links ]
31. JOHRI, B. M. 1984. Embryology of angiosperms. Springer-Verlag. [ Links ]
32. KIILL, L. H. P. & J. GOMES DA COSTA. 2003. Biologia floral e sistema de reprodução de Annona squamosa L. (Annonaceae) na região de Petrolina-PE. Ciencia Rural 33 (5): 851-856. [ Links ]
33. KUIJT, J. 1969. The biology of parasitic flowering plants. University of California. [ Links ]
34. LERSTEN, N. R. 2004. Flowering plant embryology, whit emphasis in economics species. Blackwell Publishing. [ Links ]
35. LUQUE, R. H., C. SOUSA & J. E. KRAUS. 1996. Métodos de coloraçao de Roeser (1972)-modificadoe Kropp (1972) visando a subtituicao do azul de astra por azul de alciaô 8 GS ou 8 GX. Acta Bot. Brasil. 10: 199-212. [ Links ]
36. MAJEWSKA-SAWKA, A., J. BOHDANOWICZ, B. JASSEM & M. I. RODRIGUEZ-GARCÍA. 1990. Development of nuclear vacuoles in sugar beet male meiocytes. Ann. Bot. 66 (2): 139-146. [ Links ]
37. MANNING, J. C. 1996. Diversity of endothecial patterns in the angiosperms. In: G'ARCY, W. G. & R. C. KEATING (eds.), The anther, form, function and phylogeny, pp. 136-158. Cambridge University Press. [ Links ]
38. MAUSETH, J. & G. MONTENEGRO. 1992. Secondary wall ingrowths on vessel elements in Ombrophytum subterraneum (Balanophoraceae). Amer. J. Bot. 79: 456-458. [ Links ]
39. MUSSELMAN, L. J. & J. H. VISSER. 1989. Taxonomy and natural history of Hydnora (Hydnoraceae). Aliso 12: 317-326. [ Links ]
40. NIKRENT, D. L & L. J. MUSSELMAN. 2004. Introduction to parasitic flowering plants. The Plant Health Instructor 13: 300-315. [ Links ]
41. NOVARA, L. J. 2009. Balanophoraceae. Flora del valle de Lerma. Aportes botánicos de Salta - Ser. Flora 8 (16): 1-7. [ Links ]
42. PADILHA DE OLIVEIRA, M. S., G. COUTURIER & P. BESERRA. 2003. Biologia da polinização da palmeira tucumã (Astrocaryum vulgare Mart.) em Belém, Pará, Brasil. Acta Bot. Bras. 17 (3): 343-353. [ Links ]
43. RAGHAVAN, V. 1997. Molecular embryology of flowering plants. Cambridge University Press. [ Links ]
44. RUTISHAUSER, A. 1982. Introducción a la embriología y biología de la reproducción de las angiospermas. Ed. Hemisferio Sur. [ Links ]
45. RUZIN, S. E. 1999. Plant microtechnique and microscopy. Oxford University Press. New York. [ Links ]
46. SANDERS, P. M., A. Q. BUI, K. WETERINGS, K. N. MCINTIRE, Y-C. HSU, P. Y. LEE, M. T. TRUONG, T. P. BEALS & R. B. GOLDBERG. 1999. Anther developmental defects in Arabidopsis thaliana malesterile mutants. Sex Plant Reprod. 11: 297-322. [ Links ]
47. SCOTT, R. J., M. SPIELMAN & H. G. DICKINSON. 2004. Stamen structure and function. Pl. Cell 16: 46-60. [ Links ]
48. XIFREDA, C. C. 1999. Balanophoraceae. In: ZULOAGA F. & O. Morrone (eds.), Catálogo de las Plantas vasculares de la Rep. Argentina II. Monogr. Syst. Bot. Mo. Bot. Gard. 74: 353-354. [ Links ]
49. ZULOAGA, F., O. MORRONE & M. BELGRANO. 2008. Balanophoraceae. Catálogo de las Plantas Vasculares del Cono Sur. 2. Monogr. Syst. Bot. Missouri Bot. Gard. 107: 1566. [ Links ]
Recibido el 25 de abril de 2012,
aceptado el 31 de agosto de 2012.













